商金源,闫曼平,叶京飞,程悦宁,王振军,冯二凯,王春霞,赵 艳,朱先鹏, 廖远军,罗国良*
(1.中国农业科学院特产研究所 农业部经济动物疫病重点实验室,长春 130122;2.吉林省通化市柳河县农业 综合行政执法大队,柳河 135300;3.湖南省永州市零陵区畜牧水产事务中心,永州 425199)
原细小病毒(Protoparvovirus,PtPV)属于细小病毒科(Parvoviridae)细小病毒亚科(Parvovirinae),其属重要病原体包括猫细小病毒(feline panleukopenia virus,FPV)、犬细小病毒(Carnivoreprotoparvovirus,CPV)、小鼠微小病毒(minute virus of mice,MVM)、猪细小病毒(porcine parvovirus,PPV)、布法病毒(bufavirus,BuPV)等。由于PtPV基因组的编码能力有限且复制过程以及结构亚基和衣壳组装的核易位都与宿主细胞的细胞周期紧密耦合[1],所以PtPV更容易在分裂旺盛的细胞中进行复制(如肠隐窝、心肌细胞和骨髓前体细胞)。同时,细小病毒,特别是一些啮齿类PtPV,如H-1细小病毒(H-1 parvovirus,H-1PV)、MVM和LuIII细小病毒(LuIII virus),表现出明显的嗜瘤性和溶瘤性,并对人类是非致病性的[2],具有抗肿瘤特性的病毒被称为溶瘤病毒(oncolytic virus,OVs)。近年来,我国癌症的发病率和死亡率都呈现上升趋势,处于较高水平[3]。动物也十分容易患上癌症,例如,10岁以上的犬中有近一半会患上癌症。尽管目前癌症诊断和治疗方案取得了进展,但对恶性肿瘤的治疗效果仍不理想。而细小病毒这一类OVs被看作是癌症治疗的新未来,OVs可以通过细胞病变作用诱导肿瘤细胞死亡,而不会对正常宿主组织造成重大伤害[4]。目前全球已有4种OVs(Rigvir、Oncorine、Talimogene laherparepvec、DELYTACT)被批准用于治疗,由腺病毒改造的OV-Oncorine在中国获批上市,是全球第一个获批,也是我国唯一批准的溶瘤病毒药物[4]。全面了解PtPV与宿主细胞转运机制的动态相互作用将有助于更好地了解其感染机制和抗肿瘤特性。
1 PtPV形态特征及分类
1.1 病原体结构
PtPV具有直径18~26 nm的无包膜蛋白衣壳,该衣壳呈T=1二十面体对称结构。该衣壳由60个亚基组成,其中VP1和VP2组成比例近似1∶10。PtPV基因组为约5 kb单链DNA,DNA的5′端发夹端粒约为120 nt,呈T型结构;而3′端右端发夹约为250 nt,呈Y型结构(图1)。PtPV在复制过程中既会产生正链DNA也会产生负链DNA,包装正链的颗粒可能性较低。其中MVM主要包装负链,而LUIII细小病毒两种核酸链被包装的概率相似。
1.2 编码蛋白
细小病毒基因组在p4和p38启动子的控制下有两个主要的开放阅读框(open reading frame,ORF),它们分别编码复制所必需的非结构蛋白(non-structural protein,NS)和结构蛋白——衣壳蛋白(capsid viral protein,VP)(图1)[5]。
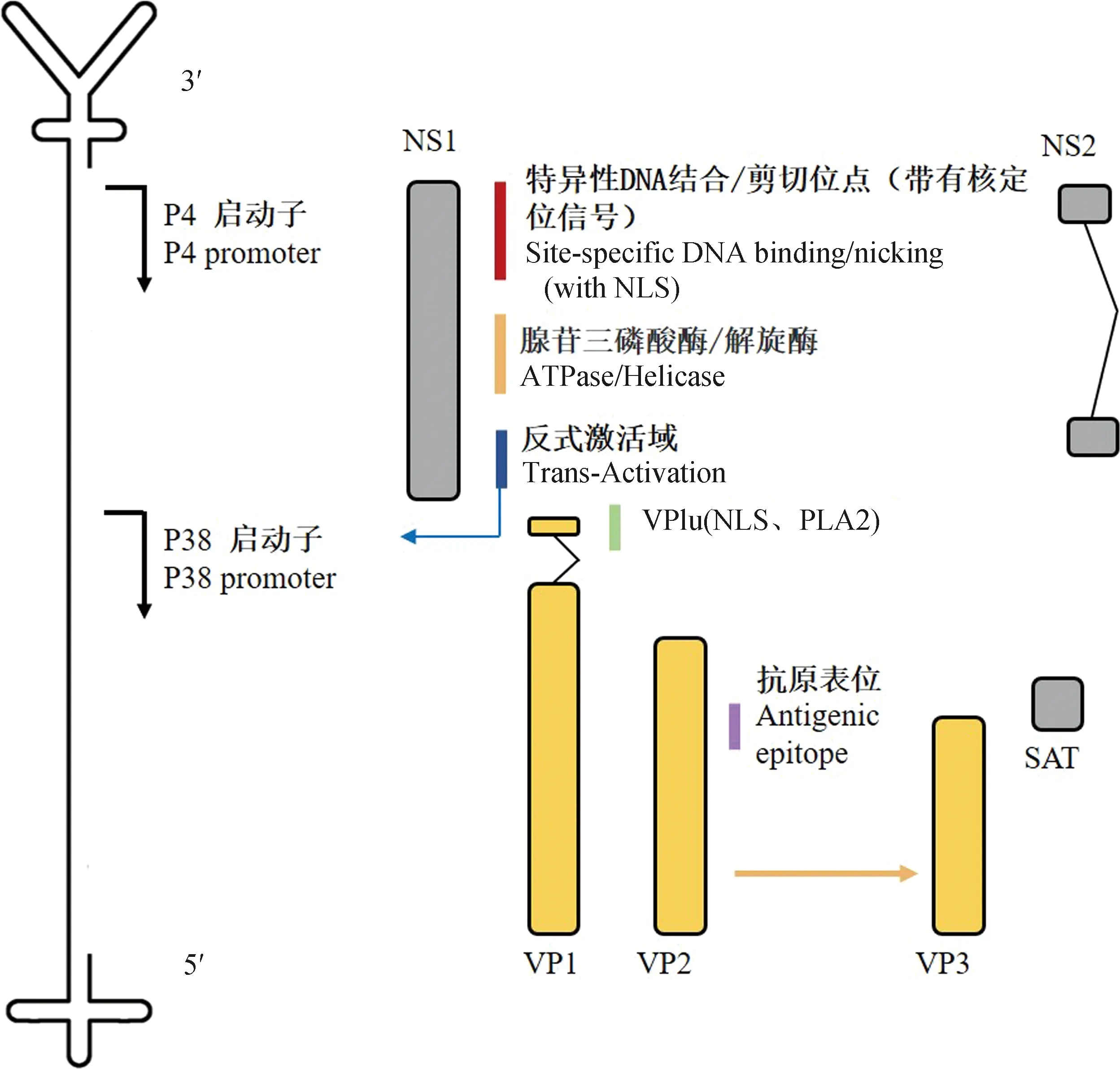
图1 PtPV基因组及编码蛋白Fig.1 PtPV genome and encoded proteins
NS蛋白是细小病毒复制过程中不可或缺的。NS1是一种80 ku左右的核磷蛋白、复制起始蛋白,含有N端起源结合结构域、解旋酶结构域和C末端交互结构域,具有特异性DNA结合位点以及ATP酶、切口酶和解旋酶活性[6],参与调节病毒基因表达、切割病毒DNA基因组,也是细胞毒性的主要介质,单纯的NS1表达足以杀死癌细胞。NS1还参与细胞周期控制、细胞凋亡、线粒体呼吸和糖酵解相关通路[7-8]。而NS2(25 ku)的作用未被清晰确定,其可能在病毒复制、病毒mRNA转录、衣壳的组装与核出口等过程中发挥作用[9]。FPV的NS2 C末端以及卷曲螺旋区域被证明可以抑制干扰素的产生(interferon,IFN),其通过靶向丝氨酸/苏氨酸蛋白激酶(threonine-protein kinase,TBK1)并阻止其被干扰素基因刺激物(stimulator of interferon genes,STING)蛋白募集,从而破坏下游蛋白IFN调节因子3(IFN regulatory factors 3,IRF3)的磷酸化,抑制IFN以减弱先天免疫反应实现免疫逃避[10]。除了NS1、NS2,PtPV还表达另一种非结构蛋白SAT(small alternatively translated)蛋白,在PPV感染中诱导不可逆的内质网应激导致细胞的凋亡和裂解[11]。
VP蛋白ORF编码VP1和VP2两种结构蛋白。VP1蛋白大约80 ku,是较大但数量很少的衣壳成分,含有独特的N端延伸,称为VP1u;VP2蛋白大约64 ku,是主要的衣壳成分;而对于该属的一些成员,例如PPV,会在基因组包装后通过水解切割VP2的N末端15~18个氨基酸产生VP3[5,12]。VP1包含一个143个残基的N末端序列(VP1u),该序列含有参与核定位的碱性氨基酸基序(nuclear localization sequence,NLS)以及会影响磷脂酶A2(phospholipase A2,PLA2)酶活性[13]。VP2与受体识别和核转位有关[14],且含有刺激产生中和抗体的主要表位,VP2关键氨基酸位点的突变会影响其受体结合、抗原特征和宿主范围[15]。
1.3 分类学
依据国际病毒分类委员会(The International Committee on Taxonomy of Viruses,ICTV)对细小病毒的分类报告[16],可以通过NS1遗传距离标准来对细小病毒进行确认分类。细小病毒科成员的基因组序列必须是连续的,需包含具有高度保守的解旋酶超级家族3(superfamily 3,SF3)结构域的NS1的完整编码区以及VP编码区,且其基因组应该在4~6 kb,其转录因子结合域(motif pattern)也应该具有细小病毒科的特点。而划分某个细小病毒属于哪个属的依据是在该病毒的SF3结构域,此外,同一属的成员的NS1蛋白氨基酸序列应至少具有35%~40%的相似性且任何两个成员之间的相似性应该超过80%。同一种的成员则需要NS1氨基酸序列相似性超过85%[17]。
2 PtPV感染机制
2.1 结合细胞机制
PtPV通过衣壳附着在靶细胞的特定受体上。其中唾液酸(sialic acid,SA)是MVM、H-1PV、PPV等的结合受体,结合位点位于病毒衣壳的二倍轴区域(图2),而在肿瘤细胞中高表达的转铁蛋白受体(transferrin receptor,TfR)为FPV、CPV衣壳三倍轴区域的结合受体[15,18]。但体外血凝试验显示CPV和FPV可以通过SA与红细胞结合,同时也有研究证明改变或消除TfR的内化信号并不能预防其感染[2]。另外CPV、FPV的血凝性都受到溶液中钙离子浓度影响[19]。PtPV结合SA的能力也使其可以与肠黏液、组织碎片和食物中的SA结合,使其在环境中存在时间更久,也更容易传播。
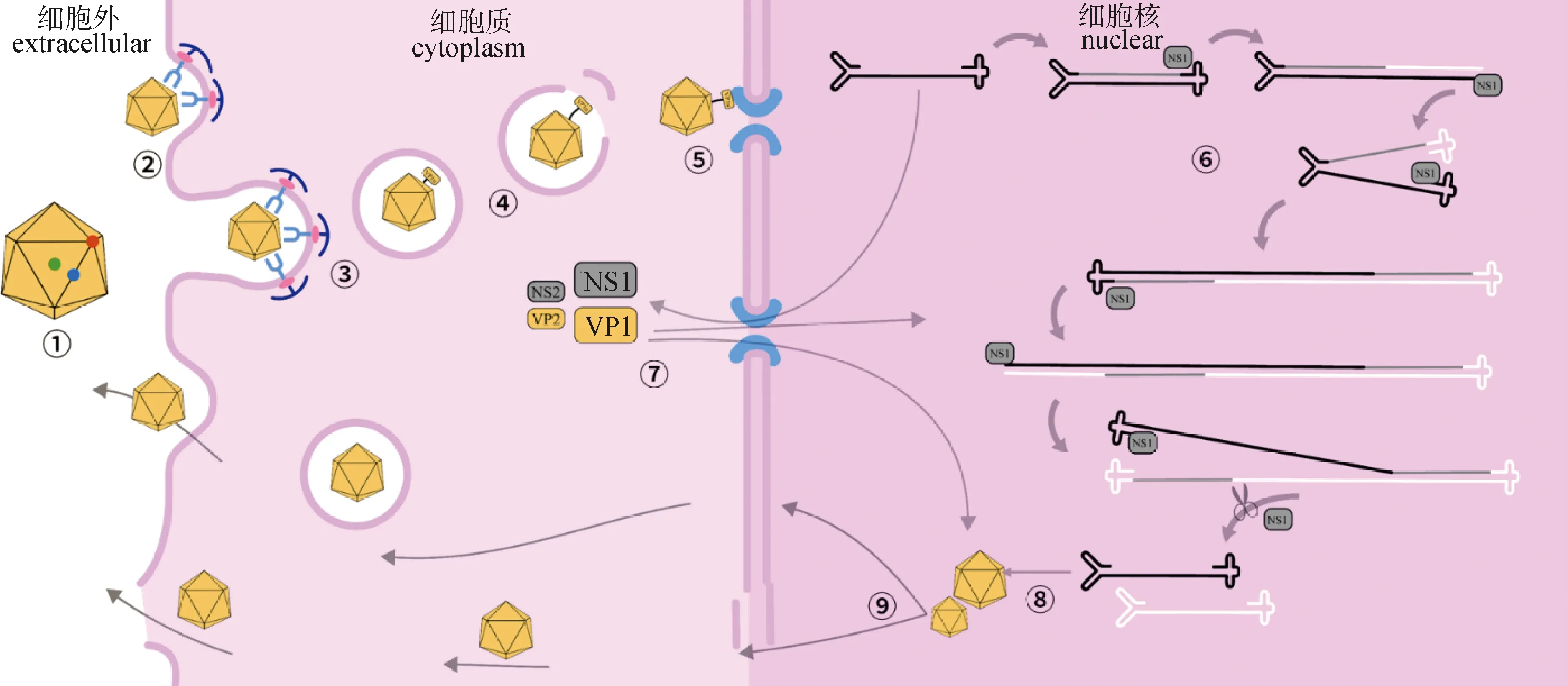
①PtPV颗粒二十面体结构(红:五倍轴,绿:三倍轴,蓝:二倍轴);②PtPV衣壳与细胞膜表面一种或多种特定受体结合;③PtPV衣壳通过网格蛋白介导的内吞作用内化;④病毒通过磷脂酶裂解内体膜从内体逃逸;⑤PtPV通过核孔复合体入核;⑥病毒基因组复制机制;⑦表达NS1蛋白并入核参与复制和衣壳组装;⑧衣壳包装基因组;⑨后代病毒通过胞吐或裂解扩散 ①PtPV particle has an icosahedral structure (red-colored point: pentameric axis;green-colored point: trimeric axis;blue-colored point: dimeric axis); ②PtPV capsids bind to one or more special receptors exposed on the host cell membrane; ③PtPV capsids are internalized via clathrin-mediated endocytosis; ④Escape from the endosome by cleaving the endosomal membrane with a phospholipase; ⑤PtPV entry into the nucleus through the nuclear pore complex; ⑥Replication of the viral genome; ⑦Expression of the NS1,which enter the nucleus and participate in replication and capsid assembly; ⑧The new capsids package the new genome; ⑨Release of progeny virus through cell lysis or vesicular diffusion图2 PtPV感染与复制机制示意图Fig.2 Illustration of the infection and replication mechanism of PtPV
PtPV在与功能受体结合后被宿主细胞的内吞作用内化[2]。一般是通过网格蛋白介导的内吞(clathrin-mediated endocytosis,CME),以CPV为例,部分病毒在形成网格蛋白包被的区域被捕获,而另一些病毒则在结合部位诱导网格蛋白组装[20]。虽然CME是主要的内吞途径,但也存在其他内吞途径,例如MVM就确定了还有至少3种不同的机制:小窝蛋白(caveolin)、脂筏(lipid-raft)和网格蛋白非依赖性载体介导的内吞途径[21]。
2.2 入核途径
PtPV的内体运输过程被认为是缓慢的。pH不断降低的内体微环境会导致病毒衣壳结构发生变化,导致VP1u序列暴露并发挥磷脂酶活性,从而分解内体膜并逃逸(图2)。因此,一些药物如巴佛洛霉素 A1(bafilomycin A1)和弱碱二磷酸氯喹(weak base chloroquine diphosphate)可以提高内体pH值,从而阻止PtPV的感染[2]。
从内体逃逸后,PtPV会利用细胞骨架,如微管(microtubules,MTs)、中间纤维(intermediate filament,IF),以及相关运动蛋白,如肌动蛋白(actin),转运到细胞核。PtPV入核过程则需要暴露在外的VP1u序列中的NLS引导,NLS是一种核定位信号,有助于将病毒导航到细胞核,从而导致进一步的核易位。而在PPV中发现另一种NLS是一种新型核定位基序,在感染晚期将VP2三聚体靶向细胞核[22]。对于PtPV的入核机制目前有两种解释,一是通过衣壳蛋白VP1的NLS与核转运受体输入蛋白β(importin-β)相互作用[23],结合核孔复合物并通过核孔进入;二是病毒与核孔的直接作用或者与importin-β间接作用导致核包膜的局部解体使病毒进入细胞核[8-9,23]。在核输入的经典途径中,importin-β通过importin-α连接到暴露在病毒表面的NLS,病毒随之结合核孔复合物并通过核孔进入核篮(nuclear basket),importin-β与病毒解离回到细胞质[23]。MVM在入核过程中甚至可以直接改变核膜的结构并对核外膜造成损伤[24]。
2.3 病毒的复制与释放
PtPV复制依赖于宿主细胞有丝分裂,且严格依赖于S期细胞因子。在转录因子的作用下,p4启动子被激活,并开始表达NS1。PtPV基因组通过滚动发夹复制(rolling hairpin replication,RHR)复制(图2),这是一种由NS1启动的单向、链置换形式的DNA复制[25],该机制依赖于发夹末端的顺序展开和重新折叠[16],单向链置换合成产生连续的双链中间体,具有核酸内切酶活性的NS1会周期性地从中切下后代单链[26]。同时NS1激活P38启动子,诱导VP蛋白的表达,并指导衣壳组装过程。
新合成的衣壳蛋白在细胞质中形成三聚体(1×VP1+2×VP2),并仅在S期通过结构依赖的运输基序转运到细胞核中,且该易位依赖于细胞Raf-1激酶的三聚体磷酸化。之后衣壳蛋白三聚体在细胞核中组装为病毒衣壳。通过对AAV、MVM的研究,新产生的MVM完整衣壳可以从细胞核中有效输出,并且受到暴露于外部的磷酸化的VP2 N端序列内的Ser和Thr调节[27-28]。PtPV后代病毒粒子可以通过囊泡主动转运到细胞外围,如MVM[29];或是在细胞核中积累,直到通过细胞裂解释放,如FPV[16];亦或是同步存在的。
3 PtPV的细胞毒性与溶瘤性
3.1 PtPV诱导细胞死亡的机制
PtPV可以诱导细胞坏死或凋亡,具体机制因病毒和细胞类型而异。目前公认的是,PtPV的主要调节蛋白NS1在病毒的复制、传播、胞吐以及诱导细胞死亡等方面发挥重要作用,但其诱导细胞死亡的分子机制尚未完全阐明。NS1是PtPV基因组早期表达产物,其积累将终止宿主细胞DNA复制和诱导DNA损伤,并使控制细胞周期的因子失调导致细胞周期停滞于在S期或G1期[30]。已有研究表明CPV、H-1PV、MVM的NS1可以通过活化多种半胱天冬酶(caspases)、引起线粒体膜去极化、引发活性氧(reactive oxygen species,ROS)的聚集导致细胞色素C的释放、p53非依赖性细胞凋亡等内在凋亡通路[31-34]。啮齿动物PtPV的NS1还会破坏细胞骨架,包括微丝(microfilaments)、凝溶胶蛋白(gelsolin)、IF等[30]。在MVM感染细胞相关试验中发现NS1细的胞毒性活性似乎与蛋白激酶2(protein kinase Ⅱ,CKⅡ)复合物的形成相关,并发现NS1-CKⅡ复合物可以磷酸化原肌球蛋白、肌动蛋白等导致其重排和降解从而破坏细胞骨架并刺激和调节胞吐作用来控制病毒的传播与细胞溶解[31,35]。此外,研究发现除了通过ROS/线粒体途径诱导细胞凋亡外,PPV还可以通过激活TLR2-NF-κB信号通路诱导细胞凋亡[36],在感染早期,NS1激活NF-κB信号通路并诱导炎性细胞因子IL-6和TNF-α的分泌,这些炎性细胞因子进一步激活NF-κB通路,从而上调信号通路相关因子和炎性细胞因子的表达水平[37]。NS1的活性和功能已被证明受到多种信号通路的调控,包括磷脂依赖性激酶、蛋白激酶C、蛋白激酶B(PDK/PKC/PKB)等[30]。NS1上不同氨基酸残基的磷酸化和乙酰化也被认为是蛋白质不同功能的开关。例如,研究表明H1-PV NS1的K85、K257残基的乙酰化可以增强NS1的细胞毒性[38-39]。
3.2 PtPV的抗肿瘤机制
溶瘤病毒在抗肿瘤方面具有三个核心机制,包括对肿瘤细胞的细胞病变作用、刺激免疫系统增强抗肿瘤免疫能力以及与其他肿瘤治疗方式的协同作用。从某些数据来看,PtPV与免疫系统之间存在密切的合作,可以协同抑制肿瘤生长[40]。
啮齿动物以及食肉动物PtPV的NS1已被证明具有肿瘤毒性[39],在癌细胞中NS1可以导致细胞周期停滞、细胞凋亡、坏死、溶酶体样程序性细胞死亡或细胞溶解[30]。此外,NS1的功能还强烈依赖于PDK/PKC/PKB信号传导,而激活PDK/PKC/PKB通路的突变是继P53基因失活突变之后第二常见的癌症相关基因,在大多数癌症中,PDK/PKC/PKB级联反应会被上调,因此NS1的细胞毒性会特异性地靶向癌细胞[41]。NS1对细胞骨架的破坏也使得比正常细胞原肌球蛋白表达量低的癌细胞更容易被诱导死亡。随后NS1裂解癌细胞释放肿瘤相关抗原(tumor-associated antigens,TTA)和损伤、病原体相关分子模式(danger- and pathogen-associated molecular patterns,DAMPs and PAMPs),激活TAA特异性细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTL)反应,从而导致肿瘤细胞被识别和破坏。这种反应还引起树突状细胞(dendritic cells,DC)交叉递呈,进一步促进免疫系统对肿瘤的识别和激活肿瘤特异性CTL[34]。
3.3 PtPV在抗肿瘤方面的应用案例
目前啮齿动物原细小病毒中H-1PV在临床试验中表现出较好的抗肿瘤活性和安全性,含有H-1PV的药物制剂ParvOryx在原发或复发性胶质母细胞瘤患者I/IIa期临床试验(ParvOryx01)证明了H-1PV的安全性和耐受性[42]。在部分胶质瘤细胞中,H-1PV可导致活性的组织蛋白酶B、L从溶酶体转移到细胞质,同时下调细胞质中半胱氨酸蛋白酶抑制剂(cystatin)B、C的水平[43]。ParvOryx01成功后,进行了H-1PV的第二次临床试验(ParvOryx02),该试验通过静脉和瘤内注射ParvOryx来评估该疗法在不能手术且存在肝转移的胰腺癌患者中的安全性、耐受性和疗效[44]。在两项试验中ParvOryx所有剂量水平下均表现安全,患者表现出良好的免疫学特征,包括肿瘤微环境的变化和特异性免疫反应的诱导[45],在患者血清中很少检测出H-1PV中和抗体阳性[46]。但使用病毒仍存在一定的安全问题。有研究发现不同FPV/CPV-2毒株在不同宿主细胞培养物中体外生长时其VP2具有积累突变的现象[47],细小病毒的重复感染与多种细小病毒的共感染可能会促进病毒的重组和高遗传异质性,使它们在新环境中具有宿主适应性[48]。虽然相对来说PtPV的遗传突变非常有限,主要是同义突变,且由于较低的基因突变率和较强的选择性限制氨基酸突变,使得其跨物种传播相对困难。不过,CPV已经扩展了其宿主范围至猫科动物,并且能导致猫出现猫泛白细胞减少综合征[49]。不同的细小病毒共感染猫科动物可能导致病毒基因重组,使宿主范围进一步扩大[50]。
NS1也已被证明具有抑制肿瘤细胞生长的作用,能够靶向肿瘤细胞而不伤害正常细胞,并诱导机体产生抗肿瘤免疫应答。异位过表达NS1被视为抑制肿瘤的新策略,CPV2 NS1曾在小鼠乳腺肿瘤模型中表达并表现出抑制作用[32],因此已在肝细胞癌(hepatocellular carcinoma,HCC)中进行表达试验[51]。
4 小结与展望
PtPV表现出广泛的病理变化,尽管一些PtPV感染是无症状的,但有一些PtPV,如FPV、CPV和PPV等,具有显着的致病性,例如,FPV可以引起猫科动物泛白细胞减少综合征;PPV可以引起猪死产-木乃伊胎-胚胎死亡-不育综合征。PtPV对环境因素抵抗力强,可以在环境中长期存在,并通过与感染动物或其体液的直接接触以及与受污染的表面或物体的间接接触传播,对动物的健康和农业生产产生不良影响。本综述总结了目前已知的PtPV感染和复制机制的信息,阐述了病毒如何进入宿主细胞、如何繁殖和复制、以及如何通过裂解细胞或囊泡扩散释放后代病毒,但对于新出现的PtPV,如布法病毒、Cutavirus、Tusavirus等还知之甚少。有效的疫苗接种依旧是预防PtPV的重要手段,通过深入了解PtPV的感染机制和生物学特征,可以更好地预测和预防未来的病毒感染,进而保障公共卫生和农业安全。
PtPV在抗肿瘤方面具有很大的潜力。一方面,它可以选择性地感染某些肿瘤细胞,而对正常细胞的影响较小,从而减少了对患者的副作用;另一方面,PtPV具有很强的细胞毒性和免疫刺激作用,能够诱导肿瘤细胞凋亡和激活免疫系统,从而进一步增强其抗肿瘤效应。目前除了对病毒或是NS1本身的优化,也许可以进一步改善相关佐剂和载体(如脂质体、病毒载体、细胞穿膜肽等)。同时细小病毒作为生物制剂的开发还集中在其衣壳蛋白上,其衣壳蛋白可用作基因递送应用中的病毒载体,基于细小病毒的基因工程病毒已经被设计出来用于携带和输送药物、肿瘤相关抗原和免疫调节基因等。但在具体应用时需要进一步加强对其生物学特性和安全性的研究。
因此,对PtPV的研究有助于更深入地理解它们的感染机制、病原学和分子生物学特征,从而为PtPV感染的预防和治疗提供新的思路和方法。此外,对于PtPV感染的研究,以及对病毒和宿主之间相互作用的深入研究,也有望为癌症治疗提供新的策略和可能性,这些研究将为人们提供更为科学和乐观的前景。



