张祺琪,王俊梅,岳子奇,郭逸芯,施丽媛,张晓红,邹华围,彭全辉,薛 白, 王立志,王之盛,胡 瑞
(四川农业大学动物营养研究所 肉用牛低碳养殖创新团队 四川省牛低碳养殖与安全生产高校重点实验室, 成都 611130)
牦牛是青藏高原优势畜种,是当地主要的畜牧产业,也是农牧民重要经济收入来源。高原牧区漫长而严寒的冷季使得饲草料缺乏,牦牛在冷季时因饥饿造成生长性能降低和生长发育迟缓,牧民损失大,养殖生产效益低[1-2]。本课题组前期研究发现,生长迟缓牦牛的瘤胃液和血液中LPS浓度高于正常牦牛,瘤胃上皮补体C3、TNF-α等免疫炎症相关因子表达高于正常牦牛,其存在炎症反应,导致瘤胃上皮屏障功能受损、营养物质转运吸收受阻,生长迟缓牦牛饲料转化率较正常牦牛组降低38.1%[3-4]。补饲活性酵母、谷氨酰胺缓解瘤胃上皮炎症反应可增强上皮屏障功能,显着促进生长迟缓牦牛补偿生长[5]。瘤胃是反刍动物营养消化、吸收代谢和免疫的重要器官[6]。瘤胃健康是反刍动物高效养殖的基础,细胞ATP生成可为瘤胃上皮细胞增殖、屏障功能、营养转运等提供能量,瘤胃上皮细胞含有高密度线粒体,能量代谢旺盛[7]。Kong等[8]研究表明,肉牛增重速度、饲料转化率与瘤胃上皮细胞线粒体氧化磷酸化功能基因表达呈显着正相关。因此,高效的ATP生成是瘤胃上皮发育和功能健康的基础,但LPS诱导炎症反应是否抑制牦牛瘤胃上皮细胞ATP生成尚不清楚。
细胞内补体系统是响应LPS等免疫原启动免疫炎症反应和调控细胞能量代谢的重要系统。补体(complement)长期以来被认为是由肝分泌进入血液和淋巴液循环的一类蛋白。当细菌、病毒、内毒素(LPS)等外源抗原进入血液,首先被宿主抗体识别、结合后诱导血液中补体C3激活,C3蛋白分子被血液中转化裂解酶(convertase)裂解为过敏毒素(anaphylatoxin, C3a)和调理素(opsonin, C3b)活性肽段,进而激活下游补体成分级联反应,发挥激活免疫细胞、降解抗原蛋白、诱发炎症等免疫作用。近年研究发现,免疫细胞(人T细胞、淋巴细胞)和非免疫细胞(人肠上皮细胞[9]、人视网膜上皮细胞[10]、小鼠脂肪细胞[11]等)均可合成补体C3蛋白,其通过细胞内源组织蛋白酶(cathepsin)完成补体C3细胞内激活和自分泌并直接作用于细胞信号通路,除了参与细胞免疫炎症反应,还可调控细胞脂肪代谢、糖酵解等能量代谢过程[9]。并基于免疫细胞研究提出了细胞内补体-能量代谢调控轴[12]。Wang等[13]和本课题组Hu等[1]通过转录组测序发现,奶牛和牦牛瘤胃上皮存在补体C3基因表达,但瘤胃上皮细胞作为非免疫细胞是否存在LPS刺激下依赖组织蛋白酶的细胞内补体C3激活尚不清楚,由LPS诱导的炎症是否抑制瘤胃上皮细胞ATP生成亦不清楚,因此,本研究利用不同浓度LPS诱导牦牛瘤胃上皮细胞建立炎症模型,考察LPS对牦牛瘤胃上皮细胞补体C3激活关键酶、激活产物C3a和C3b浓度等的影响,以及细胞ATP生成的影响,为牦牛瘤胃上皮健康调控提供数据支撑和试验依据。
1 材料与方法
1.1 主要材料和试剂
牦牛瘤胃上皮细胞选自本课题组前期分离并构建的永生化牦牛瘤胃上皮细胞系[14];1640培养基、胎牛血清和0.25%的EDTA胰酶购自上海Gibco公司,LPS(大肠杆菌)购自美国Sigma公司,CCK-8试剂盒购自成都Oriscience公司,牛(Bovine)白细胞介素6(IL-6)、牛(Bovine)白细胞介素1β(IL-1β)、牛(Bovine)肿瘤坏死因子α(TNF-α)、牛(Bovine)补体片段3a(C3a)、牛(Bovine)补体片段3b(C3b)和牛(Bovine)柠檬酸(CA) ELISA检测试剂盒购自重庆博诺恒生物科技有限公司,SteadyPuer快速RNA提取试剂盒和SYBR Green Pro Taq HS预混型qPCR试剂盒购自湖南艾科瑞生物工程有限公司,Hifair III 1st Strand cDNA Synthesis SurperMix for qPCR试剂盒购自上海Yeasen生物公司,DAPI染色液、Mito-Tracker Red CMXRos和增强型线粒体膜电位检测试剂盒(JC-1)购自上海碧云天生物公司。
1.2 牦牛瘤胃上皮细胞复苏与培养
选取冻存牦牛瘤胃上皮细胞在37 ℃水浴锅中快速融化,1 000 r·min-1离心3 min,弃上清。加入1 mL完全培养基(89% 1640培养基+1%三抗+10%胎牛血清)重悬后接种于25 cm2细胞瓶,37 ℃、5% CO2培养至细胞密度为90%以上时,消化后传代。
1.3 LPS诱导牦牛瘤胃上皮细胞炎症模型建立
将消化离心后的牦牛瘤胃上皮细胞计数并调整细胞浓度为104·mL-1按100 μL·孔-1的细胞悬液接种于96孔板,37 ℃、5% CO2培养24 h,弃上清,用PBS洗2遍。分别加入100 μL·孔-1LPS溶液(89% 1640培养基+1%三抗+10%胎牛血清培养基稀释至10、20、40、80、160 μg·mL-1),以完全培养基培养牦牛瘤胃上皮细胞为对照组,另以只含有完全培养基的孔为空白组,每个处理设置6个重复,处理细胞24 h。采用CCK-8试剂盒检测细胞存活率,初步筛选诱导牦牛瘤胃上皮细胞炎症模型LPS的浓度。
1.4 ELISA法测定相关指标
将消化离心后的牦牛瘤胃上皮细胞按照合适密度接种于6孔板中,待细胞融合至80%~90%时,分别加入2 mL·孔-1LPS溶液(89% 1640培养基+1%三抗+10%胎牛血清培养基稀释至0、10、20、40、80、160 μg·mL-1),其中0 μg·mL-1为对照组,每个处理设置6个重复,处理细胞24 h。收集各孔细胞上清和细胞,用于后续ELISA检测 IL-6、IL-1β、TNF-α、C3a和C3b的含量,具体操作步骤按照试剂盒说明书进行。
1.5 RNA提取和qPCR
1.5.1 RNA提取和cDNA合成 收集的细胞样采用SteadyPure快速RNA提取试剂盒提取细胞总RNA,利用紫外分光光度计测定其浓度以及纯度(OD260 nm/OD280 nm≥ 1.8),检验合格后,取10 μL总RNA,按照逆转录试剂盒说明书,逆转录得到cDNA。
1.5.2 qPCR引物 参照GenBank上牦牛的IL-6、IL-1β、TNF-α、C3、ME1、LDHA、CTSB、CTSL及β-actin内参基因引物序列,通过上海生工生物工程股份有限公司成都分部设计引物并合成,并用RNase-Free ddH2O稀释至100 μmol·L-1,引物序列见表1。
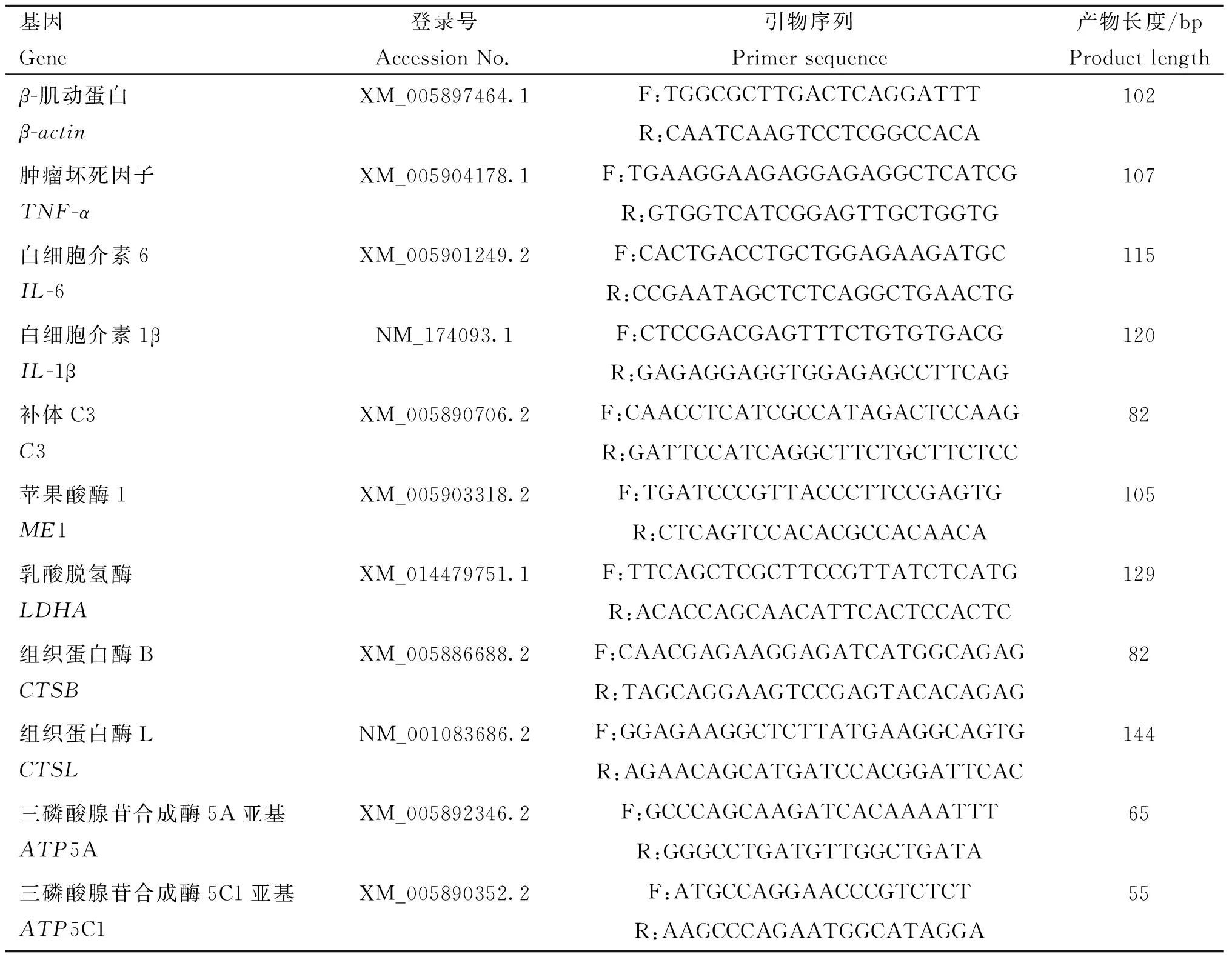
表1 实时荧光定量PCR扩增的基因引物序列Table 1 Primer sequences for Real-time PCR
1.5.3 qPCR反应 分别以不同浓度的LPS(0、10、20、40、80、160 μg·mL-1)诱导牦牛瘤胃上皮细胞的cDNA为模板,根据qPCR试剂盒进行相关基因相对表达水平检测。qPCR反应体系为2×TB Green Premix Ex Taq Ⅱ 10 μL,上、下游引物各0.2 μL,cDNA模板1 μL,2× SYBR Green Pro Taq HS Premix5 μL,加无菌无酶的ddH2O至10 μL。qPCR反应程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,共40个循环;95 ℃ 15 s,60 ℃ 60 s。每个检测进行4次重复。不同的引物mRNA的相对转录量用2-ΔΔCt(ΔΔCt=目的基因ΔCt值-内参基因ΔCt值)表示目的基因的相对表达量。
1.6 微量法检测ATP含量
将消化离心后的牦牛瘤胃上皮细胞按照合适密度接种于6孔板中,待细胞融合至80%~90%时,分别加入2 mL·孔-1LPS溶液(89% 1640培养基+1%三抗+10%胎牛血清培养基稀释至0、10、20、40、80、160 μg·mL-1),其中0 μg·mL-1为对照组,每个处理设置6个重复,处理细胞24 h。收集各孔细胞,利用微量法检测ATP的含量,具体操作步骤按照试剂盒说明书进行。
1.7 线粒体染色荧光强度
将消化离心后的牦牛瘤胃上皮细胞按照合适密度接种于12孔板中,待细胞融合至60%~70%时,分别加入1 mL·孔-1LPS溶液(89% 1640培养基+1%三抗+10%胎牛血清培养基稀释至0、10、20、40、80、160 μg·mL-1),其中0 μg·mL-1为对照组,每个处理设置6个重复,处理细胞24 h。根据Mito-Tracker Red CMXRox试剂盒说明书对线粒体染色后,用4%的多聚甲醛固定细胞20 min,再利用DAPI染色液对细胞核进行染色,利用荧光显微镜观察并拍照。
1.8 线粒体膜电位检测(JC-1)
将消化离心后的牦牛瘤胃上皮细胞按照合适密度接种于6孔板中,待细胞融合至80%~90%时,分别加入2 mL·孔-1LPS溶液(89% 1640培养基+1%三抗+10%胎牛血清培养基稀释至0、10、20、40、80、160 μg·mL-1),其中0 μg·mL-1为对照组,每个处理设置6个重复,处理细胞24 h。消化后用1.5 mL离心管收集,具体操作按照增强型线粒体膜电位检测试剂盒(JC-1)说明书进行。装载JC-1后利用流式细胞仪进行分析。
1.9 数据统计分析
获得的数据用EXCEL 2019进行初步整理,使用SPSS 27.0统计软件进行数据分析。数据先进行正态分布检验,后使用One-way-ANOVA程序进行单因素方差分析,并以Duncan’s法进行多重比较。线粒体染色荧光强度通过ImageJ软件进行分析,流式细胞仪测定的线粒体膜电位变化用FlowJo_V10软件分析,最后结果用Graph PadPrism 8.0.0软件绘制柱状图。结果以P<0.05为差异有统计学意义,P<0.01为差异极显着。
2 结 果
2.1 不同浓度LPS对牦牛瘤胃上皮细胞活力的影响
如图1所示,通过LPS不同浓度(0、10、20、40、80、160 μg·mL-1)处理牦牛瘤胃上皮细胞24 h后,细胞活力呈极显着下降趋势(P<0.01)。与对照组相比,LPS浓度为10 μg·mL-1时,显示极显着差异(P<0.01)。
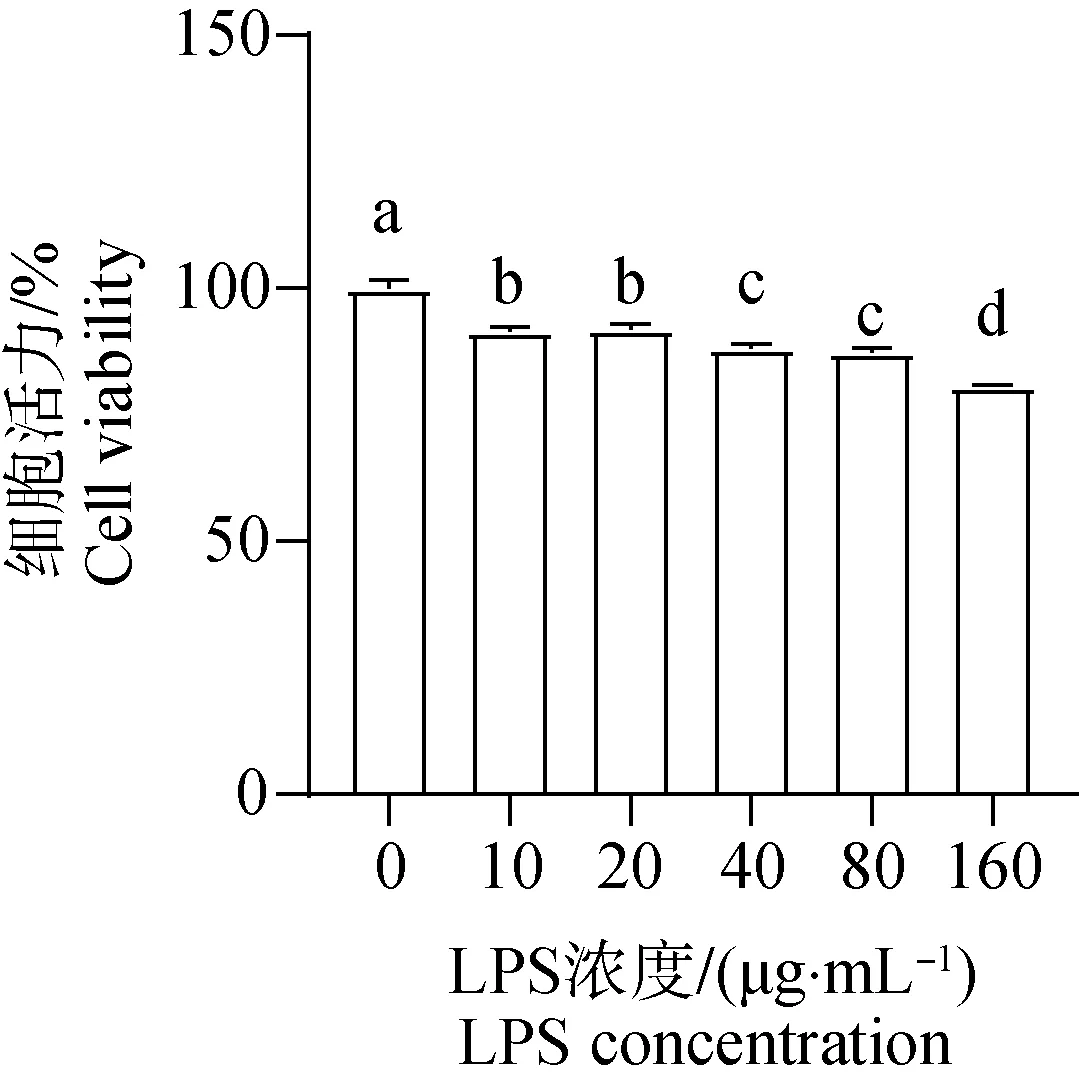
不同小写字母表示数据间差异极显着(P<0.01)。下同 Different lowercase letters indicate significant difference(P<0.01). The same as below图1 LPS对牦牛瘤胃上皮细胞活力的影响Fig.1 Effects of LPS on cell viability of yak rumen epithelial cells
2.2 不同浓度LPS对牦牛瘤胃上皮细胞促炎因子分泌的影响
图2A所示,与对照组相比,LPS不同浓度组的细胞培养基中TNF-α、IL-1β和IL-6等促炎因子浓度呈极显着上升(P<0.01)。由图2B可知,基因表达量同浓度趋势变化相同,随着LPS浓度增加,促炎因子基因表达量逐渐升高(P<0.01)。
2.3 不同浓度LPS对牦牛瘤胃上皮细胞补体C3激活的影响
如图3A所示,与对照相比,不同LPS浓度处理牦牛瘤胃上皮细胞后,补体C3的基因相对表达量极显着上升(P<0.01)。图3B得知,补体C3激活产物补体片段C3a和C3b的含量同样也随着LPS浓度上升而极显着增加(P<0.01)。细胞内补体C3激活关键酶CTSB和CTSL基因表达量如图3C,与对照组相比,CTSB的基因相对表达量随着LPS浓度增加极显着上调(P<0.01)。与之相反,CTSL的基因相对表达量极显着下降(P<0.01)。
2.4 不同浓度LPS对牦牛瘤胃上皮细胞ATP生成的影响
2.4.1 LPS对ATP生成代谢物浓度的影响 如图4所示,与对照组相比,LPS处理导致牦牛瘤胃上皮细胞ATP的含量极显着下降(P<0.01)。在LPS浓度为20 μg·mL-1时,与对照组相比,ATP的含量极显着降低(P<0.01)。细胞无氧呼吸产物乳酸(LA)浓度极显着下调(P<0.01)。三羧酸循环重要中间代谢产物柠檬酸(CA)的含量随着LPS浓度增加先上升后又逐渐下降(P<0.01)。
2.4.2 LPS对线粒体数量的影响 由图5A可知,通过线粒体红色荧光探针染色后发现,添加不同浓度的LPS,使线粒体荧光强度极显着下降(P<0.01)。由图5B统计后发现,与对照组相比,LPS浓度在10 μg·mL-1时,线粒体红色荧光强度极显着下降(P<0.01)。
2.4.3 LPS对线粒体膜电位的影响 图6所示为采用流式细胞术检测不同浓度LPS对牦牛瘤胃上皮细胞攻毒24 h后,线粒体膜电位的变化,发现随着LPS浓度的升高,产生红光的聚合物逐渐减少,也就是线粒体膜电位逐渐降低(P<0.01)。在浓度20 μg·mL-1时,与对照组相比,线粒体膜电位极显着下降(P<0.01)。
2.4.4 LPS对ATP生成相关基因表达的影响 由图7A得知,参与有氧呼吸催化丙酮酸进入三羧酸循环产能的ME1基因表达随着LPS浓度的升高极显着降低(P<0.01),图7B可知,丙酮酸进入无氧呼吸后促进产生乳酸的关键酶LDHA的基因,在添加LPS后极显着上调(P<0.01)。如图7C所示ATP5A和ATP5C1的基因表达量随着LPS不同浓度的处理极显着下调(P<0.01),在LPS浓度为20 μg·mL-1时,ME1、LDHA、ATP5A和ATP5C1的基因表达量与对照组相比均具有极显着差异(P<0.01)。
3 讨 论
前期研究表明,生长迟缓牦牛瘤胃液和血液中LPS浓度升高导致瘤胃上皮发生免疫炎症反应,损伤瘤胃上皮屏障功能,抑制牦牛饲料转化率和机体高效生长[1]。炎症是机体受到病原体、有毒化合物或者辐射等刺激时产生的保护性反应,能促进受损组织愈合并恢复动态平衡[15]。LPS可以通过上调IL-1β和TNF-α等促炎因子从而建立炎症模型[16]。奶牛的瘤胃上皮细胞在高剂量的LPS诱导下能升高促炎因子TNF-α、IL-1β、IL-6的表达[17]。目前,对于牦牛瘤胃上皮细胞炎症模型的建立未见报道,本研究发现,LPS能使牦牛瘤胃上皮细胞的细胞活力显着下调,并能诱导促炎因子的基因大量表达和含量增加。表明LPS诱导牦牛瘤胃上皮细胞成功建立炎症模型。
细胞内补体系统激活在炎症反应中起关键性的免疫调节作用[18]。补体C3是免疫系统中的重要组成,C3基因敲除小鼠能显着下调肾缺血再灌注损伤诱发的IL-1和IL-6等促炎因子表达和组织炎症反应[19]。补体C3激活是指细菌、病毒、LPS与宿主抗体结合后诱导补体C3裂解为C3a和C3b活性肽段的过程[20]。早期研究认为,炎症状态下补体C3激活发生在血液中,C3转化裂解酶(convertase)是激活关键酶。而Liszewski等[9]首次发现,在人的免疫细胞T细胞内补体C3的激活不同于血液中利用C3转化裂解酶(convertase)激活,而是被细胞内源组织蛋白酶L所激活。小鼠原代肠上皮细胞和人肠上皮细胞系Caco2胞内补体C3由组织蛋白酶B和组织蛋白酶L激活[21],抑制CTSL和CTSB活性后能缓解补体过度激活导致的肠道炎症损伤[22]。本试验中,LPS诱导牦牛瘤胃上皮细胞产生炎症后,补体C3大量激活,其下游补体片段C3a和C3b含量显着增加,且补体C3在LPS浓度为20 μg·mL-1时表达量为最大值。说明炎症能促进牦牛瘤胃上皮细胞补体C3激活并使其裂解成蛋白片段C3a和C3b而发挥作用。研究表明不同类型的细胞中激活补体C3的组织蛋白酶亚型不同,人T细胞中激活补体C3的组织蛋白酶L却不能激活人肺上皮细胞内的补体C3[9,23]。本试验发现,经过不同浓度的LPS处理后,牦牛瘤胃上皮细胞中组织蛋白酶L逐渐降低,而组织蛋白酶B则是显着升高的。说明在牦牛瘤胃上皮细胞中CTSB可能是激活细胞内补体C3的关键组织蛋白酶类型。上述结果表明,牦牛瘤胃上皮细胞存在补体C3细胞内激活过程,且组织蛋白酶B可能是激活牦牛瘤胃上皮细胞胞内补体C3的主要蛋白酶。
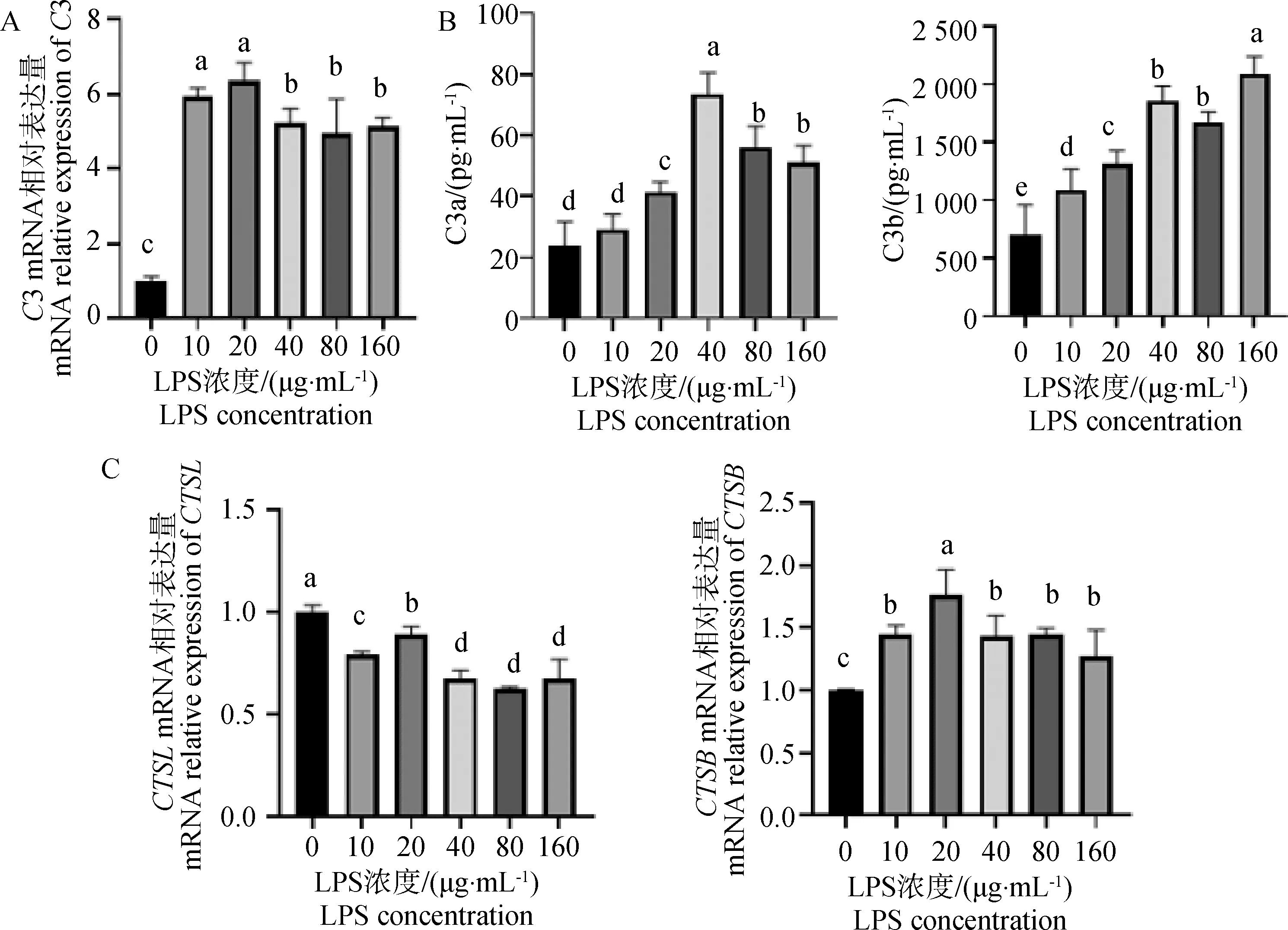
A. LPS对补体C3基因相对表达量的影响;B. LPS对补体C3激活产物C3a和C3b浓度的影响;C. LPS对组织蛋白酶B和L基因相对表达量的影响A. Effect of LPS on the gene expression of complement C3; B. Effect of LPS on the concentrations of complement C3 activated products C3a and C3b; C. Effect of LPS on the gene expression of cathepsin B and cathepsin L图3 LPS对牦牛瘤胃上皮细胞补体C3激活的影响Fig.3 Effects of LPS on complement C3 activation in rumen epithelial cells of yak
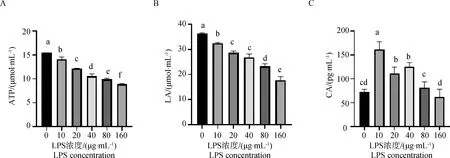
A. LPS对牦牛瘤胃上皮细胞ATP生成浓度的影响;B. LPS对牦牛瘤胃上皮细胞乳酸生成浓度的影响;C. LPS对牦牛瘤胃上皮细胞柠檬酸生成浓度的影响A. Effects of LPS on concentration of ATP produced by yak rumen epithelial cells; B. Effects of LPS on concentration of LA produced by yak rumen epithelial cells; C. Effects of LPS on concentration of CA produced by yak rumen epithelial cells图4 LPS对牦牛瘤胃上皮细胞ATP生成的影响Fig.4 Effects of LPS on ATP production in rumen epithelial cells of yak
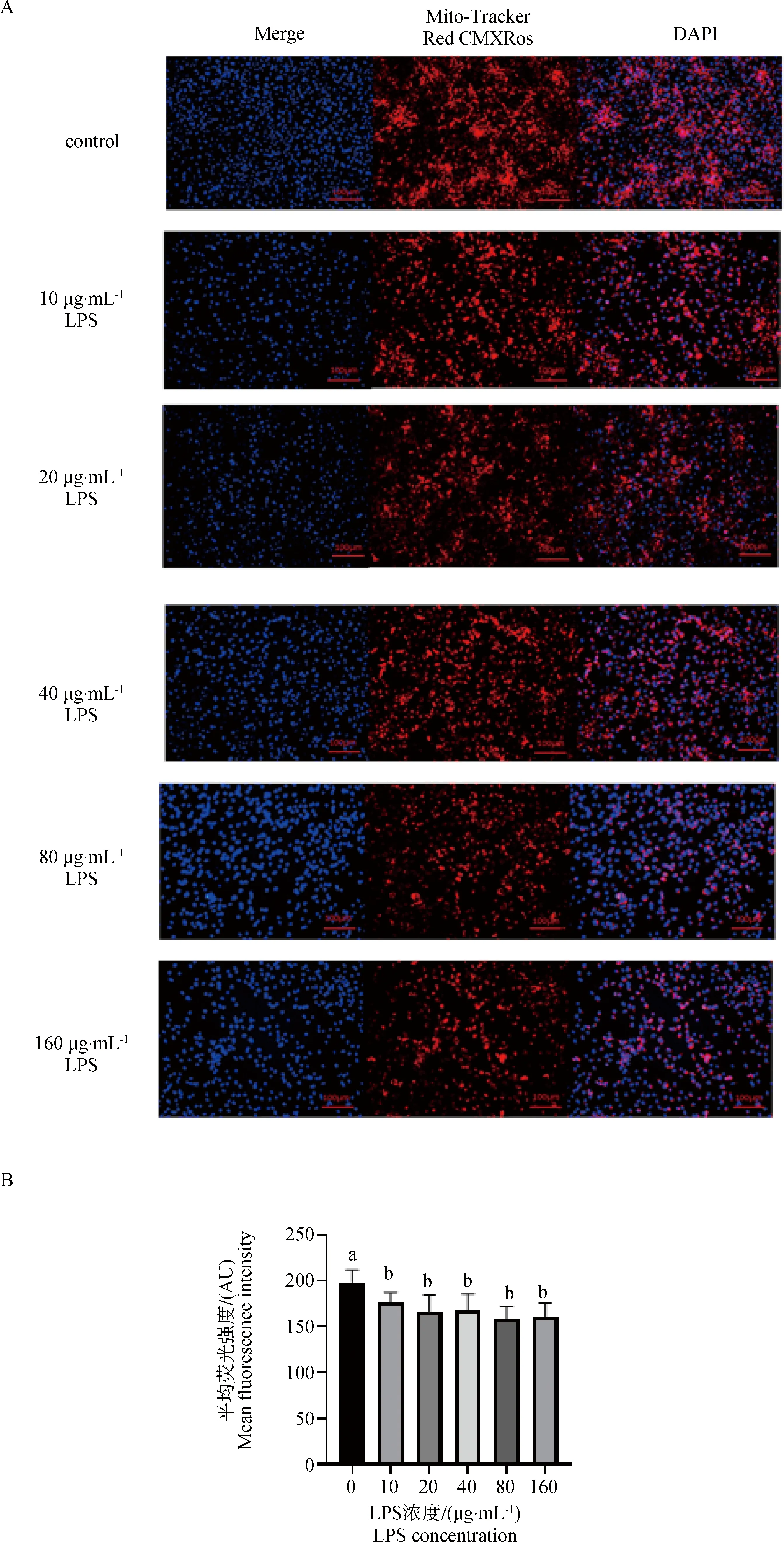
蓝色荧光表示细胞核;红色荧光表示线粒体 Blue fluorescence represents the nucleus;Red fluorescence indicates the mitochondria图5 LPS对牦牛瘤胃上皮细胞的线粒体数量的影响Fig.5 Effect of LPS on mitochondrial number of yak rumen epithelial cells
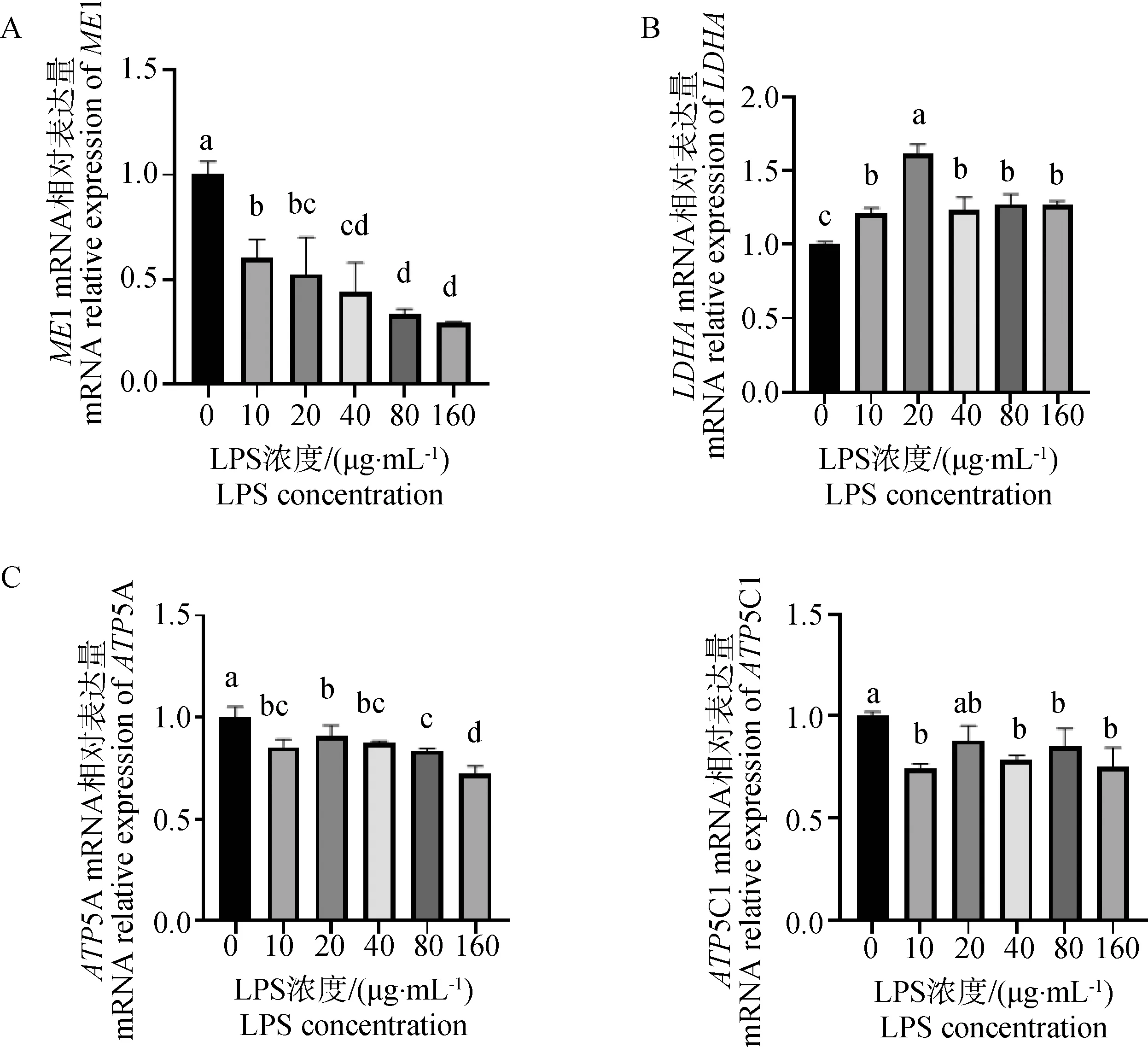
A. LPS对参与有氧呼吸促进细胞产能的关键因子ME1基因表达的影响;B. LPS对丙酮酸进入无氧呼吸促进其产生乳酸的关键因子LDHA基因表达的影响;C. LPS对牦牛瘤胃上皮细胞ATP合成酶亚基基因表达的影响A. Effects of LPS on the expression of ME1 gene involved in aerobic respiration and promoting cell productivity; B. Effects of LPS on the expression of LDHA gene, a key factor of pyruvate entering anaerobic respiration to promote lactic acid production; C. Effects of LPS on ATP synthase subunit gene expression in yak rumen epithelial cells图7 LPS对ATP生成相关基因表达的影响Fig.7 Effects of LPS on gene expression related to ATP production
近年来研究发现,细胞内补体C3激活可调控细胞ATP生成。人免疫细胞内补体C3激活参与细胞能量代谢调控,诱导氨基酸转运载体(GLUT1)和葡萄糖转运载体(LAT1)表达增强[24]。在非免疫细胞中,补体C3激活可促进小鼠脂肪细胞中甘油三酯的合成[10],反复刺激诱导滑膜成纤维细胞产生炎症后发现,C3a与线粒体上的C3aR受体结合后抑制线粒体呼吸产生ATP,使能量生成受阻[25]。本试验发现,补体C3激活后,促进丙酮酸转化为乳酸的关键酶LDHA的基因表达量显着增加,而参与有氧呼吸促进三羧酸循环的关键酶ME1表达量显着降低。这与Hu等[1]前期的研究中,生长迟缓牦牛瘤胃上皮的LDHA和ME1表达趋势一致。并且补体C3被激活后,牦牛瘤胃上皮细胞ATP5A和ATP5C1表达随之降低,且ATP含量也同样显着下调。线粒体是细胞呼吸代谢和产生能量的重要场所,线粒体膜电位是反映ATP生成的重要指标[26]。本研究中,通过对线粒体荧光强度及线粒体膜电位检测发现,线粒体数量及线粒体膜电位均显着下调。上述结果提示,LPS刺激在抑制牦牛瘤胃上皮细胞有氧呼吸作用和抑制线粒体ATP生成过程中发挥重要作用。瘤胃上皮通过跨膜转运功能将营养小分子转运入血液供机体利用,瘤胃上皮细胞内挥发性脂肪酸,氮和Na+、Mg+、K+及Ca2+等的转运都离不开线粒体ATP生成后被NA+/K+-ATP酶利用,形成电势差将钠离子泵出细胞外进行转运[7,27],说明瘤胃上皮的营养物质转运功能与ATP的生成密切相关。因此LPS诱导C3激活和炎症反应,可能通过抑制ATP生成导致瘤胃上皮功能健康问题,限制饲料转化率和机体生长效率,本研究为通过营养调控炎症下瘤胃上皮ATP生成,促进瘤胃健康和机体生长提供了理论依据。
4 结 论
本研究利用LPS诱导建立了牦牛瘤胃上皮细胞炎症模型。炎症状态下,牦牛瘤胃上皮细胞内补体C3主要被细胞内组织蛋白酶CTSB激活,裂解产物C3a和C3b浓度增加,并抑制线粒体ATP合成酶亚基ATP5A和ATP5C1基因表达,下调有氧呼吸关键酶ME1基因表达量,降低线粒体膜电位,抑制ATP生成代谢。因此LPS诱导炎症可抑制瘤胃上皮细胞ATP生成,从而导致瘤胃健康问题。



