蒋盛强,胡 靖,陈红英
(西北农林科技大学生命科学学院,杨凌 712100)
流感病毒能够引起人类、鸟类和猪等多种宿主发生呼吸道疾病,每年造成巨大的经济损失[1]。在众多流感病毒中,甲型流感病毒(influenza A virus,IAV)是在全球范围内引发大规模疫情的主要毒株。IAV属正黏病毒科,有包膜,基因组由8股单链负义RNA片段组成[2]。根据病毒表面蛋白的抗原性,IAV分为18种血凝素(HA)亚型(H1~H18)和11种神经氨酸酶(NA)亚型(N1~N11)[3]。其中,H1N1 IAV是在人群中最广泛传播的病毒亚型之一,它在1918年和2009年先后造成了两次大流行,对人类健康造成了重大威胁[4-5]。
在IAV感染过程中,需要调节宿主细胞的状态,利用细胞的底物和合成系统来进行病毒的生物合成。病毒对细胞的感染还可以通过模式识别受体(pattern recognition receptor, PRR)依赖性信号通路激活宿主的免疫应答,导致细胞产生干扰素(interferon, IFN)和其他细胞因子,激活干扰素刺激基因(IFN-stimulated gene, ISG)的表达[6-7]。先天免疫的激活能限制病毒复制并导致病毒清除;相应的,IAV也会进化出多种策略来拮抗宿主先天免疫反应,来实现病毒的自我复制[8-9]。了解宿主因子及其在IAV感染中的作用,对于全面揭示IAV的感染调控机制、控制该病毒感染引起的疾病具有重要的意义。已有的研究表明,流感病毒的感染可以改变大量的宿主细胞基因的转录水平。但是相关研究大部分都集中在蛋白质编码基因上,只有少量报道涉及了长链非编码RNA和环状RNA等非编码RNA在流感病毒感染中的作用[10-12]。环状RNA具有共价闭合的单链环状结构,没有5′ 和3′末端,因此对外切核糖核酸酶的降解具有较强的抵抗力,比线性RNA更稳定[13]。已有研究证明环状RNA在病毒感染中能够影响病毒复制,因此越来越多的研究开始关注环状RNA在病毒感染中的作用[14-15]。尽管病毒感染对环状RNA表达的影响尚不清楚,但考虑到环状RNA的高度稳定性以及其在抗病毒免疫应答中的调节作用,环状RNA也被认为是诊断和治疗病毒性疾病的潜在靶标[16-17]。近年来,有研究在流感病毒感染的细胞中发现了大量差异表达的环状RNA。例如,在H7N9流感病毒感染的小鼠肺部鉴定出数千个环状RNA的表达,其中186个在感染PB2突变病毒时差异表达[18];另一项研究在H3N2和H5N1流感病毒感染的MDCK细胞中分别发现了262和189个差异表达的环状RNA[19];最近的一项研究在H9N2流感病毒感染的A549细胞中发现了411种差异表达的环状RNA,其中一种新发现的环状RNA AIVR被鉴定为一种抗病毒因子,它可以通过吸收miRNA来增强CREBBP的表达,以此促进IFN-β的产生[20]。此外,研究发现环状RNA GATAD2A可以通过抑制自噬来促进H1N1复制,circ-0050463可以作为miR-33b-5p的海绵来上调真核翻译延伸因子1A1的表达,从而促进IAV复制[21-22]。这些研究结果表明,环状RNA在IAV的病毒感染中可能发挥着重要的调节作用。
本研究中,作者通过RNAseq对H1N1 AIV感染和未感染的A549细胞中环状RNA的表达谱进行了分析,对病毒感染前后差异表达的环状RNA进行了筛选和功能富集分析,为深入研究环状RNA在H1N1病毒感染过程中的调控作用奠定了基础。
1 材料与方法
1.1 细胞培养和病毒感染
人非小细胞肺癌细胞(A549)购自中国科学院上海生物化学与细胞生物学研究所。甲型流感病毒Influenza A virus (strain A/Wilson-Smith/1933 H1N1)毒株由湖北医药学院刘龙博士惠赠。A549细胞在37 ℃,50 mL·L-1CO2培养条件下,使用含有10 mL·L-1胎牛血清、100 U·mL-1青霉素和100 μg·mL-1链霉素的Ham’s F-12K培养基培养。将A549细胞接种在100 mm细胞培养皿中,当细胞汇合度达到80%~90%时,使用MOI为0.1的A/WSN/33(H1N1)流感病毒感染细胞。在37 ℃下孵育2 h后将培养基更换为含有1 mL·L-1牛血清蛋白(BSA)和0.2 μg·mL-1TPCK胰酶的F12K培养基。细胞经磷酸盐缓冲液(PBS)处理后用作对照。在感染36 h后收集细胞并提取RNA。
1.2 主要试剂
Trizol RNA提取试剂盒(北京天根生化科技有限公司),核糖体RNA去除试剂盒(New England Biolabs, Inc., Massachusetts, USA),NEBNext® Ultra II Directional RNA建库试剂盒(New England Biolabs),Ham’s F-12K培养基,TPCK胰酶(Sigma),青链霉素(Sangon Biotech),牛血清蛋白(BSA,Solarbio),磷酸盐缓冲液,RNase R(500 U·mL-1, GENESEED),HiFiScript gDNA Removal cDNA Synthesis Kit (Cwbio, China)反转录试剂盒,ChamQ Universal SYBR qPCR Master Mix荧光定量PCR Mix(Vazyme, China)。
1.3 主要仪器
核酸电泳仪,NanoDrop ND-1000分光光度计(Thermo Fisher Scientific),BioAnalyzer 2100 system(Agilent Technologies),illumina Hiseq测序仪,荧光定量PCR仪。
1.4 全转录组测序
1.4.1 RNA提取和样品检测 使用Trizol法提取RNA,通过琼脂糖凝胶电泳检测RNA完整性及是否存在基因组DNA污染。利用分光光度计测定总RNA的浓度。通过OD260 nm/OD280 nm比值来评估RNA的质量,并将比值在1.8~2.1的样品视为合格。
1.4.2 文库建库及测序 高通量测序服务由上海云序生物技术有限公司提供。具体步骤包括:使用核糖体RNA去除试剂盒,从总RNA中去除核糖体RNA。将处理后的总RNA经超声波处理,随机打断至200~300 bp。使用建库试剂盒将RNA反转录为cDNA,并添加测序接头和引物,最终生成测序文库。通过BioAnalyzer 2100系统评估文库的长度分布和浓度。长度主要分布在100~600 bp且浓度大于2 ng·μL-1的文库质量视为合格,并使用illumina Hiseq测序仪进行150 bp双端测序。
1.5 转录组测序数据分析
1.5.1 数据质控 使用fastqc软件对原始测序fastq文件进行质量评估。使用Cutadapt(v1.9.3)软件去除低质量和测序接头污染的reads,最终得到高质量测序数据[23]。
1.5.2 参考基因组比对和环状RNA鉴定 使用STAR(v2.5.1b)软件将得到的高质量测序数据比对到hg38参考基因组后使用DCC(v0.4.4)软件鉴定环状RNA[24-25]。DCC软件能够利用STAR软件的比对结果并结合hg38注释文件来识别剪接位点,最终特异性地检测和定量环状RNA。
1.5.3 差异表达环状RNA的筛选及功能分析 使用EdgeR(v3.16.5)包,以|log2FC|≥1、Pvalue<0.05为条件筛选出流感病毒感染后差异表达的环状RNA[26]。使用R包pheatmap对差异表达的环状RNA进行聚类分析[27]。使用R包ClusterProfiler对差异表达环状RNA的来源基因进行GO(Gene Ontology)富集分析和KEGG(Kyoto Encyclopedia of Genes and Genomes)通路分析[28]。
1.6 环状RNA验证
1.6.1 荧光定量PCR验证环状RNA差异表达 使用HiFiScript gDNA Removal cDNA Synthesis Kit试剂盒将H1N1亚型流感病毒感染和未感染细胞的总RNA逆转录为cDNA。以GAPDH为标准化对照,使用ChamQ Universal SYBR qPCR Master Mix进行实时定量PCR。每个样本设置3个重复,通过2-ΔΔCt方法计算每个环状RNA的相对表达水平。引物序列如表1所示。荧光定量检测的程序为预变性:95 ℃ 30 s;40个循环反应:95 ℃ 10 s,60 ℃ 30 s;熔解曲线:95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。
1.6.2 RNase R消化和Sanger测序验证环状RNA表达 使用RNase R将RNA样品在37 ℃下消化30 min,然后在70 ℃下灭活10 min。未用RNase R处理的RNA用作对照。使用HiFiScript gDNA Removal cDNA Synthesis Kit试剂盒将RNA样品反转录为cDNA。使用特异性引物(表1),对环状RNA hsa_circ_0104558、hsa_circ_0077717和hsa_circ_0000025的反向剪接位点进行2~3轮PCR扩增。对PCR产物进行琼脂糖凝胶电泳并进行Sanger测序。
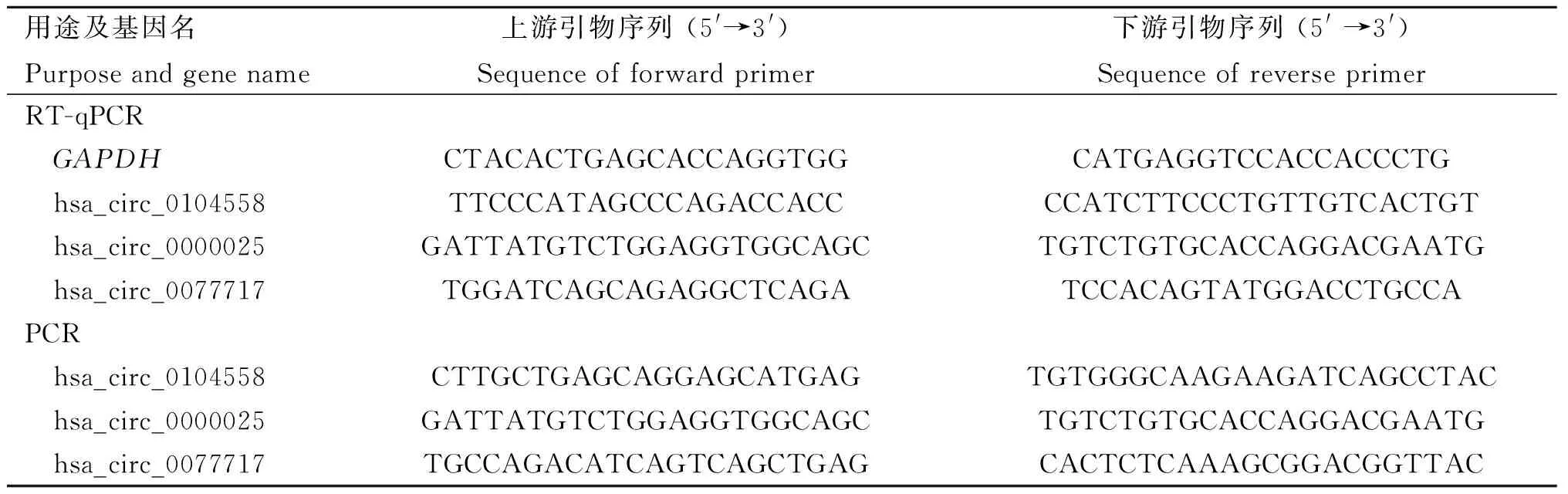
表1 用于环状RNA PCR扩增的引物序列Table 1 Primer sequences for PCR amplification of circRNAs
2 结 果
2.1 总RNA的提取和质量检验
将提取的总RNA在1%的琼脂糖凝胶中,150 V电压下电泳分离20 min,如图1所示, RNA条带清晰完整。经分光光度计测定,样品的OD260 nm/OD280 nm比值在1.8~2.0(表2),质量合格,可以用于测序。
2.2 转录组测序数据质控
转录组测序获得的原始数据情况如表3所示。感染组(E)和未感染组(C)分别获得了246 438 632和276 572 244条原始读数。将得到的原始数据进行质控和过滤后,最终分别得到239 048 836和272 234 451条高质量读数。这些高质量读数的碱基Q30值均高于92.77%,GC含量趋近于55%,表明测序数据质量高,数据准确可靠,能够进行后续分析。
表2 RNA质量检验Table 2 RNA quality inspection
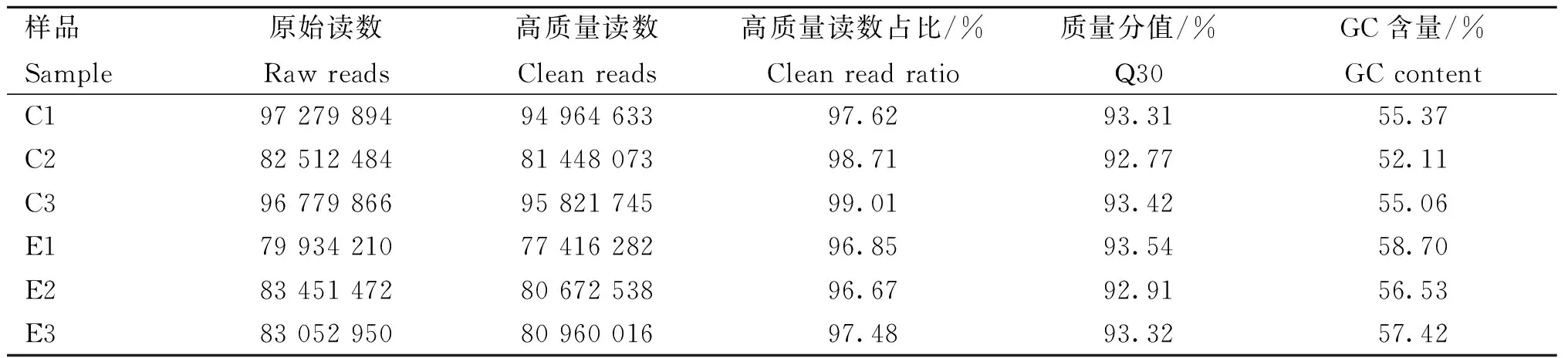
表3 测序数据质量分析Table 3 Sequencing data quality analysis
2.3 环状RNA的鉴定及其特性分析
经过DCC软件鉴定,在感染组(H1N1)和未感染组(Mock)中分别检测到1 101个和676个环状RNA表达,其中只有116个环状RNA在病毒感染前后均表达。这表明流感病毒感染显着改变了宿主细胞中环状RNA的表达模式(图2A)。统计病毒感染前后环状RNA的染色体分布,发现在所有的染色体上均有环状RNA表达,并且在感染组中每条染色体上检测到的环状RNA数量比未感染组更多(图2B)。环状RNA的长度分析表明,大约60%的环状RNA长度在300~1 000 nt,约20%的环状RNA长度超过2 000 nt。未感染组中环状RNA的平均长度为3 567 nt,在感染组中为3 556 nt(图2C)。根据来源,将环状RNA分为5类,分别为外显子型(exonic)、内含子型(intronic)、基因间型(intergenic)、反义链转录本(antisense)、正义链重叠型(sense overlapping)。流感病毒感染前后,大部分(75%~82%)环状RNA都来源于外显子,少部分(1%~4%)来源于内含子型、基因间型和反义链转录本(图2D)。
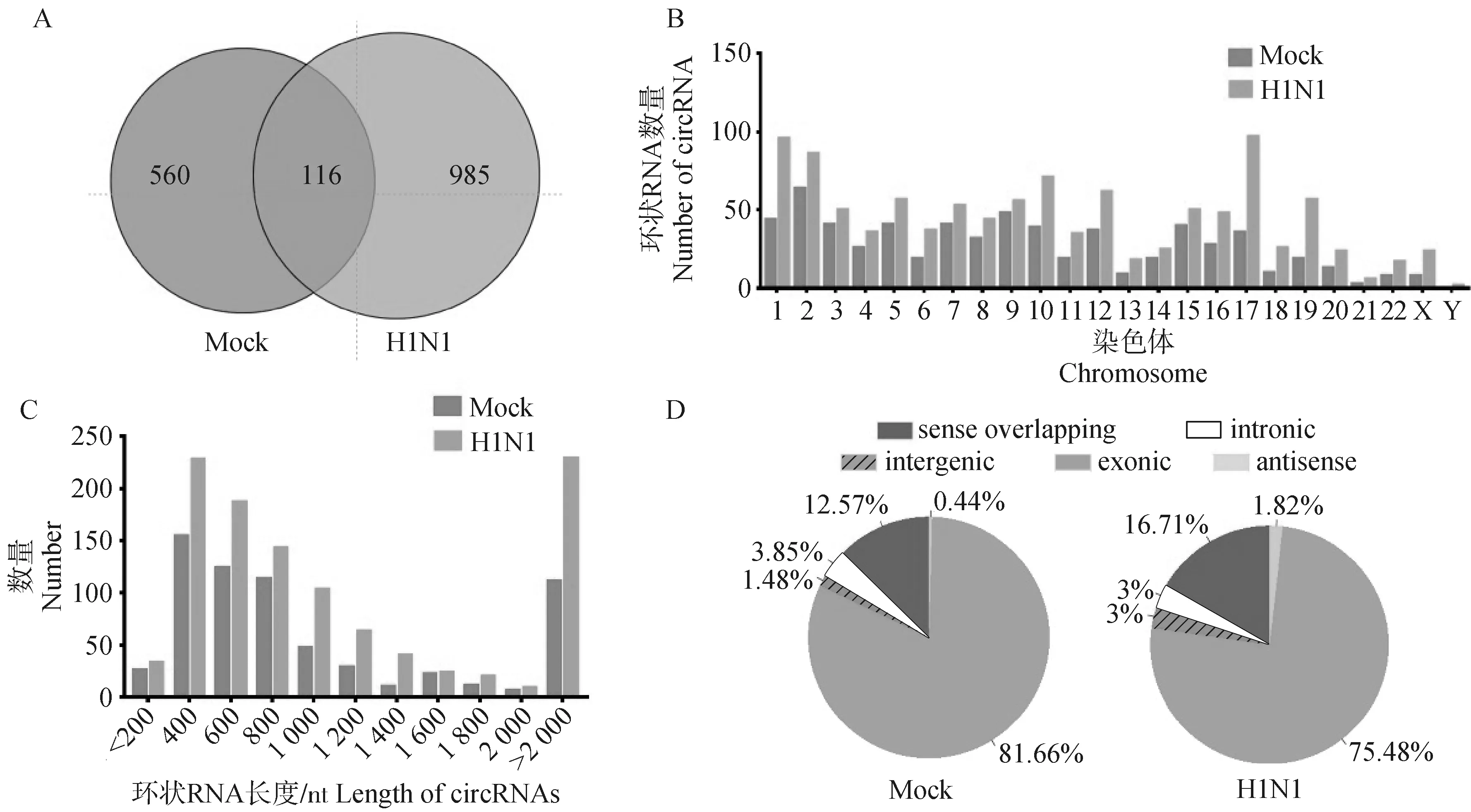
A.环状RNA在H1N1感染组和Mock未感染组A549细胞中的表达数;B.环状RNA在H1N1感染组和Mock未感染组A549细胞中的染色体分布;C.环状RNA在H1N1感染组和Mock未感染组A549细胞中的长度统计;D.环状RNA在H1N1感染组和Mock未感染组A549细胞中的来源类型。扫描文章首页OSID码可查看彩图A. The number of circRNAs identified in uninfected and H1N1-infected A549 cells; B. Distribution of circRNAs on chromosomes in uninfected and H1N1-infected cells; C. Length statistics of circRNAs in uninfected and H1N1-infected cells; D. Classification of circRNAs in uninfected and H1N1-infected cells.The color pictures can be found by scanning the OSID code on the front page of the article图2 环状RNA在A549细胞中的表达概况Fig.2 The expression profile of circRNAs in A549 cells
2.4 差异表达环状RNA分析
使用EdgeR包对流感病毒感染前后表达的环状RNA进行差异表达分析,共筛选出54个表达显着上调和18个表达显着下调的环状RNA(|log2FC|≥1,Pvalue<0.05) (图3A)。对这72个差异表达环状RNA进行层次聚类分析,表明这些环状RNA的表达水平在组内具有良好的重复性,并且在病毒感染前后表达水平有明显差异(图3B)。差异表达环状RNA主要分布在5、12、16和19号染色体,而在14、20和Y染色体上未检测到差异表达的环状RNA(图3C)。根据长度统计显示,约62%的差异表达环状RNA长度在300~1 000 nt,约25%的环状RNA长度超过2 000 nt(图3D)。分析差异表达环状RNA的来源,72%的差异表达环状RNA属于外显子型,24%属于正链重叠型,剩下的4%来源于内含子型、基因间型和反义链转录本(图3E)。
2.5 差异表达环状RNA来源基因的富集分析
为了研究环状RNA的潜在功能,对差异表达环状RNA的来源基因进行了GO富集分析和KEGG通路分析,并以Pvalue<0.05为标准,筛选出显着富集的GO条目和KEGG通路。在生物进程方面,差异表达环状RNA来源基因主要富集到RNA定位、超分子纤维组织的负调控、细胞对化学刺激的响应和胆固醇合成等条目。在分子功能方面,来源基因主要富集在单链DNA结合、RNA帽子结合和Tau蛋白激酶活性等条目。在细胞组分方面,其主要富集到细胞质膜和细胞基底等条目(图4A)。KEGG通路分析显示,环状RNA主要富集到缬氨酸,亮氨酸和异亮氨酸降解通路、FoxO信号通路、脂肪细胞因子信号通路等(图4B)。
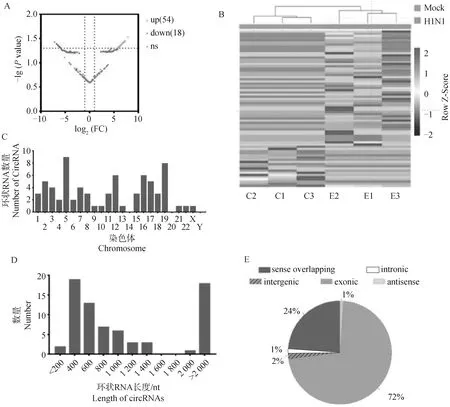
A. 差异表达环状RNA火山图;B.差异表达环状RNA表达量聚类热图;C.差异表达环状RNA染色体分布;D.差异表达环状RNA长度统计;E.差异表达环状RNA分类。扫描文章首页OSID码可查看彩图A.Volcano plot of differentially expressed circRNAs; B.Cluster heatmap of the expression levels of differentially expressed circRNAs; C.Distribution of differentially expressed circRNAs on chromosomes; D.Length statistics of differentially expressed circRNAs; E.Classification of differentially expressed circRNAs.The color pictures can be found by scanning the OSID code on the front page of the article图3 环状RNA差异表达分析Fig.3 Differential expression analysis of circular RNA
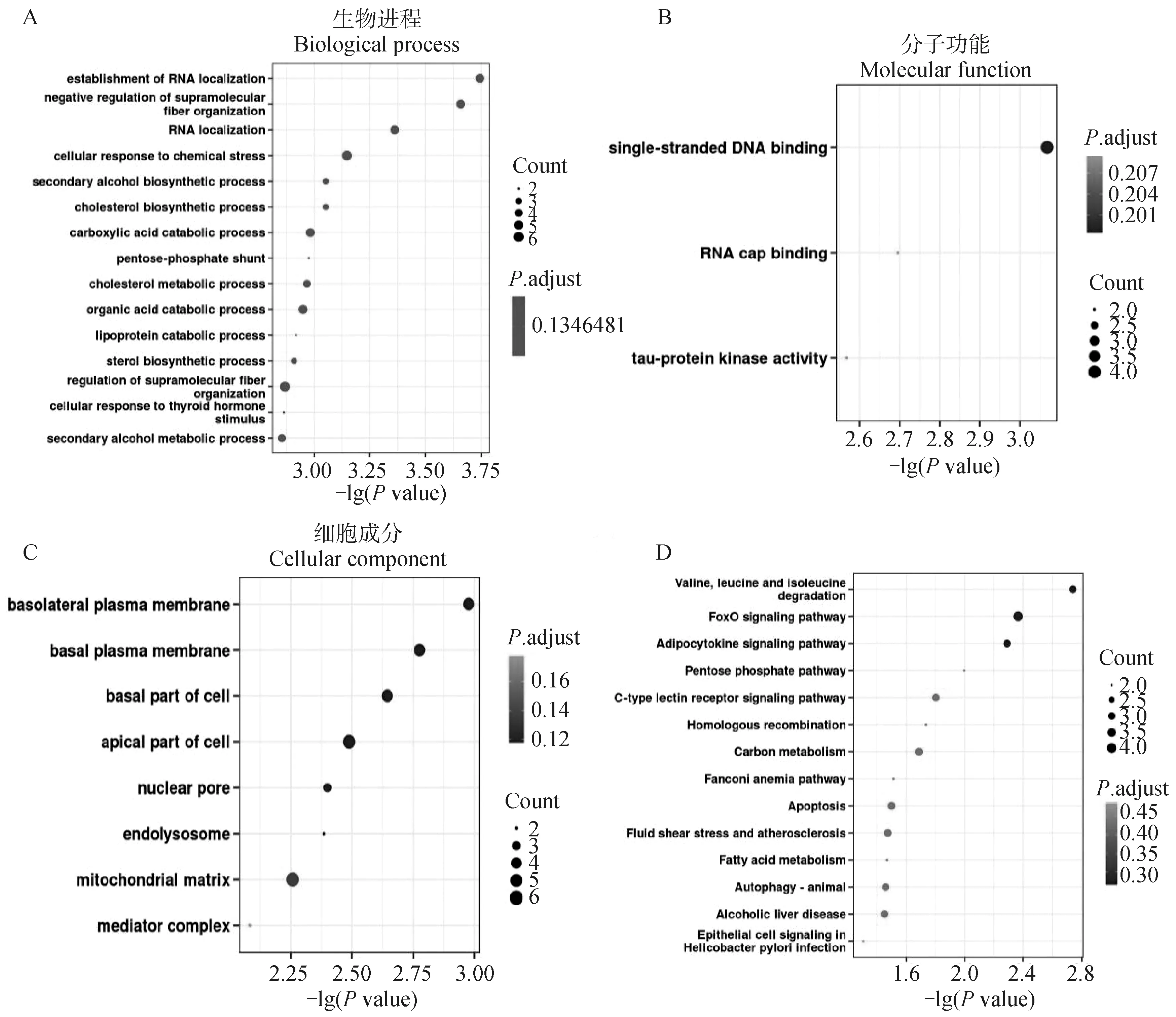
A.C. GO富集分析结果;D. KEGG通路富集结果。扫描文章首页OSID码可查看彩图 A-C. The result of GO enrichment; D. The result of KEGG pathway analysis.The color pictures can be found by scanning the OSID code on the front page of the article图4 差异表达环状RNA来源基因富集分析Fig.4 Enrichment analysis of parent gene of differentially expressed circRNAs
2.6 差异表达环状RNA验证
为了验证环状RNA鉴定的准确性,用外切核糖核酸酶RNase R对提取的RNA进行了消化处理,然后逆转录,用于PCR扩增。结果显示,经RNase R消化后,在流感病毒感染和未感染的细胞中无法检测到GAPDH mRNA的表达,但是可以检测到三种环状RNA的表达,这证实了这三种环状RNA具有抵抗外切核糖核酸酶消化的能力(图5A)。经Sanger测序证实了三种环状RNA的反向剪接位点(图5B)。
通过实时荧光定量PCR来检验感染前后环状RNA的表达水平,结果表明:在流感病毒感染细胞后,环状RNA SNUPN(has_circ_0104558)和DCBLD1(hsa_circ_0077717)的表达显着下调;EIF4G3(hsa_circ_0000025)的表达显着上调,与转录组测序的结果一致(图5C)。综上所述,这些结果对转录组测序和环状RNA鉴定的准确性进行了验证,证实了三种环状RNA在病毒感染前后的差异表达。
3 讨 论
环状RNA是一类不具有5′帽子和3′尾巴结构,由RNA反向剪接而形成的闭环非编码RNA,能够参与调控多种生物进程[29]。随着高通量测序技术的发展,越来越多的环状RNA被发现,对环状RNA的研究也越来越深入。已有研究结果显示,环状RNA在疾病发展的进程中起着重要调控作用,有可能从中筛选出用于疾病诊断或预测的生物标志物[30-31]。研究发现,环状RNA能以不同的方式调控病毒感染。例如,RIG-I能够识别外源环状RNA,从而激活免疫反应,保护宿主以抵抗病毒感染[14];dsRNA结合蛋白NF90和NF110能够调控胞内环状RNA的表达,从而影响病毒复制[15];卡波西肉瘤疱疹病毒能够诱导细胞中circ_0001400的表达,以维持病毒在细胞内的潜伏感染状态[32]。最近的研究表明,由IAV的H3N2、H5N1、H7N9和H9N2毒株引起的感染能够导致数百个环状RNA的差异表达[17,19-20]。本研究中,作者通过转录组测序对H1N1亚型流感病毒感染前后的A549细胞中环状RNA的表达谱进行了分析,在感染组和未感染组中分别检测到了1 101和676个环状RNA表达。相比于未感染组,在感染组的各个染色体上检测到了更多的环状RNA表达,这表明H1N1亚型流感病毒感染能够全面提高细胞中环状RNA的表达丰度。这些环状RNA的表达水平是由于转录或者剪接活性的改变而上调,还是由于病毒感染导致细胞生长速度变慢,从而选择性地降解线性RNA分子,导致环状RNA的积累?还需要进一步的深入研究来回答这个问题。
差异表达分析结果显示,与未感染的细胞相比,H1N1病毒感染的A549细胞中发现了72个显着差异表达的环状RNA,其中54个表达上调和18个表达下调。这些差异表达环状RNA大多分布在5、12、16和19号染色体,而在14、20和Y染色体上未检测到。虽然H1N1亚型流感病毒感染能够引起环状RNA的差异表达,但是目前尚不清楚差异表达的环状RNA在H1N1亚型病毒感染期间的作用,需要进一步研究来揭示它们之间的关联。
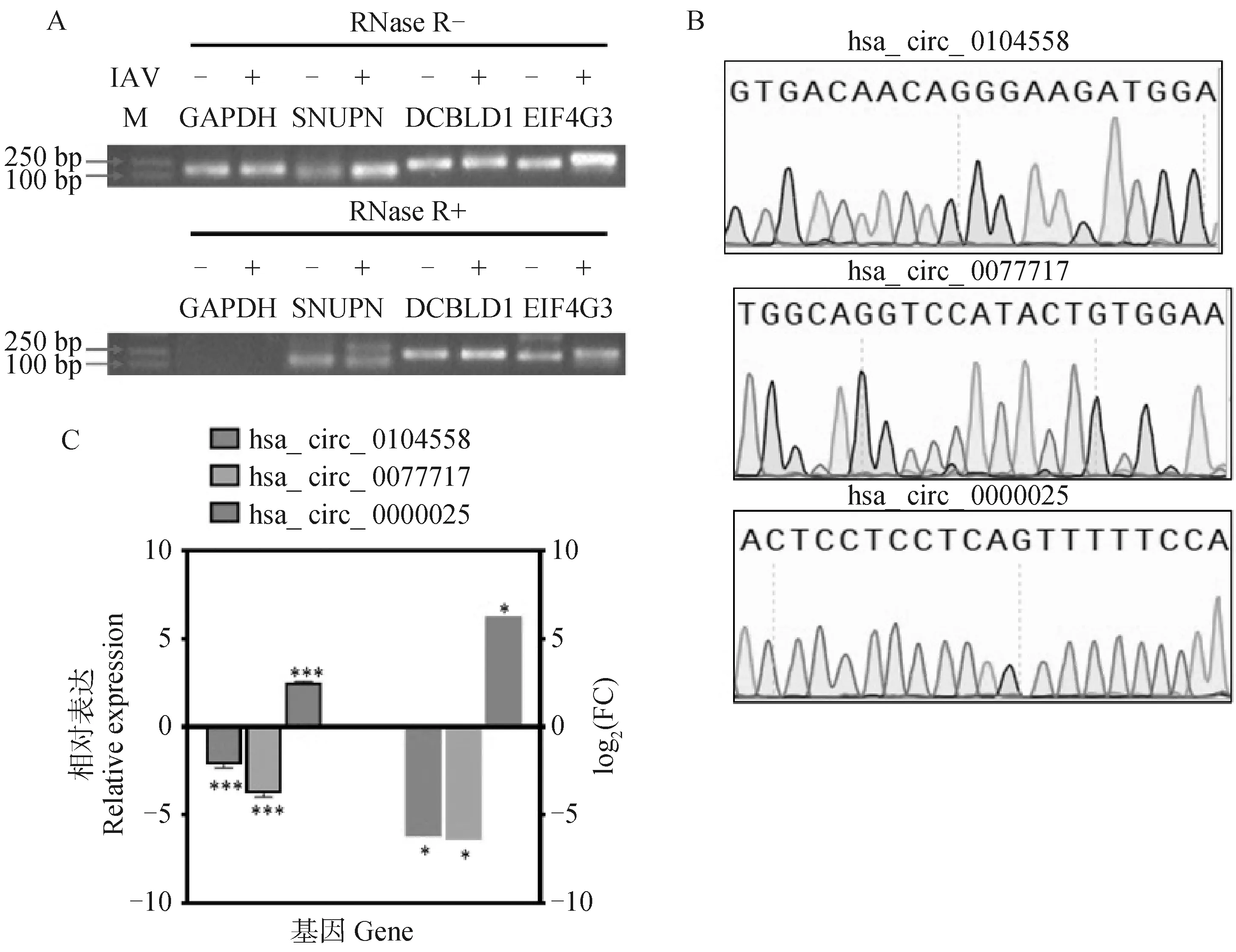
A.环状RNA抗RNase R降解能力的检测。上排和下排胶图分别展示了RNA未使用RNase R处理和使用RNase R处理后的检测结果。GAPDH mRNA作为线性RNA对照;B.三种环状RNA反向剪接位点邻近序列的Sanger测序结果;C.以GAPDH为内参,通过RT-qPCR验证IAV感染前后环状RNA的差异表达。左侧柱状图为RT-qPCR结果,右侧为转录组测序差异倍数。*. P<0.05,**. P<0.01, ***. P<0.001。扫描文章首页OSID码可查看彩图A. The resistance analysis of circRNAs to RNase R digestion. Upper and lower gel images show the RNA detection results before and after RNase R treatment, respectively. GAPDH mRNA was used as a linear RNA control; B. The adjacent sequence of back-spliced junction regions of the selected circRNAs examined by Sanger sequencing; C. Relative expression levels of circRNAs before and after IAV infection detected by RT-qPCR, using GAPDH as the internal reference. The left three bars represent the RT-qPCR results, and the right three bars represent RNA-seq results. *. P<0.05, **. P<0.01 and ***. P<0.001. The color pictures can be found by scanning the OSID code on the front page of the article图5 差异环状RNA验证Fig.5 Validation of differentially expressed circRNAs
研究表明,环状RNA可以通过多种方式调节病毒感染,如作为microRNA的海绵、与RNA结合蛋白相互作用、作为线性RNA的竞争者,以及调控亲本基因的表达等[17,33]。然而,关于环状RNA在流感病毒感染中的作用还需深入研究。目前,只有环状RNA Circ-GATAD2A被报道能够通过抑制细胞自噬来促进H1N1亚型病毒复制[22]。本研究中,通过RNase R去除线性RNA,PCR扩增、Sanger测序和RT-qPCR验证了环状RNA SNUPN(has_circ_0104558)、DCBLD1(hsa_circ_0077717)和EIF4G3(hsa_circ_0000025)在IAV感染前后的差异表达。SNUPN蛋白能够作为snRNP的特异性核输入受体而发挥作用[34];DCBLD1蛋白能够通过与酪氨酸激酶受体EGFR、VEGFR2、PDGFRβ和INSR结合,从而影响下游MAPKs或Akt的激活,导致细胞增殖和迁移速率的变化[35];真核翻译起始因子4G(EIF4G3)是翻译起始复合物中重要的支架蛋白[36]。本研究中鉴定出来的环状RNA是否识别这几种亲本基因,调控这些宿主细胞蛋白的表达和功能还有待深入研究。
通过对H1N1亚型流感病毒感染后差异表达环状RNA的亲本基因进行GO和KEGG分析,发现差异表达的环状RNA主要富集到生物进程中的RNA定位、超分子纤维组织的负调控、细胞对化学刺激的响应以及胆固醇合成过程等条目;分子功能中的单链DNA结合、RNA帽子结合和Tau蛋白激酶活性等条目;细胞组分中的细胞质膜和细胞基底等条目。此外,富集到的KEGG通路包括缬氨酸、亮氨酸和异亮氨酸降解通路,FoxO信号通路,脂肪细胞因子信号通路等。这些差异表达的环状RNA是否参与IAV感染过程的调控及其调控机制,还有待进一步的研究。
4 结 论
本研究通过转录组测序,获得了在H1N1亚型流感病毒感染的A549细胞中的环状RNA表达谱。在感染组和未感染组中分别检测到了1 101和676个环状RNA表达。H1N1亚型流感病毒感染后,环状RNA丰度整体上调,表明环状RNA与病毒感染之间存在某种关联。通过差异分析,筛选出72个显着差异表达的环状RNA。GO和KEGG分析预测,这些环状RNA可能与RNA定位、氨基酸代谢等相关。这些数据可以为进一步探索环状RNA在流感病毒-宿主中的功能及病毒感染标志物的筛选提供参考。



