徐婷婷,齐芬芳,黄世会,牛 熙,李 升,冉雪琴*,王嘉福*,谢 健
(1.贵州大学动物科学学院,贵阳 550025;2.贵州大学农业生物工程研究院,贵阳 550025;3.遵义医科大学医学遗传学教研室,遵义 563000)
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路在细胞增殖、凋亡、分化、运动及基因调控等过程中起关键作用[1-2],由细胞因子、生长因子、神经递质、激素、细胞应激和细胞黏附等多种因素刺激激活,并在所有真核细胞中发挥作用。MAPK信号通路的核心是3种蛋白激酶的联级反应:活化的丝裂原活化蛋白激酶激酶激酶(mitogen-activated protein kinase kinase kinase,MAP3K)磷酸化并激活特定的 MAPK激酶(mitogen-activated protein kinase kinase,MAP2K),进一步激活MAPK[3]。MAP3K4作为丝裂原活化蛋白激酶家族成员之一,有激酶结构域和蛋白-蛋白相互作用结构域[4-6]。研究表明,MAP3K4基因不仅是原癌相关基因[7-8],还参与草鱼肠道免疫应答[9]、细胞炎症反应[10],调节cAMP反应元件结合蛋白结合蛋白CREBBP(cAMP response element-binding binding proteins)或组蛋白脱乙酰酶6(histone deacetylase 6,HDAC6)控制细胞在上皮和间充质表型之间的转换[11-12]。本实验室前期对香猪全基因组进行了重测序,从MAP3K4基因内含子15中检测到一个结构变异MAP3K4-I15-sv189,本文着重研究该结构变异的群体分布规律及其与基因表达之间的联系。
1 材料与方法
1.1 材料
香猪1 216头的血液或组织样品采自贵州从江粤黔香猪开发有限公司,50头大白猪血样和组织样采自贵州某屠宰场,其中血液样品用于基因型分析,6月龄的香猪和大白猪组织用于基因表达谱等研究。2×TaqPCR Master Mix、胶回收试剂盒、DL2000 DNA Marker、血液/细胞/组织基因组DNA提取试剂盒购自天根生化科技(北京)有限公司,Revert AidTMFirst Strand cDNA Synthesis Kit为Fermentas公司产品。
1.2 基因组提取
根据血液/细胞/组织基因组DNA提取试剂盒说明书方法,提取血液和组织样基因组DNA,经1%琼脂糖凝胶电泳检测,基因组质量良好,分装成小份量,-20 ℃保存备用。
1.3 目的基因片段扩增
参照NCBI GenBank中猪参考基因(Scrofa11.1)MAP3K4序列,取结构变异(structure variation, SV)上、下游各500 bp碱基序列,利用Primer 5设计引物PCR-MAP3K4-F/R(表1),引物由生工生物工程(上海)股份有限公司合成。以提取的香猪和大白猪基因组作为模板进行PCR检测,扩增体系为20 μL:TaqPCR Master Mix(2×)10 μL,上、下游引物各(10 μmol·L-1)0.5 μL,ddH2O 8 μL,基因组模板1 μL。PCR反应条件为:95 ℃预变性5 min;95 ℃变性30 s,57 ℃退火30 s,72 ℃延伸45 s,32个循环;72 ℃延伸10 min。PCR产物经2%琼脂糖凝胶电泳分离,紫外灯下切取含目的DNA的胶块,由生工生物工程(上海)股份有限公司进行核苷酸序列测定。

表1 引物信息Table 1 Information of primers
1.4 MAP3K4基因结构变异群体分布
以1 216头香猪和50头大白猪的血液基因组DNA为模板,PCR扩增后,取5 μL PCR产物经1%琼脂糖凝胶电泳检测,PCR产物测序,与基因参考序列等长的扩增片段命名为正常的I等位基因,比参考序列短的命名为缺失型D等位基因,根据扩增条带的大小判断SV的基因型。计算各猪群每种基因型所占比例,等位基因频率计算公式为:纯合子基因型频率+(杂合子基因型频率/2),应用IBM SPSS Statistics v26软件对2个猪品种间进行卡方检验,分析二者的等位基因频率之间是否存在差异。
1.5 基因MAP3K4结构变异区域生物信息学分析
利用在线软件Repeat Masker和RegRNA2.0(表2)分析SV区域中是否包含重复元件、以及影响内含子加工的功能元件。
表2 生物信息学分析软件Table 2 Softwares for bioinformatics analysis
1.6 qPCR扩增效率分析
以cDNA作为模板,进行qPCR扩增,qPCR产物经3%的琼脂糖凝胶电泳检测,在紫外灯下,切下含扩增产物的胶块,由生工生物工程(上海)股份有限公司完成碱基序列测定。胶回收目的片段与pGEM-T Vector连接,转化感受态细胞DH5α,涂布固体LB培养基[13],37 ℃过夜培养,得到单菌落。用灭菌的枪头沾取单菌落作为模板,进行菌落PCR,检测目的片段是否转入大肠杆菌,LB液体培养基170 r·min-1振荡37 ℃培养过夜,提取重组质粒检测浓度,将内参GAPDH和目的基因的重组质粒分别作5个10倍梯度稀释作为模板,进行RT-qPCR以检测扩增效率。检测体系为:模板2 μL,引物0.5 μL,SYBR Premix Ex TaqTM(2×)10 μL ,ddH2O 7 μL;反应程序:预变性95 ℃ 3 min,变性95 ℃ 5 s,退火60 ℃ 20 s,延伸72 ℃ 20 s。
1.7 RT-qPCR扩增
采用荧光定量PCR方法检测MAP3K4基因的表达量。据NCBI公布的MAP3K4基因mRNA参考序列(GenBank No. XM_021 086 227.1),用在线软件Primer3 Plus(www.bioinformatics.nl)设计定量引物qPCR-F/R(表1),引物跨越第23和25外显子,预计扩增199 bp。以GAPDH为内参。用TRIzol试剂盒(天根公司)提取6月龄香猪和大白猪组织样品总RNA,取 1 μL检测RNA浓度;采用Revert AidTMFirst Strand cDNA Synthesis Kit(Promega公司)逆转录为cDNA,反应体系为10 μL:2 μL总RNA,1 μL Random primer(50 μmol·L-1),1 μL dNTPs(10 nmmol·L-1),6 μL RNase-free H2O。qPCR反应体系为20 μL:SYBR Premix Ex TaqTM(2×)10 μL,定量引物各0.5 μL,cDNA 2 μL,ddH2O 7 μL。每种组织或基因型设置3个生物学样本重复,且每个样本进行3个技术重复。
2 结 果
2.1 两个猪群结构变异MAP3K4-I15-sv189基因分型
以香猪和大白猪的基因组DNA为模板,以特异性引物PCR-MAP3K4 F/R进行PCR扩增(图1),检测得到两种条带,分别是552 bp和363 bp,两者相差189 bp,结构变异MAP3K4-I15-sv189处于第15内含子中(图2)。所获序列与Ssrofa11.1猪参考基因序列进行比对,552 bp序列与MAP3K4参考序列(NC_010443.5∶6912498-6913049)的相似性为100%,363 bp片段为552 bp片段缺失了SV区域后的片段;SV区域位于Chr15: 6912533-6912721(NC_010443.5),长度189 bp。与参考基因序列一样的扩增片段(552 bp)定义为I等位基因,将缺失了189 bp的短片段(363 bp)定义为D等位基因。本文建立的结构变异MAP3K4-I15-sv189的PCR检测方法,可以区分SV的不同基因型。
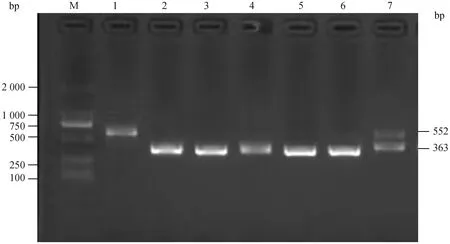
M. DL2000 DNA Marker;泳道1. II型;泳道2~6. DD型;泳道7. ID型M. DL2000 DNA Marker. Lane 1. Genotype II. Lanes 2-6. Genotype DD. Lane 7. Genotype ID 图1 结构变异MAP3K4-I15-sv189的基因分型Fig.1 Genotyping of the structural variation MAP3K4-I15-sv189
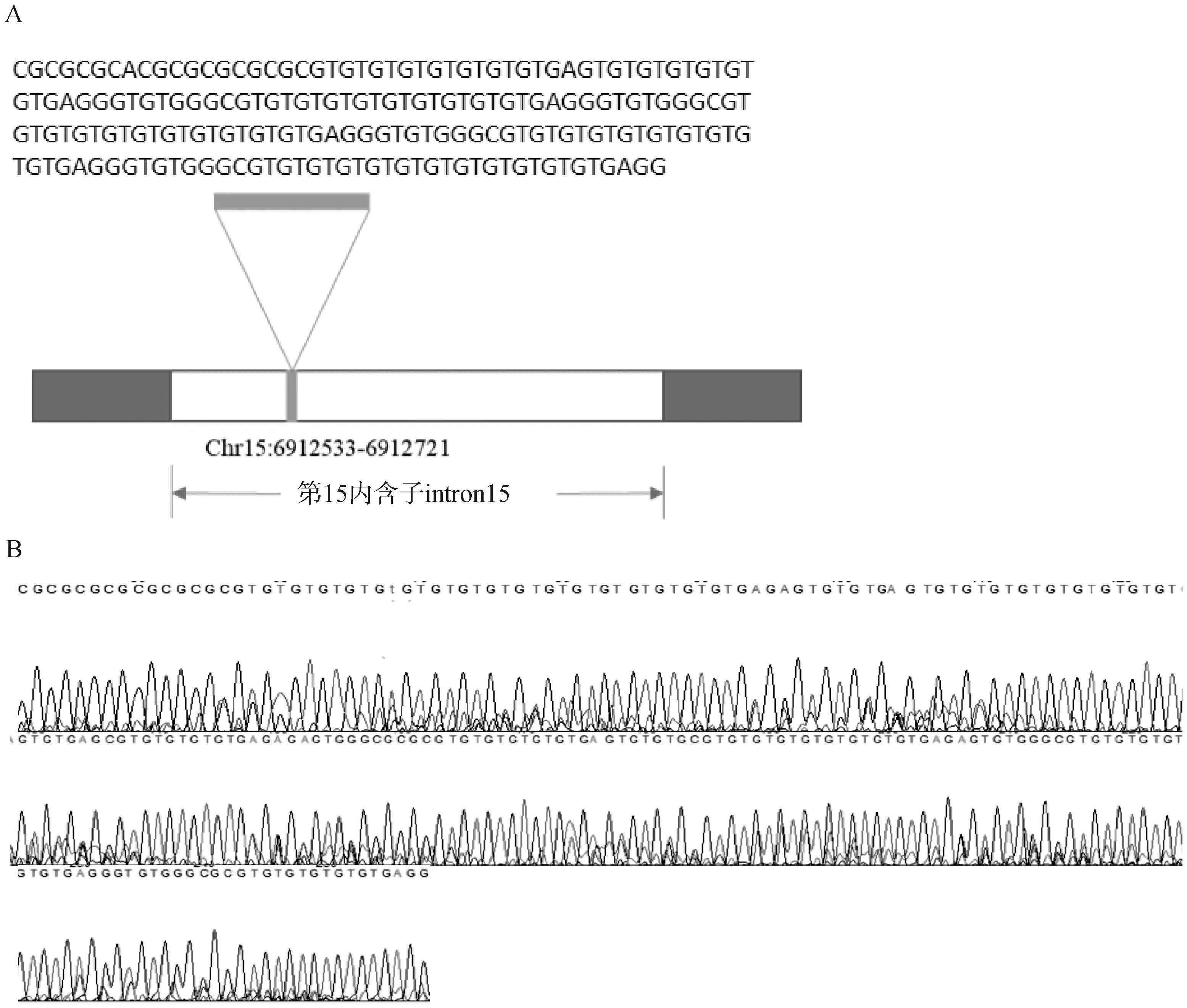
A.SV位置示意图;B.MAP3K4-I15-sv189碱基序列A.Diagram of SV; B.Sequence of structural variant MAP3K4-I15-sv189图2 结构变异MAP3K4-I15-sv189在MAP3K4基因中的位置Fig.2 Position of structural variant MAP3K4-I15-sv189 in the MAP3K4 gene
2.2 猪群中结构变异MAP3K4-I15-sv189的频率分析
采用建立的结构变异MAP3K4-I15-sv189检测方法,检测香猪和大白猪2个猪群中MAP3K4-I15-sv189的分布。香猪群体中检测出两种基因型(DD和ID),且DD型频率远高于ID型。大白猪群体中检测出3种基因型,以DD型为主。比较两个猪群间的等位基因频率(表3),香猪D等位基因频率显着高于大白猪相应值(P<0.05)。
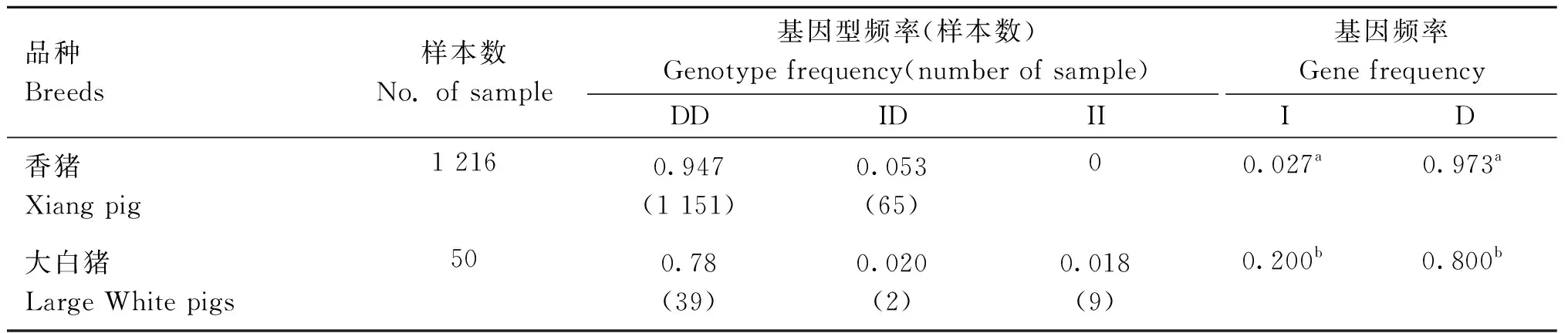
表3 两个猪品种MAP3K4-I15-sv189位点基因频率比较Table 3 Comparison of gene frequencies at the MAP3K4-I15-sv189 locus in two pig breed populations
2.3 生物信息学分析
采用RegRNA2.0预测结构变异MAP3K4-I15-sv189区域中的功能元件,以MAP3K4-I15-sv189的第一个碱基为1进行功能元件的定位(表4)。从结构变异中检测出10个内含子剪切增强子(intron splicing enhancer,ISE)、1个miRNA结合位点(ssc-miR-342);用Repeat Masker进行分析,得出MAP3K4-I15-sv189含有2个简单重复元件(simple sequence repeats ,SSR)。缺失型结构变异MAP3K4-I15-sv189将导致这些功能元件的丢失。
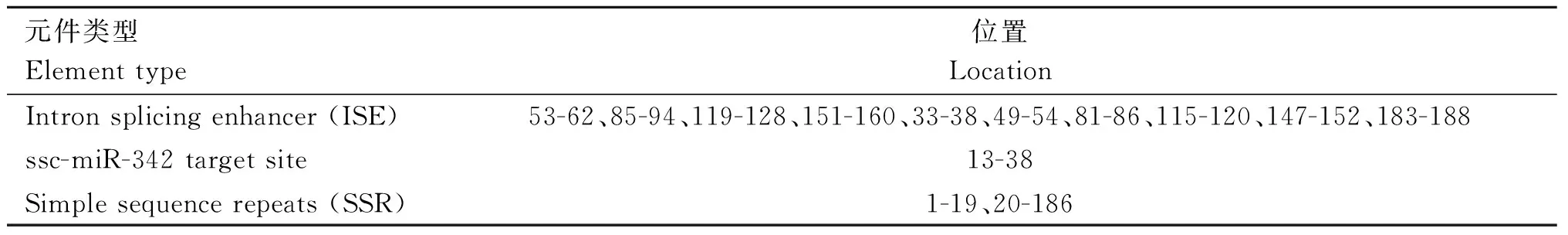
表4 SV区域功能元件预测分析Table 4 Prediction of functional elements in SV region
2.4 RT-qPCR检测方法的建立
RT-qPCR产物经测序,与NCBI上目的基因的相似性为96%,确认为MAP3K4基因。以内参和目的基因重组质粒的5个10倍稀释梯度为模板进行RT-qPCR检测,内参基因与目的基因的扩增效率相近,均在100%±10%范围内(图3),由此建立了MAP3K4表达量的RT-qPCR检测方法。

图3 GAPDH基因(A)和MAP3K4基因(B)扩增效率Fig.3 Amplification efficiency of GAPDH (A) and MAP3K4 genes (B)
2.5 香猪各组织中MAP3K4基因的表达量分析
采用RT-qPCR方法检测香猪DD型MAP3K4基因的组织表达谱(图4),肺和脑组织中的表达量最高,子宫、脾、肾、心、卵巢中有少量表达,骨骼肌中几乎不表达。

图4 香猪MAP3K4基因组织表达谱Fig.4 Tissue expression profiles of MAP3K4 gene in Xiang pigs
2.6 不同基因型肺中MAP3K4的表达
选取大白猪II型、香猪ID型和DD型肺组织(香猪没有II型),提取总RNA,应用建立的MAP3K4 RT-qPCR方法检测基因的表达量。得出3种基因型的表达量呈现从高到低的规律性变化:DD型>ID型>II型(图5)。
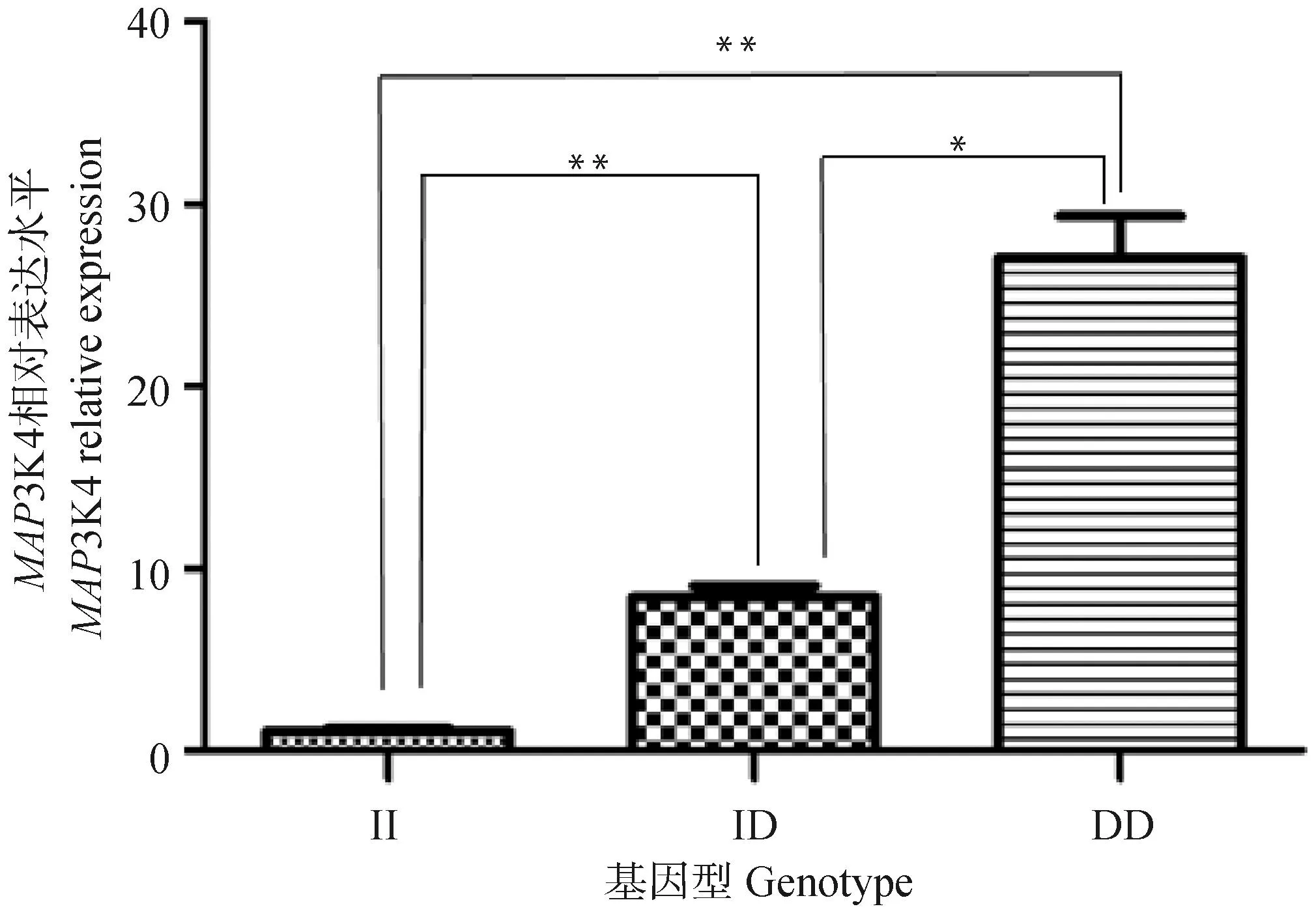
*. P<0.05;**. P<0.01图5 肺组织中MAP3K4三种基因型表达量比较Fig.5 Comparison of the expression levels of MAP3K4 in lung with three genotypes
3 讨 论
基于本实验室前期对香猪全基因组重测序数据,在MAP3K4基因第15内含子中发现一个长度为189 bp的结构变异(MAP3K4-I15-sv189),经群体检测,证实该结构变异在猪群中真实存在,且在不同猪群中表现出丰富的多态性。在基因型上,香猪群体中检测到DD和ID两种基因型,且以纯合缺失型为主。大白猪有3种基因型(DD、ID和II);在等位基因频率方面,香猪的D等位基因显着高于大白猪。组织表达谱检测显示,香猪肺和脑中MAP3K4的表达量较高。选择携带3种基因型的肺组织比较MAP3K4基因表达差异,RT-qPCR检测证实,DD型的表达量显着高于ID型和II型。对结构变异MAP3K4-I15-sv189中的功能元件进行分析发现,结构变异区域含有10个内含子剪接增强子(ISE)、1个miRNA结合位点和2个简单重复元件(SSR)。
提示结构变异缺失型个体MAP3K4基因的表达量增加,可能与结构变异中所含特殊元件有关。miRNA是基因转录后调控的重要方式之一,广泛存在于动植物和病毒体内,miRNA与成熟mRNA结合可以使mRNA裂解或者阻碍下一步的翻译过程[14-15]。蛋白激酶 Cα(protein kinase C alpha,PRKCA)基因的第15内含子中有一个miR-634结合位点,该位点是由特异性的启动子控制由聚合酶Ⅲ催化独立转录,转录产物可降低PRKCA基因的转录水平[16];MAP2K4内含子中miRNA-744结合位点可通过同时靶向β-连环蛋白和MAPK信号通路来阻碍MAP2K4的功能,从而减轻MAP2K4的促迁移作用[17];miR-342-3p 可下调前梯度蛋白2(anterior gradient protein 2,AGR2)基因,抑制非小细胞肺癌(non-small cell lung cancer,NSCLC)细胞增殖和迁移[18]。推测MAP3K4-I15-sv189中的miR-342结合位点可能以相似的方式影响MAP3K4基因的翻译效率。此外,大量研究表明,内含子剪接增强子能结合反式作用因子,调节剪接体选择性使用剪接位点的能力[19],影响内含子的剪切速度[20]。推测处于内含子中的结构变异可能通过其中的剪切增强子改变MAP3K4基因转录后的加工效率。同时,简单重复元件(SSR)以微卫星形式存在于基因组中,长25 bp[21],内含子中的SSR可调节转录频率[22],其序列长度会影响基因的表达量水平[23-24],过长会导致转录水平降低[25]。结构变异MAP3K4-I15-sv189中含有两个串联的SSRs,长186 bp,几乎涵盖整个SV区域。有研究表明(CA)n序列可影响内含子剪切增强子的作用,(CA)n序列优先结合反式作用因子,从而影响剪切效率[26],例如表皮生长因子受体(epidermal growth factor receptors,EGFR)基因的转录过程因21个连续的(CA)而受到抑制[27];将肺表面活性蛋白B(surfactant protein B,SP-B)基因内含子4中的17个连续(CA)敲除,SP-BRNA前体的剪切效率显着上升[28]。结构变异MAP3K4-I15-sv189的每个SSR序列中含有多个(GT)重复,其互补链则为多个(CA)重复,最多之处有连续11个(CA)重复。推测可能是该SV序列中连续出现的(CA)序列,起到了剪切抑制因子的作用,并拮抗内含子增强子的效应,从而降低MAP3K4基因的转录水平,DD型肺组织中MAP3K4基因缺乏结构变异,不受CA重复及miRNA的干扰作用,从而表达量较高。由此推测,这两个SSR可能是阻碍MAP3K4基因转录的因素之一。
组织表达谱显示,MAP3K4基因在脑和肺组织中高表达。MAP3K4基因中含有单核苷酸多态性位点(SNP),是中国东北汉族人群精神分裂症的易感基因位点[29],推测可能与脑中MAP3K4基因的异常表达有关。目前MAP3K4基因与猪脑部疾病间的关系尚不清楚。有研究表明,MAP3K4基因所属p38 MAPK信号通路活性在脓毒性肺损伤中升高,p38 MAPK通路受抑制可消除肺部的白细胞浸润和肺水肿[30];发生急性肺损伤和支原体肺炎时,p38 MAPK/核因子κB(nuclear factor-κB,NF-κB)通路被激活,两者调控的多种炎症因子水平显着上升,如白细胞介素12 (interleukin-12,IL-12)、IL-13和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α);敲除鞘氨醇1磷酸酯受体3(sphingosine 1 phosphate receptor 3,S1PR3)基因、加入脂氧素受体激动剂BML-111(Methyl (5 S,6R)-5,6,7-trihydroxyheptanoate)或应用解毒清肺剂来抑制MAPK信号通路的活性,则可减轻肺部炎症[31-33];党参防治急性肺损伤的靶基因主要参与MAPK级联活化密切相关通路、膜受体蛋白酪氨酸激酶活性、蛋白质结合和ATP结合等生物功能[34]。这些研究结果表明MAPK信号通路的激活与肺部炎症正相关。香猪MAP3K4基因以DD型为主,同时DD型肺组织MAP3K4基因的表达量最高,已知香猪易发生肺部疾病[35-36],推测MAP3K4基因中结构变异MAP3K4-I15-sv189的有无与香猪肺部疾病易感有关。
4 结 论
猪群中结构变异MAP3K4-I15-sv189具有多态性,香猪群体以DD型为主,且DD型肺组织的MAP3K4高表达,表明该结构变异的缺失导致MAP3K4基因表达量上升,可能是香猪肺部疾病易感的原因之一。



