宋鹏琰,王思伟, 2,岳巧娴,张寅梁,陈晓勇,周荣艳*
(1.河北农业大学动物科技学院,保定 071001;2.河北省农林科学院粮油作物研究所,石家庄 050035)
microRNA(miRNA)是一种细胞内源性长度约18~24 nt的非编码且高度保守的RNA[1],主要通过与靶基因3′-UTR的特异性碱基互补配对在转录后水平调控基因表达[2]。miRNA可调控细胞周期、增殖、凋亡等过程[3-4]。miR-200b属于miR-200家族一员,可以参与激素合成和分泌、发情周期和排卵来调节雌性动物的繁殖。miR-200b和miR-200c可以靶向调控磷酸酶张力蛋白同源物的表达抑制人颗粒细胞KGN增殖[5]。miR-200b通过下调GNAQ反馈调控GnRH的表达来调控绵羊的发情过程[6]。敲除miR-200b和miR-429的雌性小鼠不排卵,且通过抑制ZEB1的表达来调节小鼠繁殖过程[7]。miR-200b-3p还可以靶向CYP19A1基因调控小鼠颗粒细胞类固醇激素的合成和分泌[8]。此外,miR-200b在哈萨克羊和湖羊发情期卵巢中表达显着下调[9-10],在小尾寒羊卵巢黄体期与卵泡期表达水平存在差异,且黄体期高于卵泡期[11],在不同直径绵羊卵泡中表达水平也有所差异[12],但其表达调控机制尚不明确。
NR4A1(Nur77、TR3或NGF1-B)作为核受体家族NR4A成员之一,可作为转录因子介导细胞凋亡[13-14]。NR4A1能够调控卵泡发育[15]、抑制颗粒细胞增殖并促进颗粒细胞凋亡,且其与黄体退化密切相关[16-17]。通过靶基因和转录因子的预测,发现NR4A1基因3′-UTR不存在miR-200b的结合位点,但在miR-200b的启动子区上存在NR4A1的结合位点,推测NR4A1能够调控miR-200b的转录。为验证这一假设,本研究鉴定了绵羊miR-200b核心启动子区,检测了NR4A1对miR-200b启动子活性及其表达水平的影响,为miR-200b的上游转录机制提供了理论依据。
线粒体作为“能量工厂”,为细胞提供能量,调控细胞周期、增殖分化、信号传导及细胞死亡过程[18]。细胞周期与线粒体功能协调互作[19],线粒体在细胞凋亡中起着至关重要的作用。细胞周期调节因子可以控制线粒体的生物发生、代谢活动及动力学,线粒体又可以为细胞周期提供所需能量[19]。线粒体功能异常可致线粒体膜电位下降、ROS升高,导致细胞凋亡[20-21]。线粒体氧化磷酸化(oxidative phosphorylation,OXPHOS)是线粒体重要的代谢功能之一,OXPHOS缺陷导致线粒体膜电位降低,引起细胞启动适应性反应[22]。miRNA通过靶基因参与细胞线粒体OXPHOS和ROS生成,调控细胞线粒体功能[23]。miR-211在调控细胞OXPHOS和线粒体能量代谢中起重要作用[24],miR-200a促进细胞线粒体伸长[25],miR-210调控线粒体电子传递链并刺激ROS产生[26]。抑制miR-23a可提高细胞线粒体膜电位并减少ROS产生,抑制细胞凋亡[27]。拮抗miR-107的表达可致细胞线粒体膜电位和电子传递链活性降低,引发线粒体失衡[28]。该团队前期研究发现,miR-200b抑制绵羊卵泡颗粒细胞增殖并促进细胞凋亡[29],推测miR-200b是通过影响颗粒细胞线粒体功能进而发挥抑增殖和促凋亡的作用。因此,本试验研究了miR-200b对绵羊卵泡颗粒细胞线粒体功能的影响,为阐明其抑制细胞增殖和促进细胞凋亡的作用机制奠定理论基础。
1 材料与方法
1.1 试验材料
DMEM/F12培养基、胎牛血清FBS购自Thermo Fisher Scientific公司;miR-200b mimic和mimic NC合成于广州锐博生物科技有限公司;SacⅠ、HindⅢ和PrimeScriptTM RT Reagent Kit购自TaKaRa公司;HiPerFect Transfection Reagent购自QIAGEN公司;LipofectamineTM2000和Mito-Tracker Red CMXRos购自Invitrogen公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司;无内毒素质粒大提试剂盒购自天根生化科技(北京)有限公司;增强型线粒体膜电位检测试剂盒(JC-1)和增强型ATP检测试剂盒购自上海碧云天生物技术有限公司;ROS活性氧检测试剂盒购自苏州宇恒生物科技有限公司;绵羊线粒体呼吸链复合物 Ⅰ(Complex Ⅰ)ELISA试剂盒购自上海臻科生物科技有限公司;Forget-Me-NotTMEvagreen®qPCR Master Mix购自美国Biotium公司。
1.2 颗粒细胞分离培养
在保定瑞丽肉食品有限公司采集绵羊(小尾寒羊)新鲜卵巢组织,立即放入含1%双抗的37 ℃生理盐水中,48 h内运回实验室。清洗消毒后去除多余的脂肪和系膜,利用无菌刀片划破卵泡(3~7 mm)释放卵泡液混于培养基中,1 500 r·min-1离心10 min。PBS洗涤2次后,用含10% FBS,1%青霉素链霉素与50 μg·mL-1丙酮酸钠的DMEM/F12培养基混匀颗粒细胞,并置于37 ℃、5% CO2培养箱内培养[29]。
1.3 荧光素酶载体构建
在NCBI数据库中下载绵羊miR-200b(ENSOARG00000023754,Chromosome 12,NC_040 263.1:55,091,437-55,091,495)启动子区序列。利用Promoter 2.0(http://www.cbs.dtu.dk/services/Promoter/)预测miR-200b的启动子,设计特异性引物(表1),并以绵羊基因组DNA为模板进行扩增。PCR产物送北京擎科生物科技有限公司进行测序。利用限制性内切酶SacⅠ 和Hind Ⅲ将不同片段序列连接至pGL3-Basic载体上,经制备线性克隆载体、片段插入、PCR扩增及产物纯化、克隆、转化及阳性克隆检测等过程,阳性克隆送至通用生物系统有限公司进行测序。提取测序鉴定后的阳性重组质粒用于细胞转染,测定浓度后于-20 ℃保存。
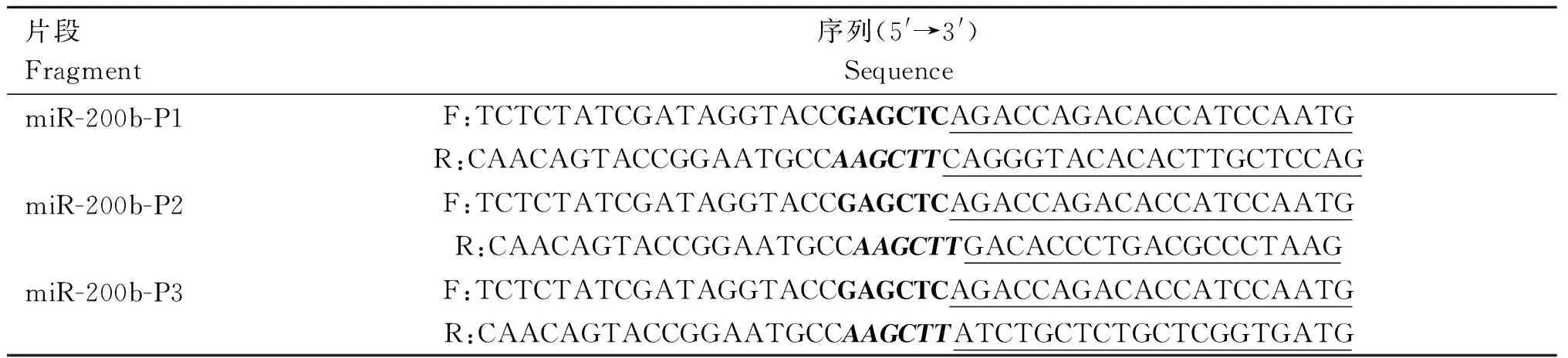
表1 启动子扩增引物Table 1 Primers used in promoter amplification
1.4 荧光素酶活性检测
以每孔8×104个细胞的密度将颗粒细胞接种于24孔板,每孔加入500 μL细胞悬液,置于37 ℃、5% CO2培养箱中,当细胞汇合度达70%~90%时,按照质粒:LipofectamineTM2000为1∶2、pGL3-control:pRL-TK为99∶1的比例分别将pGL3-Basic、miR-200b启动子重组质粒与内参载体pRL-TK共转染至颗粒细胞中,每组3个重复。转染48 h后,弃掉培养液,PBS洗涤2次,每孔加100 μL裂解液,室温震荡裂解10 min后转移至1.5 mL离心管,8 000×g(4 ℃)离心10 min。每组取5 μL上清液,加20 μL 1×LARII,混匀后测定F(萤火虫荧光素)值,再加20 μL 1×Stop &Glo Reagent,测定R(海肾荧光素酶)值。每孔检测重复3次。
1.5 Mito-tracker Red CMXRos染色
将颗粒细胞接种于24孔板,每孔0.5 mL细胞悬液,每组3个重复,37 ℃预培养。用opti-M分别稀释50 nmol·L-1miR-200b mimic和mimic NC,低速漩涡混匀,加入3 μL HiPerFect Transfection Reagent,低速漩涡混匀后室温静置10 min,然后将转染复合体逐滴加至24孔板内。48 h后,弃掉培养基,加入25 nmol·L-1Mito-Tracker Red CMXRos工作液,37 ℃孵育30 min。弃掉工作液,PBS清洗3次。滴加Hoechst 33342染色液进行核染,室温孵育10 min,PBS洗3次,弃掉液体,倒置荧光显微镜下观察拍照。然后将图片用Image J进行光密度分析和细胞长度分析。
1.6 线粒体膜电位和ROS检测
颗粒细胞转染50 nmol·L-1miR-200b mimic和mimic NC,48 h后,弃掉培养基,PBS洗涤2次。然后分别按照线粒体膜电位检测试剂盒和ROS检测试剂盒说明书进行探针的装载和检测,并用倒置荧光显微镜观察拍照。图片用Image J进行光密度分析。
1.7 ATP含量检测
将颗粒细胞接种于6孔板,每孔2.3 mL细胞悬液,每组3个重复,37 ℃预培养。转染50 nmol·L-1miR-200b mimic和mimic NC,48 h后收集上清液。每孔加240 μL裂解液,裂解细胞。裂解后4 ℃12 000×g离心5 min,取上清,放冰上待检测。先在1.5 mL离心管内加入100 μL ATP检测工作液,室温放置5 min,以消耗本底ATP;然后向检测孔内加20 μL样品或标准品,吹打混匀,2 s后检测RLU值。
1.8 线粒体复合物 Ⅰ 浓度检测
ELISA用于检测颗粒细胞上清液中线粒体复合物 Ⅰ 浓度。将步骤“1.5”中收集的细胞上清液3 000 r·min-1离心10 min。按ELISA试剂盒说明书进行配液和检测,并利用酶标仪在450 nm处测定OD值,并根据标准曲线计算样品线粒体复合物 Ⅰ 的浓度。
1.9 基因表达水平检测
将颗粒细胞接种于6孔板,转染50 nmol·L-1miR-200b mimic和mimic NC,48 h后收集细胞。首先利用TRIzolTMReagent提取RNA,然后利用PrimeScriptTMRT reagent kit进行反转录。具体步骤和体系如下:除去基因组DNA(RNA 800 μg,5×gDNA Reaction Buffer 2 μL,gDNA Eraser 1 μL,RNase-free dH2O 补至10 μL,42 ℃孵育2 min,4 ℃保存),以及反转录(上述反应液 10 μL,PrimeScript RT Enzyme Mix I 1 μL,RT Primer Mix 1 μL,5×PrimeScript Buffer 4 μL,RNase Free dH2O 4 μL。轻轻混匀,37 ℃孵育15 min,85 ℃加热失活5 s,产物-20 ℃保存)。最后利用Forget-Me-NotTMEvagreen®qPCR Master Mix进行qRT-PCR,反应体系:2×Forget-Me-NotTM qPCR Master Mix 10 μL,Forget-Me-Not EvaGreen ROX Reference Dye 3 μL,RNase-free dH2O 4.2 μL,cDNA 2 μL,Forward Primer 0.4 μL,Reverse Primer 0.4 μL。反应条件:95 ℃ 2 min;95 ℃ 30 s,60 ℃ 5 s共40个循环。数据采用2-ΔΔCt方法进行计算。引物序列详见表2。
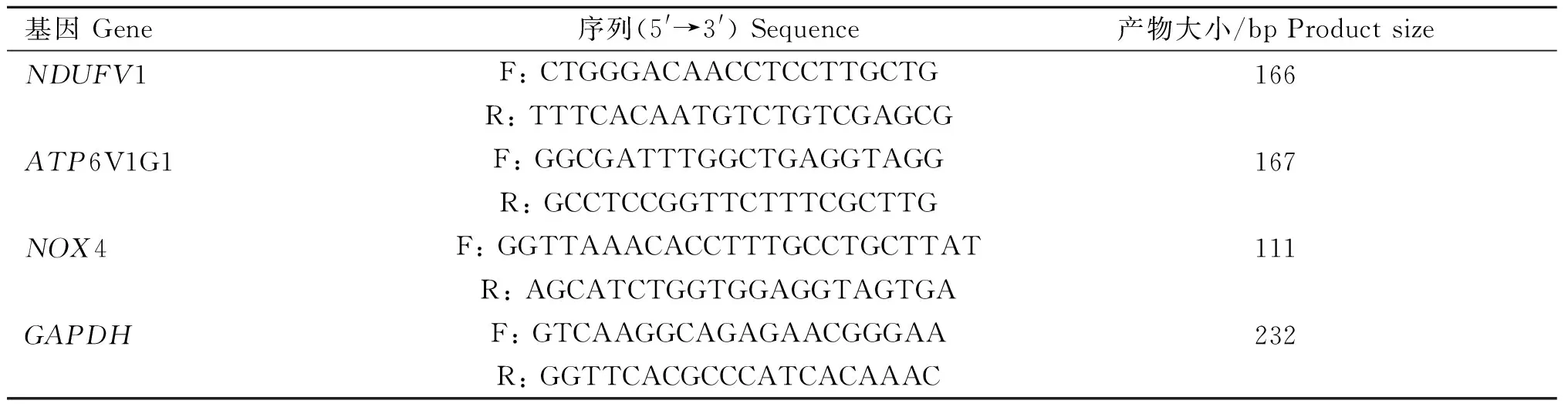
表2 qRT-PCR引物序列Table 2 qRT-PCR primer sequences
1.10 统计分析
所有数据均用SPSS 22.0进行统计分析。判断每组数据是否符合正态分布,若符合正态分布,则采用独立样本t检验;若不符合则采用非参数检验(Mann-Whitney U检验)。利用GraphPad Prism 8软件作图。所有结果以“平均数±标准差(Mean±SD)”表示,P<0.05表示差异有统计学意义。
2 结 果
2.1 绵羊miR-200b核心启动子区的鉴定
利用pGL3-Basic质粒构建miR-200b启动子区不同长度片段的荧光素酶表达载体miR-200b-P1(-159/+36 nt)、miR-200b-P2(-339/+36 nt)和miR-200b-P3(-581/+36 nt)。将不同长度片段重组质粒分别转染至绵羊卵泡颗粒细胞中,48 h后收集细胞,化学发光法检测双荧光素酶活性。如图1所示,miR-200b-P1的荧光素酶活性分别极显着高于空载体pGL3-Basic和其他片段(P<0.01),表明其为绵羊miR-200b的核心启动子。利用在线软件JASPAR(https://jaspar2018.genereg.net/analysis)预测绵羊miR-200b-P1序列中存在1个转录因子NR4A1结合位点(图2)。
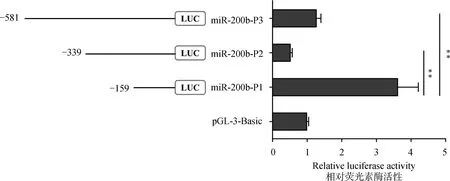
**.P<0.01,下同**.P<0.01, the same as below图1 绵羊miR-200b启动子区不同缺失载体的相对荧光素酶活性Fig.1 The relative luciferase activity of different deletion vectors of oar-miR-200b promoter
2.2 NR4A1促进绵羊miR-200b的转录
将实验室保存的NR4A1过表达载体(pcDNA3.1-NR4A1)与miR-200b-P1共转染至绵羊卵泡颗粒细胞中,48 h后收集细胞并进行双荧光素酶活性检测。过表达NR4A1的颗粒细胞中miR-200b-P1启动子活性极显着升高(P<0.01,图3A)。与pcDNA3.1组相比,NR4A1过表达的颗粒细胞中miR-200b表达水平极显着上调(P<0.01,图3B)。以上结果说明,NR4A1可促进绵羊miR-200b的转录。
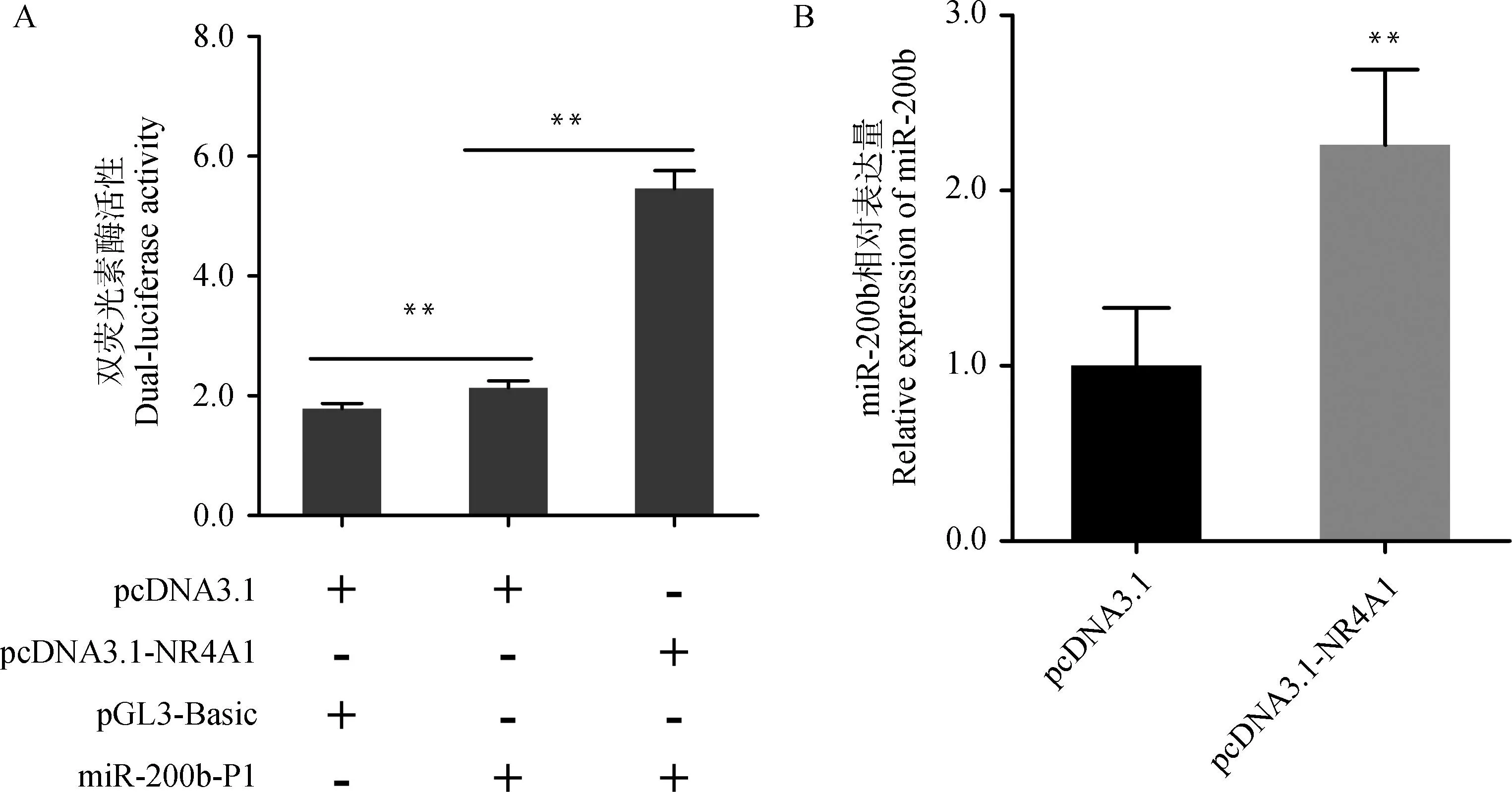
A. miR-200b-P1启动子区活性;B. miR-200b相对表达量A. The promoter activity of miR-200b-P1; B. Relative expression of miR-200b图3 绵羊miR-200b核心启动子活性及其相对表达水平Fig.3 The core promoter activity and relative expression of oar-miR-200b
2.3 miR-200b对颗粒细胞线粒体形态和数量的影响
通过Mito-Tracker Red CMXRos染色(图4A)发现,与mimic NC组相比,miR-200b mimic组的颗粒细胞线粒体发生皱缩。经统计分析,miR-200b mimic处理组颗粒细胞平均光密度显着降低(P<0.01,图4B),线粒体数量减少,且细胞长度显着缩短(P<0.01,图4C)。
2.4 miR-200b对颗粒细胞线粒体膜电位的影响
线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成JC-1聚合物(JC-1 aggregates),产生红色荧光;线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,以JC-1单体(JC-1 monomer)形式存在,产生绿色荧光;JC-1从红色荧光到绿色荧光的转变,说明细胞线粒体膜电位下降,也是细胞早期凋亡的标志性事件。与mimic NC组相比,miR-200b mimic组的颗粒细胞绿色荧光显着增强,且红色荧光与绿色荧光比值显着降低(P<0.05,图5A),说明颗粒细胞中JC-1单体明显增多,线粒体膜电位下降。
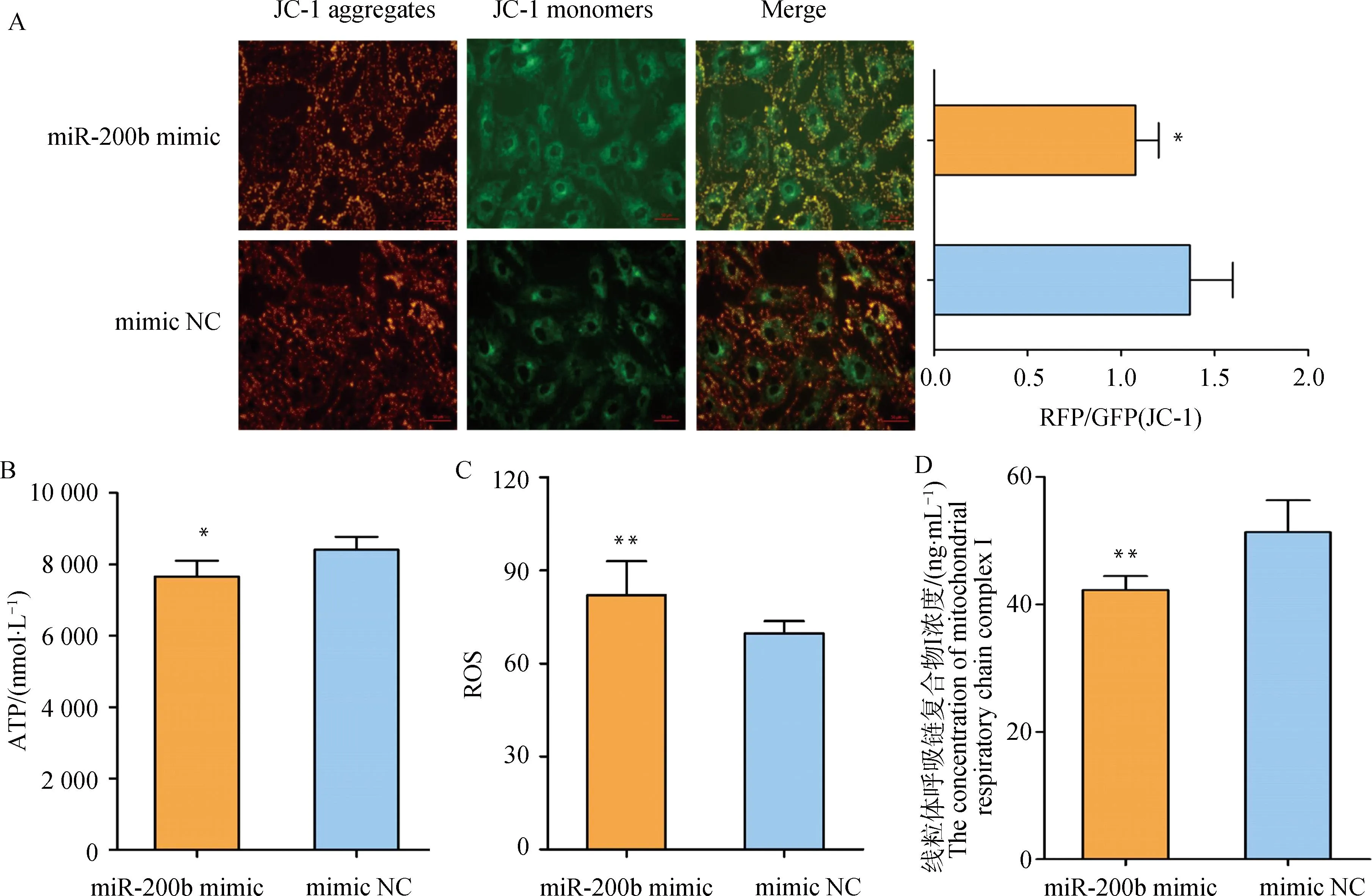
A. 线粒体膜电位染色(200×)及红色荧光与绿色荧光相对比值;B. ATP含量;C. ROS水平;D. 线粒体呼吸链复合物 Ⅰ 浓度。*.P<0.05A. Staining in mitochondrial membrane potential (200×) and relative RFP/GFP ratio; B. The content of ATP; C. The level of ROS; D. The concentration of mitochondrial respiratory chain complex I. *.P<0.05图5 过表达miR-200b的绵羊卵泡颗粒细胞线粒体膜电位及氧化磷酸化相关指标变化Fig.5 Changes in mitochondrial membrane potential and OXPHOS-related indicators in ovine follicular granulosa cells with overexpression of miR-200b
2.5 miR-200b对颗粒细胞线粒体氧化磷酸化及相关基因表达的影响
与mimic NC组相比,miR-200b mimic组的颗粒细胞ATP含量(P<0.05,图5B)和线粒体呼吸链复合物 Ⅰ 的浓度(P<0.01,图5D)显着降低,ROS水平极显着升高(P<0.01,图5C)。此外,miR-200b mimic极显着下调颗粒细胞线粒体氧化磷酸化相关基因NDUFV1(P<0.01, 图6A)和ATP6V1G1(P<0.01, 图6B)基因的表达水平,并极显着上调NOX4基因的表达水平(P<0.01, 图6C)。
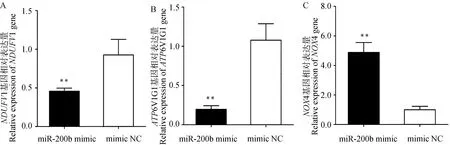
图6 绵羊卵泡颗粒细胞中线粒体氧化磷酸化相关基因的表达水平Fig.6 The expression level of mitochondrial OXPHOS related genes in ovine follicular granulosa cells
3 讨 论
miRNA主要通过与靶基因3′-UTR结合发挥其对基因下游的调控功能,但miRNA的转录及其上游调控机制研究也很重要。一些miRNAs位于基因内含子区域,与宿主基因享有相同的转录调控元件,但大部分miRNA具有自己的启动子[2]。因此,研究miRNA的启动子有助于揭示miRNA自身的转录调控过程。转录因子在动物细胞内广泛存在,能通过准确识别并结合到特异的DNA片段来发挥转录调控作用[30]。许多转录因子可调控miRNA的转录。CCAAT/增强子结合蛋白a可作用于miR-130a和miR-130b基因的启动子分别显着抑制和促进miRNA的启动子活性[31]。TGFβ1可调控miR-224启动子区域诱导miR-224的转录[32]。ZEB1和ZEB2可直接结合miR-200s 启动子区抑制其转录[33]。转录因子结合位点是转录因子在转录水平调控基因表达时结合的靶基因启动子的特殊位点[34],转录因子通过结合在miRNA启动子区域的转录因子结合位点上调控miRNA表达。本研究明确了绵羊miR-200b核心启动子区(-159/+36 nt),证实NR4A1影响miR-200b核心启动子的活性及其表达水平,促进miR-200b的转录。
NR4A(nuclear receptor subfamily 4 group A member)家族是一类及早反应基因家族[35],主要由NR4A1、NR4A2和NR4A3组成。NR4A涉及细胞生长、生存和凋亡,主要源于3种生化特性:1)作为转录因子,激活上调介导细胞增殖和存活的靶基因表达;2)作为转录因子,激活上调导致细胞凋亡的靶基因表达;3)移位至胞质并靶向定位于线粒体触发凋亡[13-14]。NR4A1在动物组织中广泛表达,并在卵巢组织中主要定位于卵泡膜细胞、黄体细胞和颗粒细胞[17,36-37],调控雌性动物卵巢功能和卵泡发育。NR4A1可作为miRNA(如miR-204-5p[38]、miR-506[39])下游靶基因发挥作用。然而,NR4A1基因3′-UTR与绵羊miR-200b间不存在靶向结合位点,因此二者不存在靶向关系。NR4A1作为转录因子可以调控多种RNAs的转录。NR4A1在黄体细胞中高表达[37],miR-200b在黄体期卵巢中表达上调[11],且二者都能抑制颗粒细胞增殖并促进细胞凋亡[16,29],推测NR4A1可调控miR-200b的转录。在本研究中,绵羊miR-200b核心启动子上存在NR4A1的结合位点,且过表达NR4A1提高了miR-200b的启动子活性和表达水平,证实NR4A1能够正向调控绵羊miR-200b的转录。
miR-200b过表达显着下调细胞周期相关基因表达抑制绵羊卵泡颗粒细胞增殖,同时显着下调Bcl-2的表达水平促进颗粒细胞凋亡[29]。线粒体在细胞周期和凋亡中扮演着重要作用[18]。细胞周期重要调控因子CDK1和Cyclin B,其蛋白定位于线粒体基质上,可磷酸化呼吸链复合物 Ⅰ 亚基,复合物被激活,可促进OXPHOS为G2/M期转化提供充足的ATP[40]。Bcl-2家族成员可驱动线粒体外膜透化,导致凋亡诱导因子和半胱天冬酶通路激活所介导的细胞凋亡[41-43]。半胱天冬酶通路与线粒体损伤相关,伴随电子传递的破坏、OXPHOS、ATP产生和氧化还原电位变化[21,44]。本研究发现,在颗粒细胞中过表达miR-200b导致线粒体功能异常,包括线粒体皱缩、线粒体膜电位下降、ATP含量降低,以及ROS水平提高。线粒体结构的完整性与形态维持对其功能发挥起着至关重要的作用,且线粒体通过OXPHOS产生ATP[45],而ROS是触发颗粒细胞凋亡所必需的[46]。通过检测发现,miR-200b过表达导致颗粒细胞线粒体呼吸链体复合物 Ⅰ 的浓度降低,且下调了参与复合物 Ⅰ 模块组装的关键基因NDUFV1的表达。同时,与ATP生成相关基因ATP6V1G1的表达水平也发生异常,且上调与ROS产生相关基因NOX4的表达。所有这些结果相互一致,表明miR-200b可负调控绵羊卵泡颗粒细胞OXPHOS,导致细胞线粒体功能异常,进而能够抑制颗粒细胞增殖并促进细胞凋亡。
4 结 论
绵羊miR-200b的核心启动子区为-159/+36 nt,NR4A1正向调控miR-200b的转录,且miR-200b抑制绵羊卵泡颗粒细胞氧化磷酸化过程,诱导颗粒细胞线粒体损伤。本研究为进一步揭示miR-200b调控绵羊卵泡发育的作用机制提供了理论依据。



