李广兴,陈 阳,陈凯婷,武梦林,张 迪,黄小丹*
(1.东北农业大学动物医学院,哈尔滨 150030;2.黑龙江省实验动物与比较医学重点实验室,哈尔滨 150030)
邻苯二甲酸二-2-乙基己酯[di(2-ethylhexyl)phthalate, DEHP]作为一种合成聚合物的增塑剂,已被广泛应用于纺织品、医疗器械、电子产品和个人护理用品等方面[1]。而增塑剂会在材料中迁移并随着时间的推移从材料中渗出,最终进入环境[2]。随着DEHP的生产和使用量越来越大,其释放在环境中的含量也呈逐年上升趋势[3]。由于DEHP不断地释放到环境中,从而通过饮食,呼吸和皮肤接触进入人体,进而危害人体健康,这引起了人们对其安全性及其对人体健康的潜在影响的一些担忧[4]。广泛的研究表明,DEHP对人和动物都有有害影响,可诱导生殖毒性、神经毒性和心脏毒性,此外还有免疫毒性[5-8]。据报道,在哮喘小鼠模型中,DEHP增加了总IgE水平,此外,BALF中酸性粒细胞数量和肺中酸性粒细胞阳离子蛋白(ECP)明显增加[9]。研究人员发现DEHP可以改变骨髓中B细胞的成熟和分化[10]。此外,DEHP使小鼠巨噬细胞发生极化,M1极化降低,而M2极化增强,提示DEHP可以影响巨噬细胞的体内免疫反应,显着降低其肿瘤预防能力[11]。DEHP持续灌胃45 d,会导致鹌鹑脾受损,组织病理学观察脾组织中可见脾小体边界和细胞间隙增大[12]。大量研究表明,DEHP等环境污染物造成的细胞损伤与氧化应激有关[13-14]。值得注意的是,DEHP通过增加ROS的产生,从而诱导氧化应激,增加Bax/cytochrome-c/Caspase-3的表达水平,抑制BCL-2的表达,启动大鼠颗粒细胞的线粒体凋亡途径[15]。此外,氧化应激损伤通过激活细胞程序性坏死途径,增加坏死相关基因TNF-α、RIPK1、RIPK3、MLKL和JNK的表达,介导鸡肾细胞程序性坏死[16]。
PTEN/PI3K/AKT通路参与了细胞生长、凋亡以及与环境有关的多个细胞过程,并与氧化应激的产生密切相关[17]。多项研究表明,当细胞发生氧化应激时,会刺激ROS的过度产生,进而激活PTEN的表达,从而抑制PI3K/AKT表达,这是导致细胞损伤的主要途径[18-19]。PTEN/PI3K/AKT通路是细胞存活的保护通路,而氧化应激也常常通过调节PTEN/PI3K/AKT通路而导致细胞损伤。抑制miR-21能上调卵巢癌细胞中PTEN表达,阻断PI3K/AKT通路的活性,从而促进细胞凋亡[20]。此外,不同剂量的CPF暴露草鱼肝细胞,PTEN通过其脂质磷酸酶活性作用于PI3K/AKT通路,阻断该通路活性从而导致细胞凋亡和坏死[19]。肿瘤坏死因子(TNF)诱导的细胞程序性坏死是受到PI3K/AKT的抑制,结果发现,RIP1、RIP3和MLKL的表达水平升高,表明抑制PI3K/AKT通路可激活细胞坏死通路,最终导致细胞程序性坏死[21]。值得注意的是,双酚A(BPA)暴露通过上调Bax、caspase-3、caspase-9、RIP1、RIP3和MLKL的表达,下调BCL-2表达,加重了缺硒鸡肾细胞凋亡和程序性坏死,PI3K/AKT的负调控在此过程中发挥着重要作用[22]。此外,硒减轻了镉暴露通过抑制PI3K/AKT途径导致的凋亡和程序性坏死,改善了鲤鱼脾淋巴细胞的损伤[23]。
综上所述,氧化应激调控PTEN/PI3K/AKT通路,在细胞凋亡和坏死中发挥着重要作用。此外,DEHP是一种有害的环境污染物。有研究表明,DEHP可引起细胞氧化应激和降低细胞中PI3K/AKT的表达水平,最终诱导细胞损伤[24-25]。然而,目前尚未有关于DEHP暴露通过ROS/PTEN/PI3K/AKT引起HD11细胞凋亡和程序性坏死的研究。因此,本试验通过建立DEHP体外暴露模型,通过吖啶橙/澳化乙锭(AO/EB)染色法和流式细胞术检测凋亡及坏死信号,氧化应激试剂盒检测氧化与抗氧化指标,qRT-PCR和Western blot检测PTEN/PI3K/AKT信号通路,凋亡相关基因(Bax、Caspase-3、Caspase-9和BCL-2)以及坏死相关基因(RIPK1、RIPK3和MLKL),探讨其在免疫毒性进展中的具体机制。本试验结果将为进一步探索塑化剂的免疫毒性机制提供新思路。
1 材料与方法
1.1 主要试剂
DEHP(纯度≥99.0%,MCE,美国)。CCK8试剂盒、BCA试剂盒(碧云天生物技术公司,上海,中国)。青霉素、链霉素、胰酶(Gibco,美国)。胎牛血清(BioInd,上海,中国)。辣根过氧化酶标记的羊抗兔/鼠二抗(Abmart,上海,中国)。
1.2 HD11细胞培养
HD11细胞在RPMI-1640培养基(含10%胎牛血清、100 IU·mL-1青霉素、100 μg·mL-1链霉素)中,于37 ℃、饱和湿度条件下,含5%CO2的培养箱中培养。根据细胞生长状况,每1 d传代1次。将HD11细胞接种到每孔细胞密度为2×106的96孔板中。每孔加入细胞悬液100 μL,待细胞融合度达70%~80%时进行DEHP处理。DEHP暴露浓度分别为0、30、60、90、120、150、180、210、240 μmol·L-1DEHP进行处理。DEHP暴露24 h后,每孔加入10 μL CCK8,随后在温箱中继续孵育2 h,用酶标仪测定450 nm处的吸光度。按照说明书的公式计算不同浓度DEHP处理细胞后的细胞活力,并以折线图的形式呈现不同浓度DEHP暴露HD11细胞后的细胞活力。使用软件SPSS分析半数抑制浓度(IC50)和95%置信区间。
1.3 HD11细胞分组
根据DEHP暴露对HD11细胞24 h的IC50,应用细胞存活率为≥80%的30 μmol·L-1DEHP为最低剂量,最终在DEHP致HD11细胞凋亡和程序性坏死及氧化应激作用的研究中,本试验用不同浓度的DEHP (0、30、60、90 μmol·L-1)处理HD11细胞24 h分别命名为对照组(C组)、低剂量组(L组)、中剂量组(M组)和高剂量组(H组)。
1.4 氧化应激相关指标的测定
按照南京建成试剂盒说明书对LMH细胞进行相应处理。用酶标仪在525 nm/532 nm/520 nm/550 nm/412 nm波长下测定ROS/MDA/T-SOD/T-AOC/GSH-PX的吸光度。
1.5 AO/EB染色和流式细胞术
1.5.1 AO/EB染色 每100 μL细胞悬液加入4 μL AO/EB混合液(AO∶EB=1∶1),在室温避光培养5 min后,将其放入荧光显微镜观察形态学改变,然后拍照记录。根据以下的公式计算细胞凋亡指数。凋亡指数=凋亡细胞数/(正常活细胞数+凋亡细胞数+坏死细胞数)×100%。坏死指数=坏死细胞数/(正常活细胞数+凋亡细胞数+坏死细胞数)×100%。
1.5.2 流式细胞术 加入195 μL Annexin V-FITC结合液重悬细胞,再避光加入5 μL Annexin V-FITC 和10 μL碘化丙啶,混匀,避光于室温下温育20 min。转移至新的流式玻璃管中,加入1×binding buffer 400 μL,轻弹混匀。用流式细胞术(NovoCyte,Aceabio,USA)和FlowJo7.6.1软件检测细胞凋亡率和坏死率。
1.6 总RNA分离及实时荧光定量PCR分析
使用总RNA试剂盒II(天根生物技术有限公司,北京,中国)中提取HD11细胞总RNA,反转录为cDNA,以β-actin为内参基因。qRT-PCR在LightCycler@480系统(罗氏,瑞士)上进行。引物序列分别见表1。荧光定量PCR反应条件:94 ℃预变性2 min;94 ℃变性15 s,60 ℃退火15 s,72 ℃延伸30 s,共45个循环;以GAPDH的Ct值为内参,采用相对定量分析2-ΔΔCt对得到的Ct值进行数据分析。
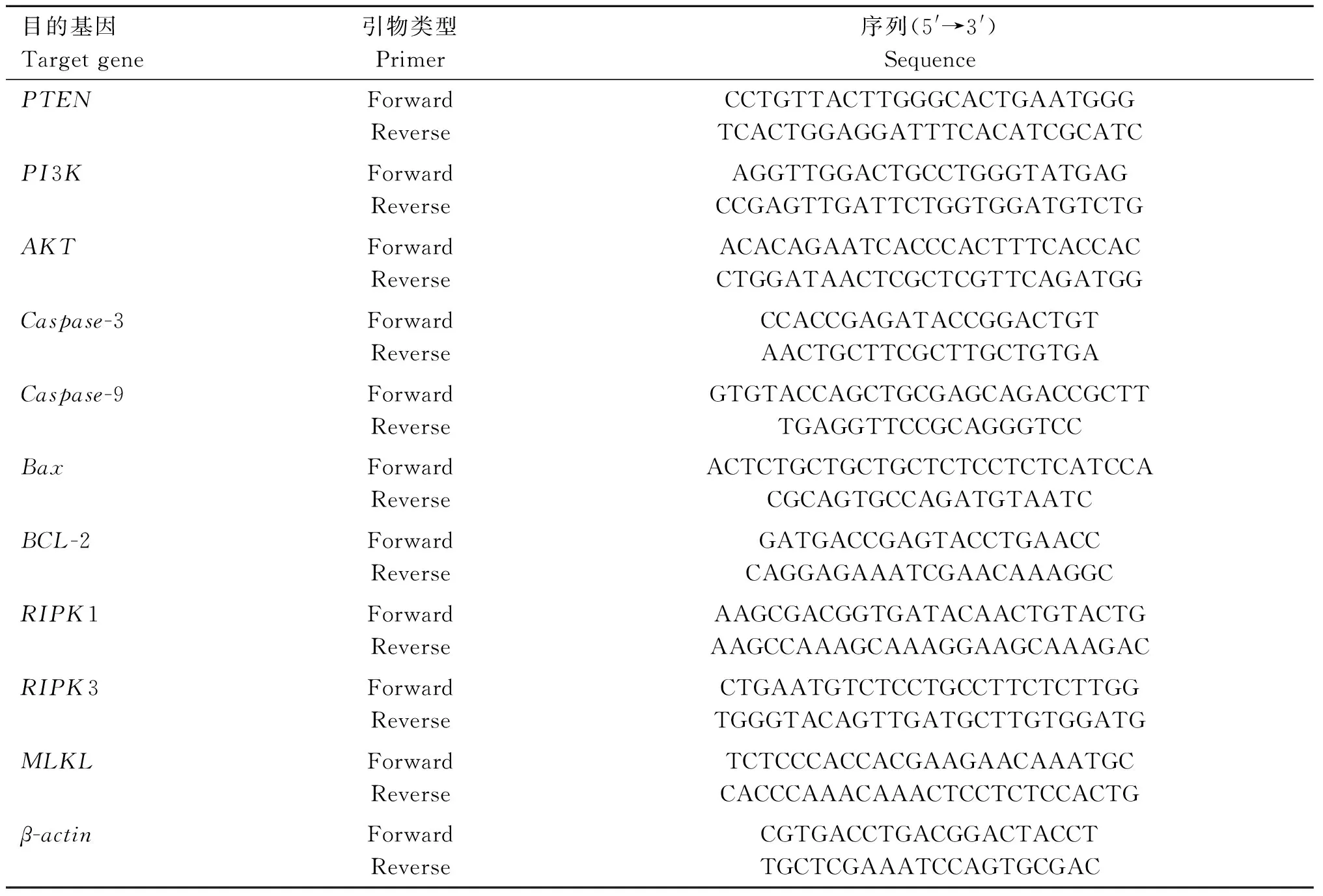
表1 鸡 qRT-PCR 的基因序列Table 1 Gene-special primers used for qRT-PCR in chicken
1.7 Western blot检测
采用BCA试剂盒检测蛋白浓度。将电泳后分离的蛋白电转至硝酸纤维素膜上,5%脱脂奶37 ℃封闭2 h,随后,将纤维膜在4 ℃的一抗中孵育过夜。用TTBS洗涤3次,每次15 min,接着在室温下进行二抗孵育时长为2 h,然后用TTBS洗涤3次,每次15 min。ECL发光压片显色,以GAPDH作为内参,扫描并分析图像,并计算相对表达量。本研究使用的抗体如下:PTEN(1∶1 000,万类,沈阳),PI3K(1∶1 000,万类,沈阳),AKT(1∶1 000,万类,沈阳),BCL-2(1∶1 000,万类,沈阳),Bax(1∶1 000,万类,沈阳),Caspase3(1∶1 000,万类,沈阳),Caspase9(1∶1 000,万类,沈阳),RIPK1 (1∶1 000,Abmart,上海),RIPK3(1∶1 000,Abmart,上海),MLKL(1∶1 000,Abmart,上海),GADPH(1∶1 000,Abmart,上海),HRP标记的山羊抗兔IgG(1∶5 000,ZSGB-B)。
1.8 统计分析
采用SPSS(17版; SPSS,Chicago,IL,USA)进行统计学显着性分析。用GraphPad(版本7.0,GraphPad Software inc. ,San Diego,CA,USA)进行统计学分析,P<0.05具有统计学意义。在每种情况下至少进行3个独立的试验,并以平均值(SEM)的“平均值±标准误差”表示数据。
2 结 果
2.1 DEHP暴露对HD11细胞活力的影响
为了明确DEHP对HD11的半数抑制浓度,用0、30、60、90、120、150、180、210、240 μmol·L-1DEHP处理HD11细胞24 h,随后进行CCK-8检测细胞活力,如图1所示,结果表明,随着DEHP浓度的升高,细胞活力呈浓度依赖式下降,DEHP显着抑制了HD11细胞的细胞活力。DEHP对HD11细胞24 h的IC50为180.644 μmol·L-1(95%置信区间:160.725~208.598 μmol·L-1)。
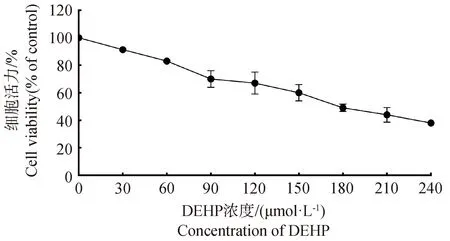
图1 DEHP暴露对HD11细胞活力的影响Fig.1 Effect of DEHP exposure on HD11 cell viability
2.2 DEHP暴露对HD11细胞氧化应激指标的影响
为了评估DEHP暴露对HD11细胞氧化应激的影响,因此,本试验检测了相关的氧化应激指标。结果如图2所示,与对照组相比,DEHP处理组的ROS与MDA表达水平显着升高,并且与DEHP浓度成正比(P<0.01)。此外,与对照组相比,T-AOC表达水平显着降低,抗氧化物酶T-SOD,GSH-PX活性显着降低(P<0.01),结果表明,DEHP可诱导HD11细胞发生氧化应激,从而导致HD11细胞损伤。
2.3 AO/EB染色和流式细胞术分析
为了证实DEHP暴露可诱导HD11细胞发生细胞凋亡和程序性坏死,用AO/EB染色和流式细胞术检测了不同暴露剂量下HD11细胞的细胞凋亡和程序性坏死比例。如图3A所示,AO/EB染色后,荧光显微镜可区分出4种细胞形态:活细胞,核染色质着绿色并呈正常结构;早期凋亡细胞,核染色质着绿色呈固缩状或圆珠状;晚期凋亡细胞,核染色质为橘红色并呈固缩状或圆珠状;非凋亡的死亡细胞,核染色质着橘红色并呈正常结构。在荧光图像中,随着DEHP暴露剂量的升高,L组、M组和H组的凋亡细胞和坏死细胞比例逐渐增加。此外,Annexin VFITC-PI荧光标记法探究细胞凋亡和坏死的具体数量。如图3C所示,流式细胞仪数据显示,坏死细胞比例5.1%增加到16.2%(第一象限),第二、三象限显示,凋亡细胞比例5.8%增加到19.8%,AO/EB和流式细胞术结果共同表明,DEHP以浓度依赖性的方式增加了凋亡细胞和坏死细胞的比例。
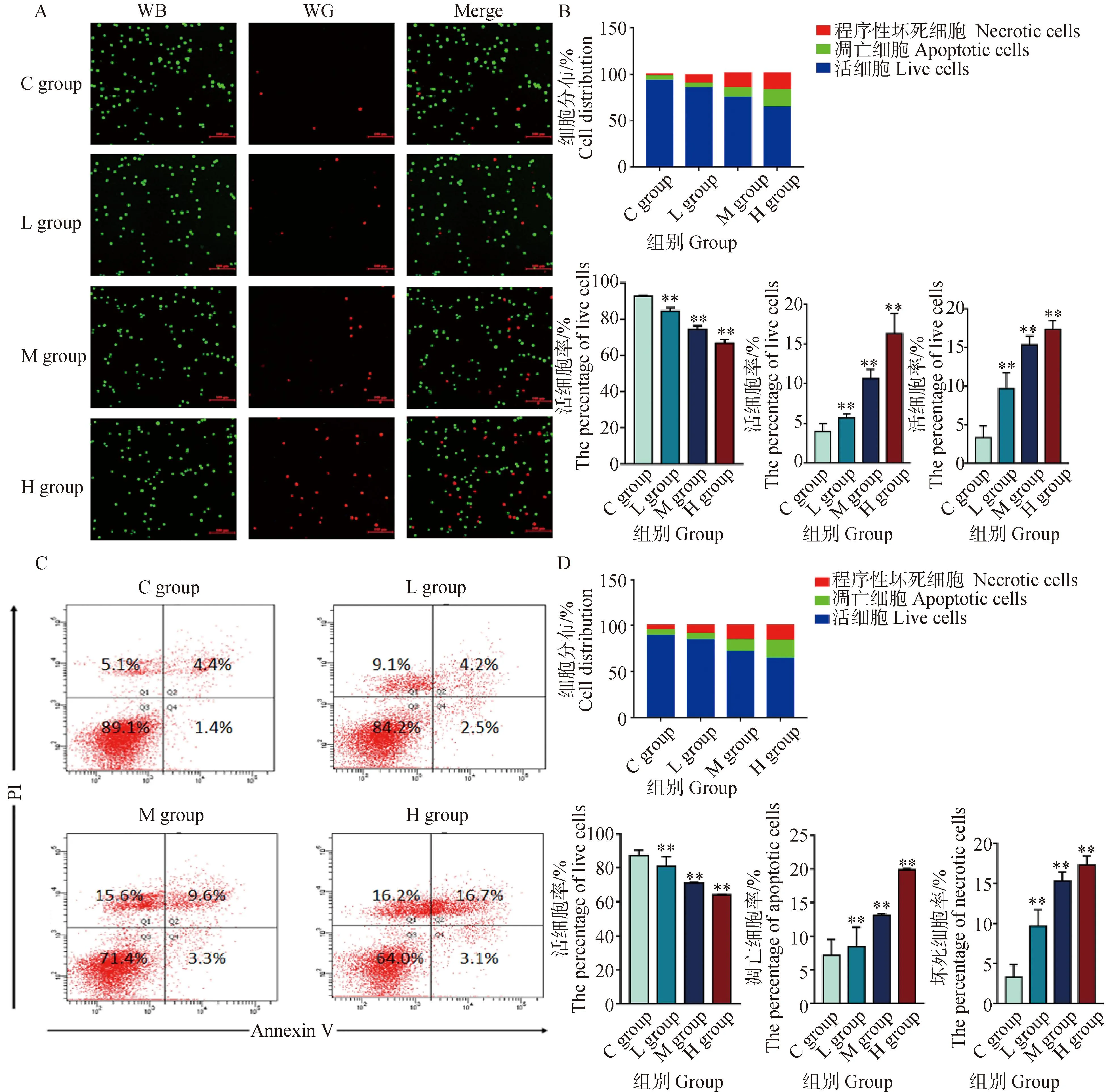
A. AO/EB染色(比例尺,100 μm);B. Image J 荧光定量强度分析;C.流式细胞术分析;D.流式细胞术定量分析。与对照组(0 μmol·L-1)相比,**. P<0.01A. The AO/EB fluorescence staining (scalebar, 100 μm); B. The AO/EB fluorescence intensity quantitative analysis by ImageJ; C. The results of flowcytometry analysis; D. The quantitative results of flowcytometry. Compared with C group (0 μmol·L-1),**. P<0.01图3 HD11细胞凋亡检测结果Fig.3 Cell apoptosis assay results for HD11 cells
2.4 DEHP暴露对HD11细胞PTEN/PI3K/AKT通路相关基因表达的影响
为了探索DEHP诱导的HD11损伤过程是否与PTEN/PI3K/AKT通路有关,本试验检测了DEHP暴露24 h后,HD11细胞中PTEN/PI3K/AKT信号通路相关基因的表达情况。如图4所示,与对照组相比,DEHP暴露组PTEN的mRNA和蛋白水平显着升高。DEHP暴露组PI3K和AKT mRNA及蛋白表达明显降低(P<0.01)。结果表明,DEHP能增强HD11细胞中PTEN的表达,进而抑制PI3K和AKT的表达,且这种作用随着DEHP剂量的增加而加强,提示DEHP能有效调控HD11细胞内PTEN/PI3K/AKT通路的活性。
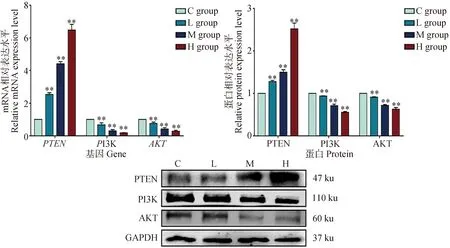
与对照组(0 μmol·L-1)相比,**. P<0.01Compared with C group (0 μmol·L-1),**. P<0.01图4 PTEN/PI3K/AKT通路相关基因mRNA及蛋白表达变化Fig.4 Changes of mRNA and protein expression of PTEN/PI3K/AKT pathway related genes
2.5 DEHP暴露对HD11细胞线粒体凋亡相关基因表达的影响
为了研究DEHP对HD11细胞凋亡的影响,进一步检测了凋亡通路相关因子Caspase 9、Caspase 3、BCL-2和Bax的mRNA和蛋白表达。如图5所示,与对照组相比,DEHP暴露组抗凋亡基因BCL-2的mRNA和蛋白表达显着降低,而Caspase 9、Caspase 3和Bax的mRNA和蛋白表达显着增加(P<0.01)。结果表明DEHP暴露诱导HD11细胞发生线粒体凋亡。
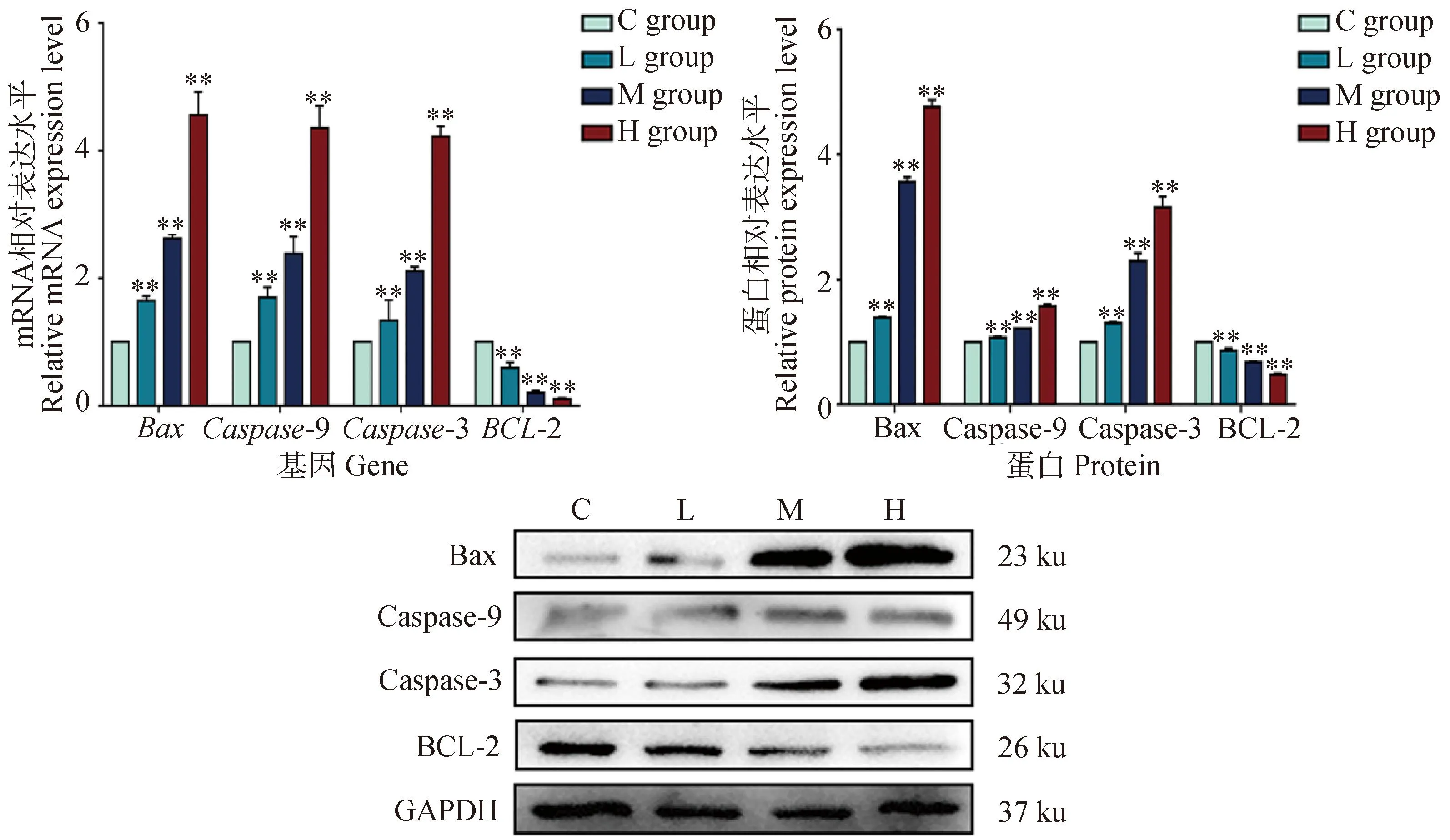
与对照组(0 μmol·L-1)相比,**. P<0.01Compared with C group (0 μmol·L-1),**. P<0.01图5 细胞凋亡相关基因mRNA及蛋白表达变化Fig.5 Changes of mRNA and protein expression of apoptosis related genes
2.6 DEHP暴露对HD11细胞程序性坏死相关基因表达的影响
为了验证DEHP暴露24 h后细胞内的坏死通路被激活,分析了程序性坏死信号通路相关基因RIPK1、RIPK3和MLKL的mRNA和蛋白表达,由图6所知,当DEHP暴露时,与对照组相比,RIPK1、RIPK3和MLKL的mRNA和蛋白表达水平均显着升高(P<0.01)。表明DEHP暴露诱导HD11细胞发生程序性细胞坏死。
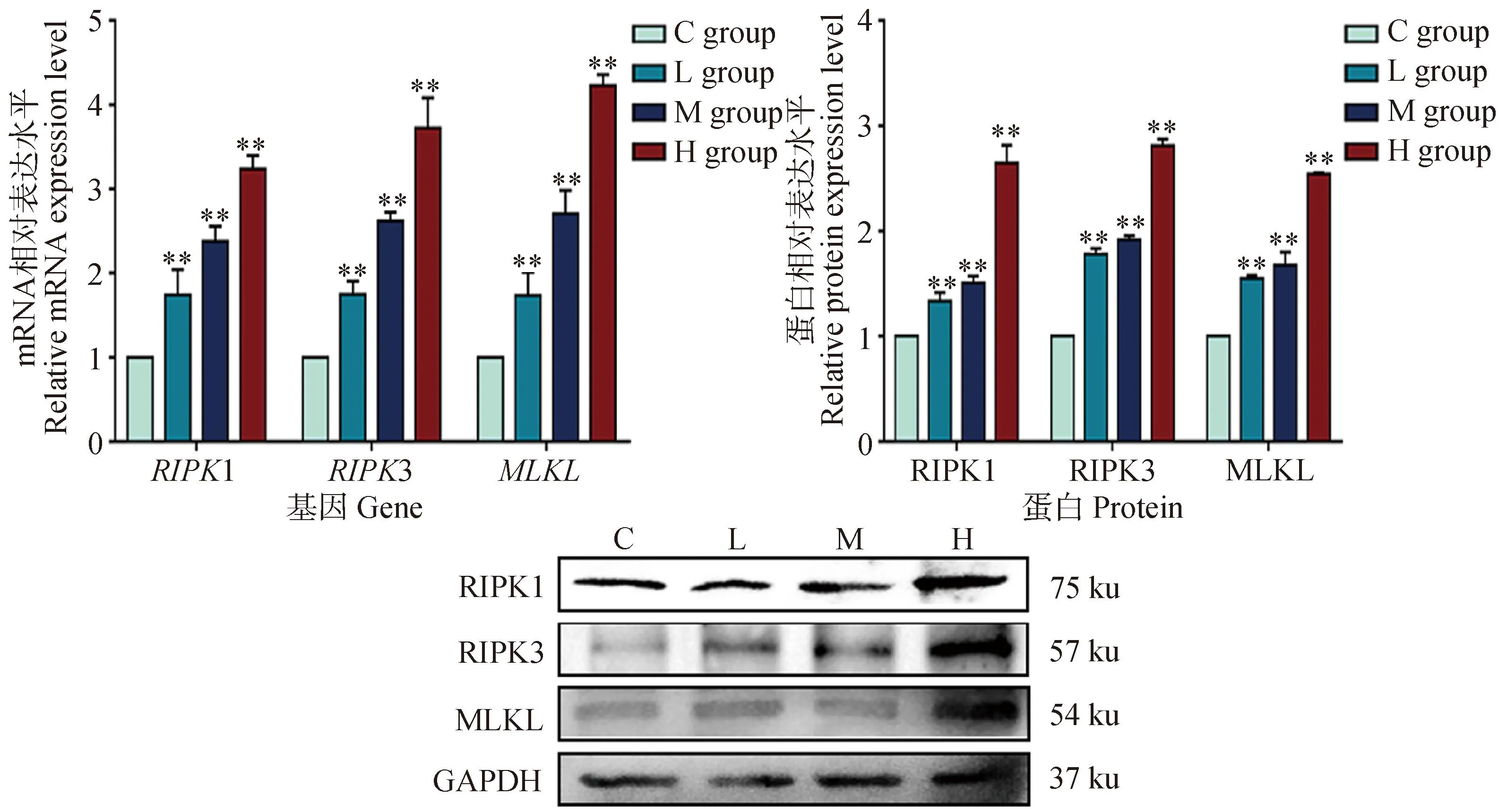
与对照组(0 μmol·L-1)相比,**. P<0.01Compared with C group (0 μmol·L-1),**. P<0.01图6 程序性坏死相关基因mRNA及蛋白表达Fig.6 Changes of mRNA and protein expression of necroptosis related genes
2.7 主成分分析和相关性分析
为了进一步探究DEHP暴露引起的HD11细胞凋亡和程序性坏死与PTEN/PI3K/AKT通路是否有关,利用PCA对上述指标进行了分析,由图7A所知,所有检测基因均位于三维结构中,PC1、PC2、PC3分别代表不同的3个组成部分,占比为94.6%、3.7%和0.8%。通过Pearson检验各基因之间的相关性。从结果中发现PTEN、PI3K、AKT通路以及凋亡和程序性坏死相关基因主要集中在PC1,且PI3K、AKT、BCL-2之间呈正相关,与其他因子呈负相关,相关分析结果如图7B所示,显示相关分析的结果与PCA基本一致。提示PTEN负调控PI3K/AKT通路进而促进DEHP诱导的HD11细胞凋亡和程序性坏死。
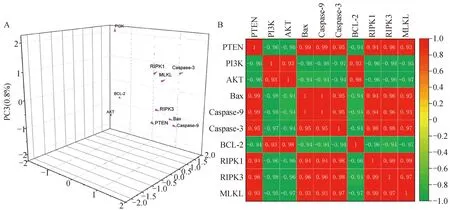
图7 主成分分析(A)及相关性分析(B)Fig.7 Principal component analysis (A) and correlation analysis (B)
3 讨 论
DEHP作为无处不在的存在于食品和自然环境中的污染物,可诱发免疫系统损伤和氧化应激损伤[26-27]。研究人员发现暴露于不同剂量的DEHP,会产生大量ROS,最终导致大鼠卵巢颗粒细胞发生线粒体凋亡[15]。此外,PTEN/PI3K/AKT通路与毒性作用机制密切相关,参与了细胞凋亡和程序性坏死通路的激活[19]。本研究探讨了DEHP是否诱导鸡巨噬细胞凋亡和程序性坏死及其可能机制,本试验研究了DEHP调控ROS/PTEN/PI3K/AKT通路在DEHP诱导鸡巨噬细胞凋亡和程序性坏死中的作用,结果表明,DEHP暴露引起了HD11细胞程序性坏死和细胞凋亡,发生了氧化损伤。此外,PTEN/PI3K/AKT通路被激活,并存在剂量效应关系。诱导鸡巨噬细胞凋亡和程序性坏死。本研究为比较医学研究提供理论基础。
生物体内活性氧(ROS)生成量是一个动态变化过程,与许多内外因素有关,它直接决定是否发生氧化应激,而这也决定了细胞存活和死亡的不同调节[28]。在正常生理条件下,ROS主要被细胞内的抗氧化系统清除,从而使其维持在较低的水平参与细胞信号调节。然而,当细胞内抗氧化系统被抑制或者抗氧化系统与ROS的产生之间失去平衡时,氧化应激就会产生,当ROS过度产生便会导致氧化损伤[29]。研究显示,环境中的许多化学物质均可诱导细胞及器官产生氧化应激[30-32]。不同浓度的H2O2作用于HepG2细胞时,ROS水平显着增加并与H2O2呈剂量效应关系[33]。此外,维生素E和姜黄素单独作用均能有效减弱邻苯二甲酸二丁酯(DBP)引起的脾氧化应激损伤[34]。DEHP被证明可以诱导多种细胞和器官产生氧化应激,如斑马鱼肝细胞、人子宫内膜基质细胞以及大口黑鲈幼鱼的肝和脾[35-38]。与以往研究相似,本研究结果显示,随着DEHP暴露水平的增加,ROS和MDA水平显着升高,T-SOD、GSH-PX活性显着降低。此外,暴露于DEHP的HD11细胞中T-AOC水平显着降低。结果提示,DEHP暴露后,HD11细胞内ROS的过量生成和细胞抗氧化能力的降低,导致抗氧化酶系统的破坏,导致细胞发生氧化应激。
DEHP暴露可诱导细胞毒性损伤,这与PTEN/PI3K/AKT信号通路的激活密切相关。例如,研究发现DEHP通过上调PTEN的表达,进而下调AKT的表达,从而抑制人胚胎干细胞增殖,促进细胞周期停滞,并诱导细胞凋亡[39]。DEHP暴露通过抑制PI3K/AKT信号通路,诱导心肌细胞毒性[40]。还有研究发现DEHP可通过激活氧化应激和下调PI3K/AKT信号通路诱导骨骼肌细胞凋亡和程序性坏死[41]。与以往研究相似,本试验结果显示,DEHP暴露后,HD11细胞发生氧化损伤,DEHP处理组PTEN基因的mRNA和蛋白表达相应升高,PI3K和AKT表达降低。值得注意的是,BCL-2和RIPK1是PI3K/AKT信号转导通路的重要下游靶点,通过抑制PI3K/AKT表达,进而使BCL-2低表达和RIPK1高表达来实现凋亡和坏死[42-43]。研究人员发现,用50和500 mg·(kg·d)-1DEHP处理小鼠35 d,会使BCL-2蛋白低表达,使Bax蛋白高表达,进而Bax与BCL-2形成异二聚体从而启动信号通路,导致线粒体损伤,最终诱导小鼠睾丸启动内质网应激诱导生殖细胞凋亡[44]。此外,500 μmol·L-1DEHP可以上调RIPK1、RIPK3和MLKL表达水平,最终导致心肌细胞发生程序性坏死[45]。与以往研究相似,本研究发现,不同浓度DEHP暴露于HD11细胞导致BCL-2的表达水平显着降低,Bax、Caspase-3、Caspase-9表达显着增强,启动了细胞线粒体凋亡途径;同样,RIPK1、RIPK3和MLKL的表达显着升高,说明细胞程序性坏死通路也被激活(图8)。
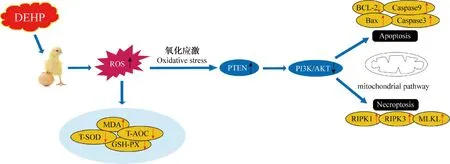
图8 图形摘要Fig.8 Graphical abstract
4 结 论
本研究首次提供了DEHP暴露引起HD11细胞凋亡和程序性坏死证据。发现DEHP可抑制HD11细胞活力,导致氧化应激反应增强,进而激活了PTEN/PI3K/AKT信号通路,促进了HD11细胞凋亡和程序性坏死,并且HD11细胞的损伤程度与DEHP浓度成剂量依赖性。这些发现为阐明DEHP对禽类中毒的分子机制提供了研究基础,为寻找切实有效地治疗DEHP所致的HD11细胞损伤药物提供了思路。本研究对DEHP的毒理学研究、生态环境保护及动物和人类健康具有重要意义。



