张家祺,贾浠宁,周 群,宋 鑫,朱晨曦,李格格,张 斌,2*
(1.西南民族大学畜牧兽医学院,成都 610041;2.青藏高原动物遗传资源保护与利用教育部/四川省重点实验室,成都 610041)
牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)是导致犊牛腹泻的主要病原之一。BVDV不仅能感染牛,也能够感染多种其他动物,包括猪、绵羊、山羊、鹿、牦牛和骆驼[1]。感染BVDV后患畜主要表现为腹泻、发热、咳嗽、生殖功能不全(如不孕、死胎、流产)、免疫抑制、持续感染、黏膜疾病、白细胞减少和出血综合征等[2]。疫苗免疫是预防BVDV的重要措施,目前国内BVDV商品化灭活疫苗已发挥了重要的作用[3-4]。但接种上述疫苗的动物在血清学上无法区分感染与免疫,不利于对养牛业的病毒监测。因此,加快对安全、高效新型基因工程疫苗的研发,对更好的防控BVDV具有重要的意义。
目前,根据国内外研究调查显示BVDV分为三种基因型即BVDV-1、BVDV-2和BVDV-3[5]。BVDV-1进一步分为23个亚型(1a~1w),BVDV-2分为四个亚型(2a~2 d),BVDV-3分为巴西源、泰国源和意大利源[6-7]。近年来,BVDV病原学监测结果表明,BVDV-1已成为我国牛群中的主要流行基因型[6]。目前国内已有针对BVDV-1a毒株来开发的商业灭活苗上市[3],相关新型基因工程疫苗也在陆续研发中,如任杰等[8]利用BVDVE0和E2基因串联表达的重组腺病毒疫苗,Jia等[9]构建了表达BVDV E2蛋白并可口服使用的重组乳酸菌疫苗,同时也有利用杆状病毒构建BVDV-1a、1b的VLPs研究[1,10-12],这些研究为BVDV新型基因工程疫苗的研制提供了参考。
E2蛋白为BVDV的表面囊膜糖蛋白,是决定BVDV抗原性的主要部位,病毒感染后能够诱导机体产生特异性抗E2蛋白的抗体,该抗体具有中和病毒的作用,因此,E2基因在BVDV亚单位疫苗和基因工程疫苗研发中常被作为重要的靶抗原[13-14]。病毒样颗粒(virus-like particles,VLPs)是由一种或多种病毒蛋白构建的非传染性和无病毒基因组的病毒颗粒,VLPs在结构上与真实病毒粒子相似,可诱导有效的体液免疫和细胞免疫应答[15],因缺乏遗传物质而无传染性使其具有良好的生物安全性。昆虫细胞-杆状病毒表达系统已广泛用于VLPs的生产,当前已成为BVDV基因工程疫苗研发的一个重要工具[16-17]。研究表明重组蛋白疫苗需要佐剂来获得强大的免疫反应[18]。因此,佐剂或免疫增强剂是蛋白质疫苗的重要组成部分。MF59是病毒类疫苗的新型商品化佐剂,当其与流感病毒和新冠病毒等联合使用时,可以明显增强抗体滴度,且耐受性良好[19]。CpG序列是一条含有未甲基化的胞嘧啶-鸟嘌呤二核苷酸的微生物单链DNA片段,能够通过Toll样受体的识别刺激先天性免疫反应[20],CpG-ODN是人工合成的CpG序列(synthetic oligodeoxynucleotide containing CpG motifs,简称CpG-ODN)目前,在临床和疫苗应用中作为免疫增强剂[21]。
该研究以本实验室分离毒株BVDV-1 SWU-Z6的E2蛋白作为靶抗原,构建含有E2基因的重组杆状病毒,并用该杆状病毒在SF9细胞中大量制备BVDV-1 E2 VLPs,经过蔗糖密度梯度离心纯化后混合MF59佐剂和CpG-ODN免疫增强剂在BALB/c小鼠体内评估其免疫原性,以及对同源毒株的免疫保护效果。
1 材料与方法
1.1 病毒、细胞及实验动物等
BVDV-1 SWU-Z6毒株[22],由本实验室分离、鉴定并保存;鼠抗BVDV-1 E2蛋白的多克隆血清由本实验室制备、保存;真核表达载体pFast Dual、SF9细胞由本实验室保存;6周龄雌性BALB/c小鼠购自成都达硕实验动物技术有限公司,所有动物试验均遵循四川省实验动物管理委员会《四川省实验动物福利与伦理》指导原则,并经西南民族大学研究伦理委员会批准。
1.2 主要试剂
感受态细胞DH5α、DH10和胎牛血清购自北京全式金生物技术股份有限公司;限制性内切酶EcoRⅠ、HindⅢ、XhoⅠ、NheⅠ、T4连接酶和pMD-19 T购自TaKaRa公司;DNA纯化试剂盒、胶回收试剂盒和去内毒素质粒提取试剂盒购自OMEGA公司;抗生素(卡那霉素、四环霉素、庆大霉素)、X-gal、IPTG购自Biofroxx公司;昆虫细胞培养基购自武汉普诺塞生命科技有限公司;转染试剂Cellfection®Ⅱ Reagent、蛋白Marker购自赛默飞世尔科技有限公司;羊抗鼠IgG抗体(IgG-FITC/HRP)购自北京博奥森生物技术有限公司。CpG-ODN 1826由上海生工生物工程股份有限公司合成,序列如下:5′-TCCATGACGTTCCTGACGTT-3′;MF59佐剂由本实验室制备并保存。
1.3 目的基因的获取
选用BVDV-1 SWU-Z6株(GenBank No.MF693403.1)的E2基因序列为模板,参考文献[10]方法对E2基因进行密码子优化,送上海生工生物工程股份有限公司针对SF9细胞优化并合成E2基因。
1.4 表达E2基因的重组质粒构建与鉴定
真核表达载体pFast Dual的PH启动子采用EcoRⅠ和Hind Ⅲ两个酶切位点,P10启动子采用XhoⅠ和NheⅠ两个酶切位点,分别针对PH启动子和P10启动子设计引物如表1,从优化合成后的质粒中扩增出目的基因片段。将PCR产物进行琼脂糖凝胶电泳鉴定后,用OMEGA PCR产物纯化试剂盒对DNA进行纯化回收。分别将纯化后获得的DNA(PH和P10)连接至pMD-19 T,16 ℃过夜。分别使用EcoR Ⅰ、Hind Ⅲ和XhoⅠ、NheⅠ限制性内切酶对E2-PH质粒和E2-P10质粒从pMD-19 T进行酶切回收。
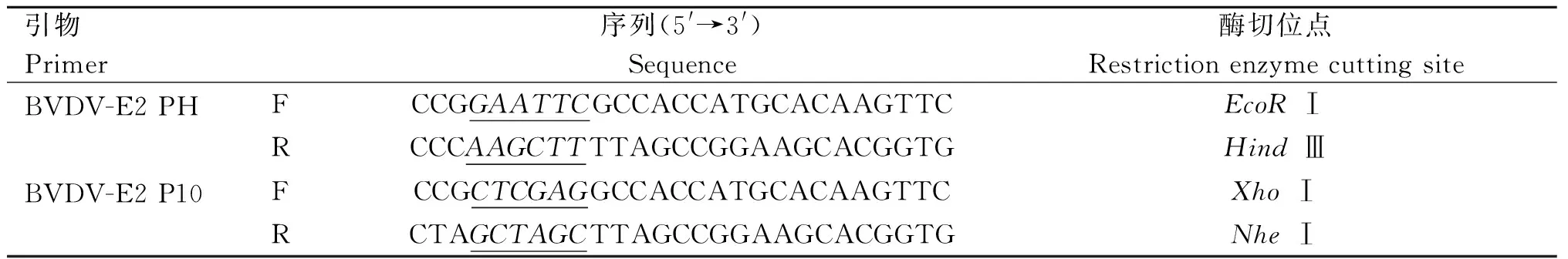
表1 PCR引物Table 1 The primers of PCR
将获得的酶切回收产物利用T4连接酶分别连接至pFast Dual载体的PH和P10启动子中。进行针对pFast Dual载体PH和P10启动子的双酶切鉴定,并对重组质粒中的E2基因进行测序验证,将构建的重组质粒命名为pFast Dual BVDV-1 E2。
1.5 重组杆粒的制备及重组杆状病毒的拯救
按照Bac-to-Bac杆状病毒表达系统手册(Invitrogen公司),将鉴定成功的pFast Dual BVDV-1 E2重组质粒转化至DH10Bac感受态细胞中,在三抗固体培养基(卡那霉素、四环霉素、庆大霉素、X-gal、IPTG)经蓝白斑筛选获得阳性克隆,并进行PCR鉴定。将鉴定正确的重组杆状病毒载体命名为Bacmid-BVDV-1 E2。
提取重组杆状病毒载体Bacmid-BVDV-1 E2,利用Cellfection®Ⅱ Reagent转染试剂转染SF9细胞,27 ℃培养48~72 h,按MOI=3感染SF9细胞,连续培养3代,将每代培养的上清放置-80 ℃保存。提取第三代培养上清的基因组DNA,用BVDV-1E2的全长引物(表1)进行PCR鉴定,鉴定正确的重组杆状病毒命名为Baculo-BVDV-1 E2。
1.6 重组蛋白的表达和鉴定
1.6.1 间接免疫荧光鉴定(IFA) 将长满细胞培养皿的贴壁SF9细胞进行传代,用新鲜的含10%胎牛血清、1%双抗的贴壁SF9细胞培养基调整细胞浓度为4×105cells·mL-1,进行6孔板铺板,每孔2 mL。使细胞分布均匀,放入27 ℃恒温细胞培养箱内,培养24 h。MOI=3感染SF9细胞,以不接种病毒的SF9细胞做阴性对照继续培养48 h。
弃去培养液,用80%丙酮室温固定30 min,PBST清洗3次,加入5%脱脂奶粉溶液2 mL,37 ℃封闭1 h,PBST清洗3次加入鼠抗BVDV-1a E2蛋白血清作为一抗(1∶50),室温孵育1 h,PBST再清洗3次,避光条件下以羊抗鼠IgG抗体(IgG-FITC)作为二抗(1∶3 000)室温作用45 min,PBST清洗3次,然后于荧光显微镜下观察目的蛋白的表达情况。
1.6.2 Western blot鉴定 取Baculo-BVDV-1 E2 P3代,以MOI=3感染SF9细胞,96 h后收集细胞悬液,反复冻融3次后超声裂解,(4 ℃ 5 000 r·min-1离心30 min)去除细胞碎片;利用20%、30%和60%的蔗糖溶液进行梯度离心纯化,获得BVDV-1 E2 VLPs。加入RIPA蛋白裂解液(含1%蛋白酶抑制剂),后进行SDS-PAGE电泳,将蛋白转移至聚偏二氟乙烯(PVDF)膜,5%脱脂乳封闭2 h;用PBST洗膜3次,以鼠抗BVDV-1 E2蛋白作为一抗(1∶1 000),室温孵育2 h,用PBST洗膜3次;以辣根过氧化物酶(horse radish peroxidase,HRP)标记的羊抗鼠IgG作为二抗(1∶5 000),室温孵育2 h,洗膜3次后,在PVDF膜上滴加ECL化学发光液,放入免染成像系统中进行曝光显色。
1.6.3 TEM观察 将“1.6.2”经蔗糖梯度离心纯化获得BVDV-1 E2 VLPs稀释后滴加在铜网上,室温孵育,用滤纸轻轻吸去铜网上多余的液体,晾干后,再滴加1%磷钨酸,室温染色3 min。然后再用滤纸吸去铜网上的液体,室温晾干进行透射电镜观察。
1.7 动物的免疫及攻毒试验
1.7.1 动物免疫 将20只6周龄雌性BALB/c小鼠随机分成4组,每组5只。即A:BVDV-1 E2 VLPs 50 μg、B:BVDV-1 E2 VLPs 25 μg、C:天腹净商品化灭活疫苗(1型 NM01株)和D:空白对照。适应性饲养1周后进行免疫,免疫时A组和B组加入等体积免疫佐剂MF59与CpG-ODN 20 μg,免疫剂量为每只小鼠100 μL,免疫方式为腿部肌肉多点注射,在首次免疫后2周进行加强免疫,空白对照组注射等量PBS。每周固定时间通过眼眶静脉采血分离血清用于测定特异性抗体水平。
1.7.2 特异性抗体检测 利用本实验室建立并优化的间接ELISA方法检测免疫小鼠的特异性抗体水平,其优化后的方法为将抗原BVDV-1 SWU-Z6终浓度调整为0.1×108.11TCID50包被在聚乙烯96孔板中4 ℃放置24 h,使用5% BSA 37 ℃封闭1 h;将被检测的鼠血清按1∶10的梯度稀释在该96孔板中并37 ℃孵育1.5 h;HRP标记的羊抗鼠IgG按1∶5 000稀释并置于37 ℃孵育1.5 h;最佳显色时间为37 ℃ 15 min;被检测血清≥2.1倍空白血清OD450 nm处的吸光值则判定为阳性。
1.7.3 攻毒试验 二免4周后进行攻毒,利用BVDV-1 SWU-Z6毒株,以1×108.11TCID50·只-1的剂量采用灌胃途径对A、B、C、D组小鼠用进行攻毒,攻毒完成后每天观察小鼠的活动状况和精神状态并记录。在攻毒后第5、7和10天收集小鼠粪便样本并称量小鼠体重,所得粪便提取RNA,根据文献[23]合成定量引物,用荧光定量PCR检测病毒拷贝数含量。
1.7.4 数据统计分析 应用软件GraphPad Prism 8.0对免疫组与非免疫组的抗体效价采用one way ANOVA进行统计分析。P<0.05被认为具有统计学意义(*.P<0.05,**.P<0.01,***.P<0.001),P>0.05意味着没有显着差异(n.s)。所有结果均代表至少三次重复试验。误差线表示标准偏差(SD)。
2 结 果
2.1 重组质粒pFast Dual BVDV-1 E2的构建与鉴定
为了构建质粒pFast Dual BVDV-1 E2,以针对SF9细胞优化合成的E2基因序列为模板使用表1引物扩增得到带有不同酶切位点的E2基因,大小为1 174 bp(图 1A)。重组质粒pFast Dual BVDV-1 E2经EcoRⅠ、Hind Ⅲ和XhoⅠ、NheⅠ分别双酶切后,得到的条带大小与插入基因E2的大小相符(图 1B)。通过对重组质粒中的E2基因进行测序,发现与之前测得的序列完全一致,表明重组质粒pFast Dual BVDV-1 E2构建成功。
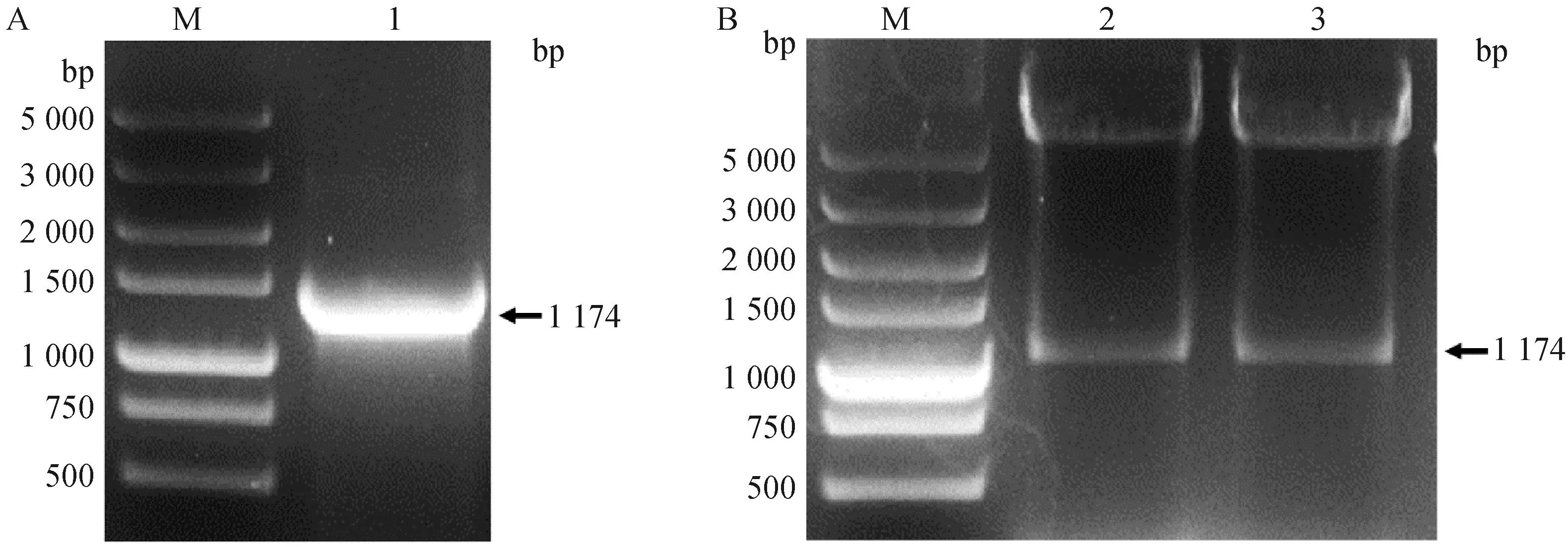
M.Marker DL5000相对分子质量标准;1.BVDV-1 E2基因;2.pFast Dual BVDV-1 E2 EcoR Ⅰ、Hind Ⅲ酶切鉴定;3.pFast Dual BVDV-1 E2 Xho Ⅰ、Nhe Ⅰ酶切鉴定M.Marker DL5000;1.PCR result of BVDV-1 E2 gene;2.pFast Dual BVDV-1 E2 digested by EcoR Ⅰ and Hind Ⅲ; 3.pFast Dual BVDV-1 E2 digested by Xho Ⅰ and Nhe Ⅰ图1 BVDV-1 E2基因PCR扩增(A)及pFast Dual BVDV-1 E2重组质粒酶切鉴定(B)Fig.1 Amplification of BVDV-1 E2 gene of SWU-Z6 by PCR (A) and restriction endonuclease analysis of recombinant plasmids pFast Dual BVDV-1 E2 (B)
2.2 重组杆状病毒的拯救
重组杆状病毒Baculo-BVDV-1 E2以MOI=3感染SF9细胞,27 ℃培养72 h,SF9细胞出现肿胀、变大和变圆的现象。

图2 Baculo-BVDV-1 E2第三代导致SF9细胞病变Fig.2 CPE in SF9 by the third generation of Baculo-BVDV-1 E2
2.3 BVDV-1 E2 VLPs的表达与鉴定
为了验证该杆状病毒是否能正确表达E2蛋白,利用IFA、TEM和Western blot技术进行检测及观察。
IFA检测结果表明,Baculo-BVDV-1 E2感染的SF9细胞可观察到明显的绿色荧光(图 3A1),对照组细胞未观察到荧光(图 3B1)。

A. Baculo-BVDV 1 E2感染SF9细胞;B. 正常SF9细胞A. Sf9 cells infected with Baculo-BVDV 1a E2; B. Normal SF9 cells图3 Baculo-BVDV-1 E2蛋白表达的间接免疫荧光鉴定Fig.3 Identification of the protein expression of the Baculo-BVDV 1a E2 by immunofluorescence assay
TEM电镜结果显示,BVDV-1 E2蛋白可自我组装成圆形、椭圆形或不规则的VLPs,粒子直径在80~100 nm之间(图4A)。
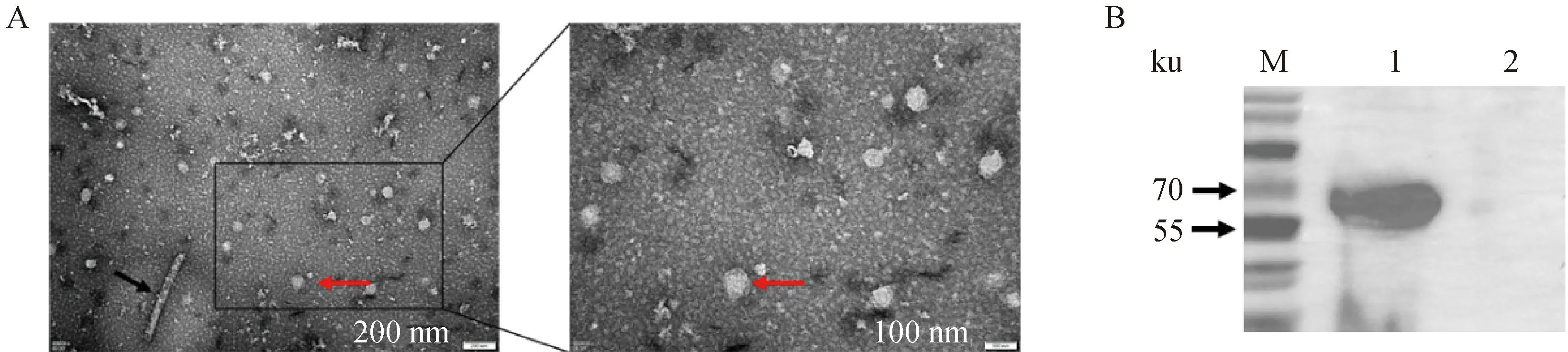
A图中:红色箭头指向BVDV-1 E2 VLPs,黑色箭头指向杆状病毒;B图中:1. BVDV-1 E2 VLPs;2. SF9 空白细胞In Fig. A: Red arrows point to BVDV-1 E2 VLPs;black arrows point to baculovirus; In Fig. B: 1. BVDV-1 E2 VLPs;2. Normal SF9 cells图4 BVDV-1 E2 VLPs的TEM观察(A)及Baculo-BVDV-1 E2感染SF9细胞表达蛋白的免疫印迹分析鉴定(B)Fig.4 The TEM image of BVDV-1 E2 VLPs(A)and western blotting analysis of protein expression of cells infected Baculo-BVDV-1 E2(B)
Western blot结果显示,经过蔗糖梯度离心纯化获得的BVDV-1 E2 VLPs在约60 ku处有目的条带(图4B),表明E2蛋白在真核细胞中能正确表达,并具有良好的生物学活性。
2.4 ELISA检测特异性抗体水平
为了检测免疫后小鼠是否产生针对BVDV的特异性IgG抗体,如图5A所示,在免疫后每周采血分离血清,并通过间接ELISA检测免疫小鼠的特异性IgG抗体水平。结果如图5B、C所示,BVDV-1 E2 VLPs在第一剂免疫接种后BVDV特异性IgG抗体水平逐渐升高,在二免后一周血清中特异性IgG抗体滴度达到峰值;其中BVDV-1 E2 VLPs 50 μg组抗体滴度最高为1∶100 000,抗体滴度明显高于对照组(P<0.001),BVDV-1 E2 VLPs 25 μg组抗体滴度最高为1∶10 000。相较于BVDV商业灭活苗组,该VLPs能刺激机体产生较高水平的BVDV血清抗体。

A. 小鼠的免疫和攻毒流程图;B. 小鼠特异性抗体水平变化;C. 小鼠特异性抗体效价变化A. Schematic diagram of immunization and challenge in mice; B. Antibody level changes of mice; C. Changes in mice antibody titers图5 小鼠免疫及攻毒试验流程图(A)及特异性抗体变化(B、C)Fig.5 Schematic diagram of immunization and challenge in mice(A)and antibody titers changes of mice(B,C)
2.5 攻毒保护的效果评价
为了评价该VLPs的攻毒保护效果,利用BVDV-1 SWU-Z6毒株,以1×108.11TCID50·只-1的剂量采用灌胃途径感染小鼠。
空白攻毒组小鼠感染后体重总体呈现下降趋势,平均下降百分比为16.324%;免疫BVDV-1 E2 VLPs 50 μg组小鼠与空白攻毒组比较,感染后第7天体重虽有一定程度的下降但总体呈上升趋势,平均升高百分比为1.515%,体重显着高于空白攻毒组;免疫BVDV-1 E2 VLPs 25 μg小鼠和免疫BVDV商业灭活苗小鼠体重总体呈下降趋势,平均下降百分比分别为3.435%和2.539%(图6)。
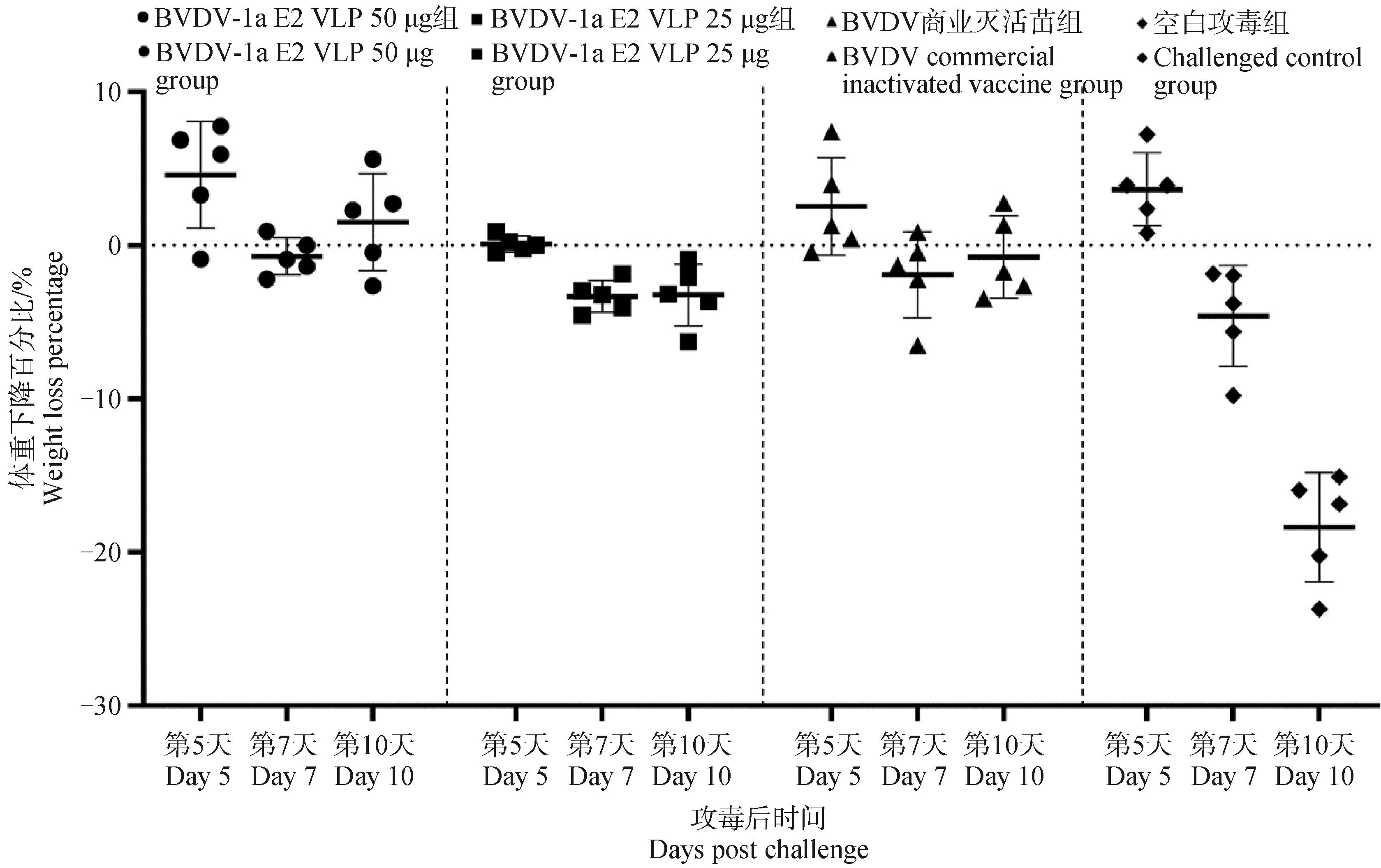
图6 攻毒后小鼠体重变化情况Fig.6 Weight change of mice after challenge
荧光定量PCR检测病毒拷贝数含量的结果表明,免疫BVDV-1 E2 VLPs 50 μg小鼠和免疫BVDV商业灭活苗小鼠在第10天检测不到BVDV,免疫BVDV-1 E2 VLPs 25 μg小鼠在攻毒后第10天只有一只小鼠BVDV病毒拷贝数为4.74 copies·mg-1,而空白攻毒组小鼠在感染后一直能检测到BVDV。
体重和病毒载量结果说明,小鼠肌肉注射免疫BVDV-1 E2 VLPs 50 μg后,可以对BVDV-1 SWU-Z6毒株感染呈现明显的保护效果(图6和表2)。
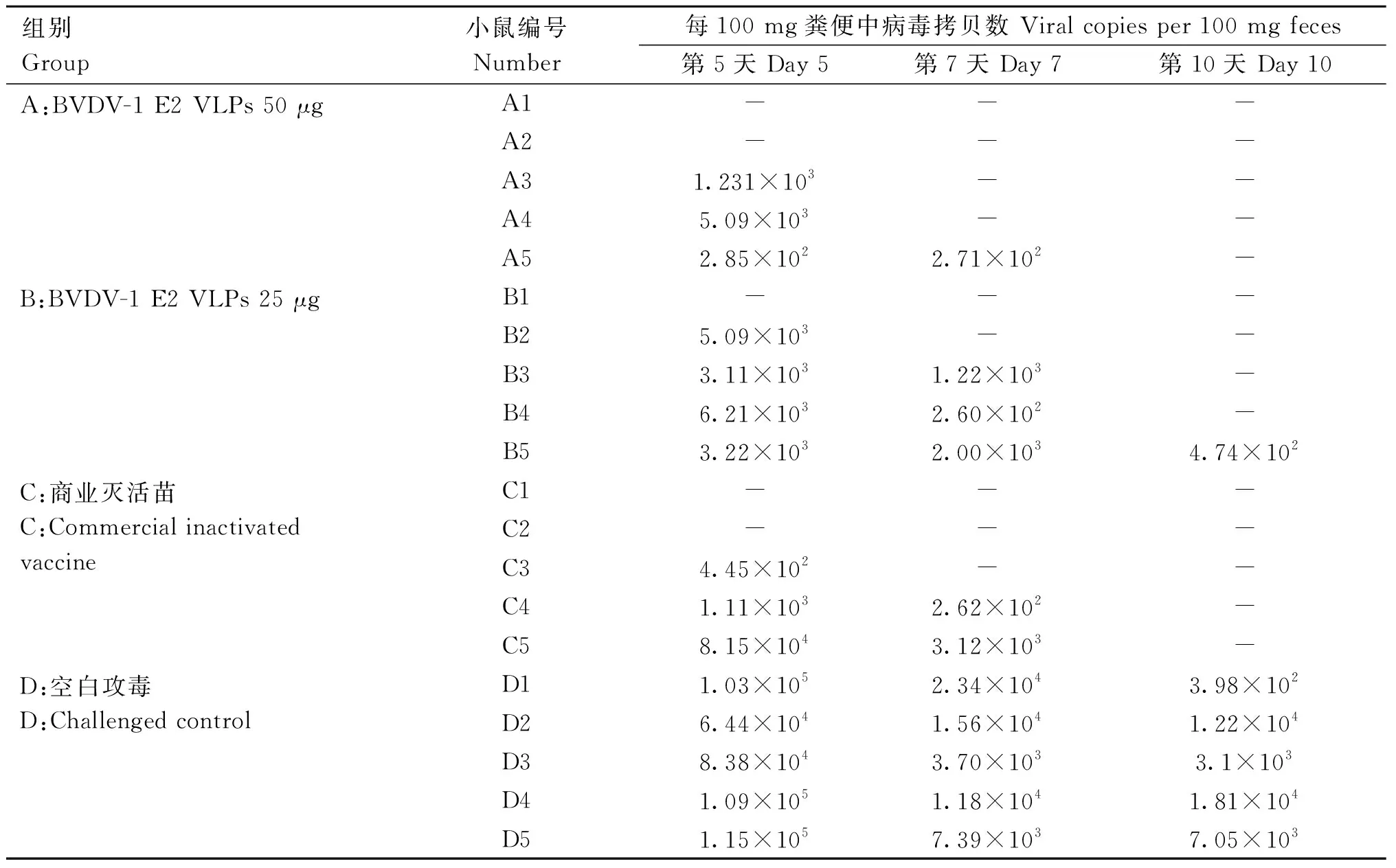
表2 实时荧光定量RT-PCR检测攻毒后小鼠粪便中BVDV病毒载量Table 2 The BVDV virus load in mouse feces after challenge was detected by using real-time fluorescent quantitative
3 讨 论
牛病毒性腹泻病毒(BVDV)是牛的重要病原体之一,给全球养牛业造成了重大损失。流行病学表明,BVDV-1型已成为国内牛群中的主要流行基因型[6],其中BVDV-la基因亚型是我国牛群中流行的主导亚型之一[24]。一般而言,为了有效控制传染病,基本原则应包括消除病原体宿主,预防或减少感染个体向易感动物的传播[4]。然而,由于在全球范围内BVDV的根除仍处于起步阶段,因此疫苗免疫成为BVDV防控的一个重要手段,加快对安全、高效新型基因工程疫苗的研发,为更好地防控BVDV具有重要的意义。
VLPs由病毒结构蛋白组装而成,与疫苗佐剂混合能够诱导强烈的体液免疫和细胞免疫应答,具备产生长期免疫应答的能力,其缺乏病毒遗传物质具有良好的生物安全性,近年来已成为疫苗研究领域的热点[1]。VLPs疫苗的一系列优势,奠定了其在新型疫苗的研制方面具有巨大潜力和良好前景。昆虫细胞-杆状病毒表达系统作为一种VLPs的生产平台,已广泛用于VLPs的生产,并已开发数种许可疫苗,例如人乳头瘤病毒疫苗、流感病毒疫苗和乙型肝炎病毒疫苗等[25]。E2蛋白是BVDV的主要保护性抗原,能诱导机体产生高滴度的中和抗体,已成为疫苗开发的重要抗原蛋白[12,14,26]。BVDV进入宿主细胞由E2介导并结合细胞表面受体CD46,由于E2蛋白存在多个糖基化位点,其分子质量大小同样存在一定差异[27]。有报道表明,蛋白糖基化在维持BVDV抗原蛋白免疫原性中具有重要作用,而昆虫细胞-杆状病毒表达系统具有完整的翻译后修饰功能,使E2蛋白糖基化并正确折叠成更接近真实病毒的VLPs[28]。
本研究选取BVDV-1a亚型流行株SWU-Z6抗原编码基因E2,以期能够较好地与田间流行病毒亚型匹配,构建含有E2基因的重组杆状病毒,并使用昆虫细胞-杆状病毒表达系统成功构建了由E2蛋白自动组装成的BVDV-1 E2 VLPs,经IFA、Western blot验证和电镜观察证实E2蛋白得到正确表达并成功组装VLPs。ELISA结果显示在二免2周后,免疫BVDV-1 E2 VLPs 50 μg组小鼠针对BVDV-1 SWU-Z6的IgG抗体滴度达到1∶100 000,不同免疫剂量产生的抗体滴度虽存在差异,但明显高于商业灭活疫苗对照组。攻毒保护试验中结果显示,BVDV-1 E2 VLPs 50 μg剂量两次免疫后,免疫组小鼠在攻毒后7 d表现出体重下降,而后开始回升;在攻毒后第10天采集粪便没有检测到病毒。这些结果表明该VLPs的免疫能够有效诱导机体产生中和病毒的特异性抗体,能有效阻止因病毒攻击造成的小鼠体重下降以及病毒在小鼠体内的复制,对BVDV-1 SWU-Z6毒株的感染产生良好的免疫保护能力。这一结果与BVDV干酪乳杆菌口服疫苗效果基本一致[29]。并且进一步验证了通过灌胃途径建立的小鼠感染模型,为BVDV疫苗效果评价提供参考依据。本研究所获得的BVDV-1 E2 VLPs在攻毒保护效力上与商业灭活苗相比没有明显的差异,且不表达BVDV非结构蛋白,与现有NS3蛋白抗体检测试剂盒兼容,在区分病毒的感染与免疫方面存在优势[30]。但利用昆虫细胞-杆状病毒表达系统生产VLPs疫苗的成本较高,在后续研究中,为适应BVDV VLPs疫苗的工艺化生产,应该对重组蛋白表达条件进行优化。
本研究中VLPs诱导的抗体效价优于本实验室之前构建的亚单位疫苗[31],有研究表明单独的抗原蛋白通常不能诱导最佳的免疫反应,需要用合适的佐剂或佐剂组合来配制使用。MF59是一种由角鲨烯、聚山梨酸酯80、山梨醇三油酸酯和柠檬酸三钠组成的水包油佐剂,已被证明能显着促进针对配伍抗原的抗体产生以及Th2和Th1免疫反应的增强[32]。此外,它还可以增强注射部位的抗原摄取,主要靶细胞类型可以是单核细胞、巨噬细胞和树突状细胞[18]。CpG-ODN是一种有效的免疫增强剂,可以诱导Th1反应,诱导细胞毒性T淋巴细胞的产生和干扰素的分泌,并通过激活TLR9上调抗原提呈细胞的功能,增强对抗原的特异性体液和细胞免疫应答[32]。最初将MF59与CpG联合使用是在流感领域,其诱导了高于单独佐剂的抗体滴度和Th1应答[33],Singh等[34]的一项研究中,MF59佐剂配伍CpG与重组脑膜炎球菌抗原免疫小鼠能明显增强其抗体滴度。有研究表明将使用大肠杆菌表达系统制备的Erns和E2蛋白配伍MF59佐剂和CpG-ODN免疫增强剂能有效地提高小鼠对BVDV的体液和细胞免疫应答[35]。本研究中低剂量的E2蛋白就能诱导机体产生高滴度的IgG抗体可能与该蛋白配伍的MF59+CpG-ODN佐剂组合有关,但该VLPs配伍MF59+CpG-ODN佐剂组合是否能提高机体的体液和细胞免疫应答还需进一步试验来论证。
该研究初步以BALB/c小鼠为模型,评价了BVDV-1 E2 VLPs与MF59+CpG-ODN佐剂组合有良好的免疫效果,其较低的蛋白含量就能诱导高水平抗体并能够保护小鼠抵御同源病毒的攻击,认为该VLPs良好的体液免疫应答可能与MF59+CpG-ODN佐剂组合有关,同时细胞免疫应答也至关重要。因此,在后续研究中会对该疫苗诱导的细胞免疫应答水平开展系统的检测,有关该VLPs是否能保护小鼠免受异源病毒的攻击以及在牛体内的免疫效力如何,还将有待进一步的试验。
4 结 论
本研究以国内近年来流行毒株BVDV-1 SWU-Z6为研究对象,成功制备了BVDV-1 E2 VLPs。将VLPs混合MF59佐剂与CpG-ODN免疫增强剂免疫小鼠,两次免疫后诱导产生较强的体液免疫反应,能够有效诱导机体产生针对BVDV-1 SWU-Z6毒株的高水平抗体,可有效抵抗BVDV同源毒株的攻击。本研究为BVDV商品化基因工程疫苗提供了新的开发思路。



