孟令宅,陈春丽,于蒙蒙,王占新,王素艳,刘 鹏,何塔娜,郭 茹,陈运通,刘长军,祁小乐,吴志强,高玉龙*
(1.中国农业科学院哈尔滨兽医研究所 动物疫病防控全国重点实验室 禽免疫抑制病创新团队,哈尔滨 150069;2.温氏食品集团股份有限公司养禽事业部生产管理室,广东省畜禽健康养殖与环境控制企业重点实验室,新兴 527439)
禽偏肺病毒(avian metapneumovirus, aMPV)属于副黏病毒科肺病毒亚科偏肺病毒属家族的成员,其为有囊膜的不分节段单股负链RNA病毒[1-3]。该病毒之前被称为禽肺病毒,是火鸡鼻气管炎的病原体。aMPV感染鸡后,会导致鸡肿头综合征(swollen head syndrome, SHS)及产蛋量的急剧下降,因其具有传播性强、亚型种类多、感染宿主多样性等特点,对我国养禽业发展及公共卫生安全产生了严重的影响[4-5]。
aMPV于1978年在南非首次被分离报道,随后在全世界范围内广泛流行,目前,除大洋洲以外的所有家禽饲养区均有分布[6]。aMPV的基因组全长约13.3 kb,包含8个基因,顺序为3′-N-P-M-F-M2-SH-G-L-5′[7]。基于G基因的抗原性差异,aMPV可分为A、B、C和D四种亚型[8]。1998年,沈瑞忠等[9]在国内某肉鸡场中首次分离鉴定到一株aMPV;2009年,郭龙宗和曲立新[10]对胶东地区的多个种鸡场进行了血清学检测,结果表明aMPV感染普遍存在,多个鸡场血清阳性率可达100%;近年来,该病流行态势进一步增大,且本地鸡中感染占比越来越高[11-12]。2012年,中国东南部的某黄羽肉鸡场的鸡出现了严重的呼吸道症状,临床症状包括眼眶肿胀,面部充血、鼻和眼部出现分泌物,经病毒分离鉴定为C亚型aMPV感染[13];此外,肖志宇等[14]对我国四川、福建、江苏、广东等多个省份的不同品种鸡群进行了调查,结果显示,目前我国本地鸡中的黄羽肉鸡、清远麻鸡中aMPV感染率相对较高,且主要流行毒株为B亚型。黄羽肉鸡是我国肉鸡养殖中的特色品种,在我国肉鸡养殖产业中占有重要地位,年出栏量超过了40亿羽,曾占到肉鸡总出栏量的50%左右,已成为我国居民肉类食品的主要来源之一。然而,由于我国禽病种类繁多,尤其像禽偏肺病毒病等新发疫病,缺乏有效的防控技术手段,导致家禽生产性能下降、死淘率增加。因此,必须加强相应的防控技术研究。本实验室在2016年从某肉种鸡场中首次分离到一株B亚型aMPV LN16株[15],致病性结果显示该毒株对SPF鸡、商品蛋鸡、商品肉鸡均具有明显的致病性,然而,目前尚无B亚型aMPV对黄羽肉鸡致病性的评价以及现有疫苗对黄羽肉鸡保护效果评价的报道。
当前疫苗免疫是预防该病的重要措施[16]。欧洲一些国家主要通过灭活疫苗和弱毒疫苗来预防A亚型和B亚型aMPV的感染[17];美国也已研制出针对C亚型aMPV的弱毒疫苗MN/turkey/1-a/97-P63株[18];本实验室早期研制出针对B亚型禽偏肺病毒病的灭活疫苗,其对SPF鸡、商品蛋鸡及商品肉鸡均能提供良好的免疫保护效果[19]。目前,我国黄羽肉鸡品种繁多,发病情况复杂,也有疑似aMPV引起的肿头和流鼻涕的临床症状。因此,本研究评价了B亚型aMPV对黄羽肉鸡的致病性及灭活疫苗对黄羽肉鸡的免疫保护效果,为国内黄羽肉鸡B亚型禽偏肺病毒病的防控提供一定的技术支持及理论指导。
1 材料与方法
1.1 细胞、病毒毒株及实验动物
Vero细胞及B亚型禽偏肺病毒灭活疫苗(LN16-I株)均由本实验室保存[20];B亚型禽偏肺病毒强毒LN16株(aMPV/B LN16)由本实验室分离、鉴定并保存;黄羽肉鸡(品种为三黄鸡,包括公鸡与母鸡)购自温氏食品集团股份有限公司江苏分公司。
1.2 主要试剂
TRIzol、反转录试剂BioRT Master HiSensi cDNA First-Strand Synthesis Kit、Premix Ex TaqTMMix均购自大连宝生物科技股份有限公司;禽偏肺病毒ELISA抗体检测试剂盒购自美国IDEXX公司(货号99-44300)。
1.3 试验设计
将26只21日龄黄羽肉鸡随机分为2组:免疫组和对照组各13只(aMPV抗体检测为阴性),其中,免疫组通过胸肌接种0.5 mL灭活疫苗,对照组注射等量的无菌PBS。初次免疫3周后,加强免疫一次,采集初次免疫后1~6周内免疫组与对照组全部鸡只的非抗凝血,分离血清。加强免疫3周后,采取滴鼻方式,使用强毒株aMPV/B LN16进行攻毒试验,攻毒剂量为5 000 TCID50·只-1。观察并记录攻毒后1~7 d内各组的临床症状,每日观察两次。攻毒后9 d,随机选择每组3只鸡进行剖杀,采集并固定鼻甲及气管等组织,进行病理观察。
1.4 ELISA抗体水平检测
将采集的免疫组与对照组(每组13只)鸡的非抗凝血置于37 ℃温箱1 h后,再置于4 ℃冰箱存放1 h,使血清充分析出。将分离的血清进行500倍稀释后,按照ELISA检测试剂盒说明书测定ELISA抗体效价。
1.5 中和抗体效价的测定
将Vero细胞提前1 d铺于96孔板。将分离的免疫组与对照组鸡的血清(每组13只)置于56 ℃水浴锅中30 min灭活补体,使用0.22 μm滤器将血清过滤后进行连续2倍梯度稀释,将稀释不同倍数的血清与aMPV/B LN16(2 000 TCID50·mL-1)等体积混合后,置于37 ℃培养箱中孵育1 h,期间上下颠倒混匀一次。取100 μL孵育后的混合液接种于长满的Vero细胞96孔板中,每个样品6个重复,每日观察细胞状态,7 d后统计各孔的病变情况,按照Reed-Muench方法计算中和抗体效价(效价>4 log2为阳性)。
1.6 排毒检测
采集免疫组与对照组鸡(每组13只)攻毒后1~7 d内的腭裂拭子,将腭裂拭子溶于800 μL PBS 离心管中,涡旋震荡25 s后,取200 μL病毒悬液提取病毒基因组RNA,参考BioRT Master HiSensi cDNA First-Strand Synthesis Kit说明书将RNA样品进行反转录,按照本实验室建立的RT-qPCR检测方法[19],检测各组的排毒情况,引物序列见表1。

表1 aMPV/B荧光定量PCR检测引物Table 1 The detection primers of aMPV/B RT-qPCR
1.7 组织病理学观察
采集攻毒后第9天免疫组与对照组(每组3只)鸡的鼻甲骨及气管等组织,固定于10%的福尔马林溶液后进行常规处理,石蜡包埋切片。使用苏木素和伊红进行染色后于光学显微镜下观察病理组织学变化,记录各组的损伤情况。
2 结 果
2.1 ELISA抗体效价检测
采集初次免疫后1~6周内免疫组与对照组(每组13只)鸡的血清,测定血清中的ELISA抗体效价,结果显示,初次免疫后第2周抗体开始转阳,第2周与第3周时ELISA平均抗体滴度分别为5.5×103及 3.2×104,抗体阳性率均为100%。加强免疫后,第2周与第3周时ELISA平均抗体滴度分别为4.1×104及4.2×104(图1),均显着高于初次免疫3周内的ELISA抗体滴度,空白组ELISA抗体始终为阴性。以上结果表明灭活疫苗免疫后,可以诱导黄羽肉鸡产生高水平aMPV特异性抗体。
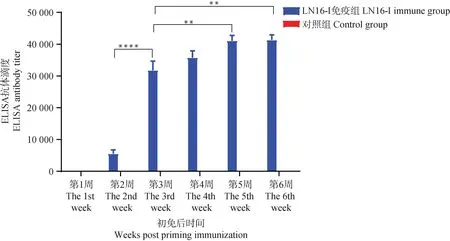
使用双向方差分析确定统计学意义,****. P<0.000 1;**.P<0.01Two-way ANOVA was used to determine the statistical significance,****. P<0.000 1;**. P<0.01图1 免疫后血清中ELISA抗体水平Fig.1 Serum antibody levels after immunization
2.2 中和抗体效价检测
采集初次免疫后1~6周内免疫组与对照组(每组13只)鸡的血清,测定血清中和抗体效价,结果显示,初次免疫后第2周,中和抗体开始转阳;第2、3周时平均中和抗体效价分别为3.38 log2和4.86 log2,阳性率分别为40%和100%;加强免疫后的第1、2、3周时平均中和抗体效价分别为5.58 log2、6.69 log2和7.42 log2(表2),均显着高于初次免疫3周内的中和抗体滴度,阳性率均为100%。以上结果表明灭活疫苗免疫后,可以诱导黄羽肉鸡产生高水平的中和抗体。
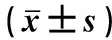
表2 免疫后血清中和抗体水平Table 2 Serum neutralizing antibody levels of after
2.3 临床症状观察
攻毒后观察1~7 d内的临床症状,每日上午下午各观察一次,结果显示,B亚型aMPV强毒株LN16攻击后,未免疫黄羽肉鸡第3天开始出现流混浊或黏稠样鼻涕(图2)、甩头等临床症状,一直持续到第7天,发病率为85%(11/13);灭活疫苗免疫组黄羽肉鸡均未出现临床症状,发病率为0%。上述结果表明,B亚型aMPV强毒株LN16对黄羽肉鸡有明显的致病性,而灭活疫苗能够有效预防B亚型aMPV强毒株攻击所引起的临床症状。
A.攻毒对照组;B.免疫组A. The challenge control group; B. The vaccinated group 图2 攻毒后临床症状观察结果Fig.2 The results of clinical symptoms after challenge
2.4 排毒检测
攻毒后1~7 d,采集免疫组与对照组(每组13只)鸡的腭裂拭子,采用RT-qPCR的方法检测腭裂拭子中的病毒拷贝数。结果显示,B亚型aMPV强毒株LN16攻击后,未免疫黄羽肉鸡在第3 天达到排毒高峰,排毒量为4.9×106copies·mL-1;第7天排毒量降至最低,排毒量为 2.1×103copies·mL-1。免疫组黄羽肉鸡出现轻微排毒,在第3天高峰期时排毒量为2.8×104copies·mL-1,与未免疫组相比下降了约99.43%(图3)。这些结果表明B亚型aMPV强毒株LN16感染可引起黄羽肉鸡高水平的排毒,而灭活疫苗可显着降低病毒在呼吸道中的复制。
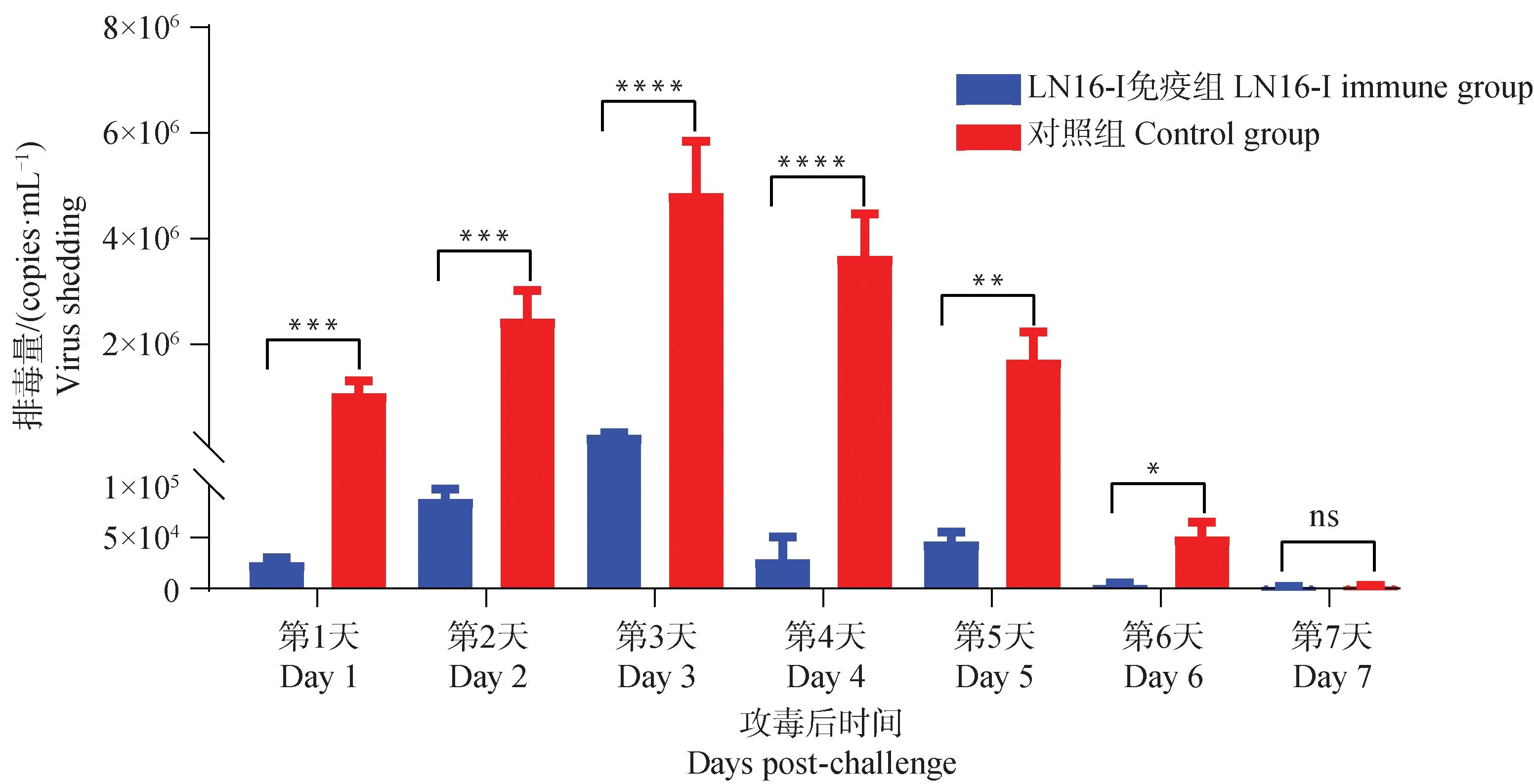
使用双向方差分析确定统计学意义,****. P<0.000 1;***.P<0.001;**. P<0.01;*. P<0.05; ns. P>0.05Two-way ANOVA was used to determine the statistical significance,****. P<0.000 1;***. P<0.001;**. P<0.01;*. P<0.05; ns. P>0.05图3 攻毒后排毒情况Fig.3 The virus shedding after challenge
2.5 病理组织学检测
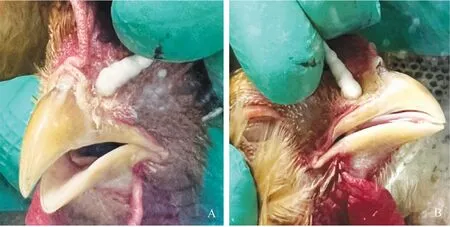
攻毒后第9天,每组随机取3只鸡进行剖杀,将鼻甲、气管固定、染色后进行病理组织学观察,结果显示,B亚型aMPV强毒株LN16攻击后,未免疫黄羽肉鸡鼻甲黏膜下层可见多发性炎性细胞浸润,上皮细胞可见多量变性坏死,气管黏膜固有层可见多量炎性细胞浸润,灭活疫苗免疫黄羽肉鸡均未出现明显病理损伤(图4)。以上结果表明B亚型aMPV强毒株LN16对黄羽肉鸡具有明显的致病性,可引起鼻甲和气管出现明显的病理损伤,而灭活疫苗可有效预防强毒株攻击后对机体造成的病理损伤。
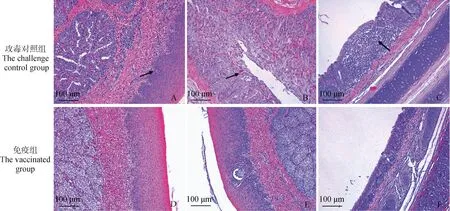
A和D. 鼻甲黏膜下层;B和E. 鼻甲黏液腺上皮;C和F. 气管黏膜固有层A and D. Submucosa of turbinate; B and E. Mucinous glandular epithelium of turbinate; C and F. Lamina propria of tracheal mucosa图4 攻毒后黄羽肉鸡不同器官的病理组织学变化Fig.4 Histopathological changes of different organs in yellow feather broilers after virus challenge
3 讨 论
aMPV感染不仅可以引起严重的呼吸道症状,而且极易与其它病原体发生混合感染,造成感染的禽类症状加重及生产性能下降[16-17]。根据流行病学调查结果显示,目前国内规模化养禽场中aMPV感染阳性率很高,且近年来本地鸡感染占比越来越高[21]。然而,关于aMPV对本地鸡的致病性及疫苗对本地鸡的免疫保护效果等方面的研究相对较少。
本研究以黄羽肉鸡为研究对象,首次证明了B亚型aMPV对黄羽肉鸡具有明显的致病性,感染鸡可出现流鼻涕、鼻痂等临床症状,发病率为85%。病理组织观察结果显示,B亚型aMPV感染可引起黄羽肉鸡鼻甲骨黏膜层和气管固有层的炎性细胞浸润,大量上皮细胞坏死。本实验室前期数据表明,B亚型aMPV可感染SPF鸡、商品蛋鸡及商品肉鸡,排毒最高的器官组织为鼻甲骨,排毒高峰期在感染后的第2~3天,排毒峰值分别为1.2×105及3.2×105copies·mL-1[22-24]。在本研究中,未免疫组黄羽肉鸡在感染后1~7 d出现排毒,在第3天时达到峰值,为4.9×106copies·mL-1。以上数据说明,B亚型aMPV不仅对SPF鸡、商品蛋鸡及商品肉鸡具有致病性,对黄羽肉鸡也具有很强的致病性。此外,根据本研究中的排毒检测结果,在黄羽肉鸡群发病早期采样,更容易分离到该病毒。
研制安全有效的疫苗可以大大降低该病引起的经济损失。为满足临床实际生产需求,本研究又进一步系统评估了B亚型禽偏肺病毒灭活疫苗(LN16-I株)对黄羽肉鸡的免疫保护效果。本实验室前期数据表明,该灭活疫苗可以诱导SPF鸡、商品蛋鸡及商品肉鸡产生强烈的体液免疫应答,加强免疫后3周,诱导机体产生的ELISA平均抗体效价分别为7.9×104、7.3×104、3.7×104,中和抗体平均效价分别为7.21 log2、7.6 log2、6.5 log2[19-20,25]。本研究中灭活疫苗加强免疫3周后,黄羽肉鸡的ELISA抗体平均效价可达4.2×104,中和抗体平均效价可达7.42 log2。这表明灭活疫苗免疫后同样可以诱导黄羽肉鸡产生较强的体液免疫反应。研究表明,高水平的aMPV特异性抗体可以有效抑制病毒在呼吸道的复制,从而减缓临床病程[26-27]。此外,中和抗体的水平是评价疫苗免疫效力的关键指标,中和抗体可以通过阻断病毒囊膜与宿主细胞受体的相互作用或抑制病毒基因组的释放来保护宿主细胞免受病原体的侵害[28],因此本研究中高水平的aMPV特异性抗体和中和抗体可能在预防疾病和病毒清除方面发挥主要作用。
预防发病和减少排毒是评价疫苗免疫效力的关键指标[29]。本研究中,攻毒对照组黄羽肉鸡在攻毒后的1~7 d内出现了严重的临床症状和排毒现象,灭活疫苗免疫组未出现临床症状,高峰期排毒量相比攻毒对照组也降低了约99.43%,表明该灭活疫苗不仅可以预防强毒株引起的呼吸道症状,还可以显着降低强毒株攻击后的排毒水平,有利于控制aMPV在我国鸡群中的流行。此外,未免疫组的黄羽肉鸡鼻甲及气管组织在强毒株攻击后出现了大量的炎性细胞浸润及上皮细胞的坏死,而免疫组的鸡均未出现明显病理损伤,这表明,该灭活疫苗能够保护呼吸道黏膜的完整性,尽管免疫鸡呼吸道中可以检测到部分aMPV,但其低水平的复制不能对机体造成明显损伤。
4 结 论
本研究首次证明B亚型禽偏肺病毒对黄羽肉鸡具有明显的致病性,B亚型禽偏肺病毒灭活疫苗(LN16-I株)免疫后可为黄羽肉鸡提供良好的免疫保护,为控制国内aMPV在黄羽肉鸡群中的流行提供了一定的理论支持与技术指导。



