钟乐苗,刘秉珲,吴春琳,吴异健,3*
(1.福建省农林大学动物科学学院,福州 350002;2.福建农业职业技术学院,福州 350119;3.福建省兽医中药与动物保健重点实验室,福州 350002)
鸡毒支原体(Mycoplasmagallisepticum,MG))是一种禽类病原体,可引起鸡的慢性呼吸道疾病,被世界动物卫生组织(WOAH)列为最具致病性的禽类支原体之一[1]。鸡群平均感染率高达80%,给家禽业造成巨大的经济损失,其影响在较长时期内仍将是一个巨大的挑战[2]。MG与宿主细胞的初始黏附是感染和发病机制中的关键步骤,细胞黏附是一个多步骤进展[3]。GapA 和 CrmA时MG成功定植呼吸道黏膜过程中是必不可少的细胞黏附蛋白[4]。细胞黏附辅助蛋白MgC2功能上参与黏附过程;PvpA是高频变异蛋白,在免疫逃避的发病机制中发挥重要作用[5-6]。细胞黏附蛋白和细胞黏附辅助蛋白是鸡毒支原体感染的毒力因子,针对这些蛋白的预防策略可能是鸡毒支原体感染的重要预防措施。
目前对禽支原体病的防控主要集中在检测方法和疫苗研究[7]。在“限抗”之前广泛使用的抗生素有四环素类、大环内酯类(泰乐菌素和替米考星)、氟喹诺酮类(恩诺沙星和二氟沙星)和截短侧耳素(泰妙菌素)[8-9]。抗生素的广泛使用导致耐药细菌的增加和传播,阻碍了治疗和控制工作。免疫信息学工具应用可能是预防和控制鸡群间鸡毒支原体感染的有力保障[10]。目前F 株、ts-11 株、6/85 株和减毒活疫苗被广泛使用,但减毒活疫苗仍有一定毒力,对鸡群还有一定程度的致病性,此外,MG培养困难导致菌苗昂贵并且需要重复剂量[11-12]。因此,以低成本开发高效疫苗非常重要。免疫信息学的最新进展使我们能够利用可用数据来预测抗原蛋白中最有效的表位区域,这进一步有利于基于表位的疫苗开发。由高度免疫原性的B和T细胞表位组成的表位疫苗在刺激体液和细胞免疫反应方面具有很高的潜力[13]。此外,基于表位的疫苗还具有成本效益、安全性和基于选择的免疫力[14]。
因此,本研究通过免疫信息学工具预测四种(GapA 、CrmA、MgC2、PvpA)鸡毒支原体抗原蛋白的MHC-Ⅰ 和 MHC-Ⅱ 结合 T 细胞特异性表位和 B 细胞表位。在大肠杆菌系统中表达多表位融合基因,将具有免疫活性的融合蛋白用弗式佐剂/黏膜佐剂乳化开发为多表位疫苗。免疫SPF雏鸡,收集免疫前和免疫后不同时间点的鸡血清,以评估免疫保护效果。本研究设计的多表位疫苗可以为MG潜在疫苗的研制提供技术和数据支撑。
1 材料与方法
1.1 菌种、质粒和血清样本
SPF鸡胚购自济南斯帕法斯家禽有限公司,SPF雏鸡由实验室自行孵化饲养。MG-HY株(TOC-ID5为10-4.5·0.2 mL-1),由本实验室分离鉴定保存[15]。MG免疫鸡阳性血清、MG鸡阴性血清由实验室制备。原核表达质粒pET-32a(+)由本实验室保存;大肠杆菌(E.coli) BL21 (DE3)感受态细胞均为北京全式金生物技术股份有限公司。
1.2 主要试剂
ProteinIso®Ni-NTA Resin、TMB ELISA用底物、山羊抗鸡IgG-HRP和T4 DNA连接酶均购自全式金(北京)公司;质粒中提试剂盒为 Omega公司产品;蛋白Marker购自Thermo公司;限制性内切酶BamH I、HindⅢ购自宝生物(大连)公司;IPTG、Amp和咪唑均购自北京索莱宝公司;SDS-PAGE Gel Kit购自北京康为世纪生物科技有限公司;IDEXX (编号:99-06729)禽败血支原体抗体检测试剂盒购自北京爱德士元亨生物科技有限公司;牛血清白蛋白(BSA)购自上海翊圣生物科技有限公司;96孔ELISA板购自CORNING公司;完全弗氏佐剂购自Sigma公司;CTB黏膜免疫佐剂购自爱必信(上海)生物科技有限公司。
1.3 抗原表位预测
Uniprot 知识库(https://www.uniprot.org/)数据用于从FASTA 格式的MG-R(low) 中检索抗原蛋白的氨基酸序列。检索蛋白质 GapA(登录号:Q9REM8)、CrmA(登录号:F8WJY4)、PlpA(登录号:Q7NBF9)和Mgc2(登录号:AXP19 700.1)并用于进一步分析。应用在线软件ABCpred (http://www. imtech.res.in/raghava/abcpred/)和(http://tools.immuneepitope.org/main/)预测MG-R(low)、MG-F、MG-Ts11株的CrmA、GapA、Mgc2、PvpA蛋白的B细胞和T细胞表位。将选定的蛋白质序列提交给 VaXiJen v 2.0(http://www.ddg-pharmfac.net/vexijen/ )服务器以识别抗原性,以 0.4 的阈值分数协助预测潜在抗原。运用ToxinPred(https://webs.Ⅲtd.edu.in/raghava/toxinpred/)软件预测潜在是否具有细胞毒性。
1.4 候选表位多肽序列的设计与合成
将筛选的目标表位通过4个甘氨酸(GGGG)进行串联排列,得到预期的多表位肽序列。结合DNAStar(http://www.dnastar.com)软件Protean程序分析多表位肽的抗原位点情况,并命名为mEA。通过遗传密码子将多表位肽的氨基酸序列推导为核苷酸序列,尽可能选择大肠杆菌优势密码子,使用三肽囊素作为载体蛋白,同时在序列两端分别加上BamH Ⅰ和Hind Ⅲ酶切位,总计942个碱基。基因构建至原核表达载体pET-32a(+)的BamHⅠ和Hind Ⅲ两个酶切位点之间,最后由生工生物工程(福建)股份有限公司合成并提供目的质粒、阴性质粒及其甘油菌。
1.5 重组质粒的双酶切鉴定
阳性克隆菌(加入Amp)经过12 h培养后,提取质粒,利用限制性内切酶BamH Ⅰ和HindⅢ对重组质粒进行双酶切鉴定。回收目的基因片段,送至生工生物工程有限公司测序,鉴定正确的重组质粒命名为pET32a-MG-mEA。
1.6 重组蛋白的表达纯化
将重组质粒pET32a-MG-mEA转化至 BL21(DE3)感受态细胞中,获得重组表达菌株后接种于含Amp抗性的50 mL的LB液体培养基中,37 ℃培养至OD600nm值为0.6时,加入IPTG至终浓度为0.5 mmol·L-1,37 ℃振荡培养4 h。孵育后,离心收集菌体,加入适量PBS(pH=7.4)混匀后在冰上超声裂解,破碎后的菌液 4 ℃、12 000 r·min-1离心 30 min分离上清与沉淀。12% SDS-PAGE电泳分析重组蛋白的表达形式。用Ni-NTA Resin纯化重组蛋白,最后用碧云天公司的BCA蛋白浓度测定试剂盒检测蛋白浓度。
1.7 重组蛋白的Western blot鉴定
对重组蛋白进行Western blot鉴定。将高浓度的纯化产物进行 SDS-PAGE 电泳分离,然后转印至硝酸纤维(NC)膜,用含有 5%脱脂奶粉的 TBST 溶液 4 ℃过夜封闭。用MG阴、阳性鸡血清作为一抗,按 1∶500 稀释,室温孵育 2 h。用辣根过氧化物酶(HRP)标记的山羊抗鸡 Ig G 抗体为二抗,按 1∶3 000 稀释,室温孵育 1 h。通过使用ECL 发光法检测目的条带。
1.8 动物免疫保护试验
1.8.1 重组蛋白MG-mEA油乳剂的制备和质量检验 将重组蛋白MG-mEA按照一定的比例与弗氏完全佐剂或黏膜免疫佐剂(油包水型)混合乳化。将制备的油乳剂多表位疫苗接种于普通肉汤培养基、厌氧肉肝汤和营养琼脂各2支,37 ℃培养24 h,进行疫苗的无菌检验。
1.8.2 制备感染菌液 对实验室分离鉴定冻存的MG-HY株进行复壮,采用MG牛心液体培养基进行扩大培养,置于37 ℃培养箱培养,待其培养基pH下降颜色由红变黄后,进行CCU测定,将其稀释至109CCU·mL-1后备用。
1.8.3 试验分组及免疫程序 将 80 枚SPF鸡种蛋(购自济南斯帕法斯家禽有限公司)孵化至18日胚龄时随机分为8组,每组10只。根据佐剂的适用性,完全弗氏佐剂乳化疫苗采用注射途径,CTB黏膜免疫佐剂乳化疫苗采用点眼滴鼻给药途径。Ba免疫组和Bb免疫组分别在7和21日龄进行免疫,200 μg·羽-1。Bc免疫组首先在孵化至18胚龄时在尿囊腔初次免疫重组MG-mEA(重组蛋白+弗氏佐剂)油乳剂,200 μg·羽-1,7日龄采用点眼滴鼻途径进行二免(重组蛋白+黏膜佐剂)。具体免疫程序见表1。
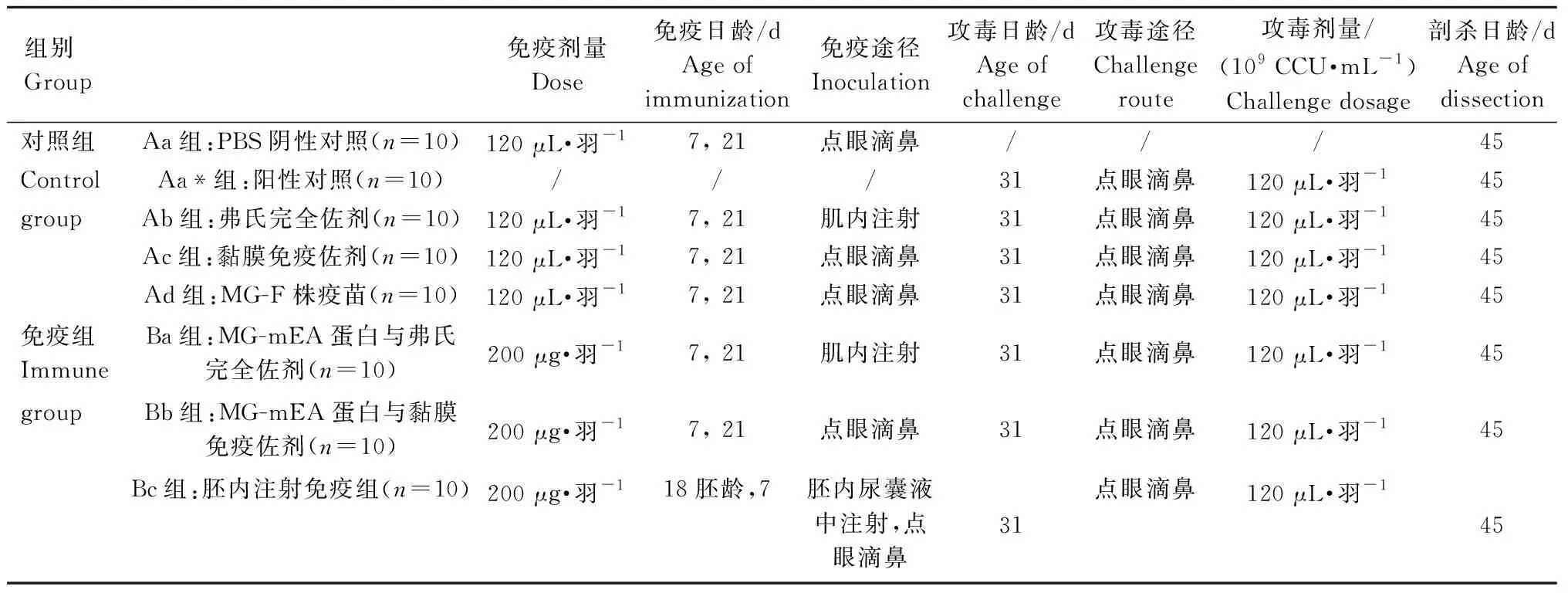
表1 试验分组及免疫程序Table 1 Grouping and immunization program in this study
1.8.4 攻毒保护试验 二免后10 d用MG-HY株菌液经滴鼻点眼进行攻菌,120 μL·羽-1(109CCU·mL-1),攻毒后观察各组鸡发病情况,连续观察2周(45日龄)后剖杀。采集气管的下1/2段冻存于-80 ℃,用于MG再分离,气管的上1/2段固定在10%福尔马林中,进行组织病理学分析。
1.8.5 临床症状及剖检病变观察 攻菌后观察鸡群的发病、死亡情况,统计其死亡率,连续观察10 d。剖检后观察不同试验组鸡的喉气管、肺和气囊等组织的病理变化情况,并做好记录。
1.8.6 组织病理损伤观察 采集的气管病理组织经10%福尔马林固定后,逐级酒精脱水、透明、浸腊、包埋、切片,常规苏木精-伊红染色法(Hematoxylin-Eosin Staining,HE)染色,光镜下观察组织病理学损伤情况。
1.8.7 鸡毒支原体在气管中载量检测 为了测定MG的感染程度,用购自Omega Bio-tek Inc.(Georgia, USA)的细菌DNA试剂盒提取气管中细菌DNA模板。MG 16S基因(ID:NC_017 502.1)作为MG基因组扩增测序片段,引物:MG16sRF (5′-GAG CTA ATC TGT AAA GTT GGT C-3′, Tm=57.80 ℃)MG16sRR (5′-GCTTCCTTGCGGTTAGCAAC-3′,Tm=63.64 ℃)。使用Roche LightCycler仪器(Roche, Shanghai, China)通过qRT-PCR检测小鸡气管中MG的DNA拷贝数;根据循环阈值(Ct)和来自培养物的MG数量绘制DNA标准曲线[16]。
1.8.8 抗体水平检测 首免前及免疫后7、14、21、31 d以及攻菌后两周(45 d)每组随机抽取3只鸡颈静脉采血并分离血清,依照IDEXX 禽败血支原体检测试剂盒说明,进行标品稀释、加样、温育、配液、洗涤、加入酶标试剂、温育、洗涤、显色、终止及酶标仪读数等步骤进行试验。
2 结 果
2.1 生物信息学分析
将筛选出来的评分高、免疫原性好且无细胞毒性的多个B细胞和T细胞表位,作为目标表位(表2)。VaxiJen v 2.0 服务器用于评估蛋白质的抗原性。抗原性的阈值分数是 0.4。选择的所有蛋白质序列都是使用 AllerTop v.2.0.0 预测的非过敏原。表3总结了蛋白质(CrmA、GapA、Mgc2、PvpA)的抗原评分和过敏性。

表2 鸡毒支原体黏附素B细胞、T细胞表位预测与筛选Table 1 The B-cell, T-cell epitopes predicted and selected of Mycoplasma gallisepticum cytadhesin proteins
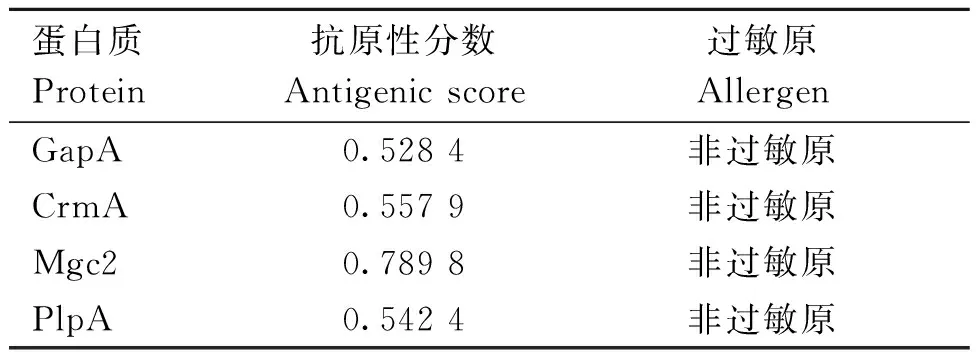
表3 鸡毒支原体黏附蛋白的抗原性和致敏性预测Table 3 Prediction of antigenicity and allergenicity of adhesin from Mycoplasma gallisepticum
2.2 二级结构预测及理化特性分析
SOPMA服务器(https://www.bioinfo123.cn/zaixiankeyangongjv/633.html)描述了重组蛋白序列的二级结构,图1显示无规则卷曲(random coil)(紫色)的占比高于α-螺旋(alpha helix)(蓝色)和β-折叠(beta turn )(绿色)。评估所设计的多表位疫苗的理化特性对于验证疫苗的安全性和有效性至关重要。因此,Expert Protein Analysis System分析了各种物理和化学性质。设计的多表位疫苗由311个氨基酸组成,分子量约为30.047 ku。理论pI计算为10.75,表明多表位疫苗在性质上具有显着的基础性。不稳定指数估计为35.78,这意味着蛋白质稳定。计算出的脂肪族指数和亲水性(GRAVY)的总平均值分别为24.18和-1.027,表明疫苗具有热稳定性和亲水性(表4)
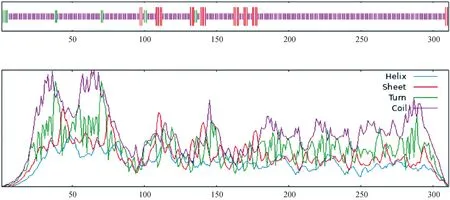
图1 重组蛋白序列的二级结构Fig.1 Secondary structure of recombinant protein sequence
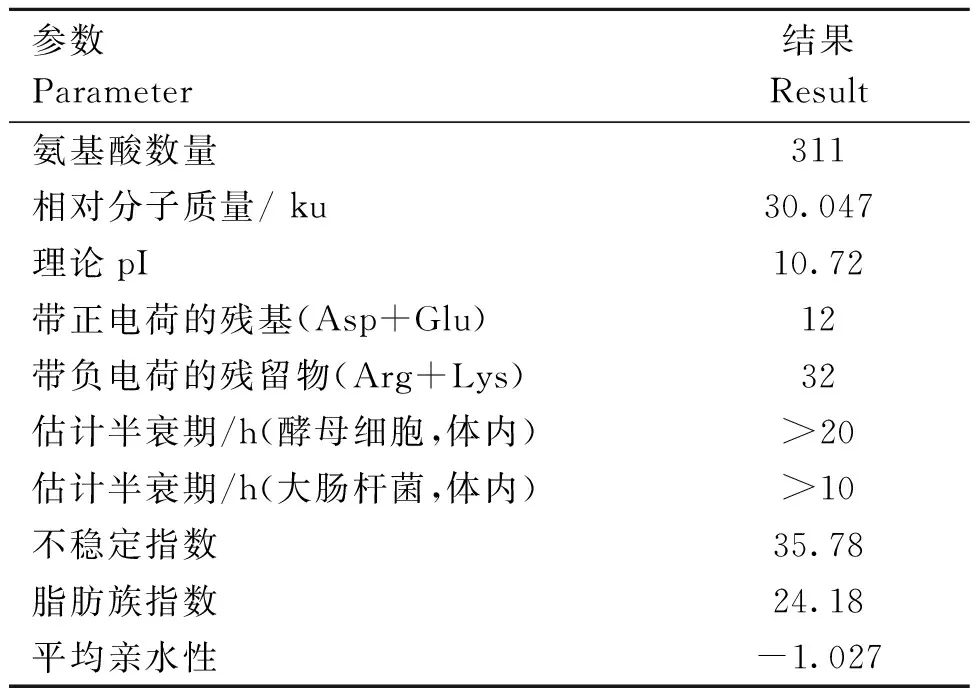
表4 多表位疫苗构建的理化性质评价Table 4 Evaluation of physicochemical properties of multi-epitope vaccine construction
2.3 重组质粒的鉴定
利用Snap Gene进行重组质粒的构建。图2A显示目的基因片段插入pET-32a(+)载体后,成功克隆了重组质粒pET32a-MG-mEA(图2B)。经限制性内切酶(BamHⅠ和Hind Ⅲ)酶切鉴定结果显示(图2C),质粒经酶切后出现约5 869 bp的载体片段,以及大小约942 bp的目的基因片段,片段大小与预期结果一致。测序结果显示序列正确无移码、碱基插入、碱基缺失等突变。此外,质粒采用T7引物(F:TAATACGACTCACTATAGGG;R:ACAT-CCACTTTGCCTTTCTC)进行PCR扩增。经1% 琼脂糖凝胶电泳,在第一泳道的空白对照组无明显条带,在第2泳道可见一条约1 680 bp明显的条带(图2D)。
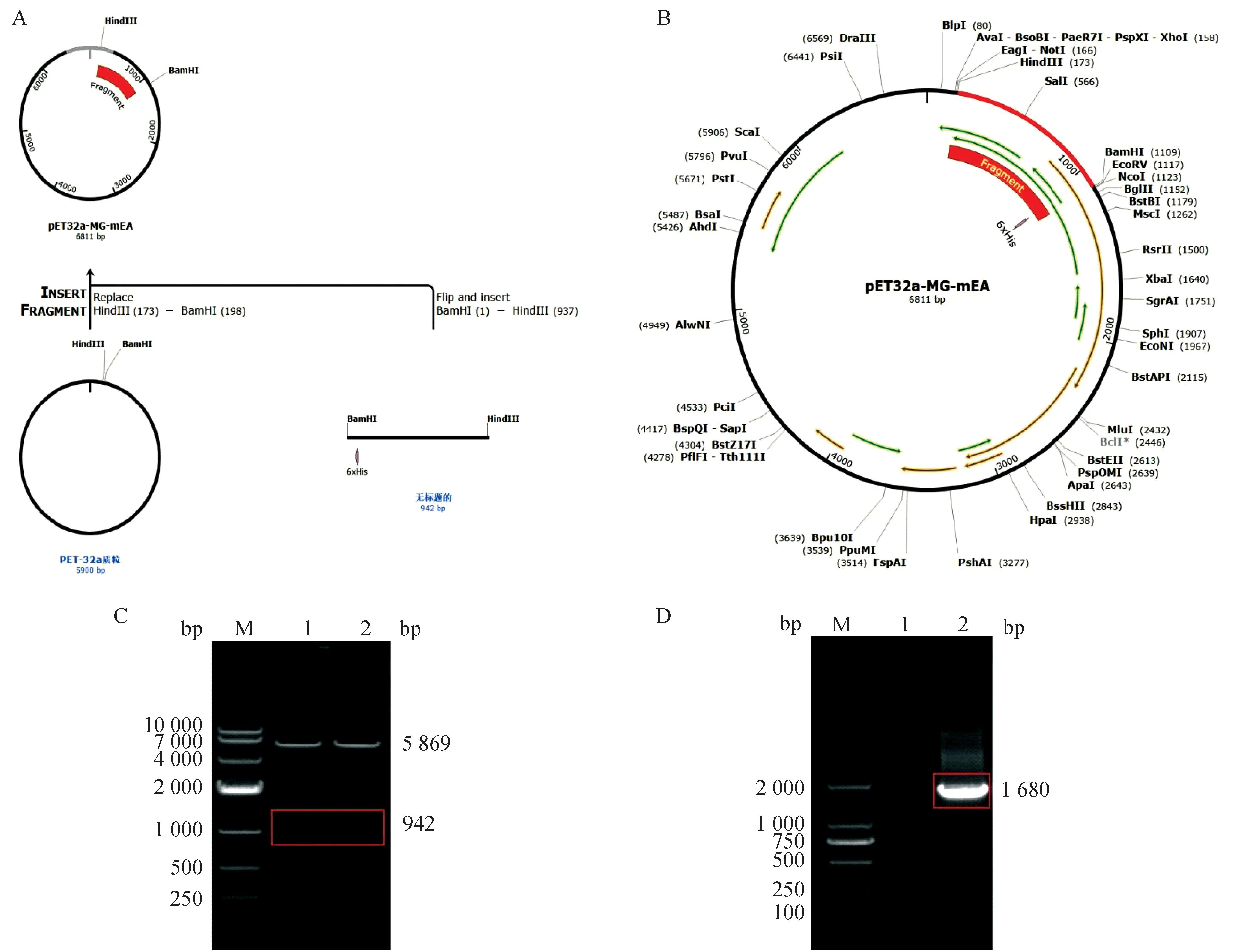
A. 目的基因片段插入pET-32a(+)载体结构分析;B. 红色部分表示编码多表位疫苗构建体的基因,黑色部分表示载体骨架;C. 重组质粒pET32a-MG-mEA的双酶切鉴定结果(M. DNA相对分子质量标准;1、2. BamHⅠ和Hind Ⅲ酶切鉴定);D. T7通用引物PCR检测结果(M. DNA相对分子质量标准;1. 空白对照;2. PCR扩增结果)A. Structural analysis of the target gene fragment inserted into the pET-32a(+) vector; B. Red part indicates the gene encoding the multi-epitope vaccine construct and black part indicates the vector backbone; C. Results of double digestion identification of recombinant plasmid pET32a-MG-mEA (M. Standard DNA molecular mass;1, 2. Digestion of pET32a-MG-mEA by BamHⅠ and Hind Ⅲ); D.PCR results of T7 universal primer (M. Standard DNA molecular mass;1. Blank control; 2. PCR amplification results)图2 重组质粒pET32a-MG-mEA鉴定Fig.2 Identification of recombinant plasmid pET32a-MG-mEA
2.4 重组蛋白的诱导表达
将pET32a-MG-mEA转化E.coliBL21(DE3)感受态细胞后,用IPTG诱导表达MG-mEA蛋白。取pET-32a(+)诱导组菌液、重组质粒未诱导组菌液、重组质粒经IPTG诱导组菌液(图3A);诱导后的菌体上清液及超声后包涵体沉淀分别进行SDS-PAGE电泳试验,结果发现48 ku左右有明显的蛋白表达条带(图3B)。将超声后溶解在10 mmol·L-1咪唑中的MG-mEA可溶性蛋白上样后,经可溶性蛋白平衡液洗涤(10 mmol·L-1咪唑),再分别用10、20、50、100和200 mmol·L-1咪唑洗脱液依次洗脱,洗脱流出液进行SDS-PAGE分析,结果显示100 mmol·L-1咪唑洗脱液可洗脱目的蛋白。
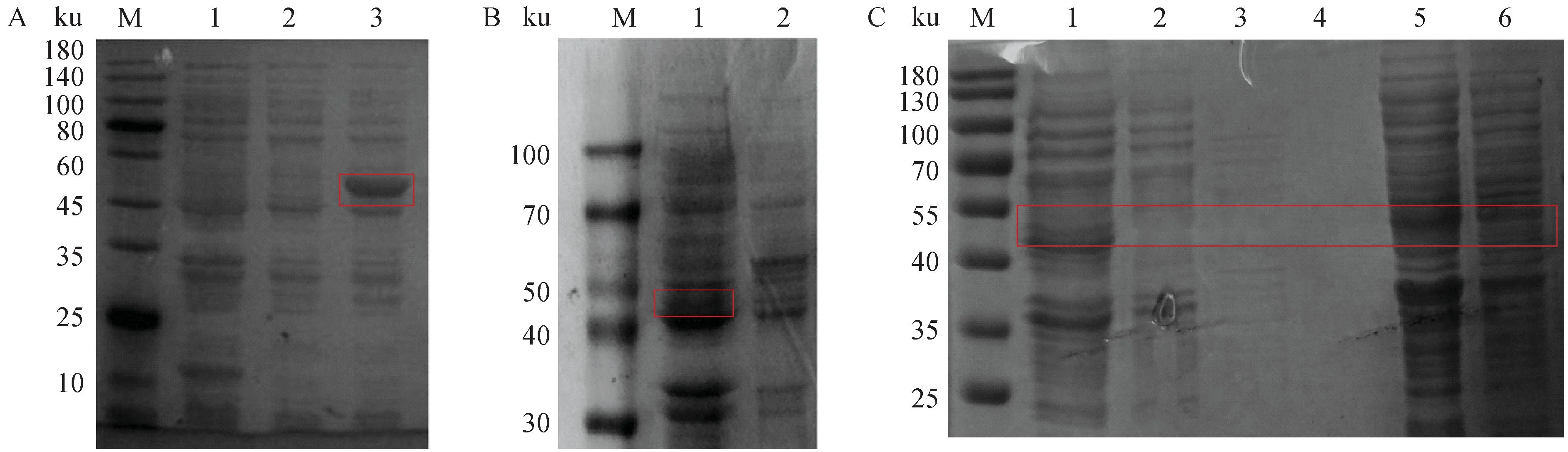
A.重组蛋白的SDS-PAGE电泳分析(M.蛋白相对分子质量标准;1.pET-32a(+)诱导组;2.重组质粒未诱导组;3.重组质粒经IPTG诱导组);B.重组蛋白的可溶性分析(M.蛋白相对分子质量标准;1.超声后上清溶液;2.超声后包涵体沉淀);C. MG-mEA可溶性蛋白的纯化结果(M.蛋白相对分子质量标准;1.上样流出液;2~6. 10、20、50、100、200 mmol·L-1咪唑洗脱流出液。红色方框表示目的条带位置A. SDS-PAGE electrophoresis analysis of recombinant proteins (M. Standard protein molecular mass; 1. pET-32a(+) induced group; 2. Recombinant plasmid uninduced group; 3. Recombinant plasmid induced by IPTG group); B. Solubility analysis of recombinant proteins (M. Standard protein molecular mass; 1. Supernatant solution after sonication; 2. Inclusion body precipitation after sonication); C. MG-mEA purification results of soluble proteins (M. Standard protein molecular mass; 1. Supernatant effluent solution; 2-6. 10, 20, 50, 100, 200 mmol·L-1 imidazole elution effluent solution) . The red box indicates the position of the destination strip图3 重组MG-mEA蛋白的SDS-PAGE电泳Fig.3 SDS-PAGE electrophoresis of recombinant MG-mEA protein
2.5 Western blot鉴定
取纯化后的重组蛋白 MG-mEA进行Western blot分析,并以SPF鸡血清为阴性对照。Western blot分析结果显示(图4)使用阴性血清孵育未见明显的条带,使用MG阳性血清孵育可以看到大小48 ku的目的条带。
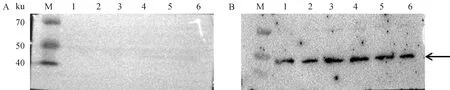
A. 重组蛋白 MG-mEA与阴性鸡血清的Western blot反应;B. 重组蛋白 MG-mEA与MG阳性鸡血清的Western blot反应;M.蛋白相对分子质量标准;1~6. 3个批次的重组蛋白A. Indicates Western blot reaction of recombinant protein MG-mEA with negative chicken serum; B. Indicates Western blot reaction of recombinant protein MG-mEA with MG-positive chicken serum; M. Standard protein molecular mass; 1-6. 3 batches of recombinant protein图4 重组蛋白的Western blot结果Fig.4 Western blot results of recombinant protein
2.6 重组蛋白 MG-mEA免疫保护效果评价
2.6.1 重组蛋白油乳剂安全性评价 将重组 MG-mEA蛋白分别与完全弗氏佐剂和CTB黏膜免疫佐剂1∶1进行乳化,外观呈乳白色,均匀一致。疫苗分别接种于普通肉汤、厌氧肉肝汤及普通琼脂培养基中,37 ℃培养24 h,均无菌生长。各试验组在接种前后24 h内均未见明显的应激反应和接种部位的不适反应。剖检发现在免疫接种部位以及全身都未发现有肿瘤等情况,说明本试验制备的MG-mEA对鸡无明显的刺激性,接种部位和全身都无不适,安全性良好。
2.6.2 雏鸡临床症状与剖检病变观察 整个试验期内,PBS接种对照组(Aa组)临床症状和生长发育表现没有异常变化。直至全群剖杀前,各组鸡均未出现死亡。随着感染时间的推移,感染组鸡羽毛蓬乱无光泽,精神沉郁,采食量减少,部分鸡出现轻微的呼吸道症状。使用MG攻击的Aa*组、Ab组、Ac组表现出明显的呼吸啰音,个别鸡出现咳嗽、眼部肿胀等症状(图5)。Ad组、Ba组、Bb组、Bc组均无明显临床症状出现。
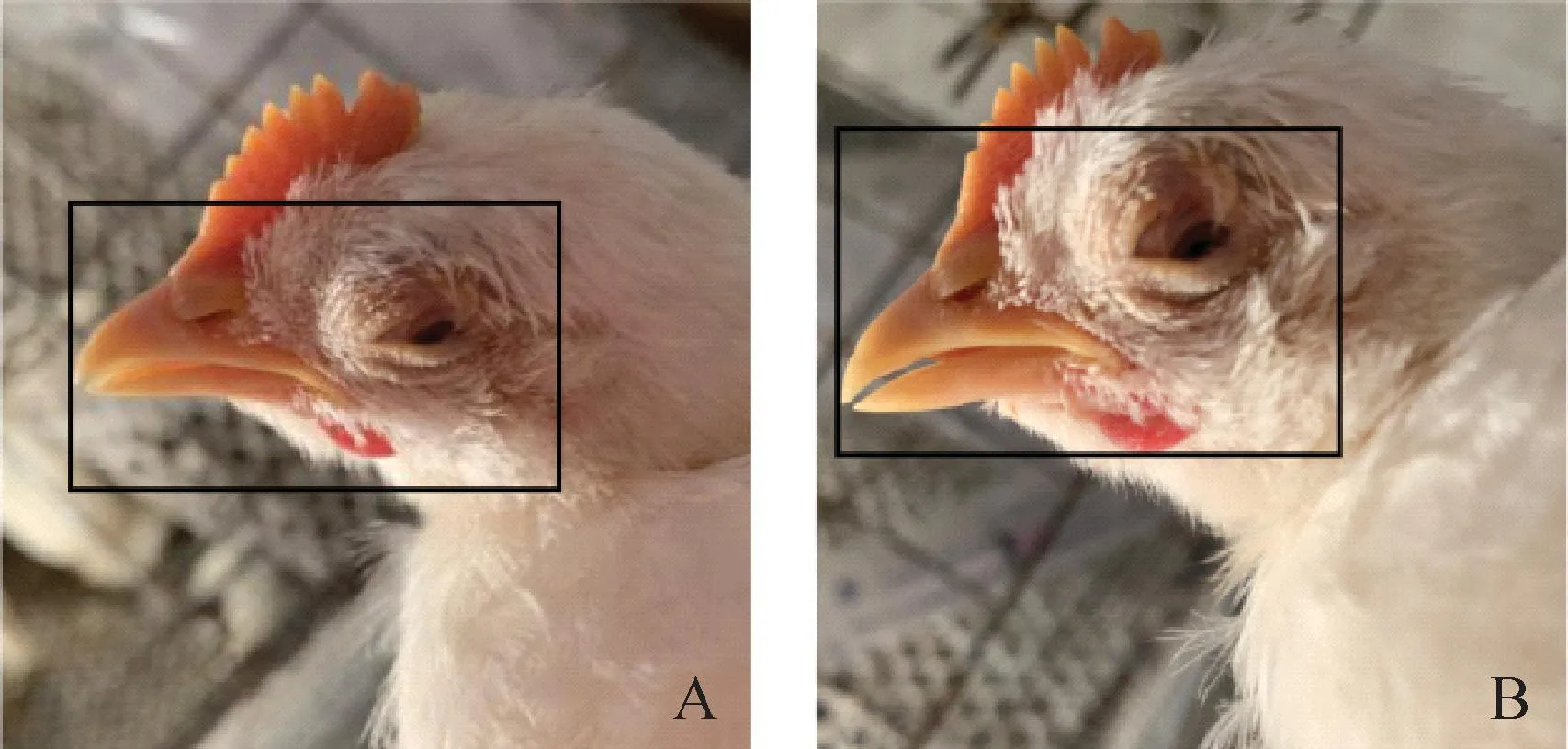
A. 35 d观察结果;B. 45 d观察结果。黑色方框表示鸡只眼睑肿胀,张口呼吸A. Observations of 35 d; B. Observations of 45 d. Black boxes indicate swollen eyelids and open-mouth breathing in chickens图5 感染组鸡的临床症状观察Fig.5 Observation of clinical symptoms in the infected group of chickens
剖检发现Aa组鸡均无明显病理变化,气囊透明无分泌物(图6A)。MG攻击的Aa*组、Ab组、Ac组的鸡气囊呈现明显的病理变化,可见气囊混浊、增厚,出现泡沫(图6B、C)。Ad组、Ba组、Bb组均无明显病理变化,只有Bc组的极个别鸡气囊出现泡沫的情况(图6D)。
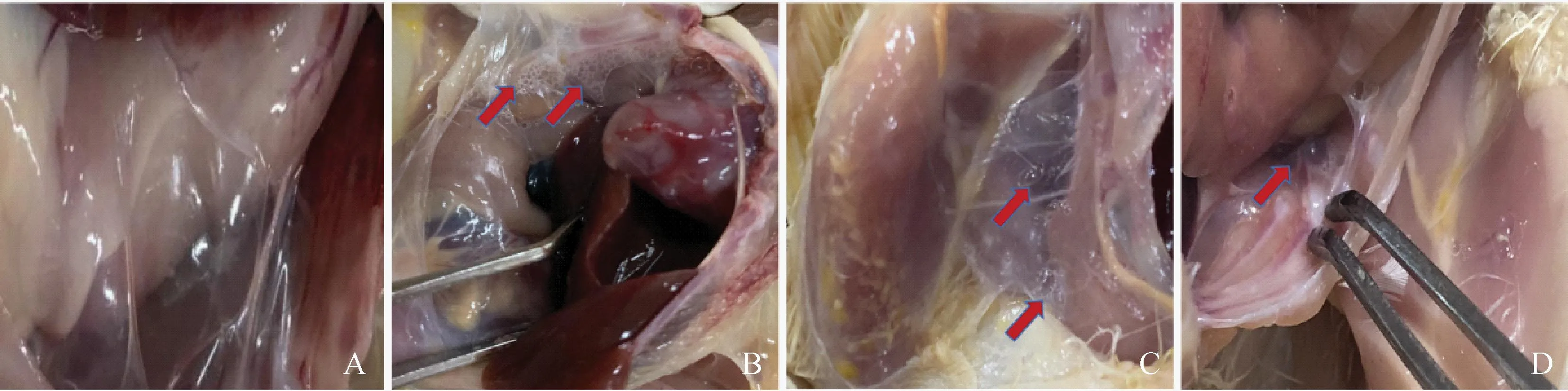
A. Aa组鸡的正常气囊形态;B. MG攻击的Aa*组的鸡气囊;C. MG攻击的Ab组、Ac组的鸡气囊;D. MG攻击后Bc组鸡的气囊。红色箭头表示气囊混浊、增厚,出现泡沫A. Indicates normal air sac morphology of chickens in group Aa; B. Indicates air sacs of chickens in group Aa* attacked by MG; C. Indicates air sacs of chickens in groups Ab and Ac attacked by MG; D. Indicates air sacs of chickens in group Bc after MG attack. Red arrows indicate cloudy and thickened air sacs with foam图6 鸡气囊的剖检观察结果Fig.6 Dissection observations of chicken air sacs
2.6.3 雏鸡抗体水平检测 ELISA结果显示(表5)重组蛋白免疫和攻毒均引起SPF雏鸡抗体滴度的增长,而PBS接种对照组(Aa组)的抗体始终保持阴性,说明整个试验过程中无非试验MG的干扰。Aa*组、Ab组、Ac组的血清抗体水平在在攻菌前(31 d)均保持阴性。在检测的5个时间点里Ad组与各免疫组(Ba组、Bb组、Bc组)抗体水平均高于Aa组(PBS对照组)(P<0.05)。3个免疫组(Ba组、Bb组、Bc组)在首免后7 d抗体水平有所上升,但随着免疫时间的延长其抗体效价表现差异越显着(P<0.05)。
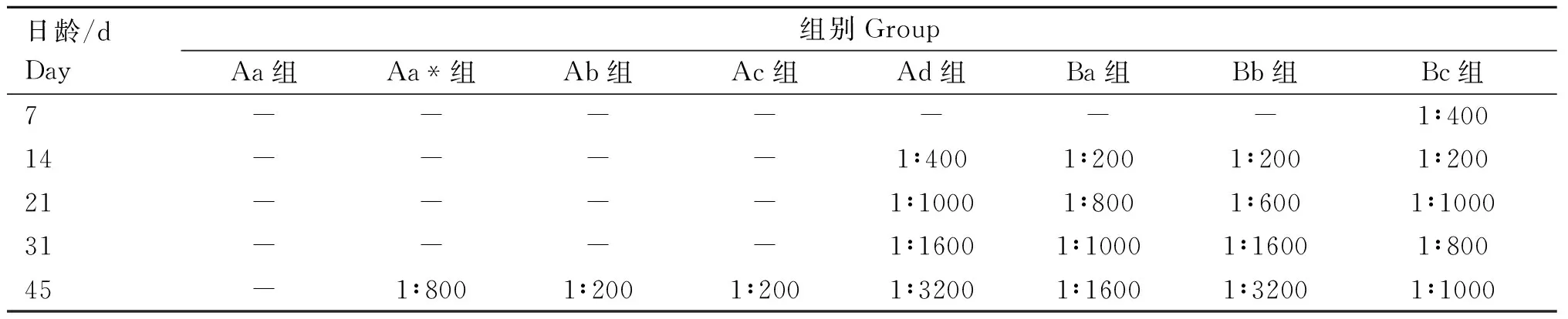
表5 免疫后各组血清抗体效价(1∶X)Table 5 Serum antibody titers of each group after immunization (1∶X)
攻毒后各免疫组均出现了抗体效价的增长(图7):其中Bc组(胚内注射免疫组)的抗体ELISA效价为1∶1 000,抗体效价较低。Ba组(MG-mEA蛋白与弗氏完全佐剂组)的抗体ELISA效价为1∶1 600;Bb组(MG-mEA蛋白与黏膜免疫佐剂组)的抗体ELISA效价为1∶3 200,与PBS组相比差异具有极显着统计学意义 (P<0.01)。Aa*组、Ab组、Ac组、的抗体水平在攻菌后转为阳性,与Aa组(PBS对照组)差异显着 (P<0.01);与攻菌前相比有显着差异 (P<0.01)。
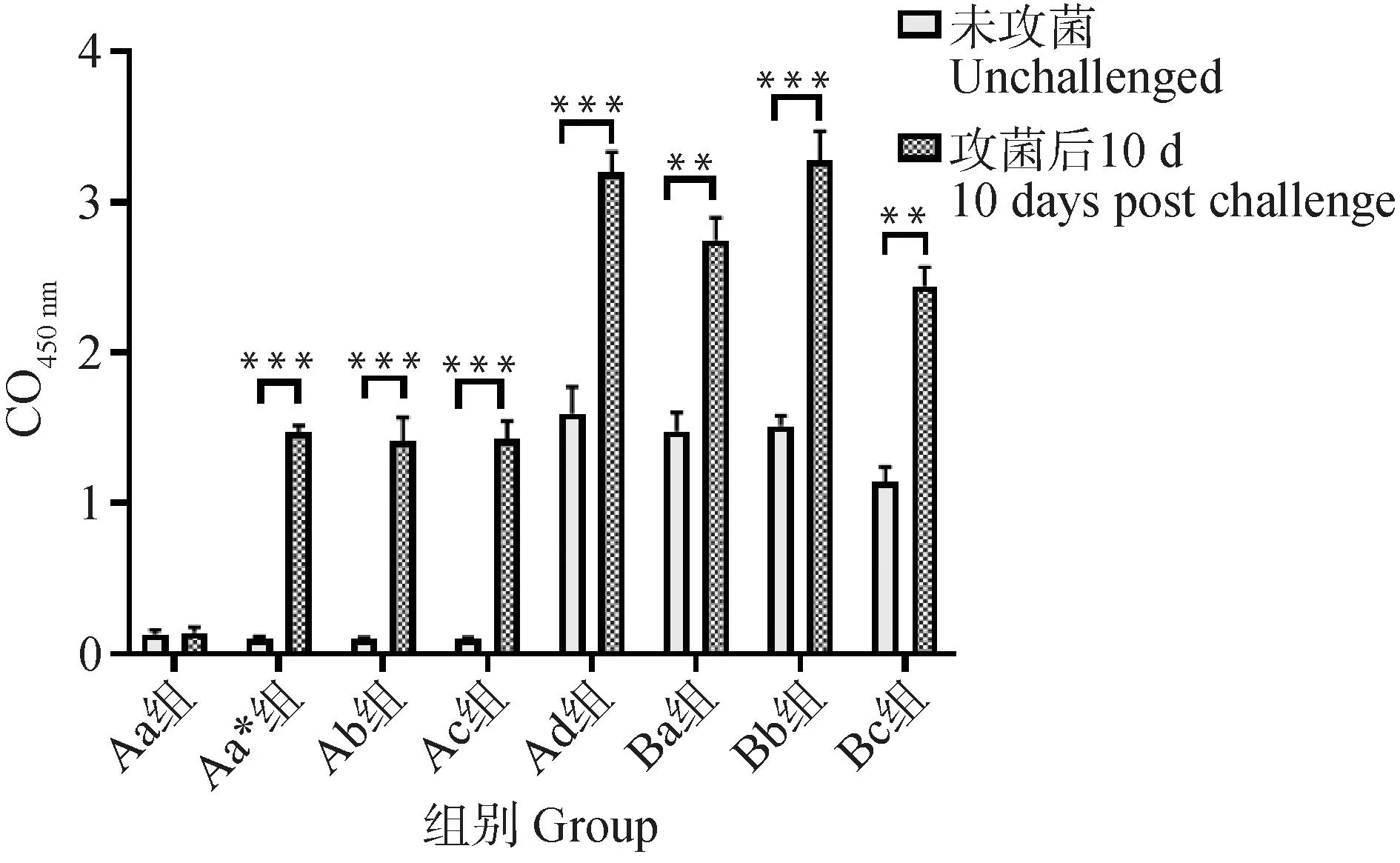
图7 免疫前后抗体效价对比结果Fig.7 Comparison of antibody titers before and after immunization
2.6.4 病理切片结果 气管病理切片的镜检显示:以Aa组作为阴性对照(图8A),3个对照组(Aa*组、Ab组、Ac组)的气管黏膜具有弥漫性上皮内炎性细胞浸润,伴有崩解的假分层柱状上皮,纤毛丢失,上皮内黏液腺膨胀或不规则(图8B)。接种疫苗的Ad组与各免疫组(Ba组、Bb组、Bc组)未见明显组织学病变,具有完整的假分层纤毛柱状上皮(图8C)。
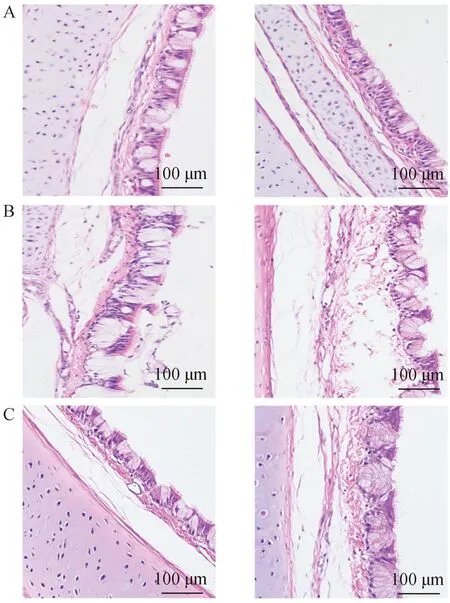
A. Aa组鸡气管组织图;B. Aa*组、Ab组鸡气管组织图(Ac组与此类似,未展示);C. Ad组与Ba组气管组织图,其他免疫组(Bb组、Bc组)与此类似,未展示A. Histological lesions of chicken trachea in group Aa; B. Histological lesions of chicken trachea in Aa*, Ab groups (the Ac group is similar to this); C. Histological lesions of chicken trachea in Ad, Ba groups, and immune groups (the groups Bb, Bc) are similar to this图8 鸡气管的组织学病变对比(HE染色)Fig.8 Comparison of histological lesions of chicken trachea (HE staining)
2.6.5 气管中MG载量检测结果 将剖杀后采集的气管组织,进行qRT-PCR评估以检测不同组别在攻菌后的细菌载量。结果显示(图9),Aa空白对照组显示为阴性,说明整个试验过程中无非试验MG的干扰。Aa*组为阳性对照组,在45 d表达量接近于 108copies·μL-1。同时,Ab组与Ac组与Aa*组检测结果无显着差异,细菌拷贝数达到了107~108copies·μL-1,与Aa组相比有显着差异(P<0.01)。此外,Ad组(MG-H株疫苗组)与3个重组蛋白免疫组(Ba组、Bb组、Bc组)差异不显着,而与Aa空白对照组相比有显着差异(P<0.05)。
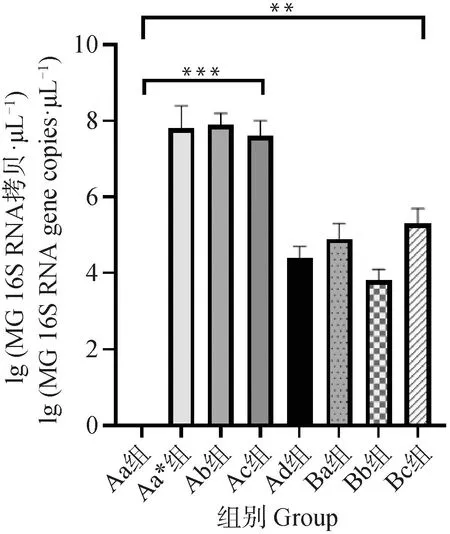
图9 鸡气管的MG载量检测结果Fig.9 Results of MG load testing in chicken trachea
3 讨 论
由于MG感染具有长期性和容易在宿主体内的成功复制、存活,致使MG难以被控制,给家禽业造成了巨大的经济损失[1-4]。MG作为非侵入性病原微生物,定植的关键是吸附于宿主呼吸道上皮细胞的纤毛上[17]。MG的感染不仅使纤毛层遭到破坏,活动停止,还会进一步导致上皮细胞逐渐变性退化死亡,最终导致脱落。病理表现为呼吸道的充血、炎症和渗出[18-19]。
临床常用的MG疫苗主要有MG-F株、MG S6温度敏感变异株,两个新的疫苗株6/85和Ts-11。宁宜宝[19]1993年对MG-F株免疫效力进行测定,发现MG-F株虽然对鸡的免疫保护力持久,是个优良的疫苗株,但仍有一定毒力,对鸡群还有一定程度的致病性;Ley等[20]研究表明,6/85和Ts-11疫苗株比F株更安全,保护率更高,二者对鸡无致病力。但接种鸡群必须为健康鸡群,一般免疫前后5 d不能使用抗生素类药物,蛋鸡在产蛋期不宜接种。经研究发现[21],常规疫苗毒力不够稳定,此外,MG培养困难和不同地区分离的毒株抗原性存在差异,常规疫苗的局限性愈来愈明显,故利用生物技术手段开发新型疫苗已势在必行。表位疫苗是在总结传统疫苗与多肽疫苗优点的基础上发展出来的一种新型疫苗,比常规疫苗具有更多优势[22]。大肠杆菌表达系统的显着特点是易于操作、成本低、产量高,故为许多研究者所选用[23]。pET表达系统是目前广泛使用的一种融合蛋白体系,有其独特的优势,带有His.Tag,是集表达、纯化和检测蛋白为一体的功能强大的系统。鉴于此,本研究选择了原核表达载体pET32a(+),通过原核表达方式制备了重组蛋白MG-mEA,并对其免疫效力进行了检测,为MG新型疫苗的进一步探索提供了重要的研究基础,对MG的有效防控具有重要的意义。
多项研究证明禽类发生呼吸道症状与MG的表面抗原有关[24-25]。相关研究表明,黏附素蛋白是鸡毒支原体吸附于宿主细胞是成功定植和确保动物致病的前提条件,其中CrmA、CrmB、GapA、Mgc2、PvpA等是MG主要的黏附素蛋白,与鸡毒支原体的吸附相关[4-6,26]。Indikov等[27]的研究发现,CrmA和GapA都是鸡毒支原体细胞黏附和发病机理所必需的黏附素,MgC2在功能上参与黏附过程;PvpA是高频变异蛋白,在免疫逃避的发病机制中发挥重要作用[28]。Kumar等[29]报道了基于免疫信息学方法制备多表位疫苗,通过对钩端螺旋体的体外结构蛋白筛选多个B/T细胞表位来构建多表位疫苗。结合前人研究基础,本研究利用多种抗原表位预测软件ABCpred、SYFPEITHI、DNAstar protean等,对MG的4个黏附素蛋白中优势B和T细胞表位预测及分析,其中表位的筛选均综合两种以上软件分析结果,提高了分析结果的可信度。抗原表位是免疫识别的标志,是抗原特异性的结构基础,同时也是全抗原引起的保护性免疫应答的主要途径[30]。考虑到合成的表位肽均为小分子半抗原,不能直接刺激机体产生良好的免疫应答[28],因此,以三肽囊素为载体蛋白进行串联整合,各表位间以GGGG氨基酸作为柔性片段连接,使构建的多肽不仅相对独立并且具有分子刚性[27,31]。使用DNAstar protean软件分析预期的多表位肽序列,发现串联的序列具有较好的亲水性、柔韧性及表面抗原性,并命名为MG-mEA。把串联的氨基酸序列尽可能的转化为大肠杆菌优势密码子,构建了重组质粒pET32a-MG-mEA,对其进行原核表达得到MG-mEA重组蛋白,纯度达到90%以上。经Western blot鉴定具有良好的抗原性。
本试验采用肌内注射、点眼滴鼻和胚内注射3种方式对进行免疫,从免疫后的抗体水平变化和攻菌后的临床症状、病理变化几方面分析了MG-mEA的保护效果。组织病理学检查结果显示,3个重组蛋白免疫组(Ba组、Bb组、Bc组)未见明显组织学病变,具有完整的假分层纤毛柱状上皮。血清抗体的ELISA检测结果显示重组蛋白免疫和攻毒均引起SPF雏鸡抗体滴度的增长。各疫苗组(Ba组、Bb组、Bc组)的抗体效价水平均高于PBS对照组(Aa组)(P<0.05),并在二免后10 d抗体水平达到最高。这与Mahdevar等[32]通过免疫信息学工具设计多表位疫苗用于治疗小鼠乳腺癌产生的试验效果一致。上述试验证明,本研究制备的MG-mEA表位疫苗,3种免疫途径均能不同程度地产生保护效果,其中,通过点眼滴鼻途径的免疫保护效果更佳。
4 结 论
本研究通过生物信息学方法来筛选优势抗原表位,构建了重组质粒pET32a-MG-mEA,对其进行原核表达得到MG-mEA重组融合蛋白。免疫保护试验结果显示,MG-mEA+佐剂可为鸡提供良好的免疫保护。本研究结果为研制安全有效的MG潜在候选疫苗提供了新的途径。



