黄媛媛,王 佳,陈嘉瑜,甘 源,袁 厅,冯志新,3,邵国青,3,王先炜,熊祺琰,3*
(1.南京农业大学动物医学院,南京 210095;2.江苏省农业科学院兽医研究所/农业部兽用生物制品工程技术重点实验室,南京 210014;3.兽用生物制品(泰州)国泰技术创新中心,泰州 225300)
间皮是分布于腹膜、胸膜、心包膜和大多数内脏器官表面的单层扁平上皮,其基本功能是作为一种保护性的湿润光滑表面减少脏器之间的摩擦,也是抵抗微生物和肿瘤细胞入侵的重要防线[1]。间皮主要由间皮细胞构成,其源自于中胚层,但具有与上皮细胞相似的特征,如细胞极性、基底膜黏附、胞间紧密连接、表面微绒毛等[2-3]。间皮细胞可分泌黏多糖和表面活性物质为脏器提供润滑和保护,同时间皮细胞还具有其他多种生理功能,如参与物质转运、参与炎症反应、调节凝血与纤溶、抑制肿瘤细胞扩散、参与间皮损伤修复等,同时也与多种病理过程有关,如浆膜炎(胸膜炎、腹膜炎、心包炎)、粘连、肿瘤的发生发展等[4-6]。
浆膜炎是动物传染病的一类常见临床表现,包括胸膜炎、腹膜炎、心包炎,引起动物浆膜炎常见的病原包括副猪革拉瑟菌(Glaesserellaparasuis,GPS)[7]、猪鼻支原体(Mycoplasmahyorhinis,Mhr)[8-9]、鸭疫里氏杆菌(Riemerellaanatipestifer)[10]等,给我国养殖业造成严重经济损失。其中Mhr在世界范围内广泛感染,可引起多发性浆膜炎、关节炎,给养猪业带来重大经济损失[11-12]。细胞模型是病原学研究的重要基础,本研究以猪腹膜间皮细胞(peritoneal mesothelial cell,PMC)为对象,建立猪原代间皮细胞分离培养方法,并以Mhr作为引起浆膜炎病原的代表将PMC细胞初步用于体外感染试验,以期为引起猪浆膜炎相关病原的感染致病机制研究提供细胞模型。
1 材料与方法
1.1 材料
1.1.1 试验动物 1~3月龄健康二元杂交猪(长白-大白)。
1.1.2 猪鼻支原体 Mhr 495c强毒株由江苏省农业科学院兽医研究所分离并保存。
1.1.3 主要试剂 DMEM/F12培养基、0.25%EDTA-胰酶、特级胎牛血清、鼠单抗白细胞 CD45单克隆抗体、兔抗第Ⅷ因子单克隆抗体购自赛默飞科技有限公司。青霉素、链霉素、DAPI、LDH试剂盒购自上海碧云天生物技术有限公司。红细胞裂解液和胶原酶购自北京索莱宝科技有限公司。鼠抗波形蛋白单克隆抗体、兔抗角蛋白18多克隆抗体、FITC-羊抗兔IgG二抗、Cy3-羊抗鼠IgG二抗购自武汉博士德生物工程有限公司。明胶、DMSO购自西格玛奥德里奇(上海)贸易有限公司。KM2培养基由江苏省农业科学院兽医研究所自制。
1.2 方法
1.2.1 猪原代腹膜间皮细胞的分离与培养 无菌采集猪腹腔大网膜组织,放入装有含双抗(青霉素100 U·mL-1、链霉素100 μg·mL-1)的无菌D-Hanks溶液的离心管中,低温条件下运送至实验室。将大网膜组织置于培养皿内,用预冷的D-Hanks溶液洗涤6~8遍。尽量剔除血管和脂肪,将剩余大网膜组织剪成1 cm2大小,加入预热的0.1% Ⅰ型胶原酶消化液,混匀后置于37 ℃摇床180 r·min-1消化约8 min,期间手动剧烈震荡一次,而后加入3倍~4倍体积的D-Hanks溶液终止消化。用力震荡,使细胞从消化的组织中充分释放出来,弃去消化后的组织,过150目筛网,收集液体于50 mL尖底离心管,300g离心10 min,弃上清。如红细胞较多,加入红细胞裂解液室温处理5 min裂解红细胞,再用D-Hanks洗涤细胞2次,最终用含15%胎牛血清(fetal bovine serum,FBS)和双抗的DMEM/F12培养基重悬。将细胞按1×106~2×106·mL-1浓度铺入25 cm2细胞培养瓶内,置于含5% CO2培养箱37 ℃培养,差速贴壁2次,即贴壁1 h后换新的细胞瓶,再次贴壁1 h,收集上清于15 mL尖底离心管,离心收集细胞,用完全培养基重悬,按3 × 105·mL-1浓度铺入0.1%明胶包被的25 cm2细胞培养瓶,置于含5% CO2培养箱37 ℃培养。
1.2.2 明胶包被方法 使用无菌PBS配制1%明胶溶液,试验前用PBS稀释至0.1%后过 0.22 μm滤器除菌,取3 mL加入25 cm2细胞培养瓶中完全覆盖瓶底或取500 μL明胶加入24孔板中使其完全覆盖孔底,4 ℃过夜,次日倒去多余液体并晾干1~2 h即可使用。
1.2.3 细胞传代培养 当原代细胞的融合度达85%~90%时,需对PMC细胞进行传代处理。使用无菌PBS润洗细胞后,向瓶内加入适量0.25%胰酶-EDTA消化液,使其完全覆盖瓶底,置于37 ℃培养箱内消化2~4 min,消化过程中注意观察细胞形态变化,当细胞变圆并与瓶底脱离后,加入与胰酶等量的完全培养基终止消化过程。收集瓶内液体于尖底离心管,300g离心10 min,用完全培养基重悬细胞沉淀,按1 × 105·mL-1浓度转移至2~3个细胞瓶内培养。
1.2.4 腹膜间皮细胞的鉴定
1.2.4.1 光学显微镜鉴定:取原代培养的PMC细胞置于光镜下观察细胞形态。
1.2.4.2 扫描电镜鉴定:玻片经灭菌处理后用明胶包被,将细胞按1 × 105·mL-1浓度接种于放置有玻片的6孔板中,待细胞生长至90%融合时,用PBS洗涤细胞3遍,加入2.5%戊二醛电镜固定液4 ℃过夜固定细胞,PBS洗涤后,用1%锇酸溶液固定,乙醇梯度脱水,临界点干燥法干燥,离子溅射,真空喷镀金后进行扫描电镜(EVO-LS10)观察。
1.2.4.3 间接免疫荧光鉴定:将细胞按1×105·mL-1浓度接种于明胶包被的24孔板中,待细胞生长至90%融合时,用PBS洗涤细胞3遍,加入1.25%戊二醛室温固定10 min,洗涤后用0.2% Triton X-100透化处理5 min,洗涤后加入5%牛血清白蛋白于37 ℃封闭1 h,再加入一抗溶液(波形蛋白、角蛋白18、第VIII因子、CD45抗体),4 ℃孵育过夜,次日洗涤后加入相应的FITC-羊抗兔IgG二抗和Cy3-羊抗鼠IgG二抗,于37 ℃室温孵育1 h,洗涤后加入DAPI室温染色10 min,洗涤后于荧光显微镜下观察。
1.2.5 细胞冻存与复苏 提前配制细胞冻存液,按50% DMEM/F12基础培养基、40% FBS、10% DMSO比例配制并混匀。弃去细胞瓶内原培养基,使用无菌PBS润洗两遍后,加入适量0.25%胰酶-EDTA消化液置于37 ℃消化,显微镜下观察待消化完全后,加入等量完全培养基终止消化,收集细胞悬液于尖底离心管,300g离心10 min,弃上清。使用已配制好的冻存液重悬细胞沉淀并转移至冻存管,将冻存管置于冻存盒中,-80 ℃放置过夜,次日转移至液氮中保存。
细胞复苏时,取出液氮中的细胞冻存管,迅速置于37 ℃水浴摇晃直至液体融化,将细胞悬液转移至15 mL离心管中,补加5 mL常温完全培养基,混匀后,300g离心10 min,弃上清,用完全培养基重悬至5 mL,转移至25 cm2细胞瓶内,置于含5% CO2培养箱37 ℃培养。
1.2.6 Mhr的培养 取Mhr菌种按1∶9的比例接种于KM2液体培养基中,置于37 ℃细菌培养箱培养,待菌液由红色变为黄色时,收集菌液或继续按1∶9比例扩大培养,最终收获的Mhr菌液分装冻存于-80 ℃,测定滴度,用颜色变化单位(color change unit,CCU)表示,分装保存备用。
1.2.7 Mhr感染细胞 将细胞按1×105·mL-1浓度接种于96孔板中,培养至85%~90%融合后进行感染,设置未感染孔为对照组。取冻存的Mhr菌液,12 000g离心20 min,弃去上清,用含1% FBS的DMEM/F12培养基重悬菌体,调整浓度至108CCU·mL-1,按100 μL·孔-1接种于感染组细胞孔中。感染24 h后取出细胞培养板观察或进行下一步试验。感染及对照组均设置3个重复孔。
1.2.8 Mhr感染后细胞活力检测 Mhr感染24 h后,取出96孔板,吸取细胞上清后分装至离心管,并做好标记,400g离心5 min。分别取各孔的上清液70 μL,加入到新的96孔板相应孔中。将乳酸溶液、10 × INT 溶液、INT稀释液、酶溶液恢复至室温。按说明书避光配制LDH检测工作液,各孔分别加入35 μL的检测工作液并混匀,室温避光孵育30 min,然后于490 nm处测定吸光度。
2 结 果
2.1 细胞分离培养及形态学观察
取健康猪大网膜组织,采用0.1% Ⅰ型胶原酶消化分离猪原代PMC细胞。消化分离的原代细胞贴壁72 h后,使用倒置相差显微镜观察细胞形态,早期细胞密度低,细胞多伸展,呈拉网状生长(图1A);培养4~8 d后,细胞逐渐融合,融合后细胞呈多边形,大小较为一致,边缘不齐,似铺路石状(图 1B)。
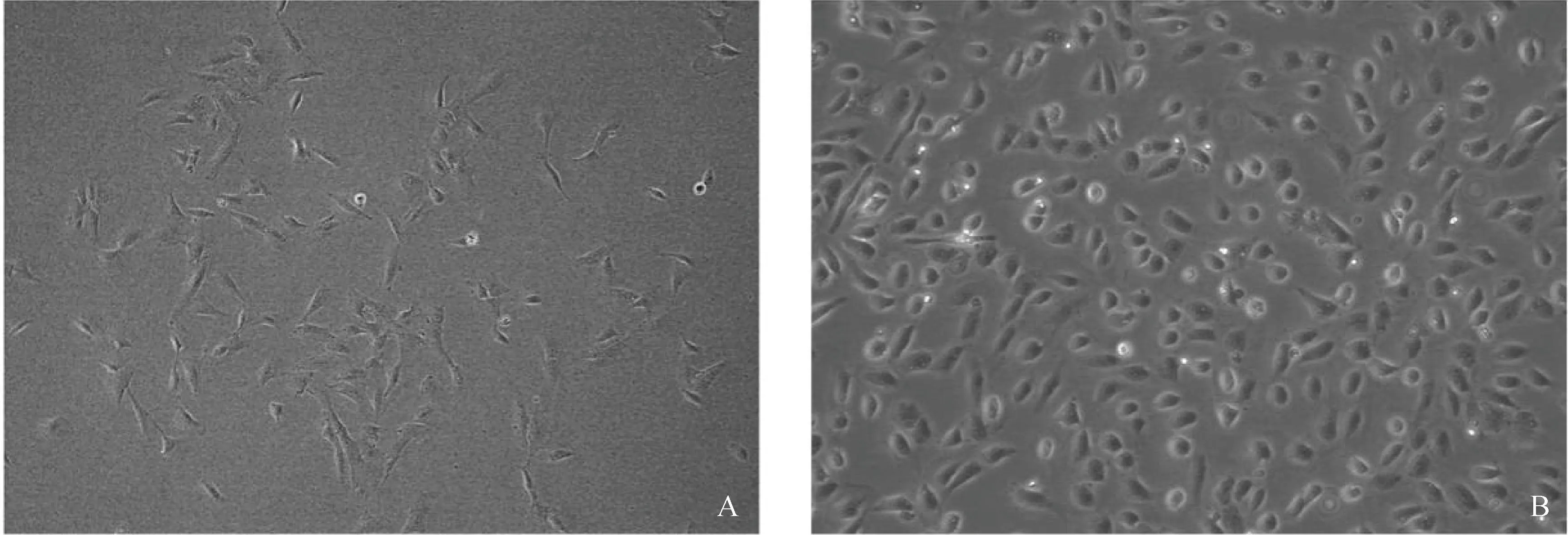
A. 培养早期的猪腹膜间皮细胞;B. 融合后的猪腹膜间皮细胞A. PMC cells in early culture stage; B. Confluent PMC cells
2.2 超微结构
利用扫描电镜对F2代细胞进行超微结构观察,结果如下图所示,电镜下细胞较为铺展,呈椭圆形或多角形,有核处细胞隆起较厚,细胞表面可见大量微绒毛(图2)。
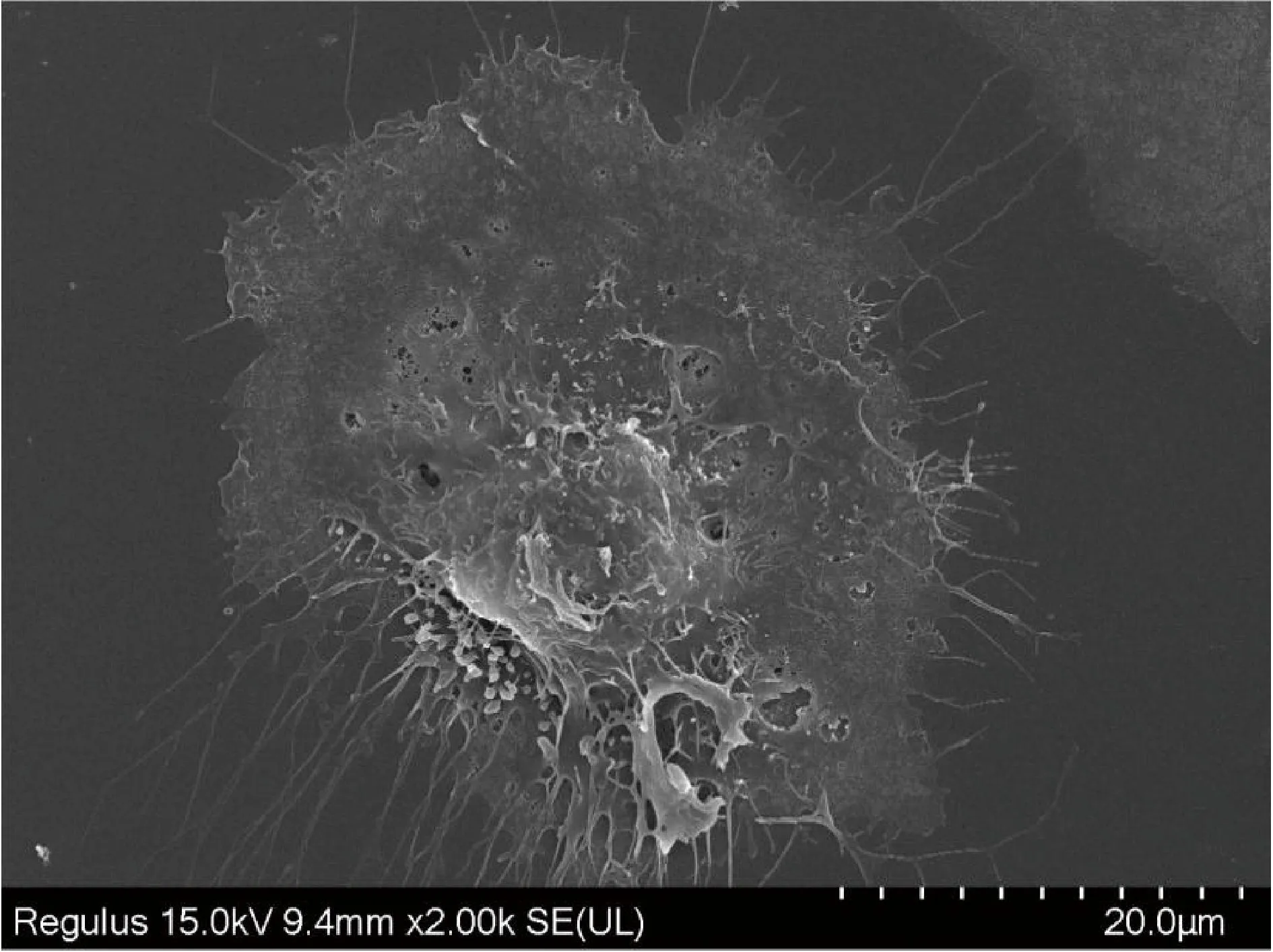
图2 扫描电镜下猪腹膜间皮细胞超微结构(2 000×)Fig.2 Ultrastructure of porcine peritoneal mesothelial cells under scanning electron microscopy (2 000×)
2.3 免疫荧光鉴定
对分离的F2代细胞进行特征性抗原的免疫荧光鉴定,结果显示,细胞角蛋白18抗原(图3A)和波形蛋白抗原(图3B)均呈阳性,符合PMC细胞特征;而第VIII因子相关抗原和CD45抗原呈阴性,由此排除了成纤维细胞、血管内皮细胞和白细胞。PMC细胞纯度可达95%。
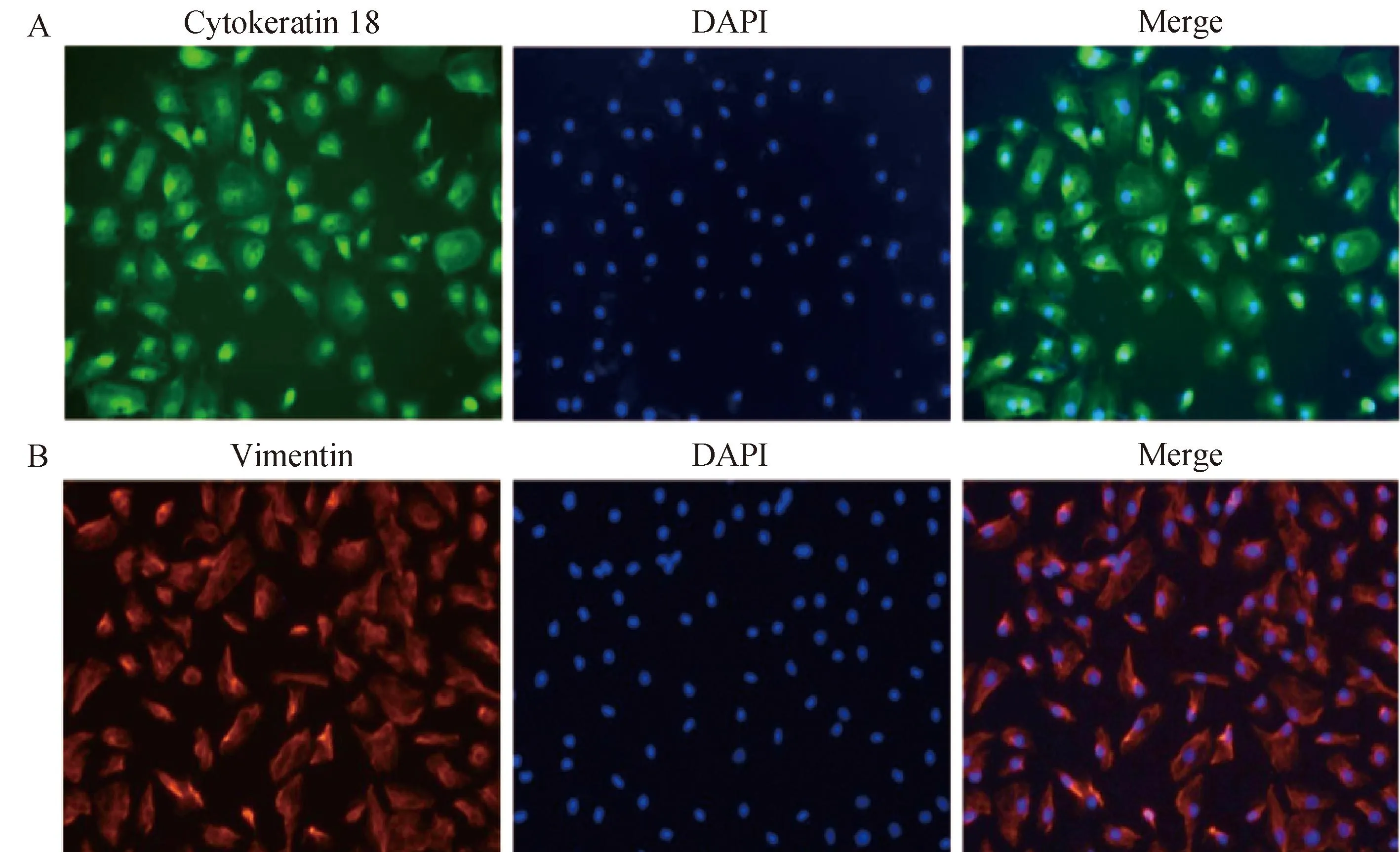
A. 角蛋白18;B. 波形蛋白A. Cytokeratin 18; B. Vimentin
2.4 传代培养
细胞传代培养2~3代时细胞贴壁率、生长速度和形态与初始原代细胞无明显差异,4~5代开始细胞贴壁率降低、生长增殖变缓,部分细胞膨大、变形,出现衰老现象。体外培养一般可维持到4~6代(图4)。
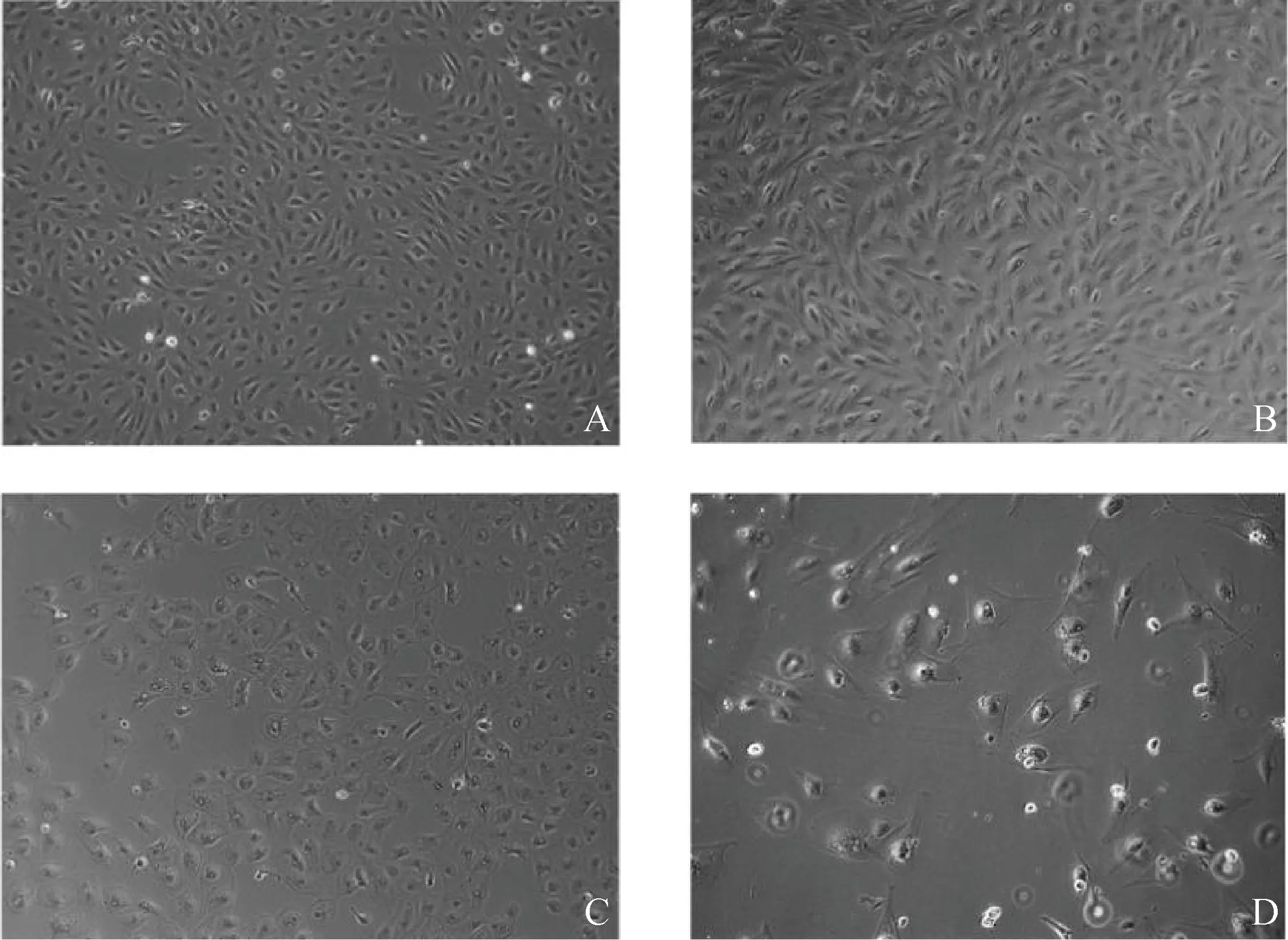
A.F2代;B.F3代;C.F5代;D.F6代A. Second generation; B. Third generation; C. Fifth generation; D. Sixth generation
2.5 细胞的冻存与复苏
细胞经冻存复苏后,细胞形态仍为典型的鹅卵石形,间皮细胞的纯度在90%以上。经冻存复苏后第6~7天生长至融合(图5)。
A.冻存细胞复苏后第2天;B.冻存细胞复苏后第6天A. The second day after resuscitation of the frozen cells; B. The sixth day after resuscitation of the frozen cells
2.6 Mhr感染诱导猪腹膜间皮细胞损伤
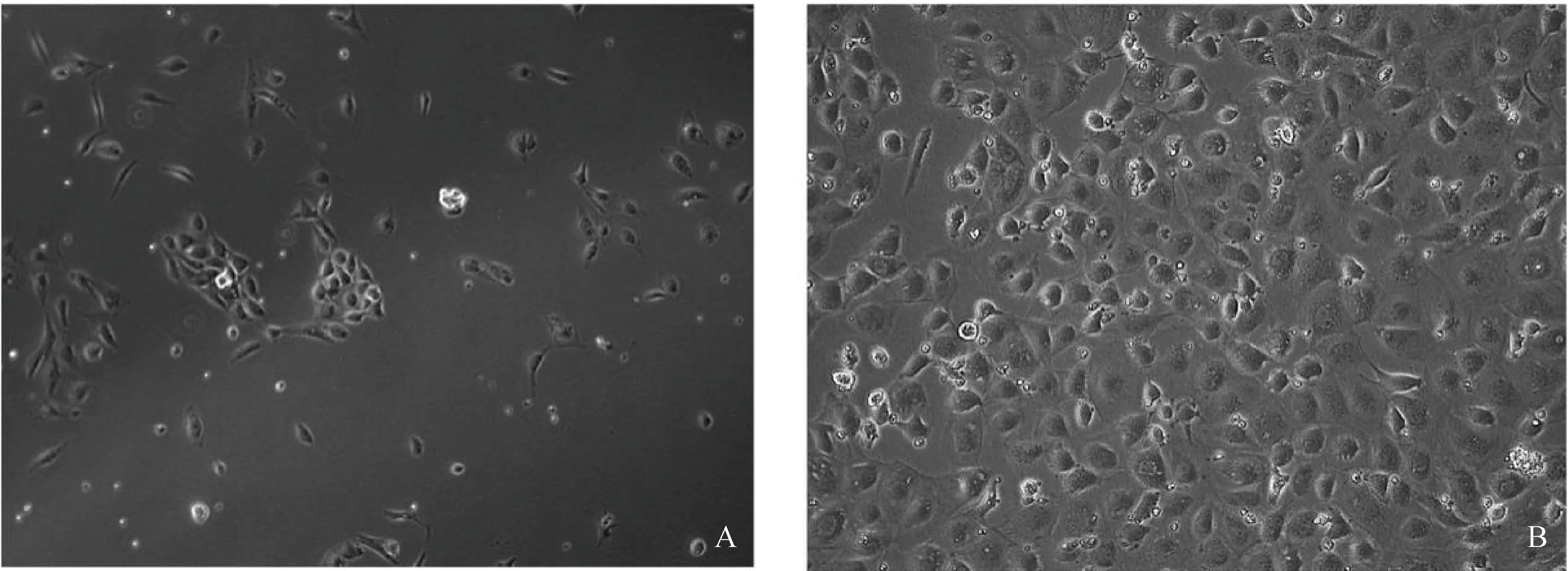
Mhr感染PMC细胞24 h后,光镜下可观察到感染组细胞发生明显皱缩(图6)。通过LDH试剂盒检测细胞LDH释放量,结果如图7所示,感染组细胞的LDH释放量较对照组细胞显着升高(P<0.01)。结果提示Mhr感染对PMC细胞有明显损伤作用。

A.感染细胞;B.对照细胞A.Infected cells;B.Control cells
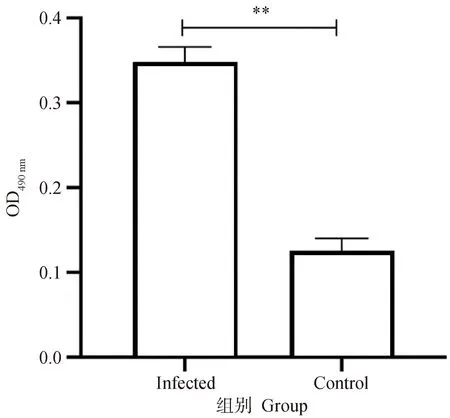
**.P<0.01
3 讨 论
间皮细胞是研究浆膜炎的主要靶细胞。大网膜是腹膜的最大褶皱,具有高密度的间皮细胞,每平方厘米的网膜组织中可提供一百万个左右的间皮细胞,能够获取相对较多的细胞,因此常用大网膜分离间皮细胞[13]。目前报道的人、大鼠、小鼠等动物的腹腔大网膜间皮细胞分离多用胰蛋白酶进行消化[14-16]。但在猪大网膜间皮细胞分离中,笔者发现胰酶消化法效果不稳定,时间难以控制,容易受到动物日龄和脂肪含量的影响,消化时间过短获得的细胞少,时间过长则易损伤细胞,或者增加成纤维细胞污染的概率,笔者改用Ⅰ型胶原酶消化,获得细胞得率和纯度更佳。
本研究结果显示,从大网膜消化的原代细胞在培养初期呈拉网状生长,不易与成纤维细胞区别,融合后才形成特殊的铺路石样外观,此时可与成纤维细胞明显区分开来,与人、大鼠等动物腹腔间皮细胞分离时的形态变化过程类似[17-18]。进一步对所分离细胞进行免疫荧光鉴定和扫描电镜鉴定,波形蛋白和角蛋白-18特征性抗原表达为阳性,细胞表面具有微绒毛,证实了笔者分离的细胞为猪原代PMC细胞。由此,本研究成功建立了猪大网膜PMC细胞的体外培养方法。
为提高培养成功率,在试验过程中需要注意以下问题:1)选用的试验猪日龄以3月内为宜。日龄过大的猪腹腔脂肪过多,大网膜是腹腔脂肪堆积的主要部位,过多的脂肪影响间皮细胞的消化,分离不易成功。2)处理组织时尽量摘除血管和脂肪组织,并多次清洗去除多余油脂,组织剪碎至1 cm2左右,组织过大与消化液接触面积不足,不利于充分消化,剪得过碎消化获得的细胞中成纤维细胞比例上升。3)根据最终获得的大网膜组织量,加入适量胶原酶消化,消化液体积以不低于组织体积的3倍为宜。消化液应提前预热,加入后充分分散组织,置于摇床中震荡消化。严格掌握消化时间,消化结束后及时终止,并充分振摇使细胞从组织碎片中释放出来。4)消化获得的细胞通过差速贴壁法去除成纤维细胞,贴壁时间以2 h左右为宜。5)合适的接种密度有利于细胞快速生长并提高细胞纯度。如果接种密度过低,细胞不但铺展速度慢,生长形态差,而且在间皮细胞的间隙处易出现成纤维细胞生长。根据笔者经验,猪原代PMC 细胞一般接种密度以2×105~5 × 105·mL-1为宜;6)F1代培养时避免换液过早。3 d内不宜挪动细胞,首次换液最好在第3~4天后进行。换液时动作轻柔,贴壁良好时可采用全换液,贴壁不佳时采用半换液。7)用明胶包被细胞瓶更有利于PMC细胞贴壁。8)试验使用细胞以1~3代为佳,4代以后细胞增殖活力下降,部分细胞形态出现老化现象,可能影响试验结果的准确性。
Mhr是临床上引起猪多发性浆膜炎的主要病原之一。本研究尝试将所分离的PMC细胞用于Mhr感染,结果发现Mhr感染后可造成PMC细胞形态发生明显的皱缩,细胞活性受损,提示PMC细胞对Mhr感染较为敏感,可成为后续Mhr诱导浆膜炎致病机制研究和疫苗、药物研究的良好细胞模型。
4 结 论
本研究采集猪大网膜组织,利用胶原酶消化法分离获得原代细胞,通过形态学和免疫学鉴定为猪PMC细胞,建立了简便、快捷的猪原代PMC细胞分离和体外培养方法。使用Mhr感染PMC细胞可观察到明显的细胞形态变化和LDH释放量的显着增加。



