高兴 王瑜
(1.宝鸡市眉县中医医院内三科,陕西 宝鸡 722300;2.渭南市富平县医院病理科,陕西 渭南 711700)
溃疡性结肠炎(UC)当前在临床上比较常见,也为一种慢性非特异性肠道炎症,在中老人中的发病率比较高[1]。当前UC的病因尚不十分清楚,也是经历了多因素、多阶段、多步骤的过程,涉及的发病机制非常复杂。环氧化酶-2(COX-2)又称前列腺素过氧化物合成酶,主要分布于内质网表达,在正常人体中的表达水平比较低,可促进前列腺素合成[2]。但是当机体发生炎症性病变时与肿瘤时,COX-2表达水平会显着提高,可阻碍宿主特异性抗原提呈细胞成熟,可促进肿瘤生长,可使得机体逃避免疫反应,导致患者病情恶化[3]。低氧诱导因子-1α(HIF-1α)的高表达可促进炎症因子的表达,可增加新生血管的形成,调控肿瘤细胞对缺氧的适应[4]。本文旨在探讨UC患者黏膜组织中HIF-1α,COX-2表达水平与患者预后的关系,现报告如下。
1 资料与方法
1.1 一般资料选取2020年2月至2022年2月在我院诊治的UC患者120例,其中男68例,女52例;年龄(51.58±3.20)岁;体质量指数(23.58±1.11)kg/m2;病程(3.29±0.14)年;心率(78.13±5.92)次/分;收缩压(125.59±10.14)mmHg;舒张压(74.59±5.39)mmHg;病变位置:左半结肠67例,直肠乙状结肠33例,全结肠20例。纳入标准:(1)符合UC的诊断标准;(2)年龄30~75岁;(3)无腹部手术史;(4)入院前1个月未使用促动力药物、止泻药物治疗;(5)临床资料完整;(6)具有手术病理检查的指征;(7)无腹部手术史的患者。排除标准:(1)妊娠与哺乳期妇女;(2)合并严重心肝肾异常的患者;(3)依从性不佳的患者;(4)患者为随机选择,无血缘关系;(5)存在化疗史、放疗史的患者。
1.2 方法
1.2.1 黏膜组织HIF-1α、COX-2表达检测取手术患者的病灶黏膜组织(黏膜组)与健康组织(健康组,距离病灶组织至少≥1 cm),免疫组织检测试剂盒购自福建迈新技术开发公司,抗HIF-1α抗体、抗COX-2抗体购自北京中杉金桥生物技术有限公司。将上述标本经10.0%福尔马林固定,脱水、浸蜡、包埋后制作4 μm切片,采用3.0%的过氧化氢室温孵育10 min左右,去除内源性的过氧化物酶,高温抗原修复10 min左右,二甲苯脱蜡后进行免疫组化染色,滴加HIF-1α抗体、抗COX-2抗体(抗体稀释度分别为1∶200、1∶500),阴性对照以磷酸盐缓冲液代替一抗,封片镜检。HIF-1α、COX-2都以细胞核内存在棕黄色颗粒为阳性,根据阳性细胞表达个数占比进行判定,阳性细胞表达个数比≤5.0%阴性(-),6.0%~25.0%弱阳性(+),26.0%~50.0%中度阳性(++),>50.0%强阳性(+++),(+)~(+++)判断为阳性。
1.2.2 调查资料记录所有患者的性别、年龄、病程、体质量指数、病变位置、收缩压、舒张压、心率等指标。所有患者随访到2023年4月1日,记录所有患者的预后情况,判定预后有效情况,有效判断标准:临床症状明显改善,无复发情况发生。
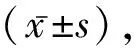
2 结 果
2.1 不同组别患者的HIF-1α、COX-2表达阳性率对比黏膜组的HIF-1α、COX-2表达阳性率为72.5%(87/120)、76.7%(92/120),健康组为18.3%(22/120)、20.8%(25/120)。黏膜组与健康组对比,HIF-1α、COX-2表达阳性率明显提高(χ2=71.013、74.863,P<0.05)。
2.2 预后情况所有患者随访到2023年4月1日,预后有效108例,有效率为90.0%。
2.3 不同预后患者的HIF-1α、COX-2表达阳性率对比预后有效患者的HIF-1α、COX-2表达阳性率为70.4%(76/108)、74.1%(80/108),预后无效患者为100.0%(12/12)、100.0%(12/12)。预后有效患者与预后无效患者对比,HIF-1α、COX-2表达阳性率明显降低(χ2=4.848、4.058,P<0.05)。
2.4 相关性分析在120例患者中,Spearman等级相关分析显示HIF-1α、COX-2表达水平与患者预后存在相关性(r=0.766、0.697,P<0.05)。
3 讨 论
现代研究[5]表明,UC的发病机制涉及肠黏膜屏障功能异常、免疫异常、遗传异常、环境异常等,且有一定的癌变倾向,为此加强早期诊治具有重要价值。HIF-1α是低氧诱导的转录因子,也是氧平衡调控的重要因子,可促使缺氧的组织细胞能保持耐受缺氧状态、氧稳态。HIF-1α可在肾脏、肝脏、肺脏、脑部等组织中广泛表达,其表达水平上升可促使血管内皮生长因子(VEGF)表达,可导致机体出现缺氧缺血性损伤。HIF-1α的高表达还可促进肿瘤细胞的增殖,增加肿瘤代谢,可促进肿瘤细胞增殖与生长。COX-2可以刺激肿瘤细胞释放前列腺素,可诱导血管生成,可促使内皮细胞迁移、细胞生长,诱导肿瘤血管形成[6]。本文结果显示,黏膜组的HIF-1α、COX-2表达阳性率较健康组明显提高(P<0.05),表明UC患者黏膜组织中可呈现HIF-1α、COX-2高表达状况。当前有研究表明表明HIF-1α可抑制机体的抗肿瘤免疫反应,在新生血管和转移灶的血管上也有表达。COX-2的高表达可为UC的发生提供调节作用,使远离血管间质的肿瘤细胞得以存活,从而参与UC的发生与发展[7]。
UC的病变位置主要位于大肠的黏膜与黏膜下层,由于UC的病情反复发作、迁延不愈,早期判断患者的预后具有重要价值[8]。本文结果显示,所有患者随访到2023年4月1日,预后有效108例,有效率为90.0%;预后有效患者的HIF-1α、COX-2表达阳性率与预后无效患者对比明显降低(P<0.05);Spearman等级相关分析显示,UC患者的黏膜组织HIF-1α、COX-2表达水平与患者预后存在相关性(P<0.05)。从机制上分析,HIF-1α在正常组织中呈现广泛性低表达表达,但是在UC呈现高表达状况。HIF-1α刺激内皮细胞和平滑肌细胞的增殖,可促进炎症因子的表达与血小板聚集,还参与血管重塑,导致患者预后恶化[9]。COX-2的高表达与受体结合后,可使核内的转录因子发生磷酸化,促进细胞有丝分裂,共同加快病情的发展,还可增加肿瘤的侵袭和肿瘤转移,可影响患者的预后[10]。
综上所述,UC患者黏膜组织中可呈现HIF-1α、COX-2高表达状况,预后相对比较好,HIF-1α、COX-2表达水平与患者预后存在相关性。由于本次研究调查没有纳入健康人群,调查人数比较少,预后判定的指标比较少,没有进行多因素分析,将在后续研究中探讨。
利益冲突说明/Conflict of Intetests
所有作者声明不存在利益冲突。
伦理批准及知情同意/Ethics Approval and Patient Consent
本研究通过宝鸡市眉县中医医院医学伦理委员会批准,患者均知情同意。



