王巍炜,洪志鹏,李高峰△,王绍佳,陈瑞彬,张继朋
(1.昆明医学院第三附属医院胸外科/云南省肿瘤医院肺癌研究中心 650118;2.昆明医学院第一附属医院胸外科 650032;3.昆明医学院第三附属医院妇科肿瘤科 650118)
宣威地区一直是西南、乃至全国的肺癌高发地区,其发病率和病死率一直高居不下,肺癌防控面临着严峻的挑战。前期研究发现宣威地区肺腺癌患者中survivin高表达,研究人员利用survivin反义核苷酸(ASODN)抑制宣威肺腺癌细胞取得了较好的效果[1-2]。在前期研究基础上本研究采用体外培养宣威肺腺癌细胞XWLC-05细胞皮下接种法,在裸鼠体内建立皮下宣威肺腺癌细胞XWLC-05细胞移植瘤模型。通过皮下移植瘤内多点注射,观察survivinASODN对肺癌移植瘤生长影响的情况,为下一步临床研究提供实验室依据。
1 材料与方法
1.1 survivinASODN的合成和主要试剂 参照文献[3]针对位于survivinmRNA 232~251bp处的序列,合成ASODN:5′-CCC AGC CTT CCA GCT CCT TG-3′和 正 义 寡 核 苷 酸(SODN):5′-CAA GGA GCT GGA AGG CTG GG-3′。序列两端碱基经硫代修饰对抗核酸酶的降解,经计算机网上检索证实与survivin以外的己知人类基因无同源性。序列由上海生物
1.7 统计学处理 采用SPSS16.0统计软件包处理数据。计量数据均以±s表示。各组间比较应用方差分析最小显着差法(F检验,α=0.05),以P<0.05为差异有统计学意义。
2 结 果
2.1 4组裸鼠一般情况 整个实验期间4组裸鼠未出现死亡,大、小便及饮食情况正常,活动度等未出现其他明显的异常情况。处死后对各组裸鼠心脏、肝脏、肾脏进行病理检查均没有发现明显变性坏死表现。
2.2 裸鼠肿瘤的体积及生长指数变化情况 survivinASODN治疗组其肿瘤生长速度较为缓慢,其中部分裸鼠表现为肿瘤停止生长,甚至其中3只出现肿瘤退缩消失。治疗结束后survivinASODN注射组瘤体的肿瘤大小明显低于其他3组,而其他3组相似。survivinASODN治疗组肿瘤生长指数为(2.78±0.27),远远低于对照组(5.71±0.31)、LIP组(6.21±0.23)和survivinSODN组(5.69±0.37),见图1。
2.3 裸鼠肿瘤的质量变化及抑瘤率情况 末次survivinASODN注射后第2周以脱臼法断颈处死所有荷瘤裸鼠,提取肿瘤并且称取质量。可以发现survivinASODN注射组瘤体的肿瘤质量为(1.06±0.04)g,低于对照组(2.22±0.03)g、LIP组工程公司帮助合成。细胞培养采用RPMI-1640培养基(Gibeo公司);新生小牛血清采用杭州四季青生物公司产品。
1.2 细胞培养 选取云南宣威肺腺癌细胞株XWLC-05,由昆明医学院第一附属医院临床医学实验研究中心提供。将其于-80℃冰箱中将保存后取出、后培养、传代,最后将处于对数生长期的细胞进行实验。
1.3 移植瘤裸鼠模型的建立 4~6周龄BALB/C裸小鼠,体质量18~22g,雌、雄均可,购于昆明医学院动物中心,饲养于SPF级无菌饲养室,自由摄取食物和水。采用培养细胞皮下接种移植法。对XWLC-05细胞常规传代培养1个月左右,于接种当日收集大量的培养细胞后,立即接种,接种细胞数量为2.0×106(约0.5mL悬液),用1mL注射器将单细胞悬液注射于裸鼠左前腋侧皮下。
1.4 实验分组及survivinASODN注射 将一批实验用裸鼠接种后至肿瘤最长径达8~10mm时,随机挑选其中48只,随机分4组,每组12只。对照组:予生理盐水处理;单纯脂质体转染(LIP)组:予等量的脂质体转染液处理;survivinSODN组:予600nmol/L survivinSODN 脂质体复合物处理;survivinASODN组:予600nmol/L survivinASODN脂质体复合物处理。各组分别于成瘤分组后每隔48h按直接移植瘤内多点注射1次,共注射5次。
1.5 XWLC-05裸小鼠皮下移植瘤体积、质量及肿瘤生长抑制率的测定 分别于每次注射前用游标卡尺测量肿瘤最长径和最短径,并称体质量。于末次survivinASODN注射后第2周以脱臼法断颈处死所有荷瘤裸鼠,取移植瘤测量肿瘤最长径(a)和最短径(b),按公式v=ab2/2计算肿瘤体积,计算肿瘤生长指数:(V治疗后-V治疗前)/V治疗前。称取瘤结节质量,以瘤结节质量计算抑瘤率:抑瘤率(%)=(对照组质量-实验组质量)/对照组质量×100%。
1.6 一般状况观察及组织学检查 观察包括裸鼠的饮食、大小便、精神状况等。处死裸鼠后标本固定后,留取心脏、肝脏、肾脏和肿瘤组织用4%多聚甲醛固定后在光镜下观察肿瘤细胞坏死、凋亡、炎症反应等改变。(2.61±0.04)g和survivinSODN 组(2.69±0.05)g,survivin ASODN抑瘤率为(37.26±1.92)%,见图2。

图1 survivinASODN转染对裸鼠移植瘤肿瘤生长指数的影响
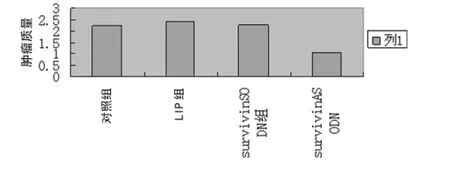
图2 survivinASODN转染对裸鼠移植瘤肿瘤质量的影响
2.4 survivinASODN转染对裸鼠肿瘤组织的影响 对照组、LIP组和survivinSODN组细胞体积大,大小不等,胞浆丰富,胞核大,深染,核分裂相多见,偶见瘤巨细胞。而survivinASODN处理组XWLC-05细胞形态与其他3组相似,但瘤组织中有大量的细胞坏死灶,结缔组织增生,炎症细胞浸润明显。
3 讨 论
survivin基因是在人类基因组文库中筛选克隆出IAP家族的一个新成员,在多种肿瘤中均有表达[4-5]。前期研究表明,和其他肿瘤细胞中情况相似[6-7],通过对特定靶向基因的survivin的反义抑制,可以影响其基因、蛋白的表达,可抑制宣威肺腺癌细胞XWLC-05增殖并诱发其凋亡,从而抑制其生长[8]。本研究采用动物实验的方法进一步研究survivinASODN对小鼠宣威肺腺癌转移瘤的干预作用。采用反义技术,针对survivin基因232~251bp处的序列,合成反义寡核苷酸,并且采用脂质体包裹、硫代磷酸修饰后将其直接多点注射于宣威肺腺癌细胞XWLC-05裸鼠皮下移植瘤内。肉眼观察发现survivinASODN组的肿瘤生长比较缓慢,其中部分裸鼠表现为肿瘤生长缓慢或者停止生长,甚至其中3只裸鼠出现肿瘤退缩消失。测量结果也显示survivinASODN组瘤体生长指数(2.78±0.27)低于与对照组、LIP组和survivnSODN组。处死所有荷瘤裸鼠称取其肿瘤质量。可以发现survivinASODN注射组瘤体的肿瘤质量为(1.06±0.04)g,低于其他3组,其抑瘤率高达(37.26±1.92)%。显微镜下观察显示,ASODN组液化坏死灶增多,凋亡细胞增加。提示,survivinASODN对宣威肺腺癌细胞XWLC-05裸鼠移植瘤产生了明显的抑制作用,结合相关研究和本研究结果推测可能是由于survivinASODN干扰survivin的表达或抑制其功能的发挥,从而抑制有丝分裂并促进自发细胞凋亡,使肿瘤生长速度延缓,瘤体质量减轻[9-10]。整个实验过程中4组裸鼠均没有出现死亡,大小便及饮食情况没有发现明显异常,处死后各组裸鼠心脏、肝脏、肾脏均没有发现明显变性、坏死表现。提示脂质体、反义核酸对于裸鼠是安全的,这可能由于survivin仅特异性地表达于肿瘤组织[11-12],而survivinASODN治疗具有良好的靶向性、特异性,其对正常组织影响较小。
survivinASODN处理宣威肺腺癌细胞裸鼠肺癌细胞XWLC-05移植瘤后,肿瘤的生长明显受到抑制,未出现明显不良反应,提示在宣威肺腺癌中采用反义核苷酸治疗是安全、可行的[13-15],为下一步临床治疗提供了思路和实验室资料。
[1] Wang WW,Li GF,Hong ZP.The effect of the exression of Survivin antioligonucleotide on the apoptosis of Xuanwei lung adenocarinome cell[J].Chinese-German Journal of Clinical Oncoloy,2011,10(5):252-255.
[2] 王巍炜,李高峰,洪志鹏,等.宣威昆明两地区肺腺癌中survivin表达的比较研究[J].医学研究杂志,2010,39(7):61-62.
[3] 1saka T,Maruno M,Nakata H,et al.Effeetiveness of spray application of ACNU in the local of malignant gliomas:report of two case[J].Neurol Res,2002,22(2):181-184.
[4] 邓开,王洪林.survivin基因在肿瘤中的研究进展[J].重庆医学,2008,37(10):1111-1113.
[5] 刘敏,李萍,兰显国,等.Survivin和VEGF在涎腺腺样囊性癌中的表达及临床意义[J].重庆医学,2010,39(10):1231-1232.
[6]Semenza GL.Regulation of Oxygen Homeostasis by Hypoxia-Inducible Factor 1[J].Physiology,2009,24(2):97-106.
[7] 李玉华,宫向前,邢建华,等.Survivin反义核酸对大肠癌HT229细胞化疗的影响[J].中华肿瘤防治杂志,2006,13(21):1620-1622.
[8] Shen C,Duck A,Polat B,et al.Triplex forming cligodeoxy-nucleotides targeting Survivin inhibitor proliferation and induce apoptosis of human lung carcinomar cells[J].Cancer Gene Ther,2003,10(5):403-410.
[9] 王志成,王海霞,郭德玉,等.survivin反义核酸抑制胶质瘤细胞增殖的实验研究[J].重庆医学,2008,37(22):2570-2574.
[10]Shen C,Duck A,Polat B,et al.Triplex forming cligodeoxy-nucleotides targeting Survivin inhibitor proliferation and induce apoptosis of human lung carcinomar cells[J].Cancer Gene Ther,2003,10(5):403-410.
[11]Tanaka K,Iwamoto S,Gon G,et al.Expression of survivin and its relationship to loss of apoptosis in breast carcinomas[J].Clin CancerRes,2000,6(1):127.
[12]Falleni M,Pellegrinii C,Marchetti A,et al.Survivin gene ex-pression in early stage non small cell lung cancer[J].J Pathol,2003,200(5):620-626.
[13]Lehner R,Bobak J,Kim NW,et al.Localization of telomerasehtert protein and Survivin in placenta:relation to placental development and hydatidiform mole[J].Obstet Gynecol,2001,97(6):965-970.
[14]孙顶,蔡建明,祝宝让,等.STAT3反义寡核苷酸对人肺腺癌裸鼠移植瘤生长的抑制作用[J].第二军医大学学报,2011,32(1):76-79.
[15]Sah NK,Khan Z,Khan GJ,et al.Structural functional and therapeutic biology of Survivin[J].Cancer Lett,2006,244(2):164-171.



