余永程,杨华荣,郑江环,宁丽洁,伍国锋
(1.贵阳医学院第二附属医院神经内科,贵州凯里 556000;2.贵阳医学院附属医院神经内科,贵阳 550004)
高血压性脑出血(hypertensive intracranial hemorrhage,ICH)继发的脑损伤会导致患者死亡或出现严重的功能障碍。国内外研究结果表明,ICH继发的脑损伤与血凝块体积、脑组织暴露于出血中的时间有直接关系,因此必须尽早清除血肿[1-2],微创治疗需要在尽可能减少手术侵入性操作对脑组织损伤的基础上最大限度清除血肿[1,3-7]。弥散张量成像(diffusion tensor imaging,DTI)是近年发展的一种可用于评估脑血管患者运动功能恢复情况的有效工具,但是采用DTI评估ICH治疗的报道只有1例[8]。本文采用DTI技术测定皮质脊髓束,以用于准确评估最小侵入操作清除颅内血肿和保守治疗的不同效果。
1 资料与方法
1.1 一般资料 2010年1月至2011年4月连续选取在急性脑出血症状发作24h内就诊的75例基底节出血患者(表1),通过头颅CT证实诊断基底节出血,出血量(30~50)mL,出血量用Tada公式计算:[π/6×血肿长度(cm)×血肿宽度(cm)×血肿高度(cm)];所有患者均有高血压病史,症状表现为突发一侧肢体麻木无力,部分患者呕吐,入院时没有严重的并发症,从发病到治疗时间为6~12h。
入院后患者被随机分为药物治疗组(MT组)和微创治疗组(MI组),两组患者在出血量、出血分布、神经功能缺损评分以及其他因素(性别、年龄、血压、发病到治疗干预的时间窗)等方面差异无统计学意义(P>0.05)。两组患者均接受了标准的药物处理流程,包括镇静、止血、脱水、降颅压。

表1 微创组及药物治疗组一般情况
1.2 方法
1.2.1 材料 立体定向仪(中国陕西西安威盛医疗器械有限公司生产),微型颅骨电钻,LY-1型血肿粉碎穿刺针(包括针体、塑料针芯、冲洗导管、引流导管、高压喷射冲洗装置,由中国北京万特福有限公司友情提供),硅胶注射器和普通手术器械。
1.2.2 立体定向微创技术清除基底节血肿 患者术前头皮备皮,安装头部定位框架后进行头颅CT扫描,取仰卧位,选择最大CT扫描血肿层面,在该血肿层面的轴面、矢状面和横断面确定避开危险结构的穿刺轨迹。
患者采用局部麻醉,在立体定向仪的指引下,用颅骨电钻驱动直径3mm穿刺针穿破颅骨,缓慢插入基底节血肿区,退除针芯,用10mL空针与穿刺针引流导管相连抽吸液态血肿,抽吸量为总出血量的1/3,用无菌生理盐水高压喷射清洗血肿腔2~3次,待冲洗液清亮后用1mL(5000U)尿激酶注入血肿腔溶解凝固的血肿,闭管30min后开管让血液自动流出。术后患者转入重症监护病房,3~5d再次复查头颅CT,如血肿完全或接近完全清除后拔出穿刺针。用绷带包扎伤口,术前术后肌注青霉素预防颅内感染。
1.2.3 DTI 入院时及术后2周进行DTI检查,评估感兴趣区(ROI)平均微小各异性值(FA)值,标准的ROI大小包含锥体束通路,设置在10~15三维像素之间,FA值通过纤维束追踪软件进行测量(张量模块函数工具,版本3.1.22,美国威斯康星密尔沃基通用电器医疗公司生产)。DTI数据处理将DEC成像和CST成像进行重组,测定MI组出血侧内囊CST的FA值并与MT组对照,患者健侧大脑半球内囊CST的FA值作为正常对照值。
根据FA成像的连续切片及三维白质束纤维成像,CST完整性分为1~4级。0级:纤维完全中断,白质纤维在多个层面消失;1级:纤维大部分中断,白质纤维数量小于健侧的1/3;2级:纤维部分中断,白质纤维数量是对侧的1/3~2/3;3级:纤维大部分或完全连续,白质纤维数量超过对侧的2/3;4级:正常。
1.2.4 神经功能评分 采用改良的国立卫生研究院中风量表(NIHSS)及自理能力恢复情况进行评分,改良后的卒中量表仅考虑运动障碍,分别于入院时、术后3和6周进行评分。
1.2.5 生活自理能力分级 根据疗效标准,将患者的生活自理能力分为5级。Ⅰ级:能够独立进行日常生活和工作;Ⅱ级:能够完成一部分日常生活,但是工具性日常生活需要部分依赖别人;Ⅲ级:日常生活和工具性日常生活都需要部分依赖别人;Ⅳ级:基本的日常生活和工具性正常生活都需要依赖别人;Ⅴ级:基本日常生活和工具性日常生活全部依赖别人或者死亡。
1.3 统计学分析 用SPSS15.0软件分析数据,计量资料用表示。用ANOVA对整个时间序列中MT组、MI组及正常对照值之间进行比较,采用t检验,以P<0.05为差异有统计学意义,对MT组和MI组患侧术前及术后CST纤维特征和平均FA值进行比较,同时比较NIHSS神经功能障碍评分。
2 结 果
2.1 清除血肿情况 MI组入院时基底节出血量为(38.2±3.2)mL,术后第3天基底节血肿量为(3.5±2.5)mL(图1);MT组患者出血量无明显变化,表明微创手术能成功地清除基底节血肿。MT组及MI组未观察到再出血情况,这可能与样本量小有关。MI组出现1例轻微颅内感染,经头孢曲松钠治疗后好转。
2.2 微创清除基底节区血肿后DTI变化 入院时观察到内囊CST显着损害,两组患者患侧内囊FA值均明显低于健侧,两组比较差异无统计学意义(P>0.05)。术后2周,MI组患者内囊CST的FA值与入院时及与MT组比较明显增加并接近正常值,见表2。
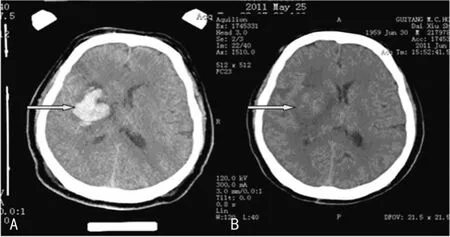
图1 微创组治疗前后CT变化
表2 微创手术清除基底节血肿后皮质脊髓束部分FA值变化()
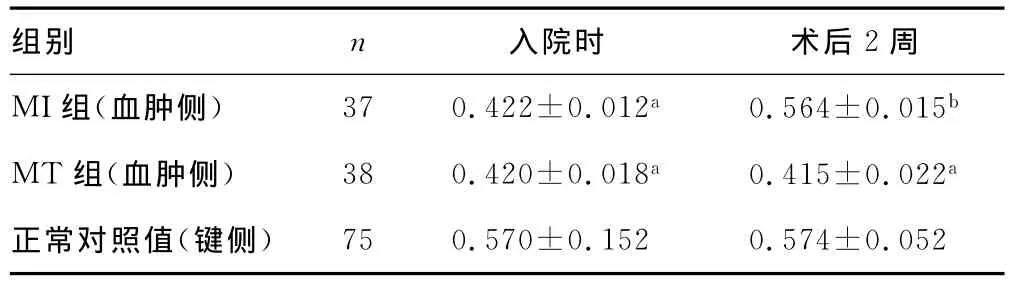
表2 微创手术清除基底节血肿后皮质脊髓束部分FA值变化()
a:P<0.05,与正常对照值比较;b:P<0.05,与 MT组比较。
组别 n 入院时 术后2周MI组(血肿侧) 37 0.422±0.012a 0.564±0.015b MT组(血肿侧) 38 0.420±0.018a 0.415±0.022a正常对照值(键侧)750.570±0.152 0.574±0.052
CTS示踪成像显示:与健侧相比,患侧CTS纤维中断、变形和/或扭曲,MI和MT组CST纤维数量小于健侧内囊纤维的1/3(图2A,图3A)。入院后2周,MI组内囊纤维数量恢复超过健侧纤维数量的2/3(图3B),而 MT组几乎无变化(图2B)。
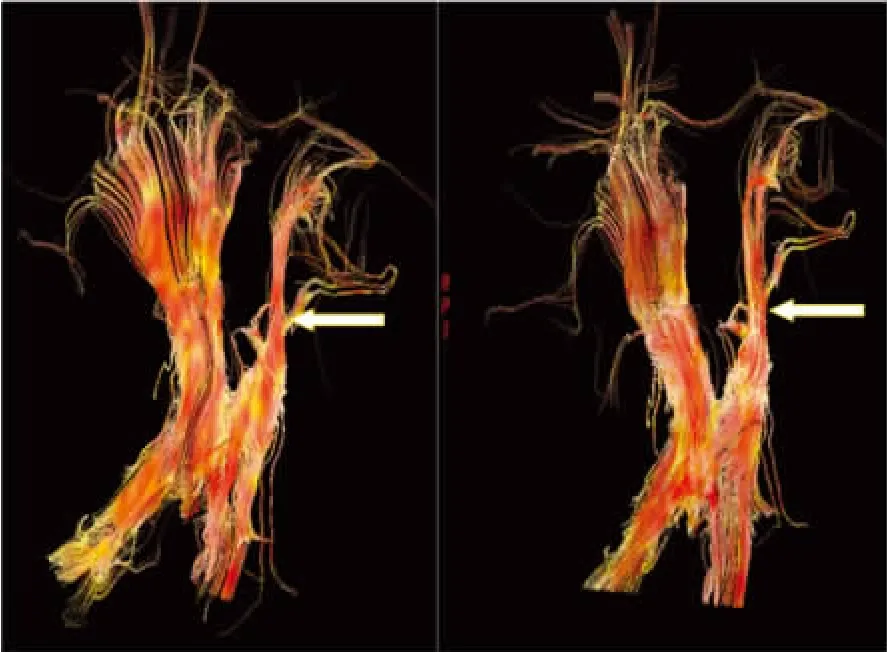
图2 药物治疗组治疗前后患侧内囊皮质纤维束变化不明显,箭头所示意

图3 微创治疗组治疗前后患侧内囊皮质纤维末比较,治疗内囊皮质神经纤维束明显增加,箭头所示意
2.3 神经运动功能变化和生活自理能力恢复比较 术后3周,MI组患者患肢肌力增加了(0.7±0.5)~(2.5±0.3)级;术后6周患肢平均肌力进一步增加(3.8±0.4)级。入院时MT组与MI组NIHSS评分无明显差异,MI组基底节血肿清除术后3及6周,NIHSS评分与入院时及MT组比较明显下降(表3),表明微创手术清除基底节血肿减少了神经系统的功能损害。MT组的NIHSS评分在基底节出血后3及6周较入院时也有下降,但神经功能评分减少的程度明显不如MT组。
从表4中可以看出,MI组患者生活自理能力恢复情况显着优于MT组,差异具有统计学意义(P<0.05),表明微创手术减少了对ICH患者的脑组织损伤,有利于患者生活自理能力的恢复。
表3 基底节出血患者微创术后NIHSS评分()
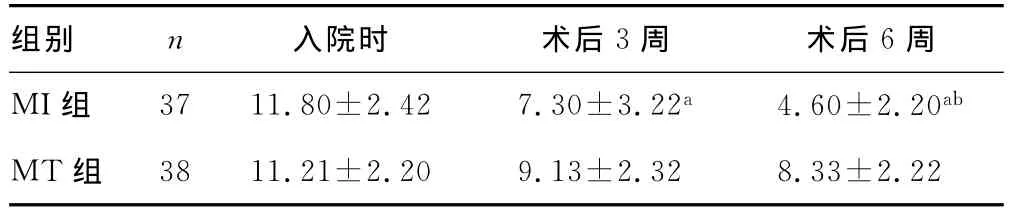
表3 基底节出血患者微创术后NIHSS评分()
a:P<0.05,与入院对照值比较;b:P<0.05,与 MT组比较。
组别 n 入院时 术后3周 术后6周MI组 3711.80±2.42 7.30±3.22a 4.60±2.20ab MT组3811.21±2.20 9.13±2.32 8.33±2.22

表4 微创手术术后生活自理能力恢复情况统计表[n(%)]
3 讨 论
高血压性脑出血的病死率及致残率都很高,有关其治疗模式和预后效果评估的探讨对临床诊治具有十分重要的意义。由于出血主要分布在基底节区,选择基底节区出血的病人为研究对象具有现实意义,结果表明:(1)微创颅内血肿清除术能够尽快清除血肿,减少对脑组织的损害,相对于保守治疗能够显着改善ICH预后;(2)微创治疗操作简便,仅需局部麻醉,需要设施设备是基层医院常规具备,便于在基层医院推广,能够在第一时间对ICH患者实施求助;(3)微创手术配合CT立体定位,可以有效避开大血管和重要功能区,减少对大脑组织和血管的进一步伤害,提高了手术及预后的效果;(4)DTI作为测定脑白质功能的技术,通过DTI示踪技术[9-10]测定FA数值来判断颅内出血病人的运动功能价值是有效可靠的,其结果与NIHSS评分结果和术后生活自理能力恢复情况是一致的;(5)通过DTI观察微创手术的结果表明,脑出血发病后2周,药物治疗组CST仍然被血肿压迫和移位,微创组的血肿侧内囊与药物治疗组比较,CST的FA值显着增加,差异有统计学意义,其血肿侧内囊纤维大部分或完全恢复到正常位置,表明DTI作为一个调节人类运动功能大脑白质有用的可视化工具,尤其是皮质脊髓束,可用于有效预测微创血肿清除术治疗ICH患者的预后[9-11]。
总之,ICH患者应用微创颅内血肿清除术简便有效,应用DTI示踪技术可以作为一种客观评价微创效果的可视化技术。
[1]Morgan T,Zuccarello M,Narayan R,et al.Preliminary findings of the minimally-invasive surgery plus rtPA for intracerebral hemorrhage evacuation(MISTIE)clinical trial[J].Acta Neurochir Suppl,2008,105:147-151.
[2]Mendelow AD,Gregson BA,Fernandes HM,et al.Early surgery versus initial conservative treatment in patients with spontaneous supratentorial intracerebral haematomas in the International Surgical Trial in Intracerebral Haemorrhage(STICH):a randomised trial[J].Lancet,2005,365(9457):387-397.
[3]Gazzeri R,Galarza M,Neroni M,et al.Minimal craniotomy and matrix hemostatic sealant for the treatment of spontaneous supratentorial intracerebral hemorrhage[J].J Neurosurg,2009,110(5):939-942.
[4]Miller CM,Vespa P,Saver JL,et al.Image-guided endoscopic evacuation of spontaneous intracerebral hemorrhage[J].Surg Neurol,2008,69(5):441-446.
[5]Y Nievas MC,Toktamis S,Haas E,et al.Benefits of adapting minimal invasive techniques to selected patients with spontaneous supratentorial intracerebral hematomas[J].Neurol Res,2005,27(7):755-761.
[6]Carviy Nievas MN,Haas E,Höllerhage HG,et al.Combined minimal invasive techniques in deep supratentorial intracerebral haematomas[J].Minim Invasive Neurosurg,2004,47(5):294-298.
[7]Kim IS,Son BC,Lee SW,et al.Comparison of framebased and frameless stereotactic hematoma puncture and subsequent fibrinolytic therapy for the treatment of supratentorial deep seated spontaneous intracerebral hemorrhage[J].Minim Invasive Neurosurg,2007,50(2):86-90.
[8]Hsieh CT,Chen CY,Chiang YH,et al.Role of diffusion tensor imaging in a patient with spontaneous intracerebral hematoma treated by stereotactic evacuation[J].Surg Neurol,2008,70(1):75-78.
[9]Yoshioka H,Horikoshi T,Aoki S,et al.Diffusion tensor tractography predicts motor functional outcome in patients with spontaneous intracerebral hemorrhage[J].Neurosurgery,2008,62(1):97-103.
[10]Cho SH,Kim SH,Choi BY,et al.Motor outcome according to diffusion tensor tractography findings in the early stage of intracerebral hemorrhage[J].Neurosci Lett,2007,421(2):142-146.
[11]Yokoyama K,Matsuki M,Shimano H,et al.Diffusion tensor imaging in chronic subdural hematoma:correlation between clinical signs and fractional anisotropy in the pyramidal tract[J].AJNR Am J Neuroradiol,2008,29(6):1159-1163.



