苏庸春,管贤敏,温贤浩,于 洁,宪 莹,肖剑文,徐红珍
(重庆医科大学附属儿童医院血液科 400014)
随着针对儿童白血病各种化疗方案的持续改进及干细胞移植的广泛开展,儿童恶性血液病尤其白血病的治疗效果有了明显的提高,但伴随着强烈化疗的开展及免疫抑制治疗在干细胞移植后的长期应用,在治疗过程中或治疗后粒细胞缺乏阶段,继发侵袭性真菌感染的患儿却明显上升[1],并成为导致最终治疗失败的重要原因之一。在对深部真菌感染时抗真菌药物的选择上,有效性、安全性及尽可能小的交叉耐药性与药物相互作用是应首先考虑的因素。米卡芬净是新近上市的一种棘白菌素类抗真菌药,已经在欧洲及美国被推荐用于儿童抗真菌感染的治疗[2]。本文作者以米卡芬净经验性治疗75例儿童恶性血液病、原发性免疫缺陷病及干细胞移植患儿继发肺部真菌感染,总结米卡芬净治疗儿童肺侵袭性真菌感染的疗效与不良反应,现报道如下。
1 资料与方法
1.1 一般资料 75例患儿中,男30例(40%),女45例(60%);中位年龄34个月(11~160个月),平均体质量16.5 kg(8~50kg)。75例患儿中,急性淋巴细胞白血病37例(49.3%),急性髓细胞白血病21例(28.0%),再生障碍性贫血6例(8.0%),原发性免疫缺陷病6例(8.0%),噬血淋巴组织细胞增生症5例(6.7%)。63例(84.0%)患者接受了持续化疗,10例(13.3%)患者行干细胞移植(其中,脐血干细胞移植9例,同胞异基因骨髓干细胞移植1例),2例(2.7%)行免疫调节治疗。
1.2 病例选择标准 所有病例均在化疗或干细胞移植后免疫抑制剂使用过程中并发较重的肺侵袭性真菌感染,或前期应用口服抗真菌药防治过程中出现肺部病变加重,达到侵袭性深部真菌感染不同程度诊断标准[3]。其中,7例患儿正在口服伊曲康唑,9例患儿正在口服伏立康唑,12例患儿在正应用静脉脂质体二性霉素B治疗中,共计28例患儿由于肺部感染加重换用米卡芬净静脉治疗。
1.3 方法 开始应用米卡芬净时即停用其他抗真菌或预防真菌药;米卡芬净剂量2.5~5mg·kg-1·d-1,静脉滴注,持续1h以上,每天1次,14d为1个疗程,根据临床症状体征及肺部影像学情况换用其他抗真菌药;未采用联合抗真菌治疗策略。
1.4 临床疗效及安全性评价 治疗前后行血、尿常规,肝肾功能及胸部高分辨率CT检查,治疗前行痰培养、G试验、GM试验寻找病原学依据;治疗期间详细观察症状、体征及有关实验室检查,并记录有无不良反应及对症处理。根据卫生部1993年颁发的抗菌药物临床研究指导原则,按痊愈、显效、进步、无效4级进行临床疗效判断,前2级合计为有效并计算有效率。
1.5 统计学处理 采用χ2检验对米卡芬净在不同危险因素及基础疾病,以及基础治疗方法间的疗效进行比较,以P<0.05为差异有统计学意义。
2 结 果
2.1 米卡芬净应用情况 75例应用米卡芬净治疗的儿童肺侵袭性真菌感染病例中,均有咳嗽至少1周以上常规抗感染治疗无效,经胸部高分辨率CT检查有斑片影、广泛渗出性病变或毛玻璃样改变;有55例同时符合粒细胞缺乏伴发热诊断,用米卡芬净治疗前粒细胞缺乏时间平均11.3d(中位数12d)。其中,达到确诊标准的6例(8.0%);达到临床诊断标准的47例(62.7%);达到拟诊诊断标准的22例(29.3%)。米卡芬净平均使用剂量为3.8mg·kg-1·d-1,治疗时间平均18d(14~28d);初始治疗及治疗过程中至治疗结束均未调整剂量,见表1。
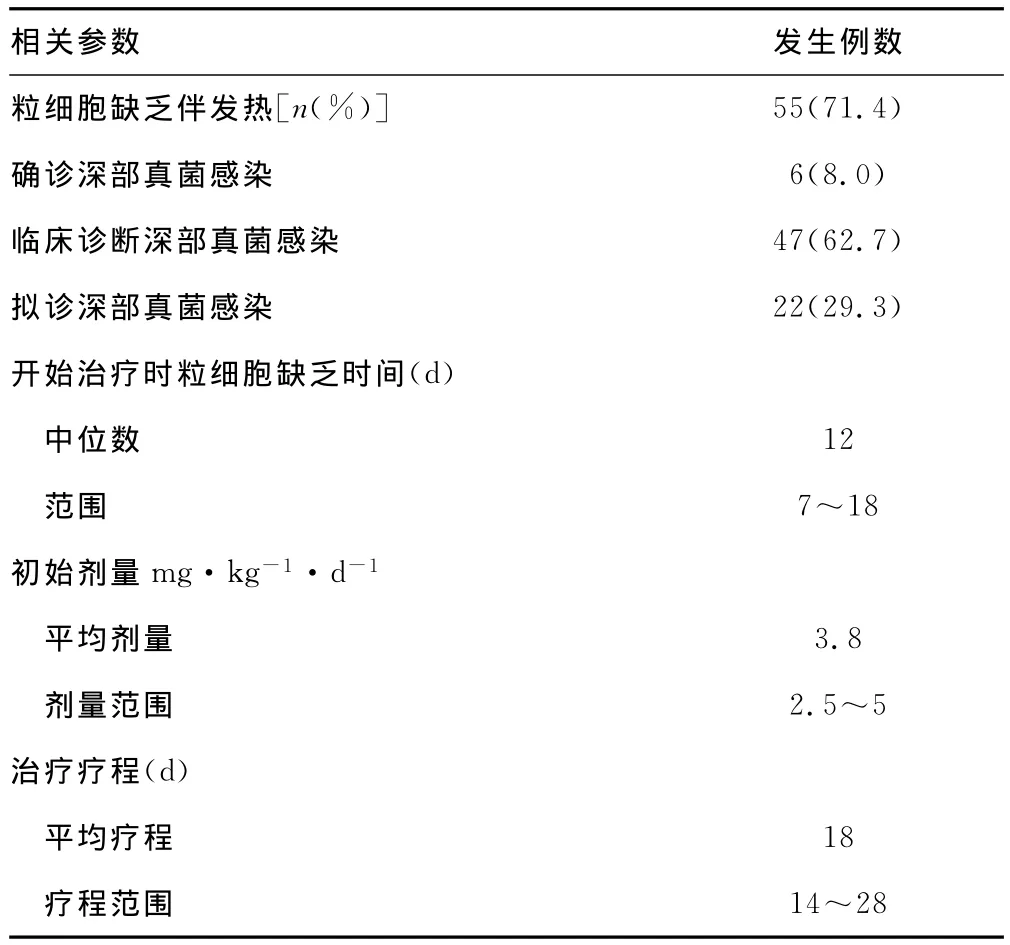
表1 米卡芬净治疗相关资料
2.2 米卡芬净对儿童肺侵袭性真菌感染疗效 米卡芬净治疗75例儿童拟诊或临床诊断深部真菌感染疗效见表2。75例患儿均表现为肺侵袭性真菌感染;经治疗后痊愈5例,显效62例,进步4例,无效4例;总有效率为89.3% ;死亡2例,病死率为2.7%。不同基础疾病应用米卡芬净治疗效果存在差异,但无统计学意义(急性白血病总有效率93.1%,原发性免疫缺陷病66.7%,噬血淋巴组织细胞增生症80.0%,再生障碍性贫血83.3%);米卡芬净在治疗化疗患儿与干细胞移植患儿合并肺部深部真菌感染疗效差异无统计学意义(P>0.05);应用米卡芬净前是否已经应用其他抗真菌药的疗效差异无统计学意义(P>0.05)。
2.3 米卡芬净治疗儿童肺真菌感染安全性评价 所有应用米卡芬净的儿童均未观察到与药物相关或可能相关的过敏及精神症状,治疗前、后转氨酶指标、肾功能指标、电解质检查、心肌酶谱指标差异无统计学意义,见表3。无因药物不良反应而停药病例。75例患儿中,有9例在用药过程中出现了药物相关不良反应,其中,4例为转氨酶轻度升高,3例为隐性黄疸(血清总胆红素小于或等于34.2mmol/L),出现皮疹及腹泻各1例(表4)。
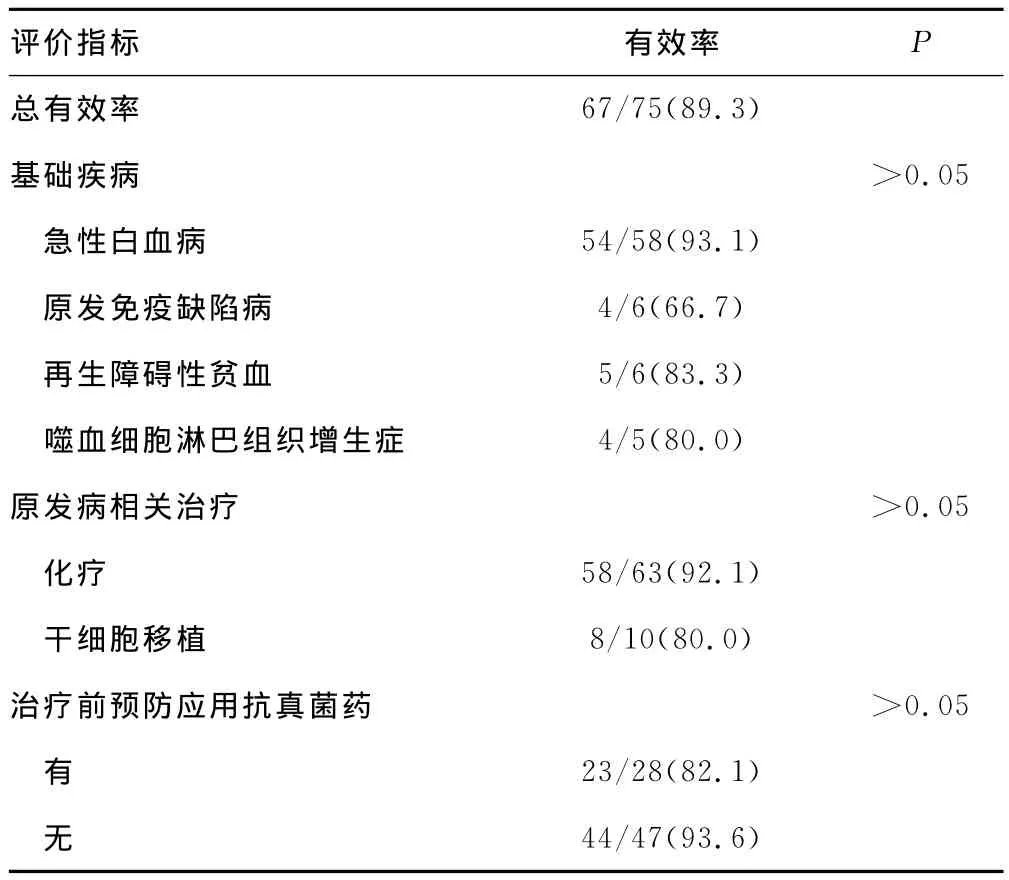
表2 米卡芬净对侵袭性儿童肺真菌感染疗效[n(%)]
表3 米卡芬净用药前后脏器功能指标监测()
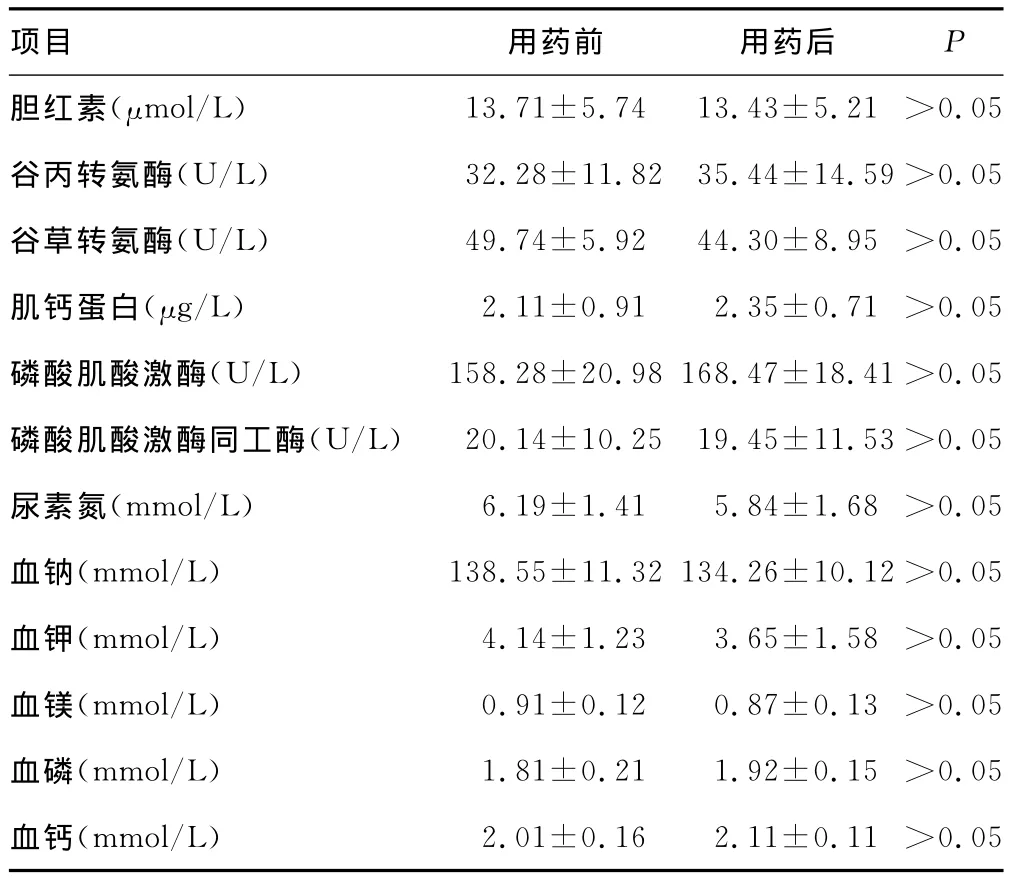
表3 米卡芬净用药前后脏器功能指标监测()
项目 用药前 用药后P胆红素(μmol/L) 13.71±5.7413.43±5.21 >0.05谷丙转氨酶(U/L) 32.28±11.8235.44±14.59>0.05谷草转氨酶(U/L) 49.74±5.9244.30±8.95 >0.05肌钙蛋白(μg/L) 2.11±0.912.35±0.71 >0.05磷酸肌酸激酶(U/L) 158.28±20.98168.47±18.41>0.05磷酸肌酸激酶同工酶(U/L) 20.14±10.2519.45±11.53>0.05尿素氮(mmol/L) 6.19±1.415.84±1.68 >0.05血钠(mmol/L) 138.55±11.32134.26±10.12>0.05血钾(mmol/L) 4.14±1.233.65±1.58 >0.05血镁(mmol/L) 0.91±0.120.87±0.13 >0.05血磷(mmol/L) 1.81±0.211.92±0.15 >0.05血钙(mmol/L) 2.01±0.162.11±0.11 >0.05

表4 药物相关不良反应
3 讨 论
近年来随着大剂量联合化疗、免疫抑制剂、广谱抗菌药物及造血干细胞移植的广泛应用,恶性血液病患者包括合并肺侵袭性真菌感染的发病率逐年升高;且由于恶性血液病患者合并肺侵袭性真菌感染时症状常不典型,明确诊断困难,因此,预后较差、病死率较高[4]。中华医学会儿科分会呼吸学组新近发布的“儿童侵袭性肺真菌感染诊治指南(2009版)”涵盖了儿童血液病治疗过程中必将发生的宿主危险因素,如原发疾病所致的免疫功能低下、强烈化疗、长期皮质激素和其他免疫抑制剂应用、造血干细胞移植、为控制继发感染采用强效广谱抗菌药物及深静脉置管等[5]。因此,儿童血液病及原发性免疫缺陷症患者必然是肺侵袭性真菌感染高危患者,在治疗原发病的过程中随时应对肺侵袭性真菌感染保持高度警惕,合理控制肺侵袭性真菌感染的危险因素;及时诊断、早期经验性治疗,对改善儿童血液病患者预后具有重要意义。本组病例达到确诊及临床诊断水平的仅53例,22例均为拟诊阶段根据病情及时加用或换用米卡芬净,这是取得较好治疗效果的一个重要原因。
目前,治疗肺侵袭性真菌感染的常用药物有:两性霉素B、唑类(如氟康唑、伊曲康唑、伏立康唑等)及棘白菌素类。虽然两性霉素B是广谱的抗真菌药并具有很强的抗真菌活性,但对儿童患者,其肾功能损害、顽固性低钾血症等严重的不良反应使其应用受到限制;唑类抗真菌药物毒性较两性霉素B低,但近年来耐药率显着增加[6]。米卡芬净是美国食品药品管理局批准的另一种棘白菌素类抗真菌药物,其抗菌谱广,对唑类抗真菌药耐药的念珠菌属和曲霉菌属具有广谱的抗菌活性,而且米卡芬净与三唑类抗真菌药及二性霉素B不存在交叉耐药[7],因此,该药一上市即很快被临床医师所接受。此外,由于米卡芬净对肝肾功能影响小,对轻中度肝肾功能损害的患者无需调整剂量,在多个真菌防治指南中已将其列入血液肿瘤患者预防性或经验性治疗深部真菌感染的推荐用药。本组资料有28例患者均为前期使用其他抗真菌药的情况下,因药物相关不良反应或病情进展换用米卡芬净治疗,并且均取得较好的疗效,且临床证实米卡芬净与其他抗真菌药之间不存在交叉耐药性。
由于目前绝大部分抗真菌药均缺乏儿童用药依据,对于儿童肺侵袭性真菌感染的治疗常常是临床医师面临的棘手问题。临床研究证实,米卡芬净对儿童肺侵袭性真菌感染患者具有抗菌效力强、安全性高、抗菌谱广的特点[8],药物经济学研究还证实以米卡芬净预防性应用于干细胞移植具有成本-效益优势,显示其高性价比的特点[9]。
本文作者应用米卡芬净经验性治疗儿童肺侵袭性真菌感染75例,取得了满意的临床效果,总体有效率89.3%。取得如此临床效果,除米卡芬净广谱的抗真菌效力外,与本研究中多数病例是在获得病原学依据之前经验性用药有关。因此,尽早的合理选用抗真菌药物对患儿最终治疗效果尤为重要。本研究还发现对儿童化疗以及干细胞移植期间合并肺侵袭性真菌感染治疗效果差异无统计学意义(P>0.05),儿童白血病、噬血淋巴组织细胞增生症及原发性免疫缺陷症合并肺侵袭性真菌感染应用米卡芬净治疗疗效差异无统计学意义(P>0.05)。因此,米卡芬净对于各种危险因素条件下继发的肺侵袭性真菌感染均有良好的治疗效果。
经过对米卡芬净在儿童深部真菌感染治疗中的临床观察及相关脏器功能随访,本研究中未发现与米卡芬净密切相关的严重不良反应,所有患儿均能良好的耐受静脉给药,除4例转氨酶轻度升高,2例出现轻度胆红素升高、腹泻及皮疹各1例外,未观察到心肌酶谱、肝肾功能、电解质指标的异常,随访各项指标用药前后差异无统计学意义,提示其安全性良好。
[1]Mor M,Gilad G,Kornreich L,et al.Invasive fungal infections in pediatric oncology[J].Pediatr Blood Cancer,2011,56(7):1092-1097.
[2]Hicheri Y,Toma A,Maury S,et al.Updated guidelines for managing fungal diseases in hematology patients[J].Expert Rev Anti Infect Ther,2010,8(9):1049-1060.
[3]谢晓恬.儿童血液病深部真菌感染的防治研究[J].临床儿科杂志,2010,28(4):396-400.
[4]Bhatt VR,Viola GM,Ferrajoli A.Invasive fungal infections in acute leukemia[J].Ther Adv Hematol,2011,2(4):231-247.
[5]中华医学会儿科学分会呼吸学组,中华儿科杂志编辑委员会.儿童侵袭性肺部真菌感染诊治指南[J].中华儿科杂志,2009,47(2):96-98.
[6]Lass-Florl C.Triazole antifungal agents in invasive fungal infections:a comparative review[J].Drugs,2011,71(18):2405-2419.
[7]乔建军,刘伟,万喆,等.米卡芬净对分离自中国的念珠菌和曲霉临床株体外抑菌活性的研究[J].中国真菌学杂志,2007,2(1):5-9,13.
[8]Antonio CA.Philip maddison and andreas H.groll.safety of micafungin in pediatric clinical trials[J].Pediatr Infect Dis J,2011,30(6):97-102.
[9]Schonfeld W,Wang Cheng J,Tong KB,et al.Cost-effectiveness analysis of antifungal prophylaxis in patients undergoing hematopoietic stem cell transplantation[J].Clin Ther,2008,30(5):964-973.



