张 欣,韩一旦,许云腾,王晓宁,严 辉,王 杰,李西海,4,王珊珊*
(1.福建中医药大学中西医结合研究院,福建 福州 350122;2.福建中医药大学中西结合学院,福建 福州 350122;3.中国科学院精密测量科学与技术创新研究院,湖北武汉430071;4.福建省中西医结合老年性疾病重点实验室,福建 福州 350122)
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是女性绝经后卵巢功能衰退、雌激素水平下降而引起的以骨髓脂肪化、骨质流失、骨微结构受损、骨强度降低为主要特征的代谢性疾病[1]。雌激素水平的下降不仅可以直接影响骨代谢,还可引起脂代谢异常与功能障碍,间接引起骨髓微循环障碍、骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)成骨成脂分化失衡,进而降低骨代谢能力、促进骨丢失[2-3]。同时,脂代谢紊乱易导致脂肪细胞增多,诱发脂肪组织扩张,故PMOP脂骨代谢紊乱患者时常伴随肥胖症状,而肥胖可通过多种作用机制对骨骼产生不利影响[4-6]。肥胖症是PMOP脂骨代谢紊乱的常见并发症,二陈汤对脂代谢紊乱具有较好的改善作用[7],基于脂代谢异常以及肥胖症对骨代谢产生的不利影响,推测二陈汤对脂代谢的调节作用可间接影响骨代谢,具备调节PMOP脂骨代谢紊乱、降低PMOP患者并发肥胖症的概率,以延缓PMOP疾病发展进程、改善其临床症状的潜力,但具体作用机制仍需进一步探索与验证,故本文选取PMOP与肥胖症的基因数据进行整合,应用网络药理学与分子对接技术从二陈汤的物质基础出发,探究其调节PMOP脂骨代谢紊乱的潜在分子机制。
1 材料与方法
1.1 PMOP与肥胖症相关疾病靶点收集与整理 通过GeneCards(https://www.genecards.org/)、DRUGBANK(https://www.drugbank.com/)、PharmGkb(https://www.pharmgkb.org/)、OMIM(https://omim.org/)以及TTD(http://db.idrblab.net/ttd/)数据库分别查找PMOP、肥胖症的相关疾病靶点,其中Gene-Cards数据库的Relevance score值越高则代表该靶点与疾病关系越密切,若靶点过多则可根据Relevance score值筛除相关性较小的靶点。利用R 4.0.3软件将各数据库所得靶点汇总后删除重复项。
1.2 二陈汤有效成分及作用靶点收集与整理 在TCMSP中药系统药理学数据库及分析平台(https://old.tcmsp-e.com/tcmsp.php)分别检索半夏、陈皮、茯苓、甘草四味药的有效成分,并根据生物口服利用度(oral bioavailability,OB)≥30%且类药性(druglikeness,DL)≥0.18筛选出具有较高活性的有效成分及其作用的蛋白质靶点。利用Uniprot蛋白质数据库(https://www.uniprot.org)对所有药物靶点信息统一进行标准化,去重后即得二陈汤相关作用靶点。
1.3 蛋白互作网络构建及拓扑分析 利用R 4.0.3软件将筛选后的PMOP、肥胖症疾病靶点与二陈汤药物作用靶点取交集,得到二陈汤作用于PMOP与肥胖症的共同靶点,将共同靶点提交至STRING 11.0(https://www.string-db.org/)数据库,生物种类选定“Homo sapiens”,最小互相作用阈值设定为“highest confidence”(>0.9),阈值越高,得到网络的可信度越高,最后隐藏网络中断开连接的节点,其余设置不变,得到蛋白互作(protein-protein interaction network,PPI)网络。然后使用Cytoscape 3.8.1软件中的CytoNCA插件对所得PPI网络进行拓扑分析,筛选核心靶点。计算PPI网络中各节点的中介中心性(betweenness centrality,BC)、紧密中心性(closeness centrality,CC)、度中心性(degree centrality,DC)、特征向量中心性(eigenvector centrality,EC)、局部边连通性(local average connectivity-based method centrality,LAC)、网络中心性(network centrality,NC)等六项拓扑参数值,分析每个节点在PPI网络中的重要性,取各项参数值均高于中位数值的节点,所得节点即为具有显着意义的核心作用靶点。
1.4 GO和KEGG富集分析 将二陈汤调节PMOP与肥胖症的共同靶点输入Metascape平台,默认P<0.01,对其生物学过程与信号通路进行聚类富集分析,并将所得数据结果利用Hiplot(https://hiplot.com.cn)平台进行可视化。
1.5 构建中药复方调控网络 运用Cytoscape 3.8.1软件和Java代码联合分析构建二陈汤药物有效成分作用于PMOP和肥胖症共同靶点的调控网络,即二陈汤调控网络,从网络中可以得到二陈汤作用于PMOP与肥胖症共同的主要活性成分及作用靶点。
1.6 分子对接 使用Pubchem数据库查找二陈汤主要活性成分的2D构象,用ChemOffice 14.0.0.117软件转换为3D结构并优化其最小自由能,使用PDB数据库(https://www.rcsb.org/)查找疾病靶点蛋白,并运用PyMOL 2.4.1软件去除水分子和原有配体后加氢,然后将处理过的活性成分与靶点蛋白导入AutoDock 1.5.6,对接位点选择以原有配体为中心,设置相应的网格箱(gird box)参数,运用Vina软件进行分子对接,对接结果可用PyMOL软件打开并查看图像,一般认为结合能<-5.0 kcal/mol时,说明活性成分与靶点蛋白具有较好的结合活性,而结合能<-7.0 kcal/mol时具有强烈的结合活性[8]。
2 结果
2.1 PMOP与肥胖症相关疾病靶点收集与整理结果 GeneCards数据库获得PMOP相关靶点1 099个,肥胖症相关靶点9 166个,经过Relevance score值筛选后,得到PMOP相关靶点839个(Relevance score≥1)、肥胖症相关靶点483个(Relevance score≥10);OMIM数据库获得PMOP相关靶点10个,肥胖症相关靶点28个;DRUGBANK数据库获得PMOP相关靶点101个,肥胖症相关靶点63个;PharmGkb数据库获得PMOP相关靶点15个,肥胖症相关靶点4个;TTD数据库获得PMOP相关靶点4个,肥胖症相关靶点81个。将各数据库PMOP和肥胖症相关靶点取并集删除重复值后,最终得到PMOP相关靶点918个,肥胖症相关靶点563个。
2.2 二陈汤有效成分及作用靶点收集与整理结果 在TCMSP数据库共筛得符合OB≥30%且DL≥0.18的半夏有效成分13个,靶点169个;陈皮有效成分5个,靶点95个;茯苓有效成分15个,靶点118个;甘草有效成分92个,靶点2506个,去重后共得到二陈汤有效成分107个,经Uniprot蛋白质数据库标准化并去重后最终得到作用靶点233个。
2.3 PPI网络构建及拓扑分析结果 通过R 4.0.3软件得到PMOP、肥胖症与二陈汤共同靶点48个,利用STRING数据库,得到共同靶点的PPI蛋白互作网络,除去无相互作用的节点后,网络共显示45个节点,148条边(图1),节点代表蛋白质,边代表蛋白质-蛋白质关联,边的不同颜色表示蛋白质之间相互作用证据的不同类型。通过Cytoscape 3.8.1软件中的CytoNCA插件对所得PPI网络进行拓扑分析,结果显示BC、CC、DC、EC、LAC、NC六项拓扑参数中位数值分别为18.069 230 6、0.686 167 945 5、25.5、0.159 415 334 5、19.268 065 265、21.716 469 98,其中拓扑参数值均大于中位数值的核心靶点共有15个,见表1,即二陈汤调节PMOP脂骨代谢紊乱的潜在核心靶点。
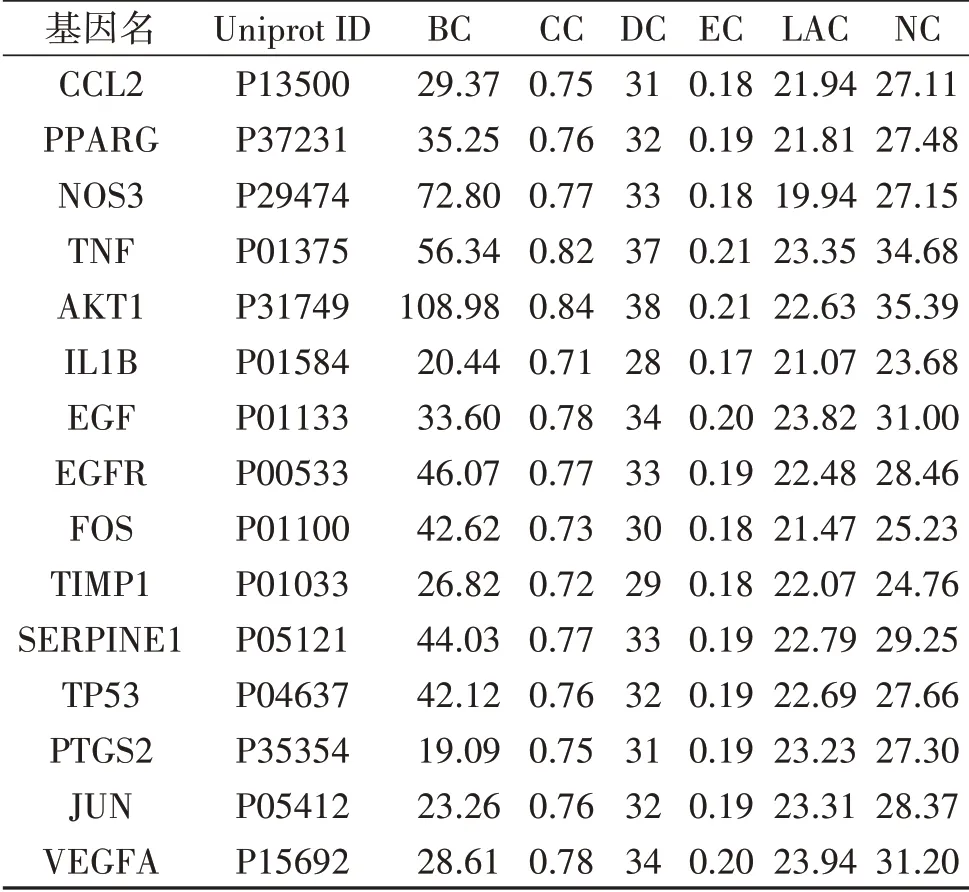
表1 PPI网络拓扑分析参数
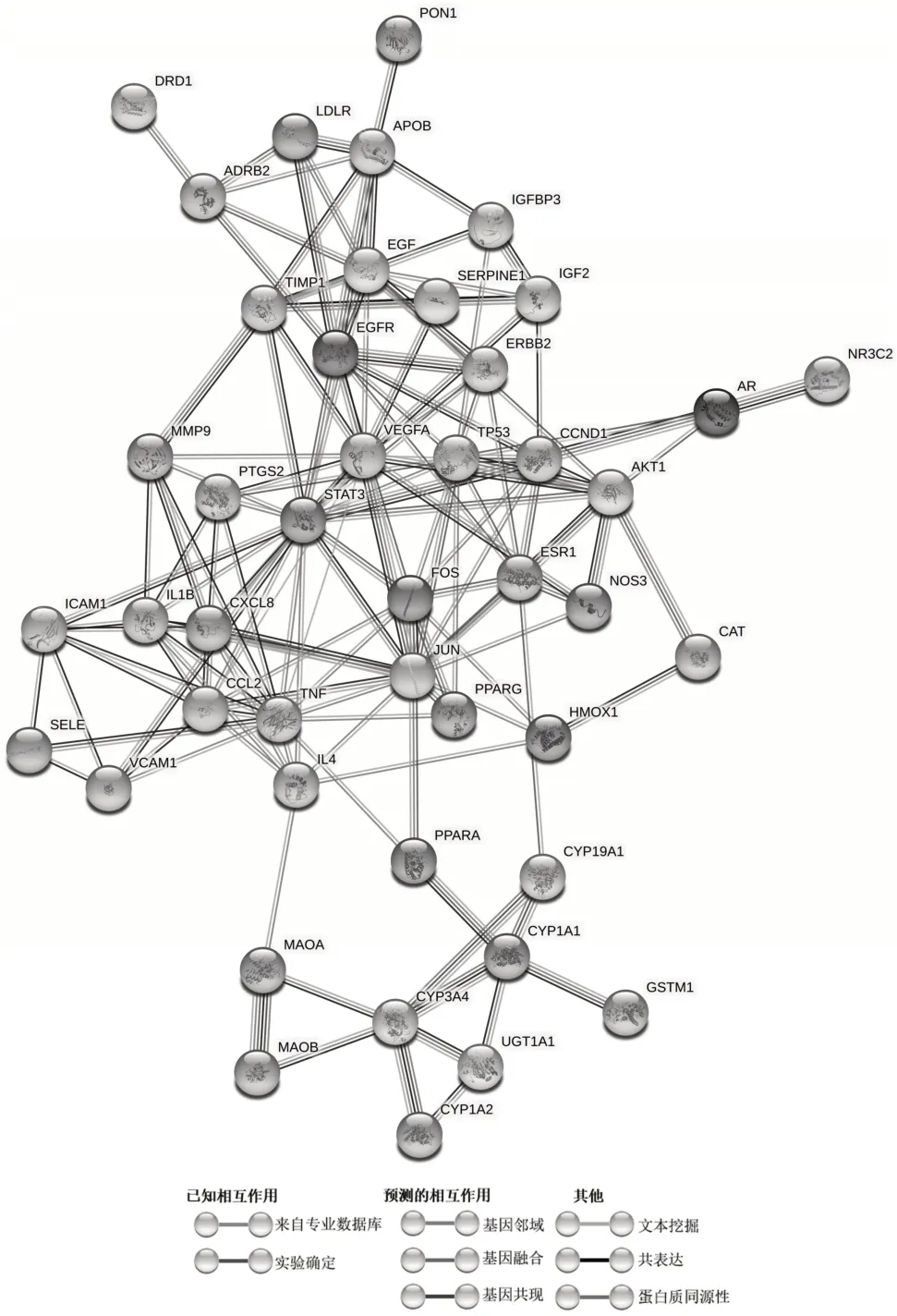
图1 PPI网络图
2.4 GO和KEGG富集分析结果 GO富集及聚类分析结果显示,满足条件的生物过程(biological processes,BP)共585条,根据功能相似性分为20类,包括对脂多糖的反应、对细胞外刺激的反应、对无机物的反应、细胞迁移的积极调控、细胞对脂质的反应、活性氧代谢的反应、类固醇代谢过程、对雌二醇的反应等,其中细胞对脂质的反应、活性氧代谢过程、类固醇代谢过程、对雌二醇的反应与脂骨代谢具有明显相关性;细胞成分(cellular components,CC)46条,根据功能相似性分为8类,包括膜筏、囊腔、网格蛋白包膜囊泡膜、RNA聚合酶Ⅱ转录因子复合物、小窝、内质网内腔、膜侧和细胞器外膜等;分子功能(molecular function,MF)66条,根据功能相似性分为14类,包括血红素结合、RNA聚合酶II转录因子结合、受体-配体活性、磷酸酶结合、伯胺氧化酶活性等,见图2。KEGG富集及聚类分析结果显示,满足条件的信号通路共130条,根据功能相似性分为16类,其中较为重要的通路包括AGERAGE信号通路、IL-17信号通路、雌激素信号通路、脂肪细胞因子信号通路以及卵巢类固醇生成,见图3。
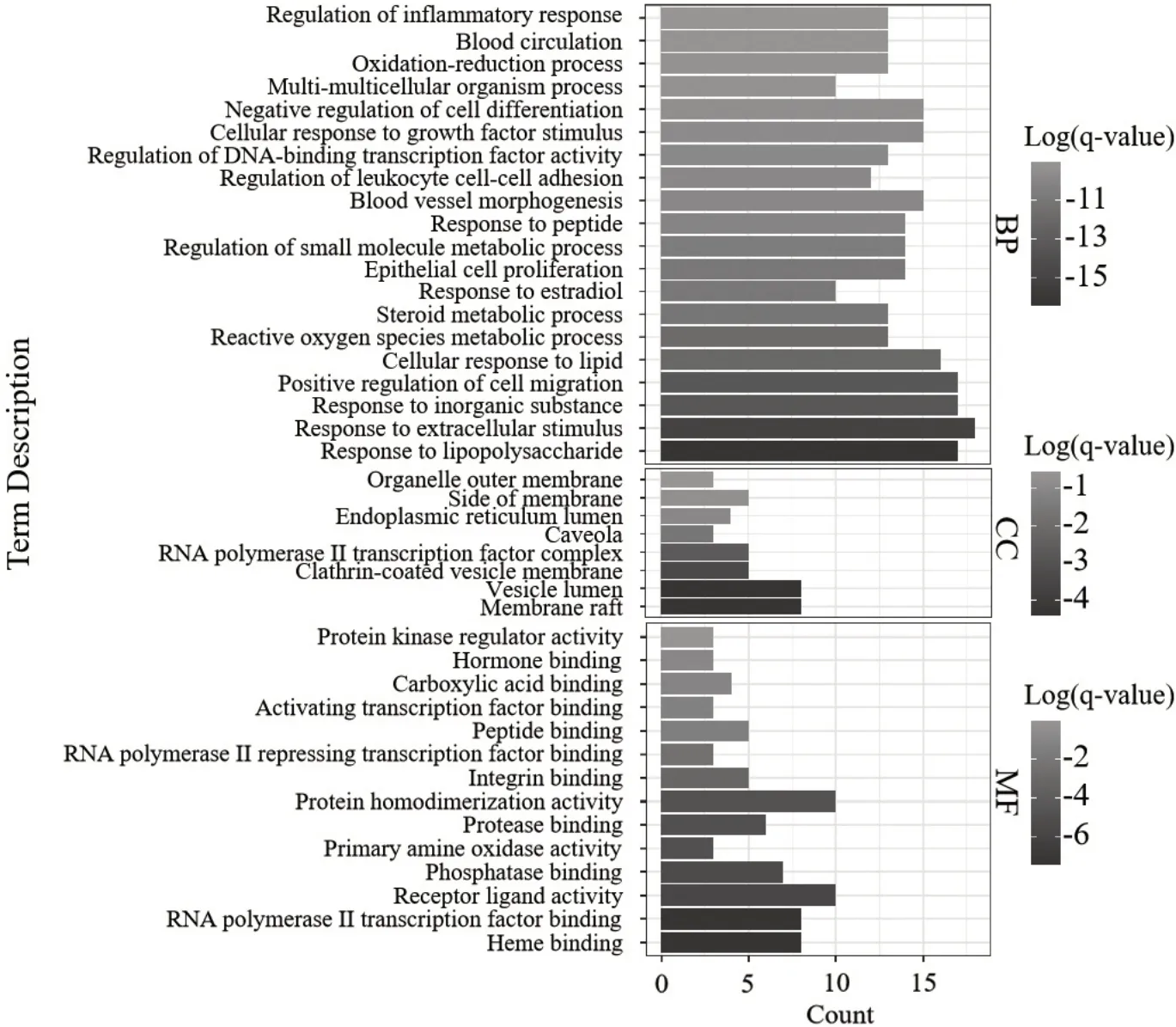
图2 GO富集分析图
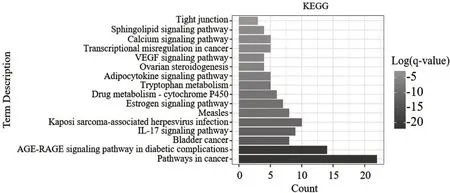
图3 KEGG富集分析图
2.5 中药复方调控网络结果分析 利用Cytoscape 3.8.1软件构建二陈汤调控网络并进行分析,见图4。调控网络总共包括148个节点(100个药物活性成分节点、48个蛋白靶点节点)和468条边,节点越大说明Degreed值越大,与之作用的活性成分越多,重要性越高,每条边则表示有效成分与靶点之间的相互作用关系,Degreed≥60的蛋白靶点包括前列腺素内酯合成酶2(PTGS2)、雌激素受体1(ESR1)、雄激素受体(AR)、过氧化物酶体增殖物激活受体γ(PPARγ),见表2;Degreed≥10的活性成分包括槲皮素(quercetin)、山奈酚(kaempferol)、柚皮素(naringenin)以及刺芒柄花素(formononetin),见表3。
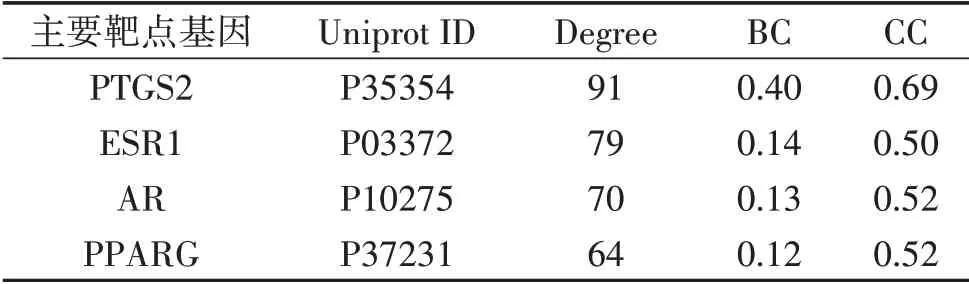
表2 二陈汤作用的主要靶点基因网络节点特征参数
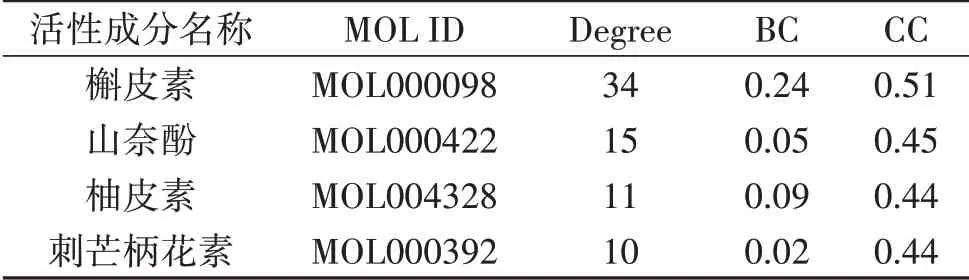
表3 二陈汤主要活性成分网络节点特征参数

图4 二陈汤调控网络图
2.6 分子对接验证结果 一般认为结合构象越稳定耗能越低,发生的作用可能性越大,将关键靶点与槲皮素、山奈酚、柚皮素以及刺芒柄花素进行分子对接,结果显示,17个关键靶点结合能均小于-5.0 kcal/mol,说明二陈汤中的主要活性成分与疾病关键靶点有较强的结合能力,见表4。其中PPARG、PTGS2不仅是二陈汤调控网络的主要靶点,同时还是PPI拓扑分析得出的核心靶点,ESR1是多条显着性较高的生物进程与信号通路中的均含有的靶点基因,ESR1、PPARG、PTGS2与槲皮素、山奈酚、柚皮素以及刺芒柄花素的结合能力均<-7.0 kcal/mol,见图5。
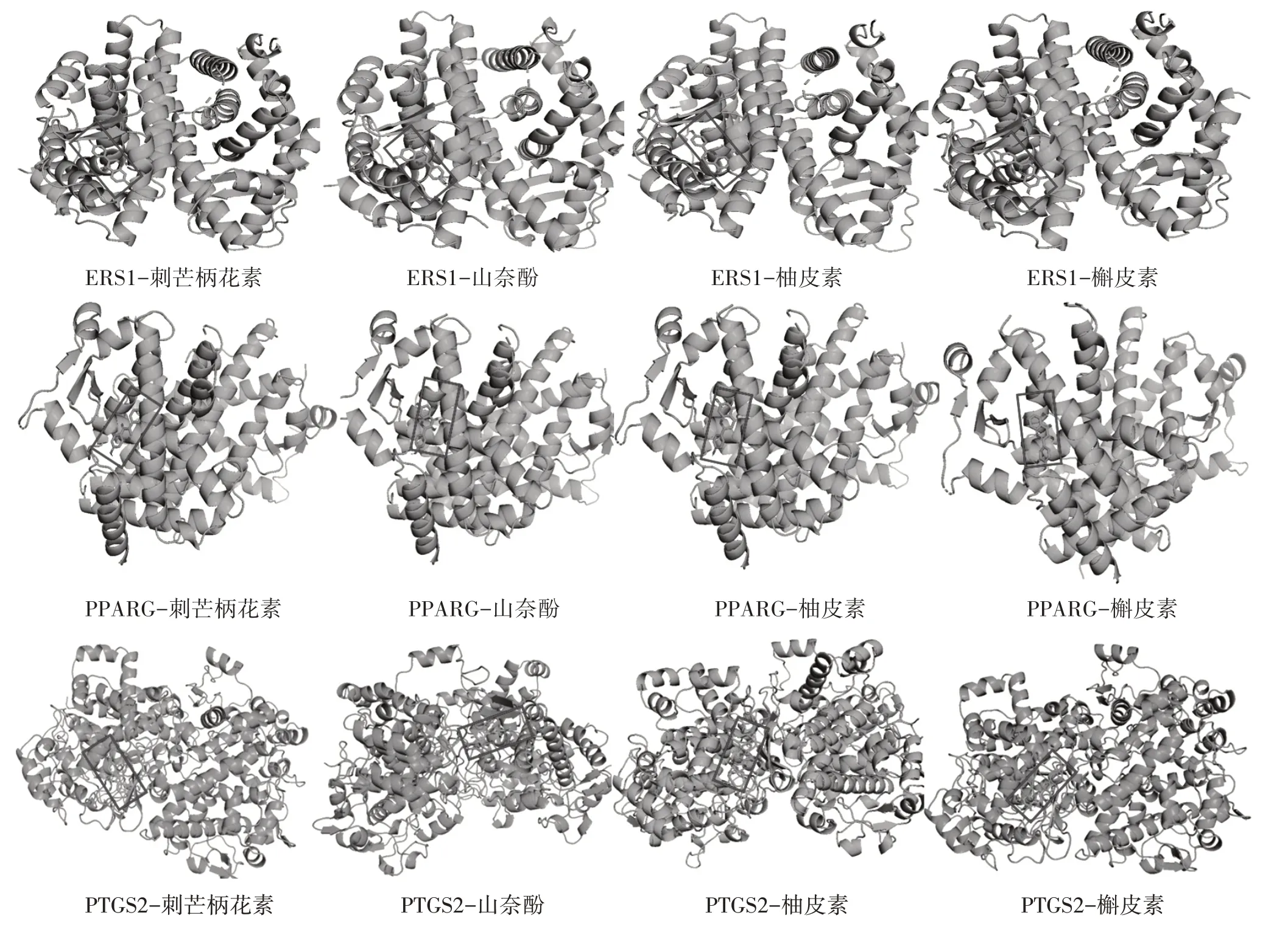
图5 ESR1、PTGS2、PPARG分子对接结果
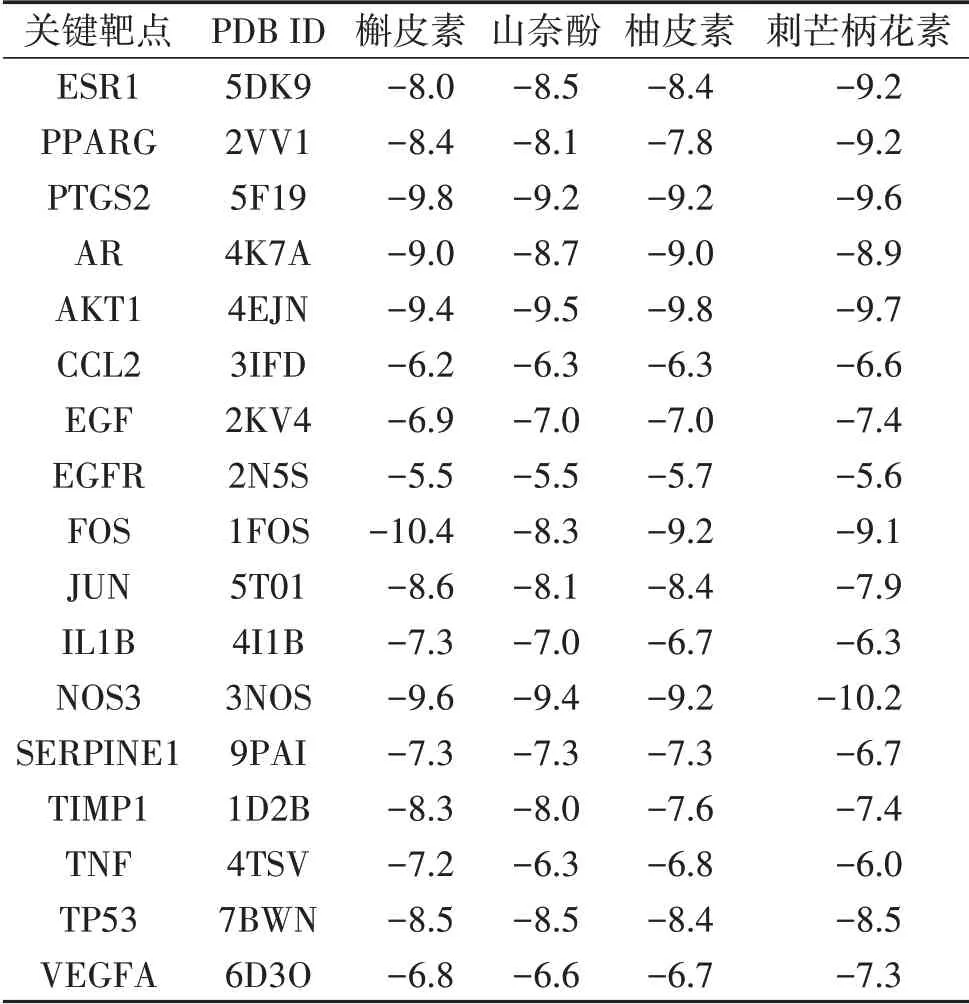
表4 二陈汤主要活性成分与关键靶点的结合能分数(kcal/mol)
3 讨论
中医理论认为,脾与PMOP发生发展密切相关,李东垣《脾胃论·脾胃盛衰论》:“脾病……则骨乏无力……令人骨髓空虚,足不能履地。”脾为气血生化之源,若脾失健运则无以濡养肾精,以致肾之主骨生髓功能失常,进而导致PMOP的发生[9],脾失健运还可导致气血运行不畅,水谷精微输布失常,停聚日久而生痰湿,进而酿成膏脂,泛溢肌腠而成肥胖[10],二陈汤出自《太平惠民和剂局方》,陈皮理气健脾,半夏化痰燥湿,茯苓健脾利湿,甘草补脾益气、缓急止痛、调和诸药,全方合用可益气健脾、化痰利湿,痰消脾健则膏脂渐去、肾精得以濡养。二陈汤对脂代谢酶与脂质转运蛋白的异常表达具有抑制作用,可改善脂肪因子的异常分泌,维持脂肪组织生理功能,减少脂质异位沉积,降低高密度脂蛋白、甘油三酯等脂肪因子对骨髓和骨代谢的不利影响[7,11-12],由此推测,二陈汤可通过抑制脂代谢异常而间接影响骨代谢,从而达到调节PMOP脂骨代谢紊乱、改善PMOP临床症状的作用,但其具体作用机制仍需进一步探索与证实。
本研究通过网络药理学方法初步筛选出二陈汤调治PMOP脂骨代谢紊乱的活性成分100个,其中槲皮素、山柰酚、柚皮素以及刺芒柄花素作用的疾病靶点最多,且对脂、骨代谢均有一定的调节作用,故推测槲皮素、山柰酚、柚皮素以及刺芒柄花素可能是二陈汤调节PMOP脂骨代谢紊乱的主要活性成分。槲皮素可通过雌激素信号促进RUNT相关转录因子2(RUNX2)、碱性磷酸酶(ALP)表达,抑制PPARγ(PPARG)、CCAAT增强子结合蛋白α(C/EBPα)表达,从而促进BMSCs的成骨分化,抑制其成脂分化,槲皮素还可促进脂肪源性干细胞向成骨分化[13-14]。山奈酚能够促进RUNX2、成骨细胞特异性转录因子(OSX)的表达,诱导BMSCs向成骨细胞分化、提高骨密度[15],并通过调节增强子结合蛋白α、脂肪甘油三酯脂酶、激素敏感性脂肪的表达水平减少脂肪细胞中的脂质积累,调节其成脂分化[16]。柚皮素可通过抑制p38信号通路的表达进而抑制破骨细胞的生成[17],降低去卵巢大鼠的骨转换率,保持骨矿密度,改善骨小梁结构[18],柚皮素还能够降低血浆和脂肪中瘦素mRNA的表达水平,并下调脂肪组织中单核细胞趋化蛋白1(MCP1/CCl2)和白细胞介素-6(IL-6)mRNA的表达水平,减轻脂代谢紊乱[19]。刺芒柄花素可下调骨组织基质金属蛋白酶-9(MMP-9)、肿瘤坏死因子-α(TNFα)、IL-6 mRNA表达,同时上调磷酸化P38丝裂素活化蛋白激酶(P38MAPK)mRNA的表达,抑制破骨细胞骨吸收,增加骨密度[20],还可作为PPARγ的激动剂,促进解偶联蛋白1(UCP1)在脂肪细胞中的表达,通过调控白色脂肪细胞褐色化以调节脂代谢[21]。
已知女性绝经后雌激素水平的下降是PMOP脂骨代谢紊乱的主要因素,且本文通过二陈汤调控网络的构建发现,ESR1的Degree值为79,是二陈汤活性成分作用的主要靶点之一,且在GO、KEGG富集分析结果显示,显着性较高的生物进程与信号通路中,细胞对脂质的反应、类固醇代谢过程、对雌二醇的反应以及雌激素信号通路中均含有ESR1。雌激素与ESR1结合后,可促进成骨细胞与免疫细胞分泌TNF-α、IL-1,并上调转化生长因子β(TGFβ)的表达,从而抑制破骨细胞骨吸收活性,维持骨密度[22],ESR1还可通过脂肪甘油三酯脂肪酶和围脂滴蛋白调节脂滴大小从而调节脂质代谢[23]。PPARG与PTGS2不仅是二陈汤调控网络中的主要靶点,同时还是PPI网络中的核心靶点,PPARγ是BMSCs成脂分化关键转录因子[24],PPARγ表达增加及活性增强均可促进BMSCs向成脂肪细胞分化,并抑制其向成骨细胞分化[25]。COX2(PTGS2)是前列腺素生物合成中的关键酶。COX2及其介导的前列腺素能够促进白色脂肪和米色脂肪褐变,以增加能量消耗,减少脂质蓄积,改善脂代谢[26]。同时,感觉神经或骨细胞中皆含有COX2介导的前列腺素E2(PGE2),PGE2可通过激活前列腺素受体4(EP4)抑制中枢神经系统的交感活动,从而促进骨生成[27]。由此推测,ESR1、PPARG与PTGS2可能是二陈汤调节PMOP脂骨代谢紊乱的关键核心靶点,分子对接结果亦显示ESR1、PPARG、PTGS2与二陈汤主要活性成分具有较强的结合活性。
GO和KEGG富集分析结果提示二陈汤可通过多种与内分泌、代谢以及免疫相关的生物进程和信号通路对PMOP脂骨代谢紊乱起到调节作用,生物进程主要包括细胞对脂质的反应、类固醇代谢过程、对雌二醇的反应、活性氧代谢过程,信号通路主要包括AGE-RAGE信号通路、IL-17信号通路、雌激素信号通路、脂肪细胞因子信号通路和卵巢类固醇生成。RAGE是晚期糖基化终产物(AGEs)的受体,AGEs与RAGE相互作用后,可激活Caspase-3信号通路,诱导成骨细胞凋亡,增加细胞内活性氧的产生,抑制MAPK、ALP活性,促进骨吸收[28],AGEs还可抑制BMSCs增值,并通过Wnt/β-catenin信号通路抑制其向成骨分化[29]。ERα不仅可刺激骨细胞产生NO和PGE2,影响破骨细胞和成骨细胞的形成[30],还可与雌二醇结合减小脂肪细胞的体积,迅速降低骨髓脂肪量[31]。IL-17A与TNF-α协同作用,可抑制Wnt信号通路促进BMSCs向成骨细胞分化以及成骨细胞矿化,亦可激活PEG2,从而抑制PPARγ、脂联素等的表达以减少BMSCs向脂肪细胞分化[32-33],故推测二陈汤可通过抑制AGE-RAGE信号通路或促进IL-17信号通路、雌激素信号通路的表达,抑制BMSCs的成脂分化,从而促进其成骨分化,达到调节PMOP脂骨代谢紊乱的作用。
本研究发现,二陈汤含有的主要活性成分以及作用的多个核心靶点与通路可对BMSCs增殖分化产生影响,女性绝经后BMSCs倾向于分化为脂肪细胞,其成骨分化以及骨形成受到明显抑制,当大量BMSCs分化为脂肪细胞时,成骨细胞的数量会相应减少,导致PMOP的发生[34-35]。故推测二陈汤对BMSCs成脂分化具有抑制作用,从而在一定程度上提升成骨分化能力,恢复脂骨代谢平衡。
综上所述,本文基于PMOM与肥胖症相关的共同靶点基因,揭示了二陈汤通过多成分、多靶点、多通路调节PMOP脂骨代谢紊乱的药效机制,其作用机制可能是通过抑制BMSCs的成脂分化、减少脂质的积累进而缓解脂代谢紊乱对骨代谢产生的影响,从而延缓PMOP疾病发展进程、改善PMOP临床症状。但因本实验结果是基于生物信息学方法,仅通过大量数据计算推测所得,有一定的局限性,故后续仍需通过动物、细胞实验进行进一步探索与验证。



