耿 仙 冯承保 吴建民 杨会茹 宋新梅
(1 河北大学医学部药理教研室,保定071002;2 河北省保定市第二医院肿瘤科,保定071000;3 河北省新乐市医院外科,新乐050700;4 河北省新乐市医院儿科,新乐050700)
DNA重组标记技术的成功是因为标记并不改变被标记蛋白的功能,特别有两大进展使得标记技术切实可行:通过合成寡核苷酸和PCR技术将标记物插入到蛋白表达载体中;在病毒、细菌、植物、酵母、昆虫和哺乳动物细胞系统中可表达重组标记蛋白。FLAG标记物是唯一专为标记目的设计的多肽标记物[1],其特点是标记物的序列不是来自任何已知的蛋白。该标记物是由8个氨基酸残基组成的多肽,具有亲水性,可置于蛋白的氨基或羧基末端。多种FLAG标记蛋白可保留全部的生化活性(如转录因子、生长因子和酶),这些标记物亦广泛应用于细胞染色、免疫印迹和免疫沉淀试验中。本实验采用聚合酶链式反应技术,将 FLAG标记物插入到GIRK4通道的氨基端,通过与蛋白表达载体的连接,表达于爪蟾卵母细胞,使之转录翻译出带有抗原表位标记的GIRK4通道蛋白,为接下来的免疫印迹、免疫沉淀试验做好充分准备。
1 材料与方法
1.1 材料 试剂:GIRK4的cDNA由美国纽约大学西奈山医学院Diomedes Logothetis教授惠赠。
1.2 实验动物 实验选用非洲爪蟾(Xenopus laevis)购自中科院上海神经科学研究所。
1.3 方法
1.3.1 构建重组质粒DNA 设计引物。将FLAG标记短肽的氨基酸序列所对应的 DNA碱基序列插入到GIRK4-pGEMHE的DNA碱基序列的上游,设计好的引物如下:
上游:5’TCT CCC GGG ATG GAC TAC AAG GAC GAC GAT GAC AAG ATG GCT GGC GAT TCT 3’下游:5’CGG AAT TCT CAC ACC GAG CCC C 3’
进行聚合酶链式反应,扩增FLAG-GIRK4 DNA片段,并将其连接至载体pGEMHE质粒DNA中,经过单克隆鉴定、测序,挑取无碱基突变的克隆,重组质粒DNA构建成功。
重组FLAG-GIRK4通道及GIRK4通道蛋白表达于爪蟾卵母细胞,使用双电极电压钳方法记录通道电流,验证重组FLAG-GIRK4通道电流的正确性。
1.4 统计学处理 信号的采集和分析软件为 pClamp 9.0、Clampfit 9.0,数据分析用Origin 7.0完成。
2 结果
2.1 成功构建重组质粒DNA 提取pGEMHE载体质粒DNA,并使用SmaⅠ 和EcoRⅠ对质粒DNA进行双酶切。聚合酶链式反应扩增目的基因片段,得到的产物片段长度与 GIRK4的碱基数相等,大约为 1300bp,同样将其用SmaⅠ和EcoRⅠ进行双酶切。将PCR扩增产物测序,结果证实PCR扩增产物为目的产物,非假阳性扩增。将双酶切后的质粒DNA和进行双酶切后的PCR产物进行连接,连接反应液转化入感受态细胞,提取重组质粒 DNA,通过双酶切鉴定(Fig.1)、测序,结果与GIRK4-pGEMHE质粒DNA的碱基序列完全相同。重组质粒DNA构建成功。
2.2 电生理实验结果 将由重组质粒DNA和GIRK4-pGEMHE质粒DNA转录而来的RNA分别注入卵母细胞,记录电流。我们首先观察在高钾细胞外液(ND96K)中,以从-80mv到+80mv的斜坡电压记录到的电流变化,Fig.2A所示为在上述记录条件下所记录到的GIRK4电流以及给ACh后的电流变化,Fig.2B所示为重组通道蛋白电流以及给 ACh后的相应电流-电压曲线变化图,最后用 ND96外液冲洗用以建立零电流基线。Fig.2C、D为以上两种通道在给 ACh前后电流随时间变化的结果。虚线为零电流位置,虚线下曲线为钳制电压为-80mv的电流变化,虚线上曲线为钳制电压为+80mv的电流变化,结果显示10μM ACh能够明显增大两者通道的电流,ACh对两种通道的激活率比较,无显着性差异(P>0.05),见 Fig.2E。这说明所加的FLAG标记短肽并未影响GIRK4通道蛋白的表达及其电流特性,为以后研究GIRK4通道蛋白的特性奠定了基础。
3 讨论
采用 DNA重组技术对蛋白进行标记可在各种表达系统中制备和检测标记蛋白,并可通过标记物对杂交蛋白进行检测和纯化。该系统的主要影响因素是因在蛋白上引入标记物可导致蛋白生物活性改变,因为标记的结果,本质上是制造了一个由目的蛋白和标记物氨基酸序列融合而成新的蛋白。第二方面的主要影响因素是在进行表位标记时,许多目前使用的标记物是由已知的蛋白(如myc基因产品)片段组成。这意味着抗标记物抗体不仅识别被研究的标记蛋白,同时还可能识别其他细胞蛋白。由于GIRK通道N末端起始于细胞内,经两次跨膜折叠后C末端结束于细胞内,而且其N末端较短,C末端却比较长,其C末端对于其在细胞膜的定位与信号传导有重要的作用。因此我们选择了在GIRK N末端添加FLAG序列。
本实验采用的方法为在 PCR引物序列中加入FLAG序列所对应的碱基序列,所用PCR循环数应尽量少,以减少碱基突变的发生率,还要使用高保真 DNA聚合酶。为了便于克隆,还要在引物的两端分别加上酶切位点及保护性碱基。为了进一步确认连接的正确性,将挑取的多个克隆提取质粒DNA,再次使用PCR反应所加入的两个酶对其进行双酶切鉴定,由于本实验插入片段为1300bp,因此我们还要通过测序的手段来验证碱基组成及序列的正确性。两栖类动物的卵母细胞是生理学中常用的基因表达系统[2]。卵母细胞能有效的表达外源性mRNA编码的受体蛋白,进一步将蛋白前体分子加工为成熟蛋白,并最终以正确的方向组装在卵母细胞表面,形成有功能的受体蛋白,与源组织的天然受体具有相同的生理生化特性[3]。利用这种方式,可以成功的将神经系统中难以用普通电生理方法研究的受体和离子通道分子,从胞体较小而且突触前后相互作用十分复杂的神经元移植到体积较大、情况较为简单、易培养的卵母细胞中。重组质粒 DNA成功表达于爪蟾卵母细胞,用双电极电压钳检测电流有表达,ACh对带有FLAG标记的重组通道蛋白的激活程度与未带有 FLAG 标记的GIRK4通道蛋白相同。通过在 PCR引物序列中加入FLAG序列所对应的 DNA碱基序列,成功构建了FLAG-GIRK4重组通道蛋白,为进一步对于GIRK4通道的研究打下了坚实的基础。
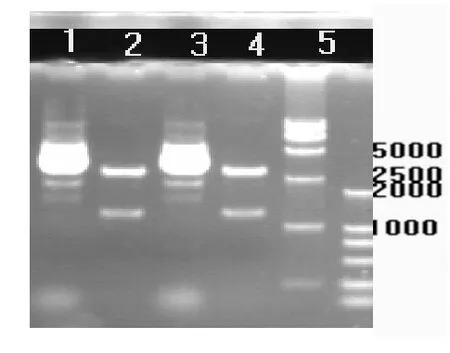
Fig.1 Electrophoresis results of FLAG-GIRK4 DNA identified by SmaⅠand EcoRⅠdouble enzyme digestion.
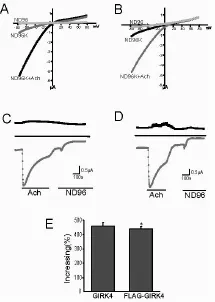
Fig.2 Effects of ACh on GIRK4 currents and FLAG-GIRK4 currents.
[1]Hopp TP, Pricekitt KS, Price VL, et al. A short polypeptide marker sequence used for recombinant protein identification and purification[J]. Bio Technology, 1988,6:1204-1210
[2]Gurdon JB, Lane CD, Wood HR, et al. Use of frog eggs ang oocytes for the study of messenger RNA and its translation in living cells[J]. Nature, 1971,233:177-182.
[3]Dumont JW. Oogenes is in Xenopus laevis (Daudin)Stage of oocyte development in labor atory maintained animals[J]. J Morphol,1972,136:153-180.



