李海霞,周 民,周有君,常 依,王雅露
(湖南省儿童医院,湖南 长沙 410007)
水牛角为牛科动物水牛(Bubalus bubalisLinnaeus)的角,可作为中药犀角的代用品。水牛角始载于梁·陶弘景《名医别录》,味苦、咸,性寒,归心、肝、胃经,专入血分,为治血热毒盛之要药,临床常用于治疗血热出血证。但其止血作用机制及有效成分尚不明确[1-2]。以往学者大多采用药理实验研究水牛角主要成分,发现水牛角含有胆甾醇、强心成分、蛋白质、肽类、氨基酸及钙盐。水牛角粉及水牛角煎液中含有镁、磷、钠等元素以及硅、铁、锰、锌、铜、铝、钛等微量元素[3-5]。有研究发现水牛角水解物在体外能够抗炎、止血,且有一定诱导血小板聚集的作用[6-8]。本课题组前期研究以干姜水煎剂为造模用药,建立了大鼠血热出血模型,故本研究采用大鼠血热出血模型研究水牛角的止血功效和作用机制。
1 材料与方法
1.1 实验动物 SPF级SD大鼠60只,雌雄各半,体质量(350±50)g,8~9周龄,购自湖南斯莱克景达实验动物有限公司,动物生产许可证号:SYXK(湘)2020-0012。湖南省儿童医院儿科医学研究所动物房饲养。湿度50%~55%,温度22~24 ℃,定期更换垫料,自由饮食,适应性饲养4 d。医学实验遵循有关实验动物管理和使用的规定。本实验已通过湖南省儿童医院医学伦理委员会审查(批件号:HCHLL-2020-36)。
1.2 药物 水牛角饮片(批号:201911902)、干姜饮片(批号:1812020242)均购自湖南三湘中药饮片有限公司,经戴冰主任药师鉴定,水牛角为牛科动物水牛BubalisLinnaens的角,干姜为姜科植物Zingiber officinaleRosc.的干燥根茎,质量均为优。云南白药(云南白药集团股份有限公司,批号:ZLA1811);无水乙醇(郑州派尼化学试剂厂,批号:181216)。水牛角水煎液制备:在水牛角中加入双蒸水500 mL,砂锅武火熬开后,文火熬30 min,去上沫,再煮30 min,倒出上清液;再煎煮一次,两次液体混合。离心10 min(3 000 r/min,离心半径为30 cm),调配至质量浓度分别为3.60、1.80、0.90 g/mL,于4 ℃冰箱保存备用。
干姜水煎液制备:将干姜饮片(适量)加10倍水浸泡后,武火煮开,文火煎煮1 h,趁热过滤,同上操作再煎煮2次之后,3次滤液混合至一起浓缩至1.5 kg/L,即为干姜水煎剂,冷冻保存,备用。
云南白药生理盐水溶液配制:将4 g的云南白药以无菌生理盐水将原液稀释为50 mg/mL。
1.3 试剂 HE染色液(上海埃彼化学试剂有限公司);磷酸盐缓冲溶液(PBS,湖北威德利化学试剂有限公司,批号:14S002);10%水合氯醛(湖南省儿童医院药房配制);苏木素-伊红染色液(批号:P032IH)、中性树胶(批号:P033IH)均购自Auragene;二甲苯(批号:10023418)、无水乙醇(批号:10009218)均购自国药集团。
1.4 主要仪器 SSW-600-2S型电热恒温水槽(上海博迅实业有限公司医疗设备厂);YT-6C型生物组织摊烤片机(湖北孝感分析试剂公司);P031IH防脱载玻片(Auragene);AE41光学显微镜(美国Motic);AG135电子天平(梅特勒-托利多);M1ii1-Qadvantage自动双重纯水蒸馏器(贝徕美生物科技有限公司);可调式移液器(德国Eppendorf公司);5810R台式高速冷冻离心机(德国Eppendorf公司);LMQ.C立式高压蒸汽灭菌器(山东新华医药公司);BJH-30P陶瓷自动中药煲(潮州市科力电器有限公司)。
1.5 分组与造模 将60只SD大鼠随机分为正常对照组、出血模型组、云南白药组、水牛角高剂量组、水牛角中剂量组、水牛角低剂量组,每组10只。除正常对照组大鼠外,其余各组大鼠以5%乙醇代替自由饮水,并灌胃干姜水煎液(15 g/kg),复制血热出血模型[6]。正常对照组自由饮水,并灌胃等体积蒸馏水。
1.6 实验给药 根据前期预实验结果设置各组给药剂量。造模6 h后,云南白药组灌胃云南白药溶液,0.5 g/(kg·d)。水牛角高、中、低剂量组大鼠分别灌胃高、中、低剂量的水牛角水煎液,剂量分别为36.0、18.0、9.0 g/(kg·d)。正常对照组、出血模型组大鼠灌胃等体积蒸馏水,10.0 mL/(kg·d)。1次/d,连续14 d。
1.7 观察指标
1.7.1 一般体征 给药前、给药后(第14天),24 h之内监测代谢笼中各组大鼠饮水量、摄食量、尿量及粪便量的变化,继续观察24 h,计算各组大鼠每100 g体质量的上述指标平均值;并于每组大鼠各取新鲜粪便1粒,先测湿质量,再置于105 ℃的烘干箱5 h,冷却后测干质量。粪便含水量=[(湿质量-干质量)/湿质量]×100%;体质量增长率=(给药后体质量-给药前体质量)/给药前体质量×100%。
给药前、给药后清晨分别测定大鼠肛温。
1.7.2 凝血功能 末次给药1 h后,10%水合氯醛(3 mL/kg)腹腔注射麻醉,手术台上切开腹腔找到腹主动脉,用采血管穿入其中,每只大鼠取10 mL血液,3.8%枸橼酸钠(1∶9)抗凝,4 ℃,3 000 r/min(离心半径30 cm)离心10min,取血清,测定凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)、凝血酶时间(TT)、纤维蛋白降解产物(FDP)、抗凝血酶Ⅲ(AT)。
1.7.3 肺组织、胃组织病理学变化 大鼠取血后处死,取右叶肺、胃组织,10%多聚甲醛溶液固定48 h,用全自动生物组织脱水机进行脱水、浸蜡、包埋、切片、苏木精和伊红(HE)染色,光镜观察拍片。
1.8 统计学方法 采用SPSS 26.0软件进行统计分析,计量资料以“均数±标准差”()表示,符合正态分布且方差齐,计量资料比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般体征 出血模型组大鼠肛温高于正常对照组(P<0.01),体质量增长率、摄食量、饮水量、尿量、粪便量及粪便含水量均低于正常对照组(P<0.01);云南白药组大鼠肛温低于出血模型组(P<0.05),体质量增长率高于出血模型组(P<0.01);水牛角高、中剂量组大鼠肛温低于出血模型组(P<0.01或P<0.05),体质量增长率、摄食量、饮水量、尿量、粪便量及粪便含水量均高于出血模型组(P<0.01或P<0.05);水牛角高剂量组大鼠肛温低于云南白药组(P<0.01);水牛角高、中剂量组大鼠摄食量、饮水量、尿量、粪便量及粪便含水量均高于云南白药组(P<0.01或P<0.05);水牛角高剂量组大鼠体质量增长率、摄食量、饮水量、尿量、粪便量及粪便含水量均高于水牛角低剂量组(P<0.01或P<0.05)。(见表1)
表1 各组大鼠一般体征比较 ()
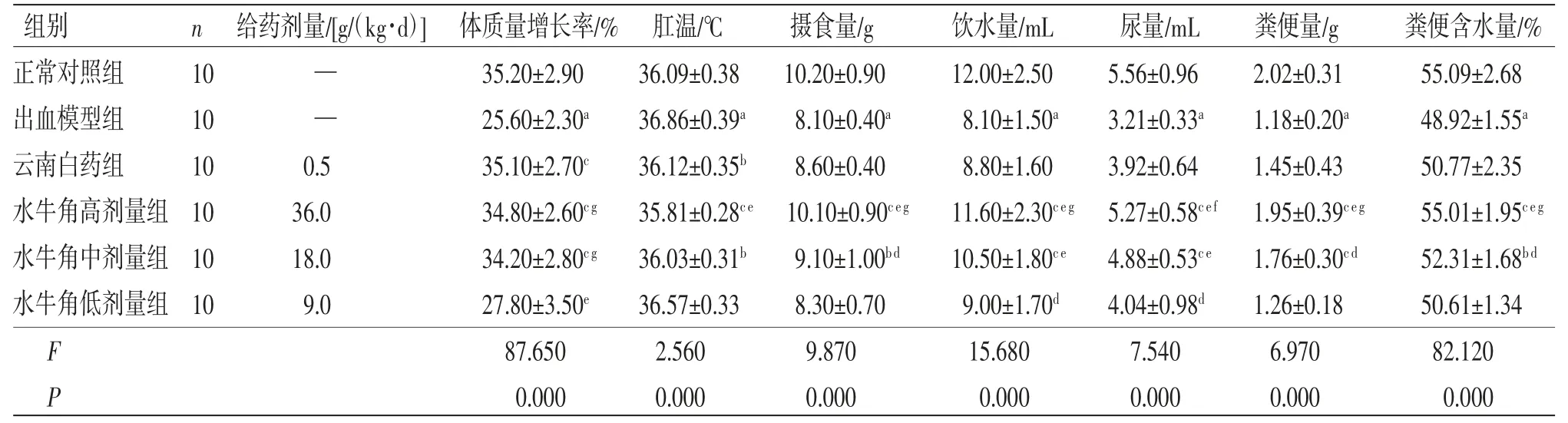
表1 各组大鼠一般体征比较 ()
注:与正常对照组比较,aP<0.01;与出血模型组比较,bP<0.05,cP<0.01;与云南白药组比较,dP<0.05,eP<0.01;与水牛角低剂量组比较,fP<0.05,gP<0.01。
?
2.2 各组大鼠凝血功能比较 出血模型组大鼠PT、APTT均低于正常对照组,FIB、TT均高于正常对照组,差异均有统计学意义(P<0.01或P<0.05)。云南白药组大鼠TT、FIB均低于出血模型组(P<0.05);云南白药组大鼠PT、APTT与出血模型组比较,差异均无统计学意义(P>0.05)。水牛角高、中剂量组大鼠PT、APTT均高于出血模型组,FIB、TT均低于出血模型组,差异均有统计学意义(P<0.01或P<0.05);水牛角低剂量组大鼠FIB低于出血模型组(P<0.01);水牛角低剂量组大鼠PT、APTT、TT与出血模型组比较,差异均无统计学意义(P>0.05)。水牛角高剂量组大鼠PT、APTT高于云南白药组(P<0.05);水牛角高、中剂量组大鼠PT、APTT高于水牛角低剂量组,FIB低于水牛角低剂量组,差异均有统计学意义(P<0.01或P<0.05);水牛角高剂量组大鼠PT、APTT、TT、FIB与水牛角中剂量组比较,差异无统计学意义(P>0.05)。(见表2)
表2 各组大鼠凝血功能指标比较 ()
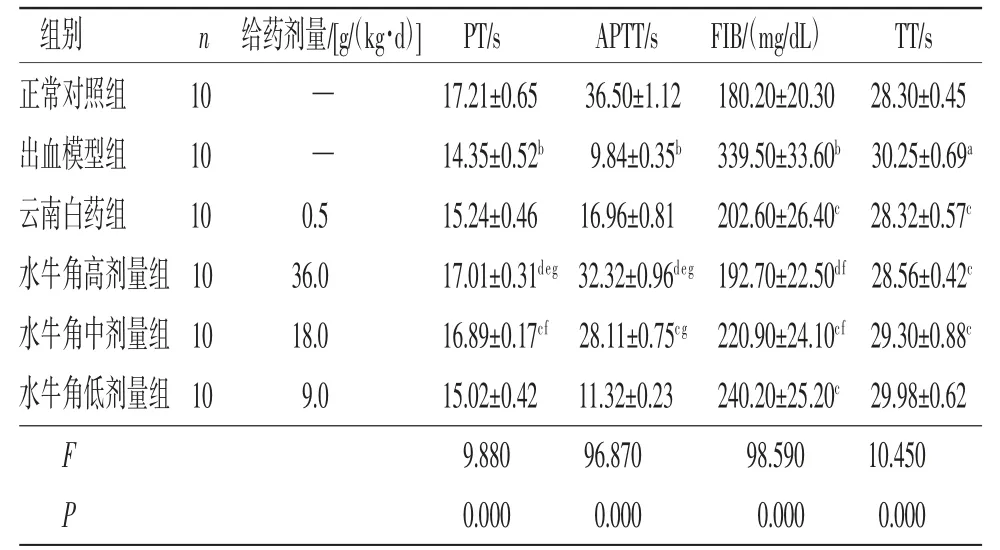
表2 各组大鼠凝血功能指标比较 ()
注:与正常对照组比较,aP<0.05,bP<0.01;与出血模型组比较,cP<0.05,dP<0.01;与云南白药组比较,eP<0.05;与水牛角低剂量组比较,fP<0.05,gP<0.01。
?
2.3 各组大鼠FDP、AT比较 出血模型组大鼠FDP、AT高于正常对照组(P<0.01);云南白药组大鼠AT与出血模型组比较,差异无统计学意义(P>0.05);云南白药组大鼠FDP低于出血模型组(P<0.01);水牛角高、中剂量组大鼠FDP、AT均低于出血模型组(P<0.01);水牛角低剂量组大鼠FDP、AT与出血模型组比较,差异无统计学意义(P>0.05)。水牛角高剂量组大鼠FDP、AT低于云南白药组(P<0.01);水牛角中剂量组大鼠AT低于云南白药组(P<0.05);水牛角中剂量组大鼠FDP与云南白药组比较,差异无统计学意义(P>0.05)。水牛角高、中剂量组大鼠AT、FDP低于水牛角低剂量组,差异均有统计学意义(P<0.01或P<0.05);水牛角高剂量组大鼠FDP、AT与水牛角中剂量组比较,差异无统计学意义(P>0.05)。(见表3)
表3 各组大鼠FDP、AT 比较 ()
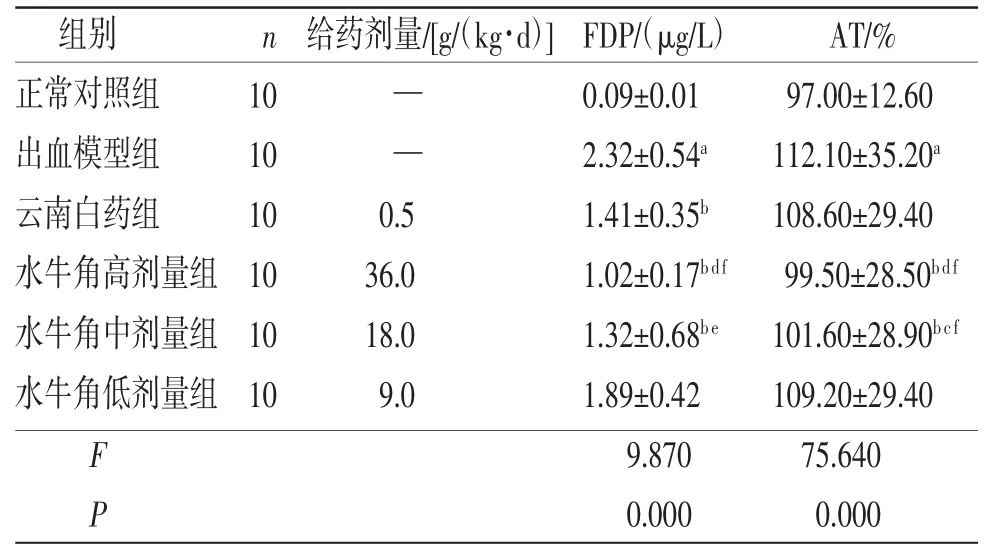
表3 各组大鼠FDP、AT 比较 ()
注:与正常对照组比较,aP<0.01;与出血模型组比较,bP<0.01;与云南白药组比较,cP<0.05,dP<0.01;与水牛角低剂量组比较,eP<0.05,fP<0.01。
?
2.4 大鼠肺组织病理学变化 正常对照组大鼠肺泡、支气管及肺间隔基本正常。出血模型组大鼠肺泡结构明显被破坏,肺泡壁毛细血管扩张充血,肺泡腔少量红细胞浸润,伴炎症细胞浸润。与出血模型组比较,云南白药组、水牛角低剂量组、水牛角中剂量组、水牛角高剂量组大鼠肺出血表现均不同程度减轻,尤其以水牛角高剂量组最明显。水牛角高剂量组大鼠肺泡结构相对完整,肺间质及间隔出血、肺泡壁显着改善,未见明显炎症细胞浸润。云南白药组、水牛角中剂量组可见部分肺泡结构破坏,肺间质和间隔少量出血,纤维组织少量增生,可见少量炎症细胞浸润。水牛角低剂量组以上情况稍有改善,但不明显。(见图1)
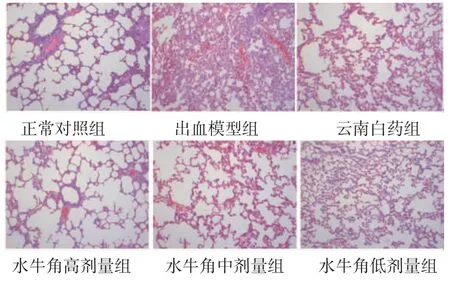
图1 各组大鼠肺组织病理图 (HE,×100)
2.5 大鼠胃组织病理学变化 正常对照组大鼠胃黏膜基本正常。与正常对照组比较,出血模型组大鼠胃黏膜水肿、充血、炎症细胞浸润,固有层中性粒细胞浸润,胃底腺有少量不规则现象,主细胞和壁细胞数明显减少。与出血模型组比较,云南白药组、水牛角低剂量组、水牛角中剂量组、水牛角高剂量组大鼠胃黏膜损伤有不同程度减轻,尤其以水牛角高、中剂量组改善明显。(见图2)
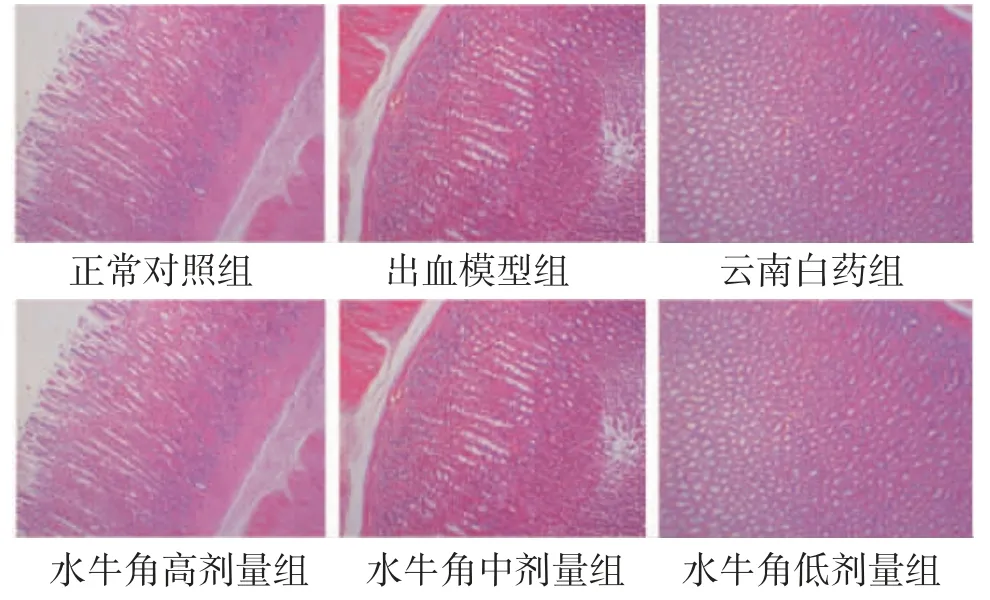
图2 各组大鼠胃组织病理图 (HE,×100)
3 讨论
研究发现,清热类中药可在炎症反应环节发挥保护血管内皮细胞、抗感染作用[9-11],但水牛角的清热止血作用机制尚不清楚。本实验采用干姜水煎液灌胃并以5%乙醇代替自由饮水,建立大鼠血热出血模型。结果显示,模型大鼠体质量、摄食量等减少,肺组织、胃组织出血,并且大鼠PT、APTT缩短,FIB含量增加,TT延长,AT、FDP升高,表明血热出血模型复制成功。
血液黏度是反映血液在血管中流动是否通畅的指标。血液黏度高和血流速度变慢,则容易发生血栓或栓塞性疾病,从而导致血液淤滞、血溢脉外而出血[12-13]。常见原因有血细胞数量增多,红细胞变形性差,血小板数量增高及黏附性增强等,或血浆中溶质成分改变,如血糖、血脂、纤维蛋白原浓度升高等[14]。本实验中,血热出血模型组大鼠饮水量、摄食量明显减少,尿量、粪便含水量及体质量增长率均明显下降,全血黏度及血浆黏度显着增加,表明干姜之辛热能入血分,耗伤津液,导致全血黏度增加、凝血功能异常,引起DIC倾向;而高、中剂量的水牛角水煎液和云南白药可改善大鼠饮水量、摄食量等一般体征,降低FIB、AT、FDP,延长PT、APTT,缩短TT,使全血及血浆黏度下降,改善血液流动性。而低剂量水牛角水煎液对以上指标改善不明显,提示水牛角的清热止血作用与剂量密切相关。本实验结果显示,水牛角高、中剂量组大鼠FDP、AT均低于出血模型组,表明水牛角水煎液能通过调整纤溶系统的动态平衡,改善肺组织和胃组织出血等病理损伤,从而综合发挥止血作用。与既往学者研究发现一致[2,15]。
关于水牛角的成分,有研究采用超高效液相色谱-四极飞行时间质谱法(UHPLC Q-TOF-MS)结合主成分分析法(principal component analysis, PCA)对水牛角、羚羊角、山羊角、牛角骨的角蛋白进行分类,并找出其标记肽段而进行鉴定。结果表明,每个样品的标记肽隐藏在大量的胰蛋白酶肽中,4种样品的四基峰离子(BPI)图谱非常相似[16]。近红外光谱技术结果显示,水牛角水解过程中脯氨酸、酪氨酸、缬氨酸、苯丙氨酸和赖氨酸的浓度最高[17-18];且水牛角与羚羊角均含有酰胺基团、CH基团和Ca3(PO4)2混合物[19]。因此,水牛角的抗血栓、抗凝血作用,可能与其含有的多肽段及氨基酸成分有关[20-22]。水牛角发挥止血的具体机制及成分有待于进一步研究。



