王绍洁,张 莹,梁晗业,张明波,徐志立△
1 大连市儿童医院,辽宁 大连 116012; 2 辽宁中医药大学药学院,辽宁 大连 116600
炎性肠病(inflammatory bowel disease,IBD)为一种常见的、慢性、反复发作性、非特异性肠炎症性疾病,病因尚未完全阐明。主要临床表现包括腹泻、黏液脓血便、腹痛等,病变连续性、弥漫性分布于结肠黏膜及黏膜下层,多数可累及直肠和乙状结肠[1]。
五味子为木兰科植物五味子Schisandra chinensis(Turcz.)Baill.(北五味子)的干燥成熟果实。《神农本草经》载:五味子性温,味酸、甘,归肺、心、肾经,具有益气滋肾、生津敛汗、涩精止泻、宁心安神等功效[2]。主要化学成分为木脂素类,其中五味子甲素(去氧五味子素、五味子素A,deoxyschisandrin)为其主要活性成分之一。关于五味子甲素的相关研究,以往主要集中于保肝等方面[3],对炎性肠病的治疗作用报道甚少,本研究对此进行初步探讨,现报道如下。
1 材料与方法
1.1 动物昆明种小鼠60 只,雌雄各半,体质量18~22 g,购自辽宁长生生物技术有限公司,实验动物许可证号:SCXK(辽)2020-0001。
1.2 药物与试剂五味子甲素(纯度≥98%,购自南京道斯夫生物科技有限公司,批号:W-005-151221),使用时以蒸馏水配制所需浓度。柳氮磺吡啶(SASP)结肠溶胶囊(广东强基药业有限公司,批号:160101);2,4,6-三硝基苯磺酸(TNBS,Sigma公司,批号:SLBP0899V);核转录因子κB(nuclear factor-κB,NF-κB)ELISA 检 测 试 剂 盒(批号:20160502)、环氧合酶2(cyclooxygenase,COX-2)ELISA检测试剂盒(批号:20160503)、羊抗兔IgGHRP(批号:20160710)、兔抗NF-κB 抗体(批号:20160605)、兔抗COX-2 抗体(批号:20160605)均购自南京建成生物工程研究所;全蛋白提取试剂盒(批号:18020220)、BCA 蛋白定量检测试剂盒(批号:17090820)均购自江苏凯基生物股份有限公司;反转录试剂盒(RevertAidTM First Strand cDNA Synthesis Kit,赛默飞公司,批号:61160020)。
1.3 仪器MR-96A 型酶标仪(深圳迈瑞生物医疗电子股份有限公司);UV-5600 型紫外可见分光光度计(上海元析仪器有限公司);TG-16W 型台式离心机(长沙湘仪离心机有限公司);MA240D 型电子分析天平(上海第二天平仪器厂)。
1.4 方法
1.4.1 IBD 模型制备及给药[4-5]将小鼠随机分为正常对照组、模型对照组、柳氮磺吡啶组及五味子甲素高(80 mg/kg)、中(40 mg/kg)、低(20 mg/kg)剂量组,每组10 只。将500 mg TNBS 溶于50%乙醇制成2.5%TNBS乙醇溶液。小鼠禁食24 h后,腹腔注射10%乌拉坦0.01 mL/g麻醉,将静脉留置针套管通过小鼠肛门轻轻插入结肠,至套管顶端距离肛门约3 cm,使小鼠倒立,除正常对照组外,各组小鼠均向相连的1 mL 注射器内缓缓注入TNBS 60 μL。拔出套管,使小鼠保持倒立60 s,放入笼中。正常对照组小鼠注入同体积50%乙醇溶液。24 h 后各组小鼠按上述方法重复操作1 次,制备炎性肠病小鼠模型。
小鼠经TNBS诱导炎性肠病48 h后,五味子甲素高、中、低剂量组分别灌胃五味子甲素80、40、20 mg/kg,柳氮磺吡啶组灌胃柳氮磺吡啶500 mg/kg,正常对照组与模型对照组灌胃等体积蒸馏水,每日1次,连续14天。
1.4.2 IBD小鼠活动、排便及粪便隐血情况 造模结束,称量小鼠体质量,观察小鼠一般状态,记录活动及排便情况。末次给药后,各组小鼠单只放入小鼠盒内3 h,观察各组小鼠粪便形状、质地,记录排便次数。以每粒或每堆(不能分清粒数者)为1次,记录排便总次数。以滤纸上有无污迹作为稀便、干便区分标准,记录稀便次数。稀便率(%)=稀便次数/总便次数×100%。收集各组小鼠3 h粪便,称粪便湿重,置于80 ℃烘箱中30 min 后,称粪便干重,计算粪便含水率(%)=(粪便湿重-粪便干重)/粪便湿重×100%。
使用隐血试剂盒说明书测定小鼠粪便隐血程度。考察各组小鼠疾病活动指数(disease activity index,DAI),用大便性状改变和有无便血作为DAI 评价小鼠IBD 评分。粪便性状评分:稀便率0%~19%计0分,20%~39%计1分,40%~59%计2分,60%~79%计3 分,80%~100%计4 分;隐血程度:阴性0分,弱阳性1分,阳性2分,强阳性3分,肉眼可见便血4 分。DAI 评分=粪便性状评分+隐血程度评分。
1.4.3 ELISA 实验 末次给药2 h 后,颈脱臼法处死小鼠,迅速取血及剪取结肠,结肠用预冷生理盐水冲洗干净,用冰生理盐水制成10%组织匀浆,离心半径8 cm,3500 r/min 离心10 min,取上清,检测IBD 小鼠结肠组织中NF-κB、COX-2 及血清COX-2含量。
1.4.4 免疫组化实验[6]末次给药2 h 后,颈脱臼法处死将小鼠,马上剖取结肠组织,10%甲醛溶液固定,石蜡包埋、切片。石蜡切片经常规脱蜡、抗原修复、阻断内源性过氧化物酶、一抗孵育,DAB显色,复染,中性树胶封片等步骤,检测结肠组织中NF-κB和COX-2表达。
1.4.5 Western Blot 实验[7]总蛋白提取、电泳、转膜、封闭后,取膜,置于5%脱脂奶粉37 ℃孵育2 h。将NF-κB、COX-2 以及β-actin 蛋白抗体分别配成1∶1000 和1∶800 浓度,4 ℃孵育过夜,TTBS室温下脱色摇床洗3次,每次5 min。同上方法稀释二抗(1:2000),室温下孵育90 min,室温下TTBS洗3次,每次5 min。DAB显色,Image J扫描分析。以NF-κB、COX-2 与β-actin 面积灰度比值作为NF-κB、COX-2表达量。
1.4.6 RT-PCR实验[8]将各组小鼠0.1 g结肠组织匀浆,常规方法提取总RNA,按试剂盒说明书所示比例配制反应体系,逆转录合成cDNA,PCR扩增,琼脂糖凝胶电泳。各反应引物序列为NF-κB:上游5'-TGCCAAGAGTGATGACGAGGAGAG-3',下游5'-TGAGCGTGGAGGTGGATGATGG-3'(327 bp);COX-2:上游5'-CCACCTCTGCGATGCTCTTC-3',下游5'-ACATTCCCCACGGTTTTGAC-3'(107bp);β-肌动蛋白(β-actin):上游5'-GGG AAA TCG TGC GTG ACA T-3',下游5'-TCA GGA GGA GCA ATG ATC TTG-3'(381 bp),引物均由生工生物工程(上海)公司制备。PCR 反应条件设定为94 ℃预变性3 min;94 ℃变性5 s,58 ℃退火15 s,72 ℃延伸15 s (共37个循环)。凝胶成像系统拍照,应用待测基因与β-actin 条带积分光密度比值检测待测基因相对表达水平。
1.5 统计学方法采用SPSS 11.5软件分析数据,计量资料以±s表示,组间两两比较采用LSD-t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 小鼠体质量和DAl正常对照组小鼠精神状态良好,行为活跃,毛发光泽,肛周洁净,大便成形;模型对照组小鼠精神萎靡,摄食减少,活动明显减少,皮毛松耸,拱背,大便稀软或腹泻,体质量减少明显,隐血检测呈强阳性。各给药组小鼠精神状态良好,毛发光泽,体质量逐渐增加。给药14 天后,与模型对照组相比,各给药组小鼠体质量增加明显,五味子甲素高、中剂量组与柳氮磺吡啶组小鼠隐血程度及DAI 降低(P<0.05)。见表1—2。
表1 各组小鼠体质量比较(±s)g
表1 各组小鼠体质量比较(±s)g
注:*表示与模型对照组比较,P<0.05;#表示与正常对照组比较,P<0.05
组别正常对照组模型对照组五味子甲素高剂量组五味子甲素中剂量组五味子甲素低剂量组柳氮磺吡啶组给药14天25.2±1.5*16.6±1.3#23.3±1.3*21.9±1.8*21.3±2.4*22.7±1.2*鼠数10 10 10 10 10 10给药前21.6±1.2 21.9±1.8 21.8±2.3 21.3±2.2 21.1±1.4 21.5±2.1给药1天19.9±1.4 19.1±2.1 19.0±1.9 18.6±1.8 18.5±2.0 19.1±1.8给药7天22.8±1.6*18.9±1.4#21.7±2.8*20.6±1.5 20.4±2.9 21.2±1.8*
表2 各组小鼠隐血程度和DAl评分比较(±s)分
表2 各组小鼠隐血程度和DAl评分比较(±s)分
注:*表示与模型对照组比较,P<0.05;#表示与正常对照组比较,P<0.05
DAI 1.6±0.7*5.4±0.7#3.1±0.8*4.0±1.1*5.1±0.9 3.0±0.7*组别正常对照组模型对照组五味子甲素高剂量组五味子甲素中剂量组五味子甲素低剂量组柳氮磺吡啶组鼠数10 10 10 10 10 10隐血程度1.4±0.7*2.6±0.5#1.7±0.6*1.9±0.7*2.5±0.5 1.9±0.6*
2.2 小鼠腹泻情况与正常对照组比较,模型对照组小鼠排便次数、稀便率及粪便含水率均增加(P<0.01),与模型对照组比较五味子甲素高、中剂量组小鼠排便次数、稀便率及粪便含水率均改善(P<0.05)。见表3。
表3 各组小鼠腹泻情况比较(±s)

表3 各组小鼠腹泻情况比较(±s)
注:*表示与模型对照组比较,P<0.05;#表示与正常对照组比较,P<0.05
稀便(%)14.1±3.3*72.2±11.2#33.1±7.6*49.8±12.4*65.8±14.3 32.0±5.3*组别正常对照组模型对照组五味子甲素高剂量组五味子甲素中剂量组五味子甲素低剂量组柳氮磺吡啶组鼠数10 10 10 10 10 10排便次数(次)6.7±1.6*11.1±2.5#7.6±1.3*8.6±1.3*10.4±2.5 7.8±1.5*粪便含水量(%)37.4±8.9*79.1±6.1#48.9±8.2*56.7±7.4*72.0±11.2 46.7±3.2*
2.3 小鼠NF-κB、COX-2 含量与正常对照组比较,模型对照组小鼠血清COX-2及结肠组织NF-κB、COX-2 含量增加(P<0.05);与模型对照组比较,五味子甲素高剂量组及柳氮磺吡啶可抑制小鼠体内NF-κB、COX-2水平。见表4。
表4 各组小鼠体内NF-κB及COX-2含量比较(±s)
表4 各组小鼠体内NF-κB及COX-2含量比较(±s)
*表示与模型对照组比较,P<0.05;#表示与正常对照组比较,P<0.05
组别正常对照组模型对照组五味子甲素高剂量组五味子甲素中剂量组五味子甲素低剂量组柳氮磺吡啶组结肠组织中NF-κB(ng/0.1 g)0.258±0.396*0.858±0.126#0.507±0.131*0.633±0.094*0.766±0.125 0.581±0.114*鼠数10 10 10 10 10 10血清中COX-2(ng/mL)0.238±0.836*0.880±0.157#0.377±0.098*0.593±0.120 0.816±0.077 0.396±0.120*结肠组织中COX-2(ng/0.1 g)0.130±0.030*0.284±0.068#0.138±0.024*0.214±0.043 0.254±0.048 0.179±0.061*
2.4 小鼠NF-κB、COX-2 蛋白表达与正常对照组比较,模型对照组小鼠结肠组织NF-κB和COX-2表达增加,各给药组降低,其中高剂量组与柳氮磺吡啶组减少更显着。正常对照组、高剂量组及柳氮磺吡啶组小鼠结肠上皮细胞阳性染色很少;模型对照组大部分上皮细胞及浸润的炎细胞呈阳性反应,染色呈深棕色;中、低剂量组部分上皮细胞呈阳性反应。见图1。
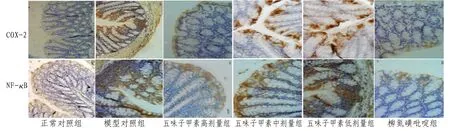
图1 各组小鼠结肠中NF-κB、COX-2表达(免疫组化法,×400)
2.5 小鼠结肠组织NF-κB、COX-2 表达与正常对照组比较,模型对照组小鼠结肠组织COX-2 表达增加(P<0.05);与模型对照组比较,五味子甲素各剂量组小鼠结肠平滑肌内NF-κB、COX-2 表达降低(P<0.05)。见图2及表5。

图2 各组小鼠结肠组织NF-κB、COX-2蛋白表达电泳图
表5 各组小鼠结肠组织NF-κB、COX-2蛋白表达比较(±s)
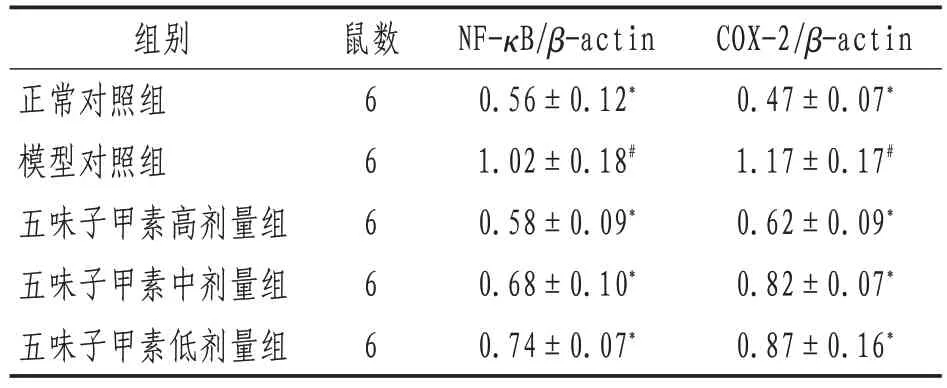
表5 各组小鼠结肠组织NF-κB、COX-2蛋白表达比较(±s)
注:*表示与模型对照组比较,P<0.05;#表示与正常对照组比较,P<0.05
COX-2/β-actin 0.47±0.07*1.17±0.17#0.62±0.09*0.82±0.07*0.87±0.16*组别正常对照组模型对照组五味子甲素高剂量组五味子甲素中剂量组五味子甲素低剂量组鼠数NF-κB/β-actin 0.56±0.12*1.02±0.18#0.58±0.09*0.68±0.10*0.74±0.07*6 6 6 6 6
2.6 小鼠结肠组织NF-κB、COX-2 mRNA 表达与正常对照组比较,模型对照组COX-2、NF-κB mRNA表达升高(P<0.05);与模型对照组比较,五味子甲素高剂量组与柳氮磺吡啶组COX-2、NF-κB mRNA表达减少(P<0.05)。见表6、图3。0.22±0.05*0.70±0.12#0.27±0.05*0.59±0.05*0.79±0.09 0.33±0.07*

图3 各组小鼠结肠组织NF-κB、COX-2 mRNA表达电泳图
表6 各组小鼠结肠组织NF-κB mRNA、COX-2 mRNA表达(±s)
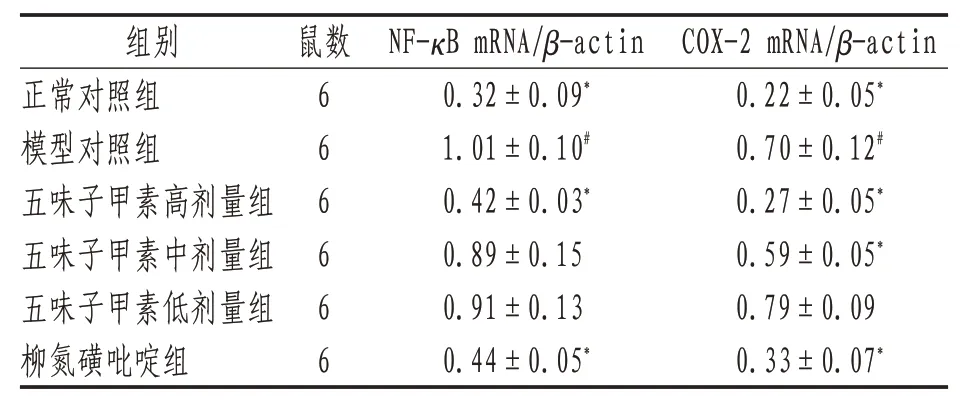
表6 各组小鼠结肠组织NF-κB mRNA、COX-2 mRNA表达(±s)
注:*表示与模型对照组比较,P<0.05;#表示与正常对照组比较,P<0.05
COX-2 mRNA/β-actin组别鼠数NF-κB mRNA/β-actin 0.22±0.05*0.70±0.12#0.27±0.05*0.59±0.05*0.79±0.09 0.33±0.07*正常对照组模型对照组五味子甲素高剂量组五味子甲素中剂量组五味子甲素低剂量组柳氮磺吡啶组6 6 6 6 6 6 0.32±0.09*1.01±0.10#0.42±0.03*0.89±0.15 0.91±0.13 0.44±0.05*
3 讨论
IBD 是一种慢性反复发作的炎症性肠道疾病,主要包括克罗恩病(Crohn's disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)[9],环境因素、免疫因素及遗传因素等均影响炎性肠病的进展。近年来,IBD 的发病率尤其在社会经济高度发达的国家和地区持续增高[10]。近年,IBD 在我国的发病率及确诊率亦逐年增加[11]。
IBD 属中医“泄泻”范畴。“泄泻”是机体感受外邪、饮食所伤、情志失调及脏腑虚弱等原因导致的脾胃受损、湿困脾土、肠道功能失司。“泄泻”的主要病变在脾胃与大小肠,病变主脏在脾,脾失健运是关键,同时与肝、肾密切相关。病理因素主要是湿,湿为阴邪,易困脾阳,脾受湿困,则运化不健,《医宗必读》载“无湿不成泻”。“泄泻”可夹寒、夹热、夹滞。脾虚湿盛是导致泄泻的关键[12]。
NF-κB 在许多细胞中均有表达,是一种普遍存在的具有多向性转录调节作用的转录因子,并且NF-κB 为多种重要生理过程的主要调节因子,对免疫系统发挥重要调节作用。在IBD复杂的细胞因子网络失调中,NF-κB 活化是其中一个中心环节。NF-κB 长期激活可加重肠上皮慢性炎症[13],并且NF-κB 的长期激活所致炎症与多种类型癌症风险相关(如IBD 与典型结肠癌等)[13-14]。COX-2是环氧酶的一种亚型,正常组织细胞中几乎不表达,但在刺激因素(细胞因子、炎症介质、肿瘤促进剂及癌基因等)作用下可大量合成而高表达,COX-2上调与炎症及肿瘤的发生、发展和转移密切相关。NF-κB过表达可激活下游靶基因COX-2表达上调;而COX-2 也可通过参与ROS 代谢促进NF-κB 激活和破坏上皮屏障完整性[15]。
五味子中主要成分包括挥发油、木脂素类、多糖以及有机酸类。现代研究表明五味子具有广泛的生物活性,中枢神经系统方面,可保护脑组织、增强学习记忆能力、镇静安眠、抗衰老、镇痛等;在消化系统方面可抗溃疡;心血管系统方面具有抗心肌缺血、抑制心肌收缩力、减慢心率及降血压等作用;亦有降血糖、肝保护、增强免疫功能等作用[16-18]。五味子甲素为五味子中含有的木脂素类活性成分,但目前缺乏对其药理活性的深入研究。
本研究结果显示,五味子甲素可抑制IBD 小鼠体质量减轻,减少TNBS 诱导的IBD 小鼠排便次数,降低稀便率及粪便含水量,并能缓解IBD 小鼠粪便隐血程度及疾病活动指数。本研究发现,五味子甲素能够抑制IBD 小鼠体内NF-κB、COX-2 基因转录和mRNA表达,下调COX-2、NF-κB蛋白表达。
总之,五味子甲素可能通过抑制IBD的NF-κB/COX-2 通路激活从而抑制炎性细胞浸润,发挥抗炎作用,达到治疗IBD的目的。



