卢梦月,刘 锐,周 莹,田 智,刘付昌盛
1 广西中医药大学,广西 南宁 530200; 2 广西中医药大学附属瑞康医院,广西 南宁 530011
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是最常见的间质性肺疾病,预后差,病死率高。IPF中位生存期为2.5~3.5年,死亡年龄中位数为65 岁,并且发病率随年龄增长而增加。现有治疗方案中,IPF 患者经酪氨酸激酶抑制剂尼达尼布和抗纤维化吡啶类药物吡非尼酮治疗虽然能减缓强迫肺活量的降低和疾病进展速度[1-4],但长期疗效尚不确定,且不能完全有效降低死亡率、提高生存率,因此,需要寻找新的靶点和药物干预措施,以便更有效地治疗IPF,降低其死亡率。
麦门冬汤出自《金匮要略》,为肺痿专设汤剂。原方由麦门冬七升、半夏一升、人参三两、甘草二两、粳米三合、大枣十二枚组成,有滋养肺胃,降逆和中功效,原治呃逆上气,咽喉不利证,后世医家用于因肺胃阴虚,虚火上炎所致的肺痿胃阴亏虚证[5]。本研究主要通过生物信息学和网络药理学方法探讨麦门冬汤治疗肺纤维化的可能机制。
1 方法
1.1 麦门冬汤药物活性成分和靶点筛选运用中药分子机制生物信息学分析工具(A bioinformatics analysis tool for molecular mechanism of traditional Chinese medicine,BATMAN-TCM)以得分≥30与P<0.05为临界值[6],中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)数据库以口服生物利用度(oral bioavailability,OB)≥30%、药物相似性(druglikeness,DL)≥0.18[7]检索麦门冬汤相关化合物及其靶点,将收集到的中药活性成分剔除重复后与相关文献结合分析。
1.2 lPF 相关疾病靶点检索以“Idiopathic pulmonary fibrosis”作为关键词检索人类基因数据库GeneCards)、比较毒物基因组数据库(CTD)、基因疾病关联数据库(DisGeNET)、药物靶标数据库(DrugBank)和在线孟德尔人类遗传数据库(OMIM)中已知的疾病靶点,数据清理原则为某一疾病靶点至少在3 个数据库中都被收录,保存删除重复后所得靶点。
1.3 lPF相关靶点在美国国立生物中心基因表达集数据库(Gene Expression Omnibus;https://www.ncbi.nlm.nih.gov/geo/)以“Idiopathic pulmonary fibrosis”为关键词检索与IPF 相关的芯片数据,获得编号为GSE53845 的芯片数据原始文件和GPL6480 芯片基因注释文件,该芯片数据的原始文件检测了包括40例IPF患者、8名健康对照者的肺活检组织,并进行了全基因组转录组分析。原始数据采用robust multiarray average(RMA)算法进行背景校正和矩阵数据归一化处理,利用limma 包二次分析芯片数据,以P值(P<0.05)且以1为底数的异倍数(fold change,FC)logFC≥1或logFC≤-1 为条件筛选相关数值,将筛选出的差异基因与已知IPF疾病靶点取交集,即为IPF发病过程已知靶点。
1.4 麦门冬汤对lPF 作用靶点预测通过venny 2.1.0 软件(https://bioinfogp.cnb.csic.es/tools/venny/index.html)对筛选的麦门冬汤预测靶点与IPF 相关发病机制基因靶点进行对比分析,两者交集基因即为麦门冬汤治疗IPF 作用机制相关靶点。并将所得基因靶点导入SRTING 数据库,将物种设置为人类,获得相关蛋白互作网络图,保存为TSV 格式,运用Cytoscape 软件对蛋白互作网络进行拓扑分析。
1.5 相关microRNA 在线预测将麦门冬汤治疗IPF潜在作用靶点的Gene Symbol上传到microRNA在线预测工具(http://ophid.utoronto.ca/mir-DIP/index.jsp)预测相关miRNA,按Integrated Score选取前10个miRNAtargets,通过Cytoscape进行可视化分析,探究麦门冬汤通过miRNA 治疗IPF的相关机制。
1.6 靶点功能富集分析将麦门冬汤治疗IPF潜在作用靶点的Gene Symbol 上传到David 6.8数据库(https://david.ncifcrf.gov/)进行功能富集分析,收集生物过程(biological process,BP)、细胞成分(cellular component,CC)、分子功能(molecular function,MF)和KEGG 通路(KEGGPathway)的富集分析结果,并以P<0.05 为显着富集的生物功能和生物信号通路,根据富集分析结果与相关信号通路,探究麦门冬汤潜在靶点治疗IPF的相关机制。
1.7 分子对接选取Cytoscape软件拓扑分析结果中关联度(degree)值排名前5的化合物及12个药物-疾病交集靶点,从RCSB PDB数据库(http://www1.rcsb.org/)及TCMSP 数据库下载关键靶点与相关化合物的三维结构与化学结构,将其上传至iGEMDOCK 软件,并对关键靶点与相关化合物进行分子对接分析。
2 结果
2.1 麦门冬汤的活性成分与靶点筛选共获得包括麦门冬22 个、半夏43 个、人参168 个、甘草205个、粳米23个、大枣74个在内的502个化合物活性成分,剔除重复项后共获得1039 个麦门冬汤药物靶点。
2.2 特发性肺纤维化相关基因分析与检索在GeneCards、CTD、DisGeNET、DrugBank 及OMIM 数据库分别检索到2792、32988、378、24、322 个靶点,收集至少在3 个数据库中都被收录的疾病基因,删除重复出现的基因靶点后共获得与IPF 发生发展相关的作用靶点303个。
应用GEO数据库下载GSE53845基因芯片数据,通过GEO2R在线工具分析IPF组与对照组数据,以P<0.01 且以1 为底的差异倍数|logFC|≥1 为条件筛选到713个差异表达基因,其中包括430个上调基因和283个下调基因,并与IPF已知靶点进行关联分析,共获取43 个共同表达的疾病基因靶点。
2.3 “药物-疾病”交集靶点预测麦门冬汤与IPF药物-疾病交集靶点共12个。麦门冬汤与IPF交集靶基因包括:精氨酸酶1(ARG1)、前列腺素G/H合酶2(PTGS2)、白细胞介素13(IL13)、血管细胞黏附蛋白1(VCAM1)、Ⅰ型血管紧张素Ⅱ受体(AGTR1)、缺氧诱导因子1-α(HIF1A)、尿激酶型纤溶酶原激活剂(PLAU)、间质胶原酶(MMP1)、基质溶素1(MMP3)、胶原α-1(Ⅰ)链(COL1A1)、胶原α-1(Ⅲ)链(COL3A1)、骨桥蛋白(SPP1),以上靶基因即为麦门冬汤治疗IPF的直接或间接作用靶点。见图1。
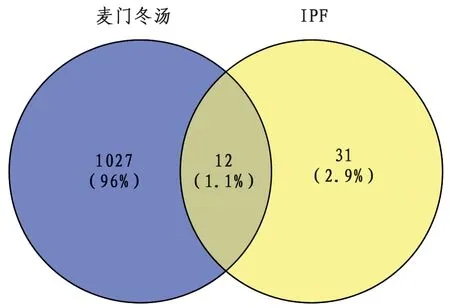
图1 麦门冬汤与特发性肺纤维化的药物-疾病交集靶标韦恩图
将上述12个交集靶点导入STRING数据库,获得相关蛋白互作网络图,保存为TSV 格式,运用Cytoscape 软件对蛋白互作网络进行拓扑结构分析,包括靶点和靶点、靶点和化合物间直接及间接作用关系。见图2。
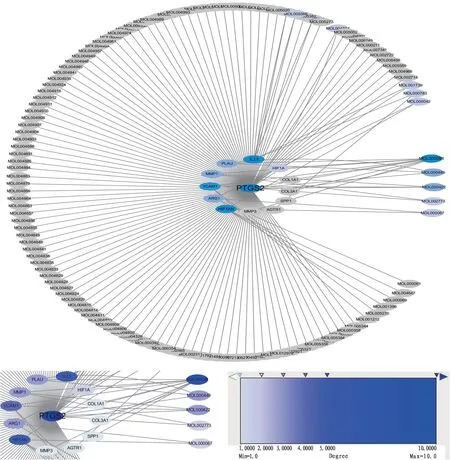
图2 麦门冬汤治疗IPF相关靶点和化合物网络图
2.4 miRNA 靶向基因调控网络构建将12 个潜在作用靶点导入mirDIP数据库进行miRNA预测分析,Minimum Score 选择very high,共搜索到与预测靶点相互关联的278条miRNA,按Integrated Score 排序选取前15 个miRNA,分别是hsa-miR-29c-3p、hsa-miR-29a-3p、hsa-miR-29b-3p、hsamiR-98-5p、hsa-miR-17-5p、hsa-let-7b-5p、hsalet-7c-5p、hsa-let-7i-5p、hsa-let-7g-5p、hsalet-7f-5p、hsa-let-7d-5p、hsa-let-7e-5p、hsamiR-26a-5p、hsa-miR-101-3p、hsa-miR-128-3p,将以上miRNA 及其相互关联的靶点数据导入Cytoscape进行可视化分析,见图3。
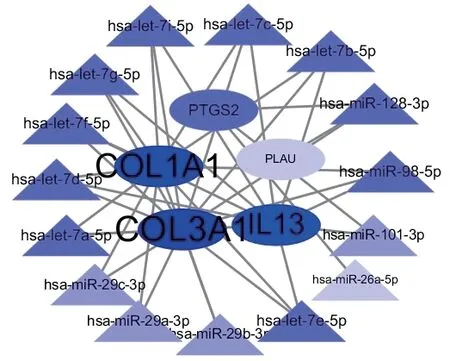
图3 miRNA靶向基因调控网络
2.5 靶点功能富集分析将12 个潜在作用靶点导入David 数据库进行GO 功能富集和KEGG 通路分析,以P<0.05 为阈值,筛选出麦门冬汤治疗IPF 参与的生物学过程与相关信号通路。发现麦门冬汤治疗IPF 潜在作用靶点参与了包括胶原分解过程、细胞外基质组织、细胞外基质分解、胶原蛋白生物合成过程、老化等29 个生物过程,细胞外空间、细胞外区域、胶原三聚体、内质网腔、细胞外基质5 个细胞组分,血小板衍生生长因子结合、丝氨酸型内肽酶活性、内肽酶活性、细胞外基质结构组成4 个分子功能;导出DAVID 数据库GO 功能富集结果,以P<0.05 为阈值,筛选出显着富集条目,将分子功能、细胞组分及前10 个条目生物过程相关数据导入GraphPad Prism 8 软件绘制成可视化条形图,见图4。KEGG 通路富集分析结果显示麦门冬汤治疗IPF 的信号通路包括NF-κB 信号通路、ECM-受体相互作用、TNF 信号通路等,其中NF-κB 信号通路差异最显着,将KEGG 通路富集分析结果数据导入Omicshare 软件进行可视化分析,见图5。
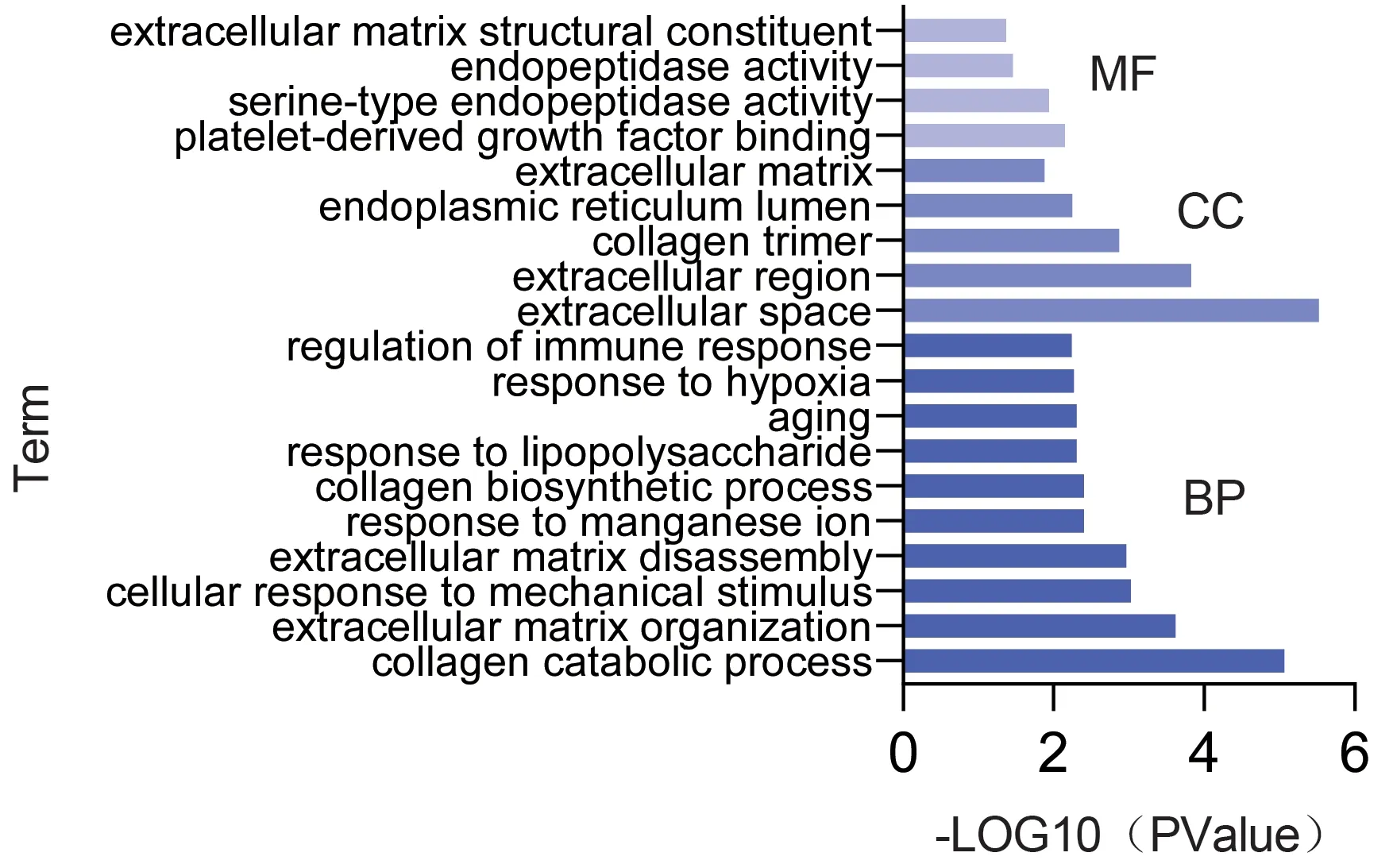
图4 麦门冬汤治疗IPF的生物学分析过程
2.6 交集靶点与相关化合物的分子对接分析在拓扑学参数计算结果中,化合物与对应靶点关联度(degree)越大,麦门冬汤通过该化合物及其相关靶点治疗IPF 的可能性越大。将关联度排名前5 的化合物槲皮素(quercetin,MOL000098)、山奈酚(kaempferol,MOL000422)、β-胡萝卜素(betacarotene,MOL002773)、豆甾醇(Stigmasterol,MOL000449)、缬氨酸(Valine,MOL000067)与12 个药物-疾病交集靶点通过iGEMDOCK 进行分子对接验证,得到60 个对接结果,见图6。对接值越低,表示二者结合性能越好,对接结果显示靶点MMP3与化合物β-胡萝卜素结合度最高,结合性能最佳,对接值为-120.723。
3 讨论
IPF 是一种进行性间质纤维化肺病,其病理特征主要表现为炎症细胞的激活与浸润、成纤维细胞大量增殖、细胞外基质过度沉积和肺组织结构破外,目前尚无有效的治疗方法。在IPF 的发生发展过程中,常涉及多种细胞因子及多条信号通路表达异常,现有的研究试图从微小核糖核酸和信号通路层面探索新的治疗方案及其相关机制。
微小RNA(MicroRNA,miRNA)是一类非编码小RNA,长度为19-22 个核苷酸,在翻译后水平调节基因表达[8-9],基于本研究miRNA-靶点网络分析发现miR-29 家族、let-7 家族等通过调节基因靶点参与了纤维化、肌成纤维细胞增殖和过度细胞外基质沉积等干预IPF的进程,这与当前IPF相关微小核糖核酸研究不谋而合。miR-29家族均与COL3A1、COL1A1相关联,Let-7家族与IL-13相关联。miR-29家族是第一批在肺、心脏和肝脏纤维化疾病中发现被下调的微小核糖核酸之一,被认为是肺纤维化的主要调节者,COL1A1、COL3A1 是miR-29 的直接靶点,miR-29 通过抑制包括COL1A1、COL3A1 等胶原蛋白在内的细胞外基质,调节与胶原蛋白合成、交联和降解相关的酶而发挥作用[10]。miR-29在肺纤维化组织中表达下调,COL1A1、COL3A1 等胶原蛋白合成增多,细胞外基质沉积,最终诱发肺间质纤维化[11-12]。COL1A1 和COL3A1 同为成纤维细胞纤维化的标志物,上皮细胞损伤后机体内成纤维细胞可活化为肌成纤维细胞[13],肺肌成纤维细胞的大量聚集和细胞外基质过度沉积被认为是IPF 病理机制之一。Let-7 家族共有let-7a、-7b、-7c、-7d、-7e、-7f、-7g和-7i、miR-98等13个包含促纤维化过程的负调节因子成员。研究发现上调let-7a 和let-7b 可抑制COL1A1 表达与肌成纤维细胞活化[14],减缓IPF 发展进程。Let-7d 则通过减缓成纤维细胞增殖,降低其迁移能力及抑制成纤维细胞因子,上调Let-7d 表达可使成纤维细胞失去部分间充质特性而达到治疗IPF 的目的[15]。Let-7c、-7e、-7f、-7g 和-7i 目前研究较少,其机制可能是通过调节促炎细胞因子IL-13 表达,抑制IPF早期炎症反应进程,起到抑制IPF的作用。
本研究GO 富集与KEGG 通路富集分析结果显示,麦门冬汤干预IPF 作用靶点主要参与了胶原分解过程、细胞外基质组织、细胞外基质分解、胶原蛋白的生物合成过程、老化等生物过程,参与调控的信号通路主要富集于NF-κB 信号通路、ECM-受体相互作用、TNF 信号通路等,还富集于癌症、阿米巴病、黏着斑等疾病通路上。TNF 信号通路和NF-κB 信号通路是常见的炎症相关信号通路,血管细胞黏附蛋白1(vascular cell adhesion molecule-1,VCAM-1)共同富集于这两条信号通路上。肺部炎症反应是肺纤维化早期病变,其介导的血管内皮细胞损伤及血管生成过多是肺间质纤维化的重要病理过程。VCAM-1 是一类膜表面糖蛋白,广泛存在于血管内皮细胞中,是介导细胞与细胞外基质相互黏附、结合的重要黏附因子。NF-κB信号通路参与机体免疫反应、炎症反应和肿瘤发生发展等多种生理病理过程,VCAM-1 被证实是其直接靶点,VCAM-1 序列中含有NF-κB 结合位点并受其调控[16-17]。当NF-κB 信号通路激活时,VCAM1表达上调,诱导血管内皮细胞黏附,细胞外基质过度沉积,从而诱导肺间质纤维化的发生发展。TNF信号通路被激活时,其关键因子TNF-α 通过刺激血管上皮细胞促进VCAM-1 及其受体表达,进而诱导纤维化[4]。
本研究发现麦门冬汤干预IPF主要与槲皮素,山奈酚,豆甾醇、β-胡萝卜素等化合物及MMP3、VCAM-1、IL-13等12个靶点密切相关,通过对以上化合物及靶点的分子对接分析发现,靶点MMP3 与化合物β-胡萝卜素结合性能最佳。MMP3 是一类主要在上皮细胞、成纤维细胞等细胞内表达的基质金属蛋白酶,通过在细胞外基质周转过程中激活基质金属蛋白酶原,降解大量的细胞外基质蛋白,调控细胞外基质中胶原蛋白不断重塑,促进胶原蛋白沉积[18]。研究发现MMP3在IPF患者移植肺内高表达,而细胞和动物模型相关研究发现MMP3可通过激活肺上皮细胞中的β-catenin 信号传导,增加E-钙黏蛋白裂解和上皮间质转化,最终发展为IPF[19]。化合物β-胡萝卜素可能通过与靶点MMP3 高度结合参与MMP3 诱导IPF 进程。而山奈酚、豆甾醇被证实具有抗炎、抗氧化、免疫调节等多种作用[20-22],由此推测麦门冬汤可在一定程度上干预IPF进展。
综上所述,本研究从生物信息学及网络药理学的角度系统预测麦门冬汤治疗IPF 的潜在分子机制,麦门冬汤治疗IPF 涉及多个miRNA、多条通路、多个靶点,在治疗IPF 时除了针对局部关键通路,还应考虑疾病病因、所处机体环境差异,进行多靶点、多系统干预,综合发挥中医药多靶点、多方面干预的可行性和优势。



