万晶晶,黄立群,张 庆,黄卫宁,*,RAYAS-DUARTE Patricia
乳酸菌发酵对燕麦淀粉物化及热力学特性的影响
万晶晶1,黄立群1,张 庆1,黄卫宁1,*,RAYAS-DUARTE Patricia2
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.美国俄克拉荷马州立大学食品与农产品研究中心,美国 俄克拉荷马州 斯蒂尔沃特 74078-6055)
以燕麦粉为原料,分别利用植物乳杆菌(L.p)和旧金山乳杆菌(L.s)两种乳酸菌对其进行发酵,研究燕麦淀粉在发酵过程中各种物化及热力学特性的变化。结果表明:燕麦粉经过两种菌发酵后pH值下降,且L.p发酵的燕麦粉pH值下降的速率和产酸量都大于L.s。但是到发酵后期,两种乳酸菌发酵的燕麦粉pH值相近。发酵燕麦淀粉的溶解度和溶胀力都随着温度的升高而增加,在不同温度下,其溶胀力和溶解度在发酵过程中的变化趋势不同,经L.P发酵的样品的溶胀力低于L.s,但溶解度大于经L.s发酵的样品。快速黏度分析仪(RVA)和差示扫描量热仪(DSC)分析得到发酵过程中燕麦淀粉的变化:发酵后燕麦淀粉糊化过程中峰值黏度随着发酵时间的延长而降低,糊化起始温度提前,糊化所需时间延长,糊化焓升高,且L.s发酵样品的糊化焓值高于L.p。发酵后燕麦淀粉的直链淀粉含量在发酵过程中呈上升趋势,L.p发酵的样品的直链淀粉的含量高于L.s。
乳酸菌;发酵;燕麦淀粉;糊化;直链淀粉
燕麦是一种多功能性谷物。和其他谷物相比,燕麦含有大量高营养价值的物质,如可溶性纤维(主要是β-葡聚糖)、蛋白质、不饱和脂肪酸、维生素、矿物质以及植物营养素等[1],它具有降低胆固醇量、降血糖、防止心血管疾病和辅助调节消化道等功效,因而成为唯一获得美国FDA健康认证的谷物[2]。燕麦的研究和利用成为世界各国研究者们关注的热点之一[3-4]。
乳酸菌发酵常用来改善产品口感和质构,增强风味和营养价值[5-6]。燕麦的乳酸菌可发酵性也引起人们的极大兴趣[7]。乳酸菌在燕麦基质生长可以利用β-葡聚糖并产生胞外多糖[8-9],这不仅可以改善产品的质构和黏性,同时提高感官品质和营养价值[10]。本课题组张坤等[11]研究了旧金山乳杆菌发酵燕麦酸面团发酵剂中β-葡聚糖含量及其分子质量的分布变化,研究发现旧金山乳酸菌发酵对β-葡聚糖分子质量分布和峰值分子质量影响不大。
燕麦粉中淀粉约占43%~64%,燕麦淀粉的物化特性成为影响燕麦及食品加工利用的关键因素之一。例如,面包的制作要求淀粉的溶胀力,沙拉酱的制作要求淀粉的乳化性,发酵粉要求淀粉的保水性等[12]。目前关于乳酸菌发酵对燕麦淀粉性质影响方面的研究鲜有报道,本研究以燕麦粉为原料,从燕麦淀粉的角度出发,探讨燕麦粉在不同乳酸菌发酵的过程中,其淀粉的溶胀力、溶解度、直链淀粉含量的变化,并通过快速黏度分析仪(RVA)和差示扫描量热仪(DSC)研究其糊化与热力学特性的变化,为燕麦烘焙与发酵食品的深加工利用提供参考。
1 材料与方法
1.1 材料与试剂
燕麦粉 内蒙古叶俊面粉厂;植物乳杆菌(Lactobacillus plantarum,L.p)、旧金山乳杆菌 (Lactobacillus sanfrancisco,L.s) 丹尼斯克有限公司。
1.2 仪器与设备
FE20实验室pH计 梅特勒有限公司(上海)公司;SPX-150/250C恒温恒湿箱 上海博讯实业有限公司医疗设备厂;高压蒸汽灭菌锅 上海三申医疗器械有限公司;超净工作台 苏净集团安泰公司;Eppendorf 5810R高速冷冻离心机 德国Eppendorf公司;快速黏度测定仪(RVA) 澳大利亚Newport Scientific公司;差示扫描量热仪(DSC) 美国Perkin-Elmer公司;SP-752紫外分光光度计 上海光谱仪器有限公司;ACPHA1-4自动压盖箱冻干机 德国Christ公司。
1.3 方法
1.3.1 菌种培养与发酵燕麦粉的制备
1.3.1.1 菌种活化与扩大培养
用接种环挑取MRS固体上的乳酸菌单菌落,接种至MRS液体培养基(10mL)中活化,30℃培养24h。将已活化好的菌悬液摇匀,取100μL接种至MRS液体培养基(10mL),在30℃进行扩大培养10h至对数后期(菌体浓度>108CFU/mL)。
1.3.1.2 发酵燕麦粉的制备
将培养至对数后期的20mL乳酸菌悬液摇匀,4℃、4000r/min离心20min,用蒸馏水冲洗两次后,接种至100g燕麦粉中,燕麦粉与水的质量比为1:2。搅拌机中搅匀后,密封。放入恒温恒湿箱中培养,培养温度为30℃,发酵时间分别为0、6、12、24h。将发酵后的燕麦粉真空冷冻干燥,磨粉,80~100目过筛备用。
1.3.2 pH值和总酸度的测定
pH值的测定根据AACC方法(2000)02-52[13]。称取10g燕麦粉,放入三角瓶中,加入90mL无CO2的蒸馏水。用磁力搅拌器搅拌30min,静置10min后用pH计测定。重复3次取平均值。
称取10g发酵剂,将其放入三角瓶中,加入90mL无CO2的蒸馏水。用磁力搅拌器搅拌30min,静置10min后用0.1mol/L NaOH溶液滴定,调pH值至滴定终点pH8.6。所需0.1mol/L NaOH溶液的毫升数即为总酸度(total titratable acidity,TTA)。重复3次取平均值。1.3.3燕麦淀粉的分离
取发酵后的燕麦粉60g加入500mL 0.01mol/L NaOH溶液,pH值调至10.4,搅拌1h后4500r/min离心15min,弃上清液,将沉淀溶解于500mL去离子水中,过80~100目筛,用HCl溶液将pH值调成中性,离心后用400mL去离子水反复离心3次。得到的淀粉沉淀采用真空冷冻干燥,磨粉过筛,贮存于4℃备用[14]。
1.3.4 燕麦淀粉溶胀力和溶解度测定
取10mL质量分数2%的淀粉乳分别在30、65、85℃条件下搅拌30min后,以4500r/min离心20min;将上清液倾入已烘干至质量恒定的铝盒中,再于105℃烘干至质量恒定,得被溶解淀粉质量(m1),称取离心管沉淀物质量(m2)。按式(1)、(2)计算溶解度(S)和溶胀力(B)[15]。
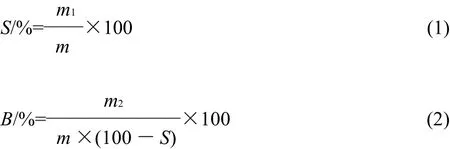
式中:m为样品干基质量/g。
1.3.5 淀粉的黏度特性分析
称取样品3.0g(干基)于样品盒中,加水25mL,先以960r/min快速搅拌10s,之后以115r/min的速度搅拌,温度在3min内从40℃加热到90℃,保温6.5min;4.5min内降温至40℃,保温5min[16]。
1.3.6 燕麦淀粉的热力学特性分析
取3.0mg的淀粉于DSC铝盒中,加入9μL的水,密封后室温下平衡过夜,使得水分分布均匀。保护气体为氮气,扫描区间为30~110℃,扫描速率为10℃/min。
1.3.7 燕麦淀粉中直链淀粉含量的测定
准确称取燕麦淀粉试样100mg置于50mL三角瓶中,加入95%乙醇1mL和1mol/L NaOH溶液9mL,涡旋振荡1min,防止结块。在沸水浴中加热10min,使淀粉糊化,冷却后,用蒸馏水转移至100mL容量瓶中稀释至刻度。取1只100mL容量瓶加入1mL 1mol/L HAC和2mL的碘液,用蒸馏水定容,作为空白对照。准确吸取5mL上述试液放入另一个100mL容量瓶中,加入1mL 1mol/L HAC和2mL的碘液,用蒸馏水定容至刻度,静置20min后,在波长620nm处用1cm比色皿测定其吸光度,根据标准曲线:y=0.2174x+0.0073(R2=0.999),即可计算出试样中直链淀粉的含量。
2 结果与分析
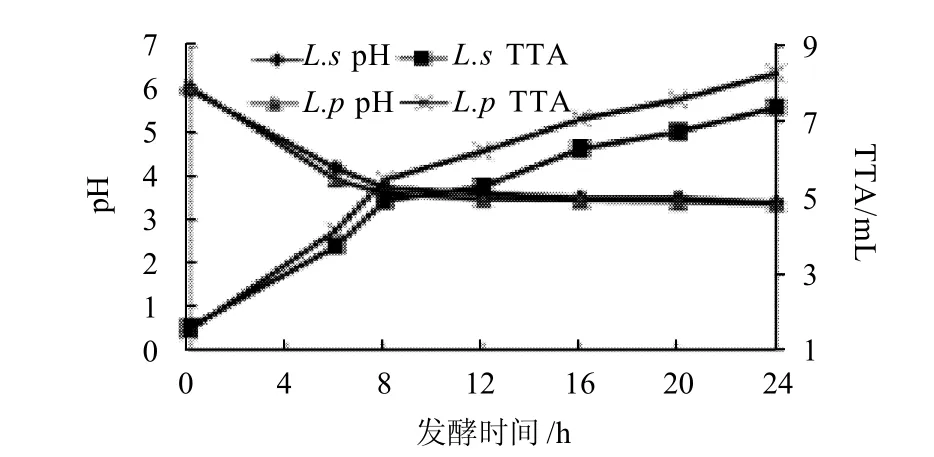
图1 燕麦粉发酵过程中pH值和TTA值的变化Fig.1 pH and TTA changes of oat flour during fermentation
2.1 燕麦粉在发酵过程中pH值和TTA的变化由图1可知,在最初的0~12h的发酵过程中,随着发酵时间的延长,燕麦粉的pH值由6.09迅速下降到3.62 左右,12h以后,pH值只有轻微的变化。总酸度从最初的1.51迅速增加到7.4~8.3。其中L.p发酵的燕麦粉pH值下降的速率快于L.s。与此同时,L.p的产酸量也显着高于L.s。但是到发酵后期,两种乳酸菌发酵的燕麦粉的pH值相近。
2.2 乳酸菌发酵对燕麦淀粉溶胀力和溶解度的影响
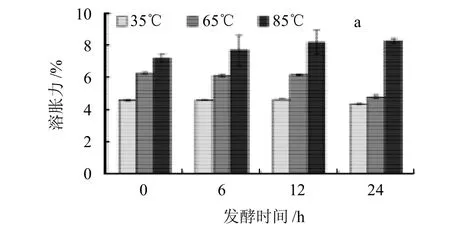
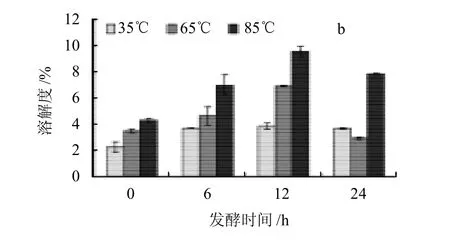
图2 植物乳杆菌发酵的燕麦淀粉在不同温度下的溶胀力和溶解度Fig.2 Swelling power and solubility of L.p-fermented oat starch at different temperatures

图3 旧金山乳杆菌发酵的燕麦淀粉在不同温度下的溶胀力和溶解度Fig.3 Swelling power and solubility of L.s-fermented oat starch at different temperatures
溶胀力和溶解度反映淀粉和水之间相互作用力的大小,这两者对淀粉的加工特性有较大的影响。由图2、3可知,大部分燕麦淀粉的溶胀力和溶解度随着温度的升高而增加,淀粉的溶解主要是直链淀粉从润胀的颗粒中逸出,这可能是因为温度达到65℃时,淀粉受热急剧吸水糊化,高能量的水和热破坏了淀粉分子内部氢键,因此淀粉的溶胀力和溶解度显着上升[17]。
图2a是经L.P发酵的燕麦淀粉分别在35、65、85℃条件下溶胀力随着发酵时间的变化。经L.P发酵后的燕麦淀粉,其溶胀力在35℃时没有显着的变化,而在65℃时,燕麦淀粉的溶胀力随着发酵时间的延长而轻微下降,而在85℃时却呈上升趋势。与经L.s发酵的燕麦淀粉(图3a)的溶胀力相比,经L.s发酵的燕麦淀粉,其溶胀力在65℃时呈上升的趋势,且在65℃和85℃时,溶胀力都高于L.p发酵的燕麦淀粉。
图2b是经L.p发酵的燕麦淀粉分别在35、65、85℃条件下溶解度随着发酵时间的变化。经L.p发酵后的燕麦淀粉,其溶解度在35℃条件下的发酵样品高于空白,在发酵过程中没有显着的变化,而在65℃和85℃条件下先上升,发酵12h后,溶解度下降。与经L.s发酵的燕麦淀粉(图3b)的溶解度相比,其溶解度在65℃时呈上升趋势,且在各温度下,其溶解度都高于经L.s发酵的燕麦淀粉。这可能与不同菌种在燕麦基质中产酸产酶的速率不同,从而导致不同菌种在发酵过程中对淀粉的发酵水解程度不同有关。
闵伟红等[18]发现经过乳酸菌发酵处理的淀粉,其溶胀力和溶解度在92.5℃高于空白,这与本研究在85℃时得到的结果相似。溶胀力越高,说明淀粉糊化时吸水性越强,因此溶胀力越高,DSC的糊化温度降低,或糊化快,但与糊化焓值呈负相关,这与后面DSC的结果一致。Richard等[19]研究表明淀粉吸水膨胀能力不仅与淀粉支链、直链含量的比例有很大关系,而且还与支链淀粉的分子结构相关,前面的结果表明经过乳酸菌发酵,燕麦淀粉的支链降解,直链淀粉有明显的增加,而燕麦淀粉经过L.p发酵处理后,直链淀粉含量先上升后下降,这可能是导致其溶解度先上升后下降的原因。
Yuan等[20]研究发现,当温度低于75℃时,发酵后的玉米淀粉,其溶胀力没有明显的变化,而当温度高于75℃后,发酵改性的淀粉的溶胀力要低于空白。根据Tester等[21]的研究表明,淀粉的溶胀特性很大程度上取决于其支链淀粉的分子质量和形状,直链淀粉对淀粉的膨胀吸水特性起着稀释和抑制的作用。聚合度在6~9的支链淀粉含量越高,淀粉的溶胀力越大,反之,聚合度在12~22的支链淀粉的含量与淀粉的溶胀力呈负相关[22]。
2.3 乳酸菌发酵对燕麦淀粉黏度特性的影响
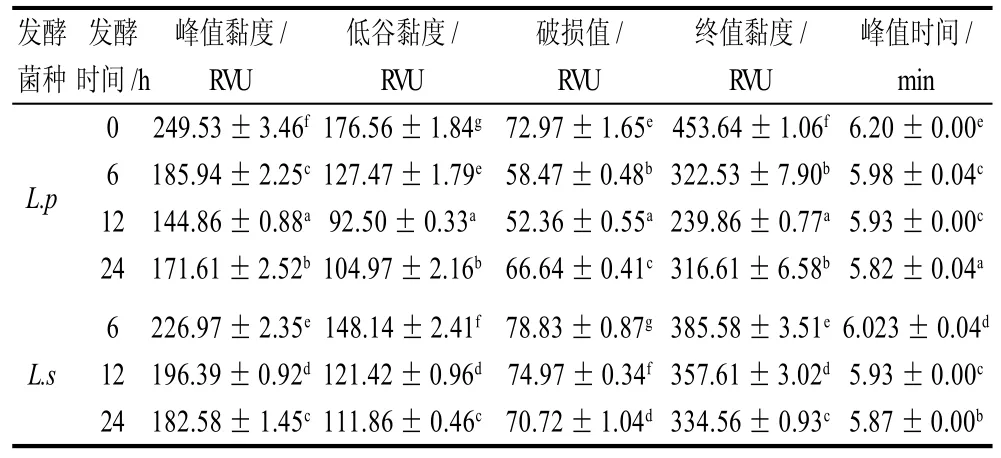
表1 乳酸菌发酵对燕麦淀粉黏度特性的影响Table 1 Effect of LAB fermentation on the gelatinization properties of oat starch
从消费者的角度考虑,燕麦淀粉的糊化性质对于其产品的接受程度至关重要[23]。糊化性质的参数包括峰值黏度、低谷黏度、破损值以及终值黏度。表1列出了空白及不同发酵菌种和发酵时间的燕麦淀粉的RVA黏度性质,从表1可以看出,经L.s发酵的燕麦淀粉,其各项糊化参数都随着发酵时间的延长而呈下降的趋势。其峰值黏度由249.53RVU显着下降到182.58RVU,终值黏度由453.64RVU显着下降到334.56RVU(P<0.05),经过L.p发酵的燕麦淀粉在发酵前24h,各糊化参数的变化趋势与L.s相同,但在发酵24h后,各项糊化参数显着上升(P<0.05)。
Yong[24]、鲁站会[25]和闵伟红[18]等研究发现发酵导致大米粉的峰值黏度降低,同样地,Olanipekun[26]和熊柳[27]等分别证明发酵导致大豆淀粉和绿豆淀粉的峰值黏度下降。这是因为在发酵过程中,一方面,乳酸菌水解支链淀粉的短链,导致支链淀粉的短/长链比降低,从而使得支链淀粉的平均链长和聚合度下降,淀粉分子变小,空间位阻减小。另一方面,非淀粉成分,如蛋白质,脂质以及β-葡聚糖也影响着燕麦粉的糊化特性[20]:发酵过程中的微生物以及微生物活动所产生的各种有机酸和酶对蛋白质进行分解,使包裹淀粉的蛋白质溶出,释放出淀粉。在剪切力的作用下更易形成有规则的排列,抗剪切的能力减弱。Zhang等[28]研究发现燕麦粉的黏度与燕麦中的β-葡聚糖含量呈正相关。这是因为随着β-葡聚糖含量的增加,燕麦粉结合水的能力随之增加。而之前的研究表明,在发酵过程中,β-葡聚糖的含量呈下降趋势,所以β-葡聚糖的含量对淀粉黏度也有一定的影响。最后乳酸菌发酵以及淀粉酶水解使淀粉部分糖化,释放结合水;综合以上因素,峰值黏度下降。
破损值与峰值黏度一样随着发酵时间的延长呈现降低趋势,破损值反映了淀粉颗粒结构在加热过程中的稳定性,破损值越大,表明淀粉颗粒越不稳定,在加热和搅拌过程中容易破裂。破损值的降低可能是因为发酵过程中,支链淀粉的水解,使得直链淀粉的相对含量上升,因此,L.p在发酵24h,直链淀粉含量下降,从而导致破损值的上升。这与袁美兰等[29]的研究结果不同,他们认为发酵的前3d,由于蛋白质的分解,使得蛋白质对淀粉颗粒的保护和稳定作用降低,淀粉颗粒更容易膨胀和破裂,破损值上升,在随后的发酵过程中,发酵对蛋白质的分解作用已趋于稳定,淀粉的水解导致破损值下降。
2.4 乳酸菌发酵对燕麦淀粉热力学特性的影响
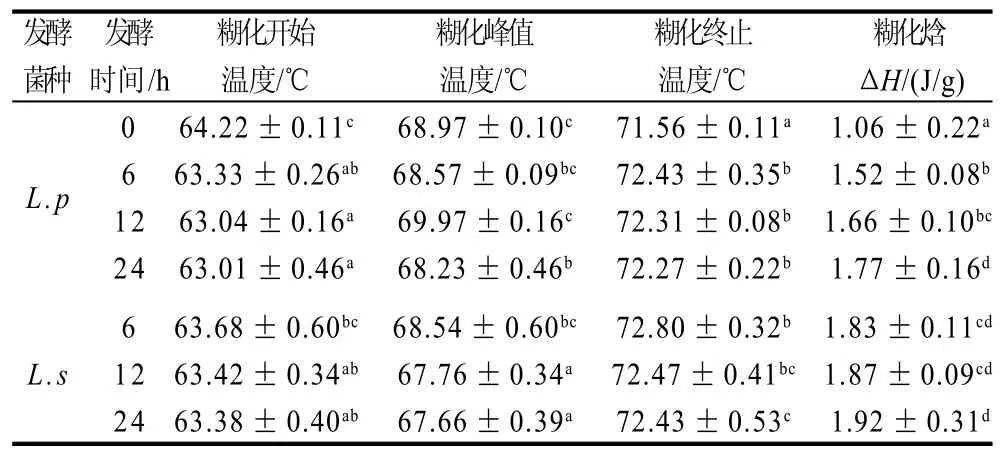
表2 乳酸菌发酵对燕麦淀粉热力学特性的影响Table 2 Effect of LAB fermentation on the thermodynamic properties of oat starch
表2为DSC曲线计算得出的糊化温度与吸热焓值,燕麦淀粉经过发酵处理后的热特性变化十分明显,糊化开始温度低于未经过发酵的空白,即经过处理后的大米粉更容易糊化,这与RVA结果一致。发酵后燕麦淀粉在糊化过程中吸热焓明显高于空白,其直接原因是发酵过程中产生大量的乳酸,酸的水解作用首先发生在结合力较弱的无定型区,使无定型区的淀粉分子链水解而溶出,造成结晶结构的相对比例增加,溶出的直链淀粉与脂类结合成复杂的双螺旋结构,这样就增加了糊化过程中所需要的热量,糊化焓上升。经L.p发酵的燕麦淀粉,其糊化焓值随着发酵时间的增加而逐渐增加,经L.s发酵的燕麦淀粉,其糊化焓值在发酵的过程中变化不显着,且L.s发酵的样品其吸热焓值均高于L.p发酵的样品,这可能与不同菌种在发酵过程中对淀粉的水解程度不同有关。
2.5 乳酸菌发酵对燕麦淀粉的直链淀粉含量的影响
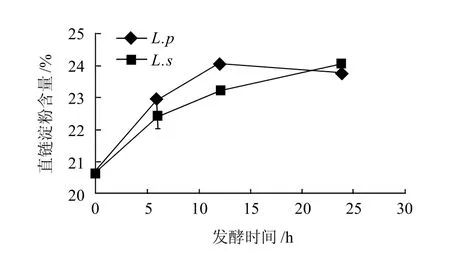
图4 燕麦淀粉的直链淀粉含量随发酵时间的变化Fig.4 Change in amylose content of oat starch during fermentation
由图4可知,L.s发酵中,燕麦淀粉的直链淀粉含量随着发酵时间的增加而增加,而L.p发酵的燕麦淀粉,在发酵的前12h,其直链淀粉的含量线性增加,12h以后,直链淀粉的含量有所下降。这是因为发酵的初始阶段产生的酸和酶可以水解淀粉分子,支链淀粉断链、脱支,使得直链淀粉的含量相对增加。但是随着发酵时间的延长,直链淀粉的含量开始轻微的下降,因为酸和酶的进一步作用,使得直链淀粉的分子质量变小,糖化水解。L.p发酵的燕麦淀粉其直链淀粉含量高于L.s发酵的燕麦淀粉,这可能与L.p发酵产酸率高于L.s发酵有关。闵伟红[30]和Numfor[31]等在研究发酵对玉米淀粉和木薯淀粉的影响时,也得到相似的结果。Lu等[32]也发现大米淀粉在发酵过程中直链淀粉的含量增加,并且推断可能有新的直链淀粉生成。
3 结 论
本实验研究了乳酸菌发酵对于燕麦淀粉的改性作用:其中淀粉糊化的峰值黏度、终值黏度和破损值随着发酵时间的延长而逐渐降低,糊化的起始温度提前,糊化焓上升;且经L.s发酵的样品,其吸热焓值高于L.p发酵样品;经乳酸菌发酵的燕麦淀粉,其直链淀粉含量呈上升趋势。本研究为乳酸菌对燕麦淀粉的改性作用以及燕麦发酵食品的深加工提供了基础理论信息,例如粉丝的生产要求糊化温度低,峰值黏度低,直链淀粉含量高于20%以及凝胶强度高的淀粉较好,而乳酸菌的发酵对燕麦淀粉的改性起着促进的作用,所以本结果对于开发无面筋燕麦面条的进一步研究提供参考。
[1]王凤, 黄卫宁, 刘若诗, 等. 采用Mixolab和Rheometer研究含外源蛋白燕麦面团的热机械学和动态流变学特性[J]. 食品科学, 2009, 30 (13): 147-151.
[2]FDA. Food labeling: Health claims; Oat and coronary heart disease[J]. Federal Register, 1996, 61(3): 296-337.
[3]COLLEONI-SIRGHIE M, JANNINK J L, WHITE P J. Pasting and thermal properties of flours from oat lines with high and typical amounts of β-glucan[J]. Cereal Chemistry, 2003, 81(6): 686-692.
[4]HUANG Weining, LI Lingling, WANG Feng, et al. Effects of transglutaminase on the rheological and mixolab thermomechanical characteristics of oat dough[J]. Food Chemistry, 2010, 121(4): 934-939.
[5]MBUGUA S K. The nutritional and fermentation characteristics of uji produced from drymilled flour (unyabaridi) and whole wet milled maize [J]. Chemie Mikrobiologie Technologie derLebensmitte, 1988, 10: 154-161.
[6]MENSAH P, TOMKINS A M, DRASAR B S, et al. Antimicrobial effect of fermented Ghanaian maize dough[J]. Journal of Applied Bacteriology, 1991, 70(3): 203-210.
[7]KEDI G, VAZQUEZ J A, PANDIELLA S S. Fermentability of whole oat flour, PeriTec flour and bran by Lactobacillus plantarum[J]. Journal of Food Engineering, 2008, 89(2): 246-249.
[8]MARTENSSON O, OSTE R, HOLST O. Texture promoting capacity and EPS formation by lactic acid bacteria in three oat-based non-dairy media[J]. European Food Research and Technology, 2008, 214: 232-236.
[9]MARTENSSON O, OSTE R, HOLST O. Lactic acid bacteria in an oatbased non-dairy milk substitute: fermentation characteristics and exopolysaccharide formation[J]. Lebensm Wiss u Technol, 2000, 33(8): 525-530.
[10]ROCCIARDI A, PARENTE E, CLEMENTI F. A simple method for the screening of lactic acid bacteria for the production of exopolysaccharides in liquid media[J]. Biotechnology Techniques, 1997, 11(5): 271-277.
[11]张坤, 黄卫宁, 堵国成, 等. 旧金山乳杆菌与自然发酵燕麦酸面团发酵剂中β-葡聚糖含量及其分子量的分布[J]. 食品科学, 2009, 30(21): 320-323.
[12]AGBOOLA S O, AKINGBALA J O, OGUNTIMEHIN G B. Physicochemical and functional properties of low DS cassava starch acetates and citrates[J]. Starch/Starke, 1991, 43: 62-66.
[13]American Association of Cereal Chemists International. AACC approved methods 02-52.01 Hydrogen-ion activity (pH): Electrometric method [S]. St. Paul, MN: The Association, 2000.
[14]LIM W J, LIANG Y T, SEIB P A, et al. Isolation of oat starch from oat flour[J]. Cereal Chemistry, 1992, 69(3): 233-236.
[15]洪燕, 顾正彪, 李兆丰. 蜡质玉米淀粉的性质及其在食品加工中的应用[J]. 中国粮油学报, 2005, 20(3): 30-34.
[16]ZHOU M X, ROBARDS K, GLENNIE-HOLMES M, et al. Effects of enzyme treatment and processing on pasting and thermal properties of oats[J]. Journal of the Science of Food and Agriculture, 2000, 80: 1486-1494.
[17]刘刚, 刘英, 陈季旺, 等. 燕麦淀粉理化性质的研究[J]. 中国粮油学报, 2008, 23(3): 86-89.
[18]闵伟红, 李里特, 王朝辉. 乳酸菌发酵对大米淀粉物理化学性质的影响[J]. 食品科学, 2004, 25(10): 73-76.
[19]RICHARD F, WILLIAN R, ACQUISTUCCI R. Physiochemical and rheological characterization of sorghum starch[J]. Journal of Food Science, 1992, 57: 1024-1028.
[20]YUAN Meilan, LU Zhanhui, CHENG Yongqiang, et al. Effect of spontaneous fermentation on the physical properties of corn starch and rheological characteristics of corn starch noodle[J]. Journal of Food Engineering, 2008, 85(1): 12-17.
[21]TESTER R F, MORRISON W R. Swelling and gelatinization of cereal starches. I. Effects of amylopectin,amylose and lipids[J]. Cereal Chemistry, 1990, 67: 551-557.
[22]VANDEPUTTE G E, VERMEYLEN R, GEEROMS J, et al. Rice starches. Ⅱ. Structural aspects provide insight into swelling and pasting properties[J]. Journal of Cereal Science, 2003, 38(1): 53-59.
[23]ZHOU M X, ROBARDS K, GLENNIE-HOLMES M, et al. Structure and pasting properties of oat starch[J]. Cereal Chemisty, 1998, 75(3): 273-281.
[24]YANG Yong, TAO Wenyi. Effects of lactic acid fermentation on FT-IR and pasting properties of rice flour[J]. Food Research International, 2008, 41(9): 937-940.
[25]鲁站会, 李里特, 阂伟红, 等. 自然发酵工艺对米粉流变学性质的影响[J]. 中国食品学报, 2002, 2(2): 9-12.
[26]OLANIPEKUN B F, OTUNOLA E T, ADELAKUN O E, et al. Effect of fermentation with Rhizopus oligosporus on some physico-chemical properties of starch extracts from soybean flour[J]. Food Chem Toxicol, 2009, 47(7): 401-405.
[27]熊柳, 孙庆杰. 发酵与发芽处理对绿豆淀粉黏度性质的影响[J]. 粮食加工, 2009, 34(3): 47-49.
[28]ZHANG D, DOEHLERT D C, MOORE W R. Factors affecting viscosity of slurries of oat groat flours[J]. Cereal Chemistry, 1997, 74(6): 722-726.
[29]袁美兰, 鲁站会, 程永强, 等. 自然发酵对米粉RVA黏度性质及米粉拉伸性质的影响[J]. 中国粮油学报, 2008, 23(1): 6-9.
[30]闵伟红, 刘艳, 林小秋, 等. 生物发酵对玉米淀粉中直链淀粉含量影响的研究[J]. 中国粮油报, 2007, 22(5): 39-43.
[31]NUMFOR F A, WALTER W W, Jr, SCHWARTZ S J. Physicochemical changes in cassava starch and flour associated with fermentation: Effect on textural properties[J]. Starch, 1995, 47: 86-91.
[32]LU Zhanhui, YUAN Meilan, SASAKI T, et al. Rheological properties of fermented rice flour gel[J]. Cereal Chemistry, 2007, 84(6): 620-625.
Effect of Lactic Acid Bacterial Fermentation on the Physico-chemical and Thermodynamic Properties of Oat Starch
WAN Jing-jing1,HUANG Li-qun1,ZHANG Qing1,HUANG Wei-ning1,*,RAYAS-DUARTE Patricia2
(1. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, China;2. Food and Agricultural Products Research Center, Oklahoma State University, Stillwater, OK 74078-6055, USA)
Oat flour was fermented solely with two species of lactic acid bacteria, Lactobacillus plantarum (L.p) and Lactobacillus sanfrancisco (L.s) in order to analyze the changes in physio-chemical and thermaldynamic properties of oat starch during lactic acid bacterial (LAB) fermentation. Fermentation with each of the two stains resulted in a decrease in pH, and L.p -fermented oat flour exhibited a faster pH drop and lager amount of acid production when compared to L.s-fermented one, but similar pH values were observed in the late period of fermentation. For both L.p- and L.s-fermented oat flours, solubility and swelling power increased with increasing temperature. For oat flour fermented by one strain, the two parameters at different temperatures both had different change trends as fermentation time increased. L.p-fermented oat flour had lower swelling power but higher solubility than its L.s-fermented counterpart. The results obtained from rapid viscosity analyzer (RVA) and differential scanning calorimetry (DSC) showed that the peak viscosity of fermented oat starch decreased as fermentation time increased, and after fermentation, oat starch had lower onset gelatinization temperature, required longer time for gelatinization, presented higher gelatinization enthalpy, and L.s-fermented oat starch had higher gelatinization enthalpy than L.p-fermented one. Oat starch presented an increasing trend in amylose content during fermentation, and L.p-fermented oat starch had higher amylose content at 6 and 12 hours of fermentation when compared to L.s-fermented one, but the amylose content of the former was slightly lower than that of the latter at 24 hours.
lactic acid bacteria;fermentation;oat starch;gelatinization;amylose content
TS201.3
A
1002-6630(2010)19-0100-06
2010-06-23
加拿大农业部国际交流与合作项目(CCSIC-Food-00107);国家现代农业产业技术体系建设专项(nycytz-14)
万晶晶(1985—),女,硕士研究生,研究方向为烘焙科学、功能配料和食品添加剂。E-mail:mathilna@163.com
*通信作者:黄卫宁(1963—),男,教授,博士,研究方向为食品烘焙与发酵技术、谷物食品化学。E-mail:wnhuang@jiangnan.edu.cn



