马亚琴,叶兴乾,吴厚玖,周志钦,王 华,孙志高
超声波辅助提取植物活性成分的研究进展
马亚琴1,2,3,叶兴乾4,吴厚玖1,3,周志钦1,2,王 华1,3,孙志高1,3
(1.西南大学柑桔研究所, 重庆 400712;2.西南大学园艺学博士后流动站,重庆 400712;3.国家柑桔工程技术研究中心,重庆 400712;4.浙江大学生物系统工程与食品科学学院,浙江 杭州 310029)
概述超声波强化提取的机理,综述超声波辅助提取植物活性物质的研究进展和现状,并分析超声波应用于食品加工领域进行强化提取的潜力,指出目前超声波辅助提取技术实现工业化生产存在的难题和今后的研究方向。
超声波;提取;植物活性成分
超声波(ultrasound)是指频率为2×104~109Hz的声波,属机械波的一种,由于超越了人类听觉的上限,故称为超声波。超声波化学是超声波和化学相互交叉渗透的一门新的学科,作为一种边缘性交叉学科,自80年代以来发展十分迅猛。随着功率超声波理论研究的深入和仪器设备制造技术的日趋完善,超声波化学技术广泛应用于食品检测和加工、化工、医疗、生物工程等许多领域[1-6]。超声波技术在食品领域中的应用根据能量强度被分为两大类:检测超声波和功率超声波[7-8]。检测超声波是指能量低于1W/cm2而频率高于100kHz的超声波,主要应用于无损检测和食品材料中物化特性的诊断,获得食品组成、质构、流变学性质等信息[9-12]。功率超声波通常指能量高于1W/cm2而频率低于100kHz的超声波,强大的能量使得介质发生物理裂解、有效的改变食品的物化特性以及加速某些化学反应的发生,主要应用于食品加工领域[13-14]。
1 低频高能超声波的作用机理和特点
媒质中引入超声波时,在介质中引起介质粒子的机械振动而与媒质发生相互作用,进而产生热作用、机械作用和空穴作用。当超声波在媒质中进行传播时,其振动能量不断地被媒质吸收导致媒质温度升高,超声波强度愈大,热作用愈强;超声波振动作用引起介质的质点发生交替压缩伸张运动,从而引起线性或非线性的交变振动,加速质量的传递作用,机械作用有助于破碎、凝聚、切割等[15-16];当液体分子间的距离超过保持液体作用的临界分子间距时形成空穴气泡,在超声波连续作用下,空穴气泡会发生持续振荡而形成稳态空化(具有较低的能量)或瞬时空化即空化泡在瞬间绝热收缩至崩溃时,产生高温、高压、强烈的冲击作用(具有较高的能量)[17-18]。低频超声波在媒质中传播时气泡崩溃比高频更为剧烈,超声波的空化作用在低温常压下有利于促成化学反应的发生,在清洗、雾化、乳化及加速化学反应等方面有广泛的应用[19-21]。
超声波在食品加工中的应用就是通过超声波产生的3种机制而实现。其中,空穴作用被认为是最重要的,
导致充气气泡的产生和微射流的出现[20]。Rayleigh[22]最早研究和分析了空穴和气泡动力学,并解决了在液态媒质中空腔气泡倒塌的一系列问题,同时也涉及了充气气泡,并假设充气气泡中的气体经历了非热压缩过程。后来的研究认为液态媒质的表面张力、黏度等都对空穴作用产生影响[18]。Laborde等[23]研究认为空穴发生的部位和空穴强度与超声波发生器的形状、声学因素、换能器的结构都有关系。超声波空穴有两个重要的特征:第一,非线性过程即空穴气泡半径的变化和声压不成比例;第二,气泡的高压缩性即当气泡在膨胀或倒塌等运动过程中累积能量而获得更多潜在的能量[24]。在瞬时空化状态,由于气泡的非线性运动引起能量的转化并集中在一个很小的空间,因此产生高压高温、激发化学反应的产生,引起致光超声波等[25]。值得注意的是,在一个一定深度的柱形容器内引入超声波,当容器内的水面为超声波振幅的1/4的奇数倍时则会出现强压稳态空穴,但是,当容器内的水面为超声波振幅的1/4的偶数倍时则出现弱压稳态空穴。如图1所示,水槽直径为12cm的圆柱形,低部是直径为6cm的换能器。超声波的这个特点在应用强化提取时具有非常重要的意义。
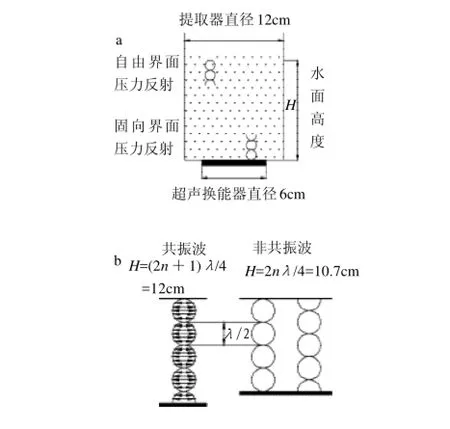
图1 低频实验装置(a)和压力波的反射(b)Fig.1 Experimental setting and reflection of pressure wave at low frequency ultrasound wave
2 超声波辅助提取植物活性成分的研究现状及其发展趋势
2.1 超声波辅助提取植物活性成分的研究现状
在食品加工领域,提取技术是一项非常重要的技术。在提取分离植物、动物、微生物中活性物质或其他一些所需成分,以及食品成分的分析都需要有效的提取和分离方法来完成。因此,高效低成本的提取方法为研究人员所关心。20世纪50年代,超声波技术首次在实验室应用于增强提取量的研究。随后,超声波技术逐渐被认可并发展迅猛,不断渗透到食品加工的各个领域。目前,超声波技术应用于提取植物活性物质的研究主要有三方面:从单个活性成分的提取到多组分的提取;从单纯的增加提取量到对提取物结构、活性的鉴定以及引入更多超声波参数(超声波能量、超声波频率)对提取过程影响的研究;从实验室研究型向工业化规模化生产应用型的思考和转变。
2.1.1 超声波辅助提取单一植物活性成分
“Specht等首次利用超声波技术进行了强化啤酒花的提取研究,并与传统的煮沸提取法对提取物含量的影响进行了比较;随后Schmall等研究表明生产啤酒中超声波处理比传统的加工方法节省30%~40%的啤酒花原料;Hoggan研究发现超声波处理啤酒花不仅可以节省原材料而且还有助于提高啤酒的品质”[26]。20世纪60年代以来,超声波辅助提取植物活性物质的报道有所增加,并得到一致的结论:超声波辅助提取较传统的提取方法其优势表现在缩短提取时间和提高提取效率。随后,deMaggio等[27]提取曼陀萝中的生物碱,30min后浸泡提取生物碱的含量仅为超声波提取的9%;Ovadia等[28]利用超声波处理杜根,超声波处理30s其提取效率高于5h索式提取;“Gilyus等应用超声波提取甜菜中的糖,结果表明在19.3kHz,60~70℃的条件下,超声波处理比传统的提取方法缩短45~60min,而在100kHz、50℃的条件下缩短30~60min”[29]。Feng等[30]综述了1970年至1996年间中国超声波在聚合物学、有机合成、化学分析、生物化学、天然材料的提取和分离、离子交换树脂的再生以及结晶过程等各个领域内的基础研究及应用,在提取方面超声波技术主要应用于对芸香科植物中药成分的提取和分离,超声波提取在室温的条件下利用乙醇溶剂就能有效的提取多种中药成分(如豆腐果苷、盐酸小檗碱、岩白菜素等)。郭孝武等[31]利用超声波提取黄岑苷,认为超声波提取10min比常规煎煮法处理3h的提取效率高;随后他们利用超声波从黄连根茎中提取黄连素的研究发现,20kHz频率的超声波有利于提取黄连素,与浸泡提取法比较,具有省时高效的优势[32]。
21世纪初,利用植物组织结构的电镜图片对超声波强化的机理给出了直接的证据。随着对超声波波理论研究的深入,超声波频率和超声波能量作为重要的超声波参数在超声波提取过程中可能产生的影响被研究人员所认识和关注,并进行此方面的初步探索和研究。此外,随着生活水平的不断提高,健康成了公众关心的焦点之一,天然活性物质的保健作用日益被消费者所认可,植物材料作为天然活性物质的丰富来源,期望产生的商业化利润和巨大的市场潜力掀起了加快超声波技术提取植
物活性物质应用的热潮。
Toma等[33]考察了超声波处理与传统的提取方法对几种植物材料溶胀系数、提取含量和细胞结构的变化。结果表明超声波处理1h,金盏花、酸橙、茴香种子、骆驼蓬属种子、啤酒花球果、土木香根、薄荷叶吸水的体积分别为6、5、4、3、3、2.5、2.5mL,溶胀率分别增加了27%、20%、100%、60%、43%、55%、38%。而提取溶剂对提取含量有最直接的影响,但是超声波处理后提取物的含量均比浸泡提取的高。此外,通过扫描电镜图片观察了超声波处理后对植物材料细胞组织结构的影响,发现植物组织的细胞结构明显被破坏,使得提取物易于从植物材料快速溶到提取溶剂,进而提高了提取效率,这首次从细胞结构的角度解释了超声波强化的机理。Li等[34]进行了超声波提取大豆油的研究,同样利用大豆粉末细胞组织结构的电镜图片探讨了超声波增强的机理。Albu等[35]利用直插式和水浴式超声波辅助提取了芸香科植物鲜样和干样中的鼠尾草酸,并与热处理比较,发现超声波处理15min达到较高的提取量,认为水浴超声波有利于大规模生产。结果肯定了超声波作为一种更经济、环保、安全的技术应该充分考虑在溶剂提取领域内的应用潜力。
2.1.2 超声波辅助提取多组分植物活性成分
20世纪70年代后,随着相关学科的发展、交叉学科的兴起以及功率超声波设备的发明与制造技术的不断完善,超声波技术在食品加工领域快速发展。超声波辅助提取技术从研究的对象、内容和深度都大大拓展。这一时期也初步进行了超声波同时提取多组分活性物质的研究,更值得注意的是对高能超声波工业化规模化应用的思考。Shoh[36]综述了高能超声波的工业化应用,并阐述了在应用中的优势和局限性。McClements[8]综述了超声波在食品加工和分析中的研究进展,认为加快高能超声波波在工业上的应用很大程度上依赖于成本低廉且可行有效的超声波设备,并分析了超声波技术从实验室研究向大规模的生产转变需要解决的一些难题。
Ebringerova等[37]研究了超声波处理对玉米水溶性木质素的主要成分(β-(1->4)-D-xylopyranan)在分子结构、分子特性、免疫活性等方面的影响,通过研究认为在一定的超声波条件下不会造成水溶性木质素分子结构的破坏和分子特性的改变;免疫细胞实验证明超声波有利于增强提取物的生物活性。但是,极端的超声波条件会破坏木质素的分子链,降低生物活性。进一步的研究表明[38],超声波处理较热处理能明显提高阿拉伯糖、木糖、半乳糖、葡萄糖、树胶醛糖的含量,不破坏分子结构并增强生物活性。随后, Hromadkova等[39]更详细的研究了超声波处理对玉米穗轴水溶性和水不溶性木质素的影响,结果表明有效的超声波提取依赖于溶剂类型,在5% NaOH溶液、60℃的条件下,超声波提取木质素的含量最高、分子结构稳定、生物活性也增强。增加超声波能量(从100W到270W)可能由于超声波的强化和机械作用造成木质素支链分子的不正常降解。此外,对玉米壳中半纤维素的6种多糖组分也进行了超声波提取的研究[40]。超声波技术也成功地应用在小麦秸秆的半纤维素[41]、木质素[42]和酚酸类物质、以及荞麦壳中半纤维素的提取[43]。Zhao等[44]对1997年至2002年间超声波化学在中国的研究现状和发展概况进行了综述,指出基础研究的方向之一是多频超声波与空穴量之间的联系,认为双频或多频超声波比单频超声波能显着的提高空穴量,并进一步探讨了空穴量增加的机理;超声波在提取方面仍然以提取药材中的有效成分为主,所涉及的植物材料和提取成分非常广泛:如从黄连、黄檗罗中提取小檗碱;从长梗绞股蓝提取绞股蓝皂苷;从海带中提取多糖硫酸盐等。罗登林等[45]综述了超声波在分离技术方面的应用,并指出超声波提取技术今后研究的重点即建立超声波场特性参数及体系物性与附加效应的对应关系。
Smelcerovic等[46]比较了超声波辅助提取、索式提取、快速溶剂提取的方法对提取金丝桃中的金丝桃素、假金丝桃双蒽醌、金丝桃苷、芦丁、槲皮素和金丝桃素6种药剂活性物质的影响,发现直插式超声波提取效率最高。然而超声波处理后,不同的药剂活性成分的最佳超声波提取条件是不相同的,这很可能由于不同活性物质理化结构的差异所引起。另一方面,从超声波角度而言,超声波参数是通过单个变量作用还是通过个多个变量的结合作用来影响植物材料,目前仍然不清楚[47]。因此,超声波同时提取多种活性物质需要考虑超声波参数的结合效应和活性物质理化结构的差异,这为超声波同时提取多种活性物质特别是不稳定的活性物质的提取给出了新的视角。
2.2 超声波辅助提取植物活性成分的发展趋势
超声波辅助提取植物材料在实验室的研究基础上被广泛报道。随着食品工业的迅速发展和消费观念的转变,天然活性物质的保健食品更为消费者所青睐,这极大的推动了商业化、市场化的发展潜力。科技的进步推动了超声波辅助提取技术的精准化和多元化应用趋势。
Romdhane等[48]利用自动装置在线检测最佳的超声波频率和超声波能量以便最大限度的增强提取效率和节约成本;张晓燕等[49]研究了多频超声波处理对葛根有效部位提取率的影响,认为在相同的超声波条件下,三频超声波和双频超声波均比单频超声波具有提取效率高、提取时间短等优点,并发现三频超声波具有更大的提取优势;贲永光等[50]利用双频超声波强化提取了三七总皂苷的研究,发现在同样的条件下,双频超声波(40kHz/25kHz)对三七总皂苷的提取率高于单频超声波
40kHz和25kHz的提取率,主要的原因可能是双频超声波的空化产额远高于单频超声波的空化产额,采用多频超声波可以减少声场的不均匀性,提高空化效应,进而提高提取效率;应用多频超声波连续逆流浸取黄芩中的黄芩苷的研究表明[51]:25kHz/50kHz双频复合连续逆流浸取27min,提取率比单频、双频交变连续逆流浸取分别提高18.6%和17.4%,是回流提取的492倍、超声波间歇浸取的131倍。混频超声波无论是在提取效率还是能量分布的均匀性等方面均较单频超声波具有优势而引起了研究人员的极大关注[52-54]。这将是未来超声波波技术应用于辅助提取有待于进一步开展研究的新方向。此外,超声波在交叉学科领域内的应用也得到了广泛的关注,利用超声波强化亚临界水萃取[55]及强化近临界CO2流体萃取[56],其萃取效果更具优势。
目前,由于商业化迫切需求更为经济有效的提取技术,加快了超声波辅助食品加工技术从最初的实验室研究向实际生产应用的思考和转变。Vilkhu等[57]对超声波辅助提取动植物材料中的多酚、多糖、花色苷等多种功能性成分的研究及其今后在食品加工领域的发展前景进行了综述,提出了超声波规模化提取活性物质的一些关键问题:1)植物材料细胞组织结构特性;2)提取成分在植物组织中所在的部位;3)超声波提取前对植物组织的处理;4)提取成分的理化性质;5)超声波对植物材料表面的破坏及生物量转变、减少提取时间、增加提取效率等许多因素。Patist等[58]探讨了超声波技术在食品领域内可能的商业化应用以及工业化规模生产面临的挑战及其未来的发展趋势,认为超声波加工技术具备大规模商业化生产的先决条件:强化加工过程、提高产品的质量、迅速回拢资金以及低成本等优势。罗登林等[59]针对超声波强化提取技术在工业化应用方面的限制,设计了一种管道螺杆传输式双频超声波动态逆流连续提取装置。该设备根据超声波波的传播特性和作用效应,结合管道螺杆传输的特点,对超声波频率和功率进行合理配置与组合,克服了超声波提取在工业放大时能量快速衰减的缺点,并具有多次反复提取,连续生产的优势。中国山东济宁金百特工程机械有限公司开发了连续逆流超声波提取成套设备,实现了提取容积最大达到6359L,提取量为355~1346kg/h的超声波工业化应用设备,这将为超声波的商业化规模化应用起到积极的推动作用。
3 结 语
超声波辅助提取技术具有加快提取效率、节约能源以及环保等优势,因而被看作是“绿色技术”。超声波技术在提取热不稳定活性物质和要求低温加工的食品方面具有广阔的应用前景。作为一项有效的食品新技术,超声波辅助提取技术得到了研究人员极大关注和广泛兴趣,标准的商业化超声波设备快速发展,但是在工业生产上的应用目前仍然比较滞后,其制约的主要瓶颈是缺乏消费者需求的设备装置和相应的性能。由此可以看出,超声波提取技术商业化应用的关键在于设计符合和满足不同消费领域各异需求的超声波设备。
[1]刘东红. 液态食品超声传播特性及品质超声检测技术的研究[D]. 杭州: 浙江大学, 2006.
[2]谷勋刚. 超声波辅助提取新技术及其分析应用研究[D]. 合肥: 中国科学技术大学, 2007.
[3]COCCIARDI R A, ISMAIL A A, SEDMAN J. Investigation of the potential utility of single-bounce attenuated total reflectance fourier transform infrared spectroscopy in the analysis of distilled liquors and wines [J]. Journal of Agricultural and Food Chemistry, 2005, 53(8): 2803-2809.
[4]MITRAGOTR S, KOST J. Low-frequency sonophoresis[J]. Advanced Drug Delivery Reviews, 2004, 56(5): 589-601.
[5]COUPLAND J N. Low intensity ultrasound[J]. Food Research International, 2004, 37(6): 537-543.
[6]吴琼英, 贾俊强. 柚皮黄酮的超声辅助提取及其抗氧化性研究[J]. 食品科学, 2009, 30(2): 29-33.
[7]ROBERTS R T. High intensity ultrasonics in food processing[J]. Chemistry and Industry, 1993, 15(4): 119-121.
[8]McCLEMENTS J D. Advances in the application of ultrasound in food analysis and processing[J]. Trends in Food Science & Technology, 1995, 6(9): 293-299.
[9]NIELSEN M, MARTENS H J. Low frequency ultrasonics for texture measurements in cooked carrots (Daucus carota L.)[J]. Journal of Food Science, 1997, 62(6): 1167-1175.
[10]GHAEDIAN R, COUPLAND J N, DECKER E A, et al. Ultrasonic determination of fish composition[J]. Journal of Food Engineering, 1998, 35(3): 323-337.
[11]POVEY M J W, MASON T J. Ultrasound in food processing[M]. London: Thomson Science, 1998: 30-41.
[12]McCLEMENTS D J. Ultrasonic characterization of food and drinks: Principles, methods, and applications[J]. Food Science and Nutrition, 1997, 37(1): 1-46.
[13]SUSLICK K S, NYBORG W L. Ultrasound: It s chemical, biological and physical effects[J]. The Journal of the Acoustical Society of America, 1990, 87(2): 919-920.
[14]WELTI-CHANES J, BARBOSA-CANOVAS G, AGUILERA J M. Engineering and food for the 21th Century[M]. New York: CRC Press, 2002.
[15]CHENDKE P K, FOGLER H S. Macrosonics in industry: 4. Chemical processing[J]. Ultrasonics, 1975, 13(1): 31-37.
[16]GONG Cuiling, HART D P. Ultrasound induced cavitation and sonochemical yields[J]. The Journal of the Acoustical Society of America, 1998, 104(5): 2675-2682.
[17]FLINT E B, SUSLICK K S. The temperature of cavitation[J]. Science, 1991, 253(5026): 1397-1398.
[18]PLESSET M S, PROSPERETTI A. Bubble dynamics and cavitation [J]. Fluid Mechanics, 1977, 9: 145-185.
[19]KNORR D, ZENKER M, HEINZ V, et al. Applications and potential of ultrasonics in food processing[J]. Trends in Food Science & Technology,
2004, 15(5): 261-266.
[20]ZHENG Liyun, SUN Dawen. Innovative applications of power ultrasound during food freezing processes: a review[J]. Trends in Food Science & Technology, 2006, 17(1): 16-23.
[21]MASON T J, PANIWNKY L, LORIMER J P. The uses of ultrasound in food technology[J]. Ultrason Sonochem, 1996, 3(3): S253-S260.
[22]RAYLEIGH L. On the pressure developed in a liquid during the collapse of a spherical cavity[J]. Phil Mag, 1917, 34: 94-98.
[23]LABORDE J L, BOUYER C, CALTAGIRONE J P, et al. Acoustic cavitation field prediction at low and high frequency ultrasounds[J]. Ultrasonics, 1998, 36(1/5): 581-587.
[24]LABORDE J L, BOUYER C, CALTAGIRONE J P, et al. Acoustic bubble cavitation at low frequencies[J]. Ultrasonics, 1998, 36(1/5): 589-594.
[25]HENGLEIN A. Chemical effects of continuous and pulsed ultrasound in aqueous solutions[J]. Ultrason Sonochem, 1995, 2(2): S115-S121.
[26]VINATORU M. An overview of the ultrasonically assisted extraction of bioactive principles from herbs[J]. Ultrason Sonochem, 2001, 8(3): 303-313.
[27]deMAGGIO A E, LOLT J A. Applications of ultrasound for increasing alkaloid yield from Datura stamonium[J]. Journal of Pharmaceutical Sciences, 1964, 53(8): 945-949.
[28]OVADIA M E, SKAUEN D M. Effect of ultrasonic waves on the extraction of alkaloids[J]. Journal of Pharmaceutical Sciences, 1965, 54(7): 1013-1016.
[29]CHENDKE P K, FOGLER H S. Macrosonics in industry 4. Chemical processing[J]. Ultrasonics, 1975, 13(1): 31-37.
[30]FENG Ruo, ZHAO Yiyun, BAO Ciguang. Sonochemistry in China[J]. Ultrason Sonochem, 1997, 4(2): 183-187.
[31]郭孝武, 张福成. 超声提取对黄芩甙成分提出率的影响[J]. 中国中药杂志, 1995, 19(6): 348-349.
[32]郭孝武, 张福成, 林书玉. 超声提取对黄连素提出率的影响[J]. 中国中药杂志, 1994, 20(11): 673-675.
[33]TOMA M, VINATORU M, PANIWNYK L, et al. Investigation of the effects of ultrasound on vegetal tissues during solvent extraction[J]. Ultrason Sonochem, 2001, 8(2): 137-142.
[34]LI Haizhou, PORDESIMO L, WEISS J. High intensity ultrasoundassisted extraction of oil from soybeans[J]. Food Research International, 2004, 37(7): 731-738.
[35]ALBU S, JOYCE E, PANIWNYK L, et al. Potential for the use of ultrasound in the extraction of antioxidants from Rosmarinus officinalis for the food and pharmaceutical industry[J]. Ultrason Sonochem, 2004, 11(3/4): 261-265.
[36]SHOH A. Industrial applications of ultrasound: A review I. high-power ultrasound[J]. IEEE Transactions on Sonics and Ultrasonics, 1975, 22 (2): 60-71.
[37]EBRINGEROVA A, HROMA DKOVA Z, HIBALOVA V, et al. Effect of ultrasound on the immunogenic corn cob xylan[J]. Ultrason Sonochem, 1997, 4(4): 311-315.
[38]EBRINGEROVA A, HROMADKOVA Z, ALFODI J, et al. The immunologically active xylan from ultrasound-treated corn cobs: extractability, structure and properties[J]. Carbohydrate Polymers, 1998, 37(3): 231-239.
[39]HROMADKOVA Z, ALFODI J, EBRINGEROVA A. Study of the classical and ultrasound-assisted extraction of the corn cob xylan[J]. Industrial Crops and Products, 1999, 9(2): 101-109.
[40]EBRINGEROVA A, HROMADKOVA Z. Effect of ultrasound on the extractability of corn bran hemicelluloses[J]. Ultrason Sonochem, 2002, 9(4): 225-229.
[41]SUN Runcang, TOMKINSON J. Comparative study of lignins isolated by alkali and ultrasound-assisted alkali extractions from wheat straw[J]. Ultrason Sonochem, 2002, 9(2): 85-93.
[42]SUN Runcang, TOMKINSON J. Characterization of hemicelluloses obtained by classical and ultrasonically assisted extractions from wheat straw[J]. Carbohydrate Polymers, 2002, 50(3): 263-271.
[43]HROMADKOVA Z, EBRINGEROVA A. Ultrasonic extraction of plant materials: investigation of hemicellulose release from buckwheat hulls [J]. Ultrason Sonochem, 2003, 10(3): 127-133.
[44]ZHAO Yiyun, FENG Ruo, SHI Yongshou, et al. Sonochemistry in China between 1997 and 2002[J]. Ultrason Sonochem, 2005, 12(3): 173-181.
[45]罗登林, 丘泰球, 卢群. 超声波技术及应用(Ⅲ): 超声波在分离技术方面的应用[J]. 日用化学工业, 2006, 36(1): 46-49.
[46]SMELCEROVIC A, SPITEKKER M, ZUEHLKE S. Comparison of methods for the exhaustive extraction of hypericins, flavonoids, and hyperforin from Hypericum perforatum L.[J]. J Agric Food Chem, 2006, 54(7): 2750-2753.
[47]RASO J, MANAS P, PAGAN R, et al. Influence of different factors on the output power transferred into medium by ultrasound[J]. Ultrason Sonochem, 1999, 5(4): 157-162.
[48]ROMDHANE M, GOURDOU C. Inverstigation in solid-liquid extraction: influence of ultrasound[J]. Chemical Engineering Journal, 2002, 87(1): 11-19.
[49]张晓燕, 丘泰球, 徐彦渊. 不同超声作用方式对葛根有效部位提取率的影响[J]. 应用声学, 2006, 25(3): 151-155.
[50]贲永光, 丘泰球, 李金华. 双频超声强化对三七总皂苷提取的影响[J]. 江苏大学学报: 自然科学版, 2007, 28(1): 12-16.
[51]曹雁平, 程伟. 多频超声连续逆流浸取黄芩中的黄芩苷[J]. 食品科学, 2008, 29(11): 219-222.
[52]SWAMY K M, NARAYANA K L. Intensification of leaching process by dual frequency ultrasound[J]. Ultrason Sonochem, 2001, 8(4): 341-346.
[53]SIVAKUMAR M, TATAKE P A, PANDIT A B. Kinetics of p-Nitrophenol degradation effect of reaction conditions and cavitational parameters for a multiple-frequency system[J]. Chemical Engineering Journal, 2002, 85 (2/3): 327-338.
[54]FENG Ruo, ZHAO Yiyun, ZHU Changping, et al. Enhancement of ultrasonic cavitational yield by multi-frequency sonication[J]. Ultrason Sonochem, 2002, 9(5): 231-236.
[55]杨日福, 丘泰球, 范晓丹. 超声强化亚临界水萃取装置设计及声空化分析[J]. 现代化工, 2009, 29(2): 70-74.
[56]李超, 丘泰球, 王卫东. 超声强化近临界CO2 流体萃取的机理[J]. 江苏大学学报: 自然科学版, 2009, 30(5): 450-453.
[57]VILKHU K, MAWSON R, SIMONS L, et al. Applications and opportunities for ultrasound-assisted extraction in the food industry: a review [J]. Innovative Food Science & Emerging Technologies, 2008, 9(2): 161-169.
[58]PATIST A, BATES D. Ultrasonic innovations in the food industry: From the laboratory to commercial production[J]. Innovative Food Science & Emerging Technologies, 2008, 9(2): 147-154.
[59]罗登林, 曾小宇, 徐宝成. 双频超声动态逆流高效提取装置的设计与分析[J]. 声学技术, 2009, 28(4): 488-490.
Advances in Ultrasound-assisted Extraction of Bioactive Compounds from Plants
MA Ya-qin1,2,3,YE Xing-qian4,WU Hou-jiu1,3,ZHOU Zhi-qin1,2,WANG Hua1,3,SUN Zhi-gao1,3
(1. Citrus Research Institute, Southwest University, Chongqing 400712, China;2. Post-Doctoral Mobile Stations of Horticulture, Southwest University, Chongqing 400712, China;3. National Citrus Engineering Research Center, Chongqing 400712, China;4. School of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310029, China)
In this paper, the mechanisms of ultrasound-assisted extraction are briefly introduced. Current research progress and future development trends related to ultrasound-assisted extraction of bioactive compounds from plants are reviewed. Application potential of ultrasound-assisted extraction technology in food processing is analyzed. Problems existing in the realization of industrial control of ultrasound-assisted extraction at present and future research direction are critically discussed.
ultrasound;extraction;bioactive compounds
TS201.1
A
1002-6630(2010)21-0459-05
2010-03-01
柑橘学重庆市市级重点实验室开放基金项目(CKLC200805)
马亚琴(1978—),女,副研究员,博士,研究方向为食品科学。E-mail:myaya211@163.com



