蒋 雨,陈安均,于 新*,褚福红,赵美美
(1.四川农业大学食品学院,四川 雅安 625014;2.仲恺农业工程学院轻工食品学院,广东 广州 510225;3.安徽农业大学茶与食品科技学院,安徽 合肥 230036)
响应面法优化微波提取野菊花抑菌物质工艺
蒋 雨1,陈安均1,于 新2,*,褚福红3,赵美美2
(1.四川农业大学食品学院,四川 雅安 625014;2.仲恺农业工程学院轻工食品学院,广东 广州 510225;3.安徽农业大学茶与食品科技学院,安徽 合肥 230036)
以野菊花的乙醇提取物对金黄色葡萄球菌的抑菌圈直径为响应值,在单因素试验基础上,根据Box-Behnken试验设计原理,研究响应面法(RSM)优化微波辅助提取野菊花抑菌物质的工艺参数。得到乙醇体积分数为50%,最佳参数为液固比40:1(mL/g)、提取时间15min、微波功率480W。经验证在此条件下,野菊花提取物对金黄色葡萄球菌的抑菌圈直径达到27.02mm,与预测值24.56mm差异不显着,置信区间大于95%。
野菊花;RSM;Box-Behnken试验设计;微波提取;抑菌
野菊花为菊科植物北野菊(C. boreale Mak.)或岩香菊(C. lavandulaefolium Mak.)的头状花序[1]。现代药理研究表明,野菊花具有消炎[2]、缓解痛风[3]、降血压、扩张冠状动脉并防止其粥样硬化[4]等作用。据报道,野菊花提取物对植物性病原菌有很好的抑制效果[5],对苹果腐烂病菌的抑制率达到94.9%[6]。研究发现野菊花中主要的抑菌活性物质包括:黄酮类化合物[4,7]、菊甙[8]、萜类物质[9]及挥发性物质[10-11]。目前,对于野菊花抑菌物质的提取多采用传统的熬煮法和溶剂提取法[6,12]。较传统方法,微波辅助提取采用能够吸收微波能量的极性溶剂为提取剂,具有加热快、加热均匀及无温度梯度等特点[13]。本研究根据多元回归分析多个独立变量及其交互关系对依变量的影响[14],应用响应面法优化了微波提取野菊花抑菌物质的工艺条件,旨在对野菊花的深入研究提供一定的参考。
1 材料与方法
1.1 材料、试剂与仪器
野菊花(岩香菊的头状花序)购于广州市药店;无水乙醇、三氯甲烷均为分析纯;牛肉膏蛋白胨培养基(牛肉浸膏3g、蛋白胨10g、NaCl 5g、琼脂粉15g、纯水1000mL,pH7.3);金黄色葡萄球菌(Staphylococcus aureus) 华南农业大学食品微生物实验室。MJ-176NR型多功能粉碎机 日本松下电器产业株式会社;G8023CSL-K3型微波炉 格兰仕微波炉电器有限公司;TGL-16C型台式离心机 上海安宁科学仪器厂;R系列-
旋转薄膜蒸发仪 无锡星海生化设备有限公司;SW-CJIF型无菌超净工作台 苏州净化设备有限公司。
1.2 方法
1.2.1 供试液的制备
称取野菊花粉末(过40目筛)5g,加入一定比例提取溶剂,梯度设置微波功率(功率=火力/%×输出功率8 0 0W),采用间歇微波提取方法(加热1 mi n,放置3min)。过滤提取液,4000r/min离心10min,取上清液,旋转蒸发(50℃)浓缩至5mL,4℃保藏备用。以等体积未加野菊花直接微波处理,旋转蒸发至5mL的提取溶剂为对照。
1.2.2 菌悬液的制备
将供试菌种接于牛肉膏蛋白胨琼脂培养基,37℃培养24h,用无菌生理盐水梯度稀释至6~7lg(CFU/mL),备用[15]。
1.2.3 抑菌活性测定
采用琼脂扩散法测定供试液的抗菌活性[16]。在直径为9cm的培养皿中倒入10mL左右的无菌的琼脂溶液,凝固后在上面安放牛津杯。培养基冷却到50℃左右时,每100mL培养基中加入2mL的菌悬液,摇匀后迅速倒入安放牛津杯的培养皿中(每皿约15mL),冷却后拔出牛津杯,每孔加入150μL供试液或对照液,37℃恒温培养24h,测量抑菌圈直径。每组实验设4个重复(组间组内各两次)。
1.2.4 响应面试验方案
根据单因素试验结果设定因素水平,采用Design-Excerpt 7.0.0软件中的Box-Behnken法设计试验方案,优化微波辅助提取野菊花抗菌物质的工艺参数,以提取物对金黄色葡萄球菌的抑菌圈直径为响应值,具体试验方案见表1。
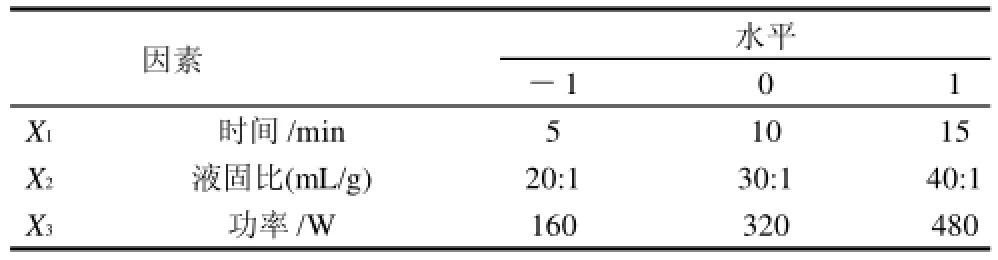
表1 Box-Benhnken设计因素及水平Table1 Factors and levels of Box-Benhnken experimental design
2 结果与分析
2.1 单因素试验
2.1.1 提取溶剂的选择
试验选用蒸馏水、体积分数分别为30%、50%、70%乙醇溶液、无水乙醇和三氯甲烷为提取溶剂,按液固比20:1(mL/g)添加,三氯甲烷为50℃索氏抽提3h,其余为微波160W提取5min。对照组均无抑菌圈,提取物的抑菌结果见图1。可以看出,极性溶剂的提取液中有效抑菌物质较多,其中以50%乙醇为最佳。因此,试验选用50%乙醇溶液为提取溶剂。
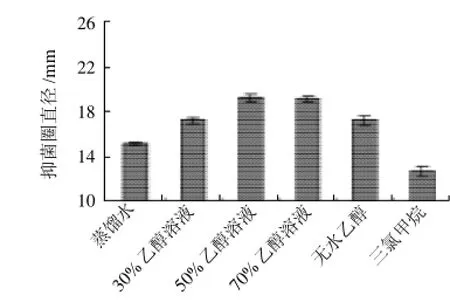
图1 不同溶剂提取物抑菌活性Fig.1 Antibacterial activity of extracts with different solvents
2.1.2 提取时间对野菊花提取物抑菌活性的影响
设定液固比为20:1(mL/g),微波功率为160W,微波浸提2~18min,研究微波加热时间对野菊花提取物抑菌活性的影响,结果如图2所示。微波提取10min时野菊花提取物的抑菌活性最大。2~10min内,抑菌圈直径不断增大,微波能快速进入植物细胞内部产生大量热量导致其膨胀破壁,而且热扩散与分子扩散运动方向一致,加速提取溶剂对细胞内活性物质的渗透[17]。浸提10min之后,抑菌圈直径有所减小,这可能与较长时间暴露于微波条件下,提取物中部分具有抑菌活性物质分解有关。
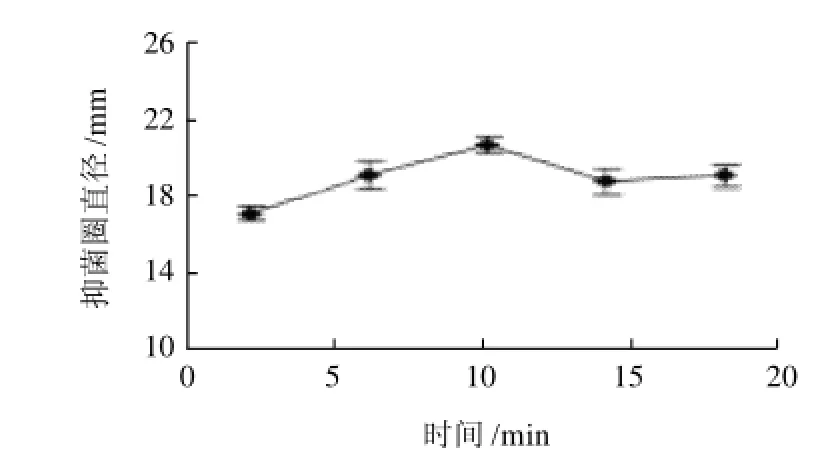
图2 提取时间对抑菌圈活性的影响Fig.2 Effect of extraction time on the antibacterial activities of the extract
2.1.3 液固比对野菊花提取物抑菌活性的影响
设定微波功率160W,提取时间10min,液固比分别为10:1、20:1、30:1、40:1、50:1(mL/g)。野菊花提取物的抑菌活性试验结果见图3,液固比30:1(mL/g)时,野菊花提取物的抑菌活性最强。继续增大液固比,抑菌活性变化不大。这可能是因为当液固比达到一定的比例时,抑菌活性物质已被充分提取。因此从试验及成本角度考虑,选取液固比为30:1为宜。
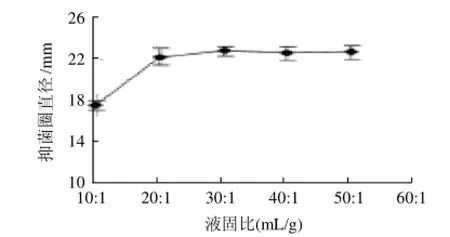
图3 液固比对抑菌活性的影响Fig.3 Effect of liquid/solid on the antibacterial activities of the extract
2.1.4 微波功率对野菊花提取物抑菌活性的影响
设定液固比30:1(mL/g),在不同微波功率(火力为20%、40%、60%、80%、100%时,对应的功率分别为160、320、480、640、800W条件下处理10min,野菊花提取物的抑菌试验结果见图4。在微波功率320W条件下,提取物的抑菌活性达到最高值,继续增加微波功率,活性反而下降。在其他参数一定的条件下,微波功率越大,提取溶剂温度升高越快,高温环境对活性物质的结构破坏作用也更强[18];另一方面,较高功率条件下的微波可能导致一部分极性较强的抑菌活性物质高频运动而热降解[14]。
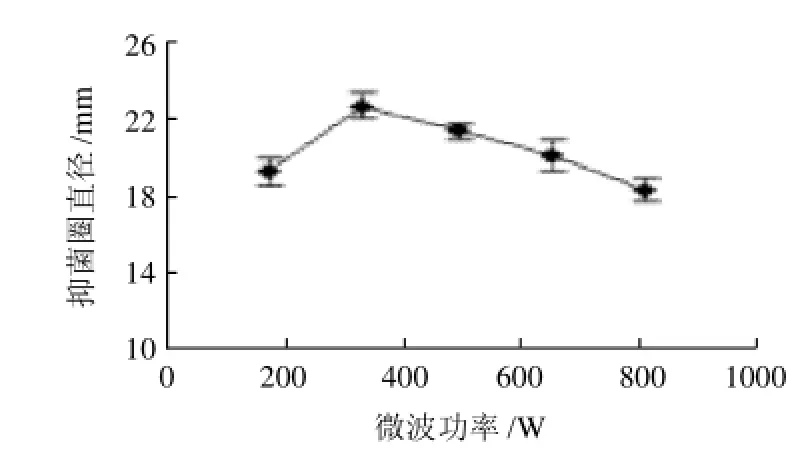
图4 微波功率对抑菌活性的影响Fig.4 Effect of microwave power on the antibacterial activities of the extract
2.2 响应面试验
2.2.1 模型的建立及显着性检验
利用Design-Expert 7.0.0软件对表2数据进行多元回归拟合,得到微波时间(X1)、液固比(X2)和微波功率(X3)的二次多项回归模型:
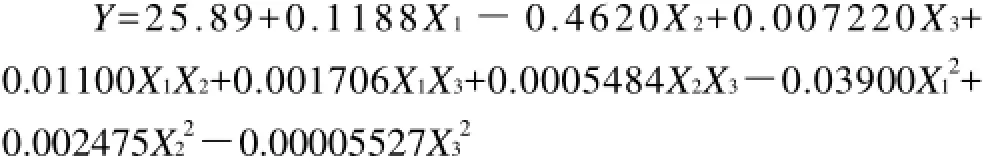
该方程的决定系数R2=0.9152。表3表明,微波提取时间一次项、微波提取时间和微波功率的交互项、微波功率二次项达到极显着水平(P<0.01)。微波提取时间一次项、微波功率一次项达到显着水平(P<0.05)。整体模型达极显着水平(P<0.01),失拟项不显着(F=2.43)。表明该二次方程模型比较显着,对试验拟合较好,可以对不同条件下的野菊花提取物的抑菌活性进行预测。另外,该模型的变异系数为3.46%,在可接受范围内。变异系数是衡量每个平均值偏离情况的参数,其值越小,重复性越好。
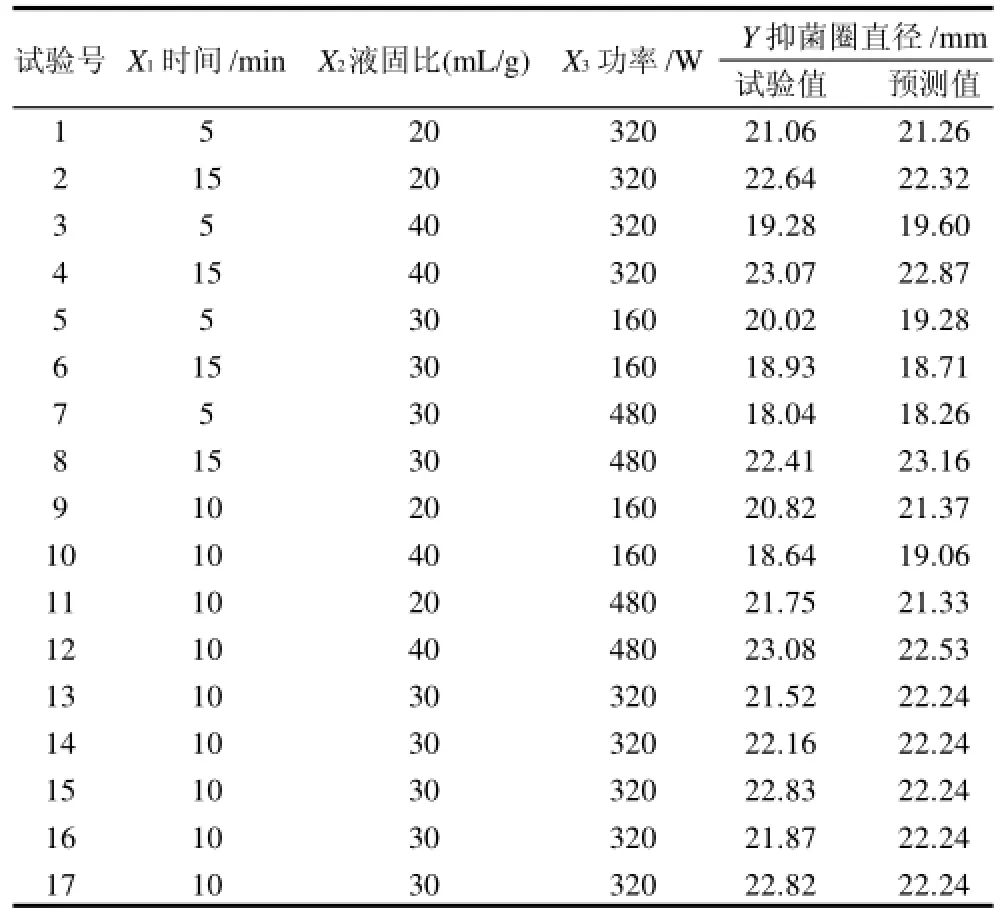
表2 响应面试验方案及结果Table2 Experimental design and results of the Box-Benhnken test
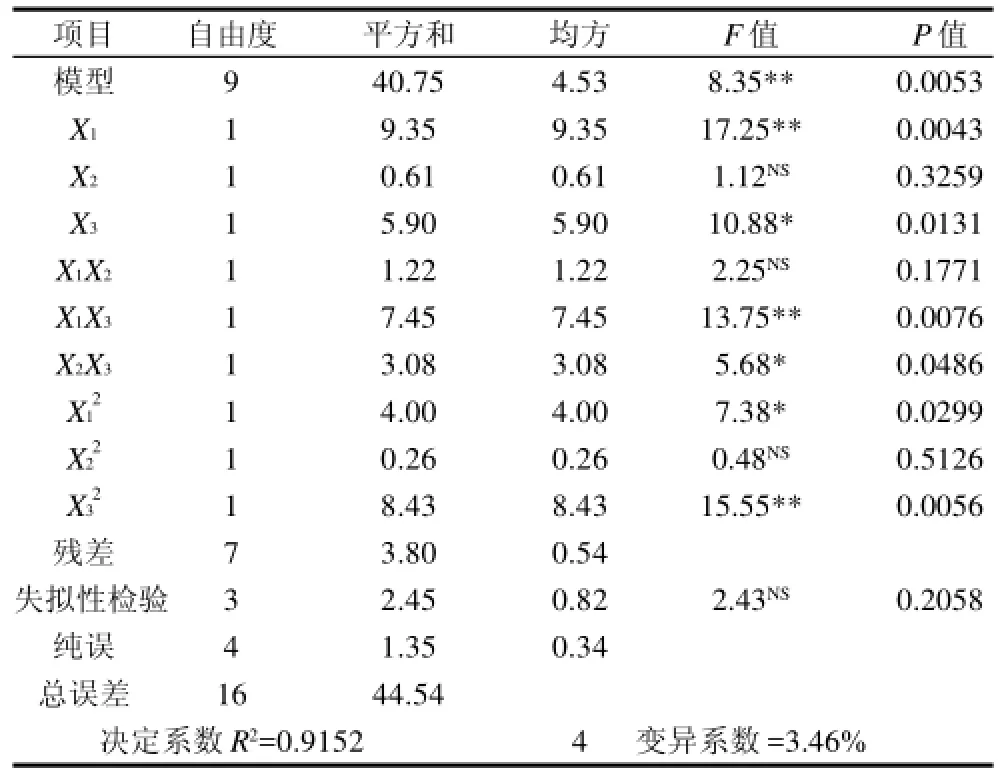
表3 回归模型方差分析Table3 ANOVA for the regression model
2.2.2 响应面分析
利用Design-Expert 7.0.0软件,根据所得回归方程分析作响应面(图5~7)。如果一个响应曲面坡度非常陡峭,表明响应值对于处理条件的改变非常敏感[19]。从
另一个方面也说明因素间存在较强的交互作用,因素间的轻微改变可导致结果的较大变化。图5显示在微波功率320W条件下,微波时间与液固比对野菊花提取物抑菌活性的影响,可以看出,抑菌活性随着液固比的提高呈近线性增加;提取时间对提取物抑菌活性的影响基本呈二次关系。液固比值较低时,提取时间12min,野菊花提取物的抑菌活性达到最大值;随着液固比增加,野菊花提取物抑菌活性达到最大的提取时间延长。液固比为40:1(mL/g)时,提取15min,提取物的抑菌活性达到最大;图6显示液固比为30:1(mL/g)时,微波功率与提取时间对野菊花提取物抑菌活性的影响,微波功率与提取时间之间的交互作用明显,这与方差分析结果一致。微波功率和时间共同增加时,野菊花提取物的抑菌活性增大,微波功率480W,提取时间15min抑菌活性达到最大;图7显示微波提取10min时,微波功率和液固比对野菊花提取物抑菌活性的影响,可以看出,微波功率为160W时,野菊花提取物抑菌活性随液固比增大而减弱;微波功率为350W时,随着液固比增大,抑菌活性先减弱后逐渐增强;微波功率为480W时,抑菌活性随液固比增大而增强。
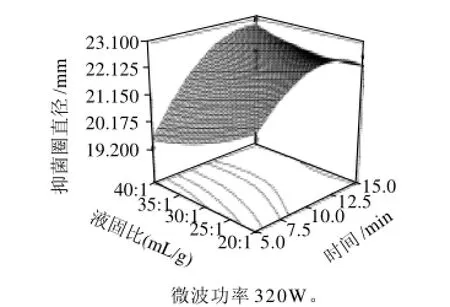
图5 液固比和时间对抑菌活性影响的响应面Fig.5 Response surface plot showing the effects of liquid/solid ratio and extraction time on the antimicrobial activity of the extract
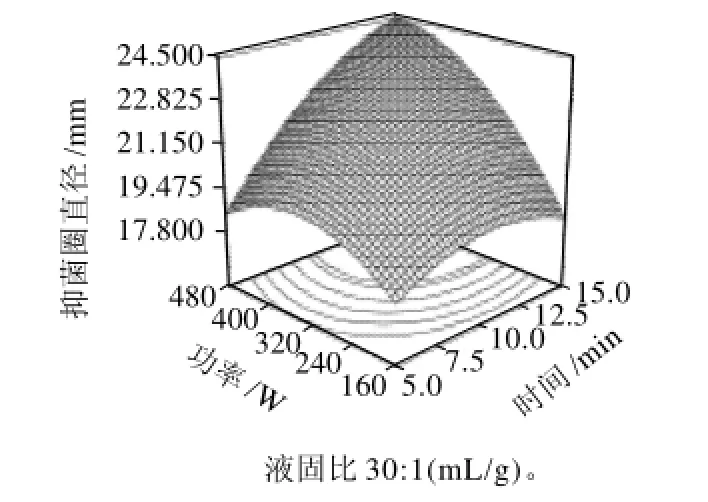
图6 微波功率和时间对抑菌活性影响的响应面Fig.6 Response surface plot showing the effects of microwave power and time on the antimicrobial activity of the extract
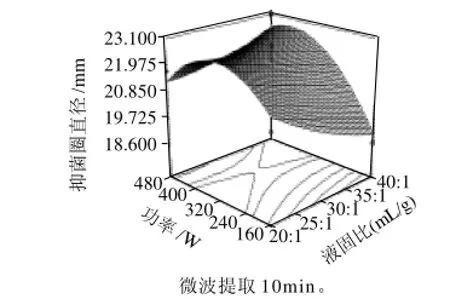
图7 功率和液固比对抑菌活性影响的响应面Fig.7 Response surface plot showing the effects of microwave power and liquid/solid ratio on the antimicrobial activity of the extract
2.2.3 提取工艺的优化
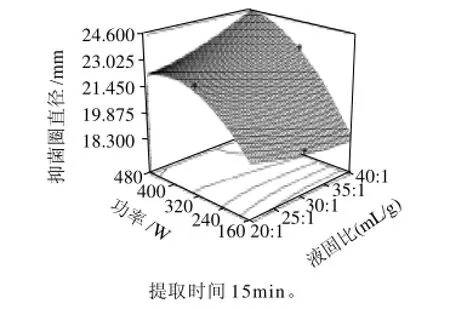
图8 提取工艺优化的响应面Fig.8 Response surface plot showing the effect of microwave power and liquid/solid ratio on the antimicrobial activity of the extract
利用Design-Expert 7.0.0软件对工艺条件进行优化分析,结果如图8所示。结合二次回归模型的数学分析结果,可以判断微波提取野菊花抑菌物质的最佳工艺参数为体积分数50%乙醇溶液、微波功率480W、液固比40:1 (mL/g),提取15min,在此条件下预测的抑菌圈直径为24.56mm。该试验点刚好处于响应面的边缘处,与试验设计的中心点偏离较大,说明试验所选因素间存在较强的交互作用[20]。验证实验表明,在此最佳条件下提取的野菊花提取物的抑菌活性最大,4次重复实验的抑菌圈直径平均值达到27.02mm,与相应面优化结果24.56mm差异不显着,置信区间CI(confidence interval)<95%。
3 结 论
以体积分数50%的乙醇提取野菊花抑菌物质通过响应面法优化,提取参数(微波提取时间、液固比、微波功率)最终获得最佳提取条件为微波功率480W、液固比40:1(mL/g)、提取15min、经验证在此条件下抑菌圈直径为27.02mm(CI>95%)。
[1]江苏新医学院. 中药大辞典[M]. 上海: 上海科学技术出版社, 1991: 2144-2145.
[2]CHENG Wenming, LI Jun, YOU Tianpa, et al. Anti-inflammatory and immunomodulatory activities of the extracts from the inflorescence of Chrysanthemum indicum Linné[J]. Journal of Ethnopharmacology, 2005, 101(1/2/3): 334-337.
[3]KONG L D, CAI Y, HUANG W W, et al. Inhibition of xanthine oxidase by some Chinese medicinal plants used to treat gout[J]. Journal of Ethnopharmacology, 2000, 73(1/2): 199-207.
[4]朱庆书, 赵文英. 超声提取野菊花总黄酮及其抑菌活性的研究[J]. 化学与生物工程, 2008, 25(12): 72-74.
[5]ALVAREZ-CASTELLANOS P P, BISHOP C D, PASCUALVILLALOBOS M J . Antifungal activity of the essential oil of flowerheads of garland chrysanthemum (Chrysanthemum coronarium) against agricultural pathogens[J]. Phytochemistry, 2001, 57(1): 99-102.
[6]万大伟, 魏艳, 李园园, 等. 野菊花提取物对19种病原真菌的生物活性研究[J]. 江苏农业科学, 2008(2): 102-104.
[7]魏艳, 万大伟, 孟昭礼, 等. 野菊花中杀菌活性物质的分离和结构鉴定[J]. 西北农业学报, 2009, 18(4): 74-76.
[8]毛胜凤, 张新凤, 余树全. 不同成熟期野菊花提取物抑菌效果比较研究[J]. 浙江林业科技, 2006, 26(5): 43-54.
[9]侯冬岩, 郭华, 李铁纯, 等. 千山野菊花萜类化合物的分析[J]. 沈阳师范大学学报: 自然科学版, 2003, 21(4): 303-306.
[10]BUKET C A, HASAN B F, SELGUK K. Antimicrobial activity and chemical composition of some essential oils[J]. Arch Pharm Res, 2002, 25(6): 860-864.
[11]胡浩斌, 郑旭东. 子午岭野菊花挥发油的化学成分及抑菌活性[J]. 新疆大学学报: 自然科学版, 2005, 22(3): 295-208.
[12]方静, 王德, 周学琴. 野菊花两种提取方式对5种常见细菌的抑菌效果的比较[J]. 数理医药学杂志, 2007, 20(3): 368-369.
[13]刘忠英, 胡秀丽, 卜凤泉, 等. 微波辅助提取刺五加中黄酮类化合物过程中的化学变化研究[J]. 高等学校化学学报, 2007, 28(3): 431-435.
[14]JEONG G T, KIMD H, PARKD H. Response surface methodological approach for optimization of free fatty acid removal in feedstock[J]. Applied Biochemistry and Biotechnology, 2007, 137/140: 583-594.
[15]常银子, 仲山民, 曹玉成, 等. 野菊花、金银花和芦荟复合提取液抑菌作用的研究[J]. 安徽农业科学, 2007, 35(16): 4872-4874.
[16]周邦靖. 常用中药的抗菌作用及其测定方法[M]. 重庆: 科学技术出版社重庆分社, 1987: 302-303.
[17]郭维图, 孙福平. 微波提取的基本特性与微波连续提取装置[J]. 机电信息, 2010(8): 28-31; 34.
[18]任红荣, 姜洪芳, 单承莺, 等. 微波提取香水莲花总黄酮的工艺研究[J]. 中国野生植物资源, 2010, 29(2): 30-33.
[19]杨佳, 张国文, 汪佳蓉, 等. 响应面分析法优化超声提取赣南脐橙皮中黄酮类化合物的工艺研究[J]. 食品科学, 2009, 30(16): 94-97.
[20]SUMANT P, QASIM K B, RANI G. Optimization of alkaline protease production from Bacillus sp. by response surface methodology[J]. Current Microbiology, 2002, 44: 286-290.
Microwave-assisted Extraction of Antibacterial Substances from Inflorescence of Chrysanthemum lavandulaefolium (Fisch.) Mak.
JIANG Yu1,CHEN An-jun1,YU Xin2,*,CHU Fu-hong3,ZHAO Mei-mei2
(1. College of Food Science, Sichuan Agricultural University, Ya’an 625014, China;2. College of Light Industry and Food Science, Zhongkai University of Agriculture and Engineering, Guangzhou 510225, China;3. College of Tea & Food Science and Technology, Anhui Agricultural University, Hefei 230036, China)
Box-Behnken experimental design coupled with response surface analysis was employed to optimize the microwaveassisted extraction of antibacterial substances using 50% aqueous ethanol form the inflorescence of Chrysanthemum lavandulaefolium (Fisch.) Mak. Anti-Staphylococcus aureus activity of the extract was investigated by determining the diameter of inhibition zone. The optimal conditions of microwave extraction were as follows: liquid-to-solid ratio 40:1(mL/g), microwave treatment time 15 min, microwave power 480 W. The experimental diameter of inhibition zone was 27.02 mm, which was in accordance with the predicted value of 24.56 mm.
Chrysanthemum lavandulaefolium (Fisch.)Mak.;RSM;Box-Behnken;microwave extraction;antibacteria
R282.71;O658.2
A
1002-6630(2010)22-0059-05
2010-01-31
蒋雨(1984—),女,硕士研究生,研究方向为农产品贮藏与加工。E-mail:jiangrong1958@yahoo.com.cn
*通信作者:于新(1959—),男,教授,硕士,研究方向为农产品贮藏与加工。E-mail:yuxin1959@yahoo.com.cn



