陈 亮,兰海楠,郑 鑫,刘景圣,*
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.吉林农业大学动物科学技术学院,吉林 长春 130118)
长白山林蛙输卵管糖蛋白多抗制备及应用研究
陈 亮1,兰海楠2,郑 鑫2,刘景圣1,*
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.吉林农业大学动物科学技术学院,吉林 长春 130118)
针对长白山林蛙输卵管糖蛋白制备特异性多克隆抗体。将新鲜林蛙输卵管蛋白粗提液经Sepharose Fast Flow阴离子交换柱和Sephadex G-100凝胶层析柱获得纯化的输卵管糖蛋白组分。以纯化输卵管糖蛋白免疫新西兰大白兔,制备多抗血清,采用辛酸-饱和硫酸铵法对多抗进行纯化并鉴定。结果表明:纯化后的多抗ELISA效价为1:64000,纯化多抗具有较高的敏感性和特异性,效价较高。利用制备的多抗对长白山林蛙输卵管分泌细胞进行免疫组织化学定位,为分泌细胞培养产物中输卵管糖蛋白进行检测提供研究条件。
长白山林蛙;输卵管糖蛋白;抗体;免疫组化
长白山林蛙(Rana chensinensis Changbaishanensis)属中国林蛙长白山亚种,主要分布于我国东北长白山和小兴安岭地区,是我国特有的药用两栖动物[1-2]。雌性林蛙输卵管排卵前的干品俗称林蛙油(蛤蟆油),因其中含有多种生物活性成分如氨基酸、雌二醇、糖蛋白等[3]而成为与人参、鹿茸齐名的珍贵滋补保健品[4-5]。据中华人民共和国药典记载[6],林蛙油具有滋阴补肾功能,用于身体虚弱,病后失调,精力耗损,心悸失眠等症。近年的大量研究也表明,林蛙油对肝脏具有保护作用[7],能明显降低肝损伤程度,能降低高血脂症大鼠血清中总胆固醇、甘油三酯和血清脂蛋白的含量[8],此外还具有明显的抗焦虑作用[9]、抗疲劳作用,可调节人体内分泌,在医学界素有“软黄金”之称[10-11]。目前,保健品市场上对林蛙油的需求量大幅上升,导致大量捕杀野生林蛙取油,造成野生林蛙数量急剧下降,严重破坏了生态平衡。为此,亟待开展对林蛙输卵管生长发育规律、输卵管中生物活性物质的产生及其生理功能的研究,探索新的方法和途径,解决林蛙油供不应求的问题,以维护生态平衡。
糖蛋白是指由糖链与多肽链以多种形式共价修饰而形成的一类具有重要生理活性的结合蛋白质[12],具有开关、调谐、作为激素、胞内转运、保护、促进物质吸收、参与血液凝固、参与细胞识别等多方面的重要生理活性[13]。糖蛋白对人类健康的重要作用越来越受到
重视,糖类和蛋白质的相互作用参与了许多生理和病理过程,目前利用糖蛋白的靶向性设计抗肿瘤药物,以及应用免疫原性制备多糖结合疫苗,激发免疫系统达到治疗目的,通过生物疗法提高治疗效果,已成为越来越重要的治疗手段[14]。1934年日本学者久保田晴光等[15]对林蛙油成分进行了分析,结果表明林蛙油的主要成分为蛋白质,占总量的5 6.3%。对林蛙输卵管糖蛋白(oviduct glycoprotein,OGP)的初步研究结果显示,输卵管组织中可溶性糖蛋白含量极高,约占输卵管蛋白质总量的58.3%~65.7%,其含量上暗示林蛙OGP具有独特的生理活性功能,在林蛙油的保健功能方面发挥着一定作用。本研究以提取后纯化的林蛙输卵管糖蛋白免疫新西兰大白兔,制备了针对林蛙输卵管糖蛋白的特异性多抗,对输卵管分泌细胞进行免疫组织化学定位,为长白山林蛙输卵管分泌细胞培养产物中糖蛋白的提取与检测,输卵管分泌细胞培养产物中糖蛋白与林蛙OGP的比较提供实验基础,为林蛙OGP的人工合成及林蛙输卵管功能性食品的开发提供参考。
1 材料与方法
1.1 材料、试剂与仪器
实验动物为雄性新西兰大白兔3只,体质量2.5kg左右,购自吉林大学动物实验中心;长白山林蛙选取柳河市安口镇地区3年龄雌性冬眠期、发情期以及排卵后的林蛙。
羊抗兔酶标二抗 北京中衫金桥生物公司;96孔酶标板 Constar公司,其他常规试剂均为分析纯。
UV-2450紫外-可见分光光度计 日本岛津公司;AKTA Prime Plus蛋白纯化仪 GE公司;VE-180垂直电泳仪 Tanon公司;WFH-103自动凝胶成像仪 上海精密科学仪器有限公司;XW-QP-003切片机 莱卡公司;CK×41倒置光学显微镜 Olympus公司。
1.2 OGP的提取与纯化
1.2.1 OGP的粗提
新鲜林蛙输卵管组织用10倍质量的生理盐水反复冲洗输卵管管腔内壁,冲洗液离心除杂。上清用70%饱和度的硫酸铵盐析,离心弃上清。沉淀用磷酸盐缓冲液(pH7.4)溶解,离心除去不溶物。弃去沉淀,透析,得林蛙输卵管粗蛋白,-20℃保存备用。
1.2.2 OGP的纯化
将粗提蛋白过Sepharose Fast Flow(9mm×140mm)层析柱,以1mL/min的流速,0.05~1.01mol/L NaCl的梯度洗脱。紫外分光光度计于540nm波长范围检测吸光度,收集含蛋白部分,透析,-2 0℃保存。
将经Sepharose Fast Flow层析柱所得组分过Sephadex G-100(1.6cm×80cm)柱层析,0.05mol/L pH8.0的PBS洗脱,紫外分光光度计于540nm波长范围检测吸光度,收集蛋白组分,苯酚-硫酸法检测糖含量。
1.2.3 纯度鉴定
采用电泳法,检测OGP的纯度。SDS-PAGE检测纯度与分子质量,12%分离胶、5%浓缩胶,每孔上样量为5μL,浓缩胶段采用80V恒压,分离胶段采用160V恒压。
1.3 动物免疫
1.3.1 阴性血清制备
将家兔称质量,编号,禁食10h以上并给与饮水后心脏采血,制备血清,用于阴性对照。
1.3.2 阳性血清制备
用基础法免疫新西兰白兔,免疫剂量OGP为1.0mg/只,具体免疫程序如下。首免:纯化OGP抗原加等量弗氏完全佐剂,皮下多点免疫。二免:2周后纯化抗原加等量弗氏不完全佐剂皮下多点免疫。三免:3周后,同二免。三免后10d耳静脉采血检测血清效价,如效价达到要求则进行心脏采血。离析血清保存备用。
1.4 OGP 多抗的纯化
采用辛酸-饱和硫酸铵法[16]对多抗进行纯化。纯化多抗进行12%SDS-PAGE电泳测定抗体分子质量,具体操作参照《分子克隆实验指南》[17]。抗体的含量测定采用双波长紫外分光光度法。
1.5 间接ELISA工作浓度的确定
采用双方阵法确定抗原、抗体最佳工作浓度[18]。用包被液OGP抗原倍比稀释为1:40、1:80、1:160、1:320、1:640分别包被酶标板各行,将纯化后的抗体从1:100开始倍比稀释至1:1600,分别加入各列,37℃温育1h。加入HRP标记的羊抗兔IgG(1:5000稀释)100μL,37℃温育1h。加入底物液避光室温显色10min后,加入终止液终止反应。OD490nm值接近1.0,且前后稀释度出现较大变化时,该孔的抗原包被浓度为OGP最佳工作浓度,该孔多抗的稀释倍数为多抗的最佳工作浓度。
1.6 多抗效价测定
用建立的ELISA方法测定纯化抗体效价,用包被液将OGP 稀释成10μg/mL,包被酶标板,每孔加入100μL 4℃过夜。用PBS-Tween3'×3洗涤拍干,每孔加入5%羊血清200μL封闭,37℃温育1h。用PBS-Tween 3'×3洗涤拍干,将纯化好的抗体从1:1000开始倍比稀释直至1:128000,100μL/孔,37℃温育1h。用PBS-Tween 3'×3洗涤拍干,加入HRP标记的羊抗兔IgG(1:5000稀释)100μL,37℃温育1h。用PBS-Tween3'×3洗涤拍干,加入底物液100μL,避光室温显色10min后,每孔加50μL终止液(2mol/L H2SO4)终止反应。测定OD490nm
值,计算出阳性血清与阴性血清OD490nm值之比(P/N),P/N>2对应最大多抗稀释倍数即为纯化后多抗的效价。
1.7 特异性检测
酶标板分别用OGP、正常排卵前雌性林蛙血清、正常排卵前雌性林蛙头多糖、正常排卵前雌性林蛙皮肤分泌液等包被酶标板,用已建立的ELISA方法对多克隆抗体进行特异性检测。
1.8 免疫组化
分别取排卵前、排卵后新鲜林蛙输卵管组织块,放入0.85% NaCl液清洗,再加入Bouin’s固定液固定,进行梯度酒精脱水、透明、浸蜡、包埋、切片(片厚5μm)、贴片。首先取切片进行常规HE染色。再选用以制得的抗体进行标本的免疫组化染色,免疫组化染色的步骤是:切片脱蜡、复水、修复、内源性过氧化物酶阻断、羊血清封闭、一抗孵化、二抗孵化、三抗孵化、D A B发色、终止、脱水、透明、封片。
2 结果与分析
2.1 OGP的纯化
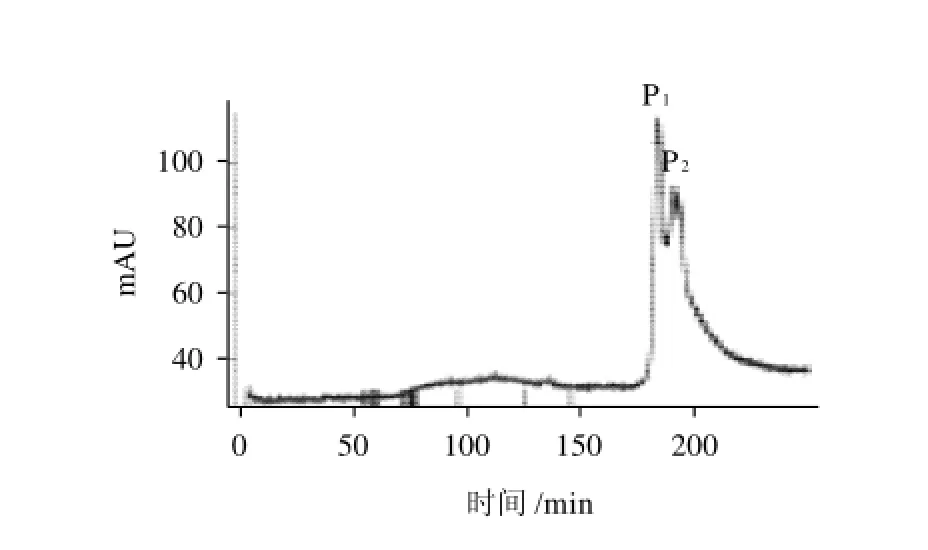
图1 样品的阴离子交换柱的分离图谱图Fig.1 Separation of the crude fresh OGP-rich extract on Sepharose Fast Flow IEC
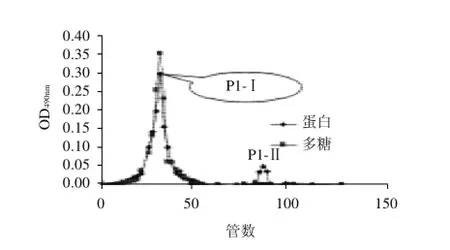
图2 阴离子交换柱中P1的Sephadex G-100凝胶柱层析洗脱曲线Fig.2 Separation of fraction P 1 of the crude fresh OGP-rich extract on Sephadex G-100 SEC
粗提蛋白经Sepharose Fast Flow阴离子交换柱层析,可以得到2个组分,分别为P1、P2,P1为主峰(图1)。经SephadexG-100凝胶层析柱层析,P1的洗脱曲线中得到了2个对称峰,分别为P1-I,P1-Ⅱ。紫外分光光度法和苯酚-硫酸法检测结果(图2)表明:P1-I是蛋白和糖的重合峰,推测其为OGP,P1-Ⅱ为单纯的蛋白组分,与本研究考查的糖蛋白性质不符,故不做研究。
2.2 OGP抗原的纯度和分子质量测定
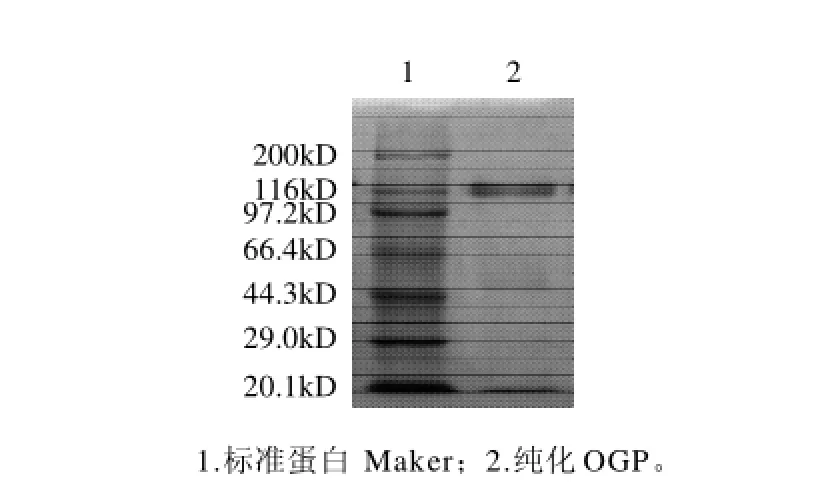
图3 纯化OGP的SDS-PAGE结果Fig.3 SDS-PAGE analysis of purified OGP
OGP收集液浓缩后经SDS-PAGE分析,结果显示其为单一蛋白带,如图3所示。OGP经Sephadex G-100柱洗脱,曲线显示多糖为单一峰,峰形基本对称,证明所获得的糖蛋白为均一组分。测定结果进一步说明该蛋白为单一纯化糖蛋白。经测定纯化O G P总糖含量为1 4%,蛋白含量为7 8%,其分子质量为1 1 6 k D。双波长紫外分光法测定纯化O G P抗原质量浓度为0.862mg/mL。
2.3 纯化多抗质量浓度测定
利用双波长紫外分光光度计法测定纯化后抗体质量浓度,蛋白质量浓度(mg/mL)按公式:OD280nm×1.45-OD260mn×0.74计算。计算得纯化后抗体质量浓度为1.687mg/mL。
2.4 最佳间接ELISA工作浓度
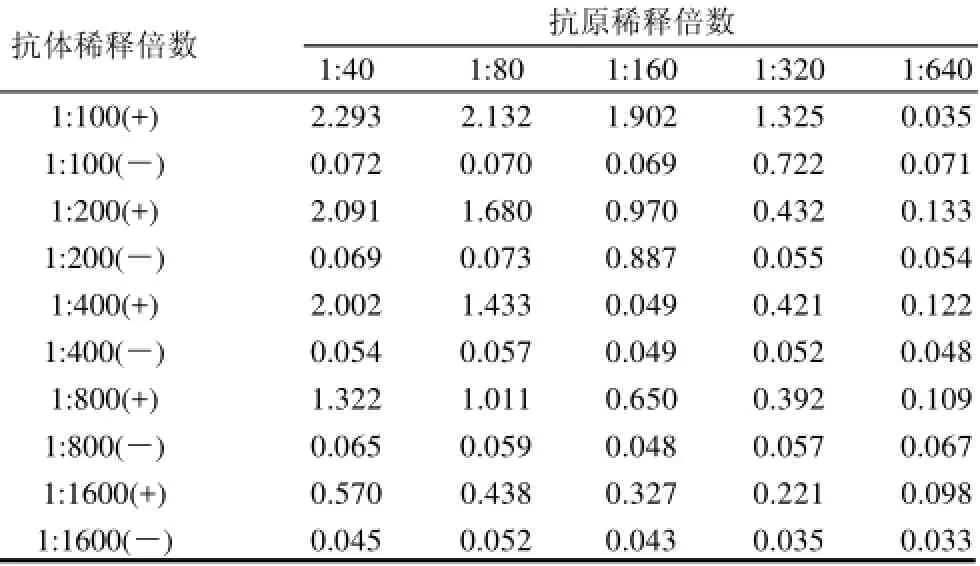
表1 采用双方阵法确定抗原,抗体最佳工作浓度Table 1 Optimal working concentrations of antigen and antibody determined by double matrix method
通过双方阵法确定抗原、抗体最佳工作浓度,抗原阴阳性抗体每个稀释度做3个重复,取平均值,读取OD490nm值在最接近1.0时的抗原、抗体稀释度,作为此抗原、抗体的最佳间接ELISA工作浓度。结果如表1所示,在抗原1:80、抗体1:800稀释时最佳,所以,抗原最佳包被质量浓度10μg/mL,抗体最佳稀释质量浓度定为2μg/mL。
2.5 纯化多抗效价测定
抗原包被浓度为1μg/孔,酶标二抗稀释倍数为1:6000,纯化后多克隆抗体效价测定结果见表2。P/N>2对应最大多抗稀释倍数为1:64000,所以纯化抗体的ELISA效价为1:64000,结果如表2所示。
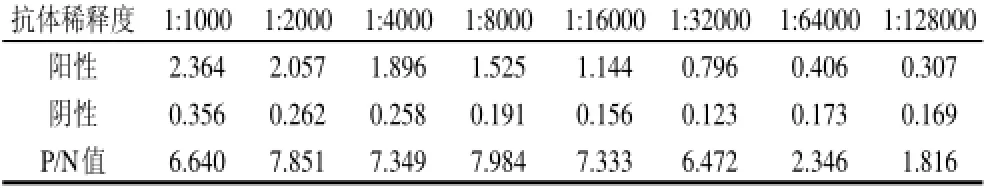
表2 纯化抗体效价Table 2 Titer determination of the purified antibody
2.6 多抗的特异性分析
通过建立的ELISA体系检测,制备的多抗与长白山林蛙输卵管糖蛋白OGP呈特异性反应,而与其他几种蛋白不发生交叉反应。特异性分析结果见表3。

表3 多抗特异性分析结果Table 3 Specificity analysis of the purified antibody
2.7 OGP分泌细胞免疫组化定位
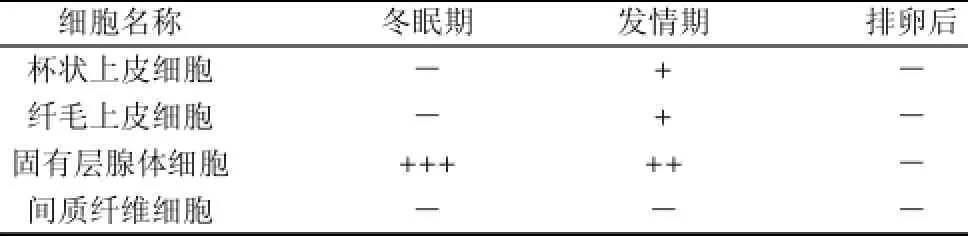
表4 免疫阳性细胞的分布Table 4 Distribution of positive immune cells in different cells and at different development stages
由表4、图4~6可知,OGP分泌细胞多分布在固有层单管状腺内,固有层主要由单管状腺构成,管状腺的导管部和分泌部无明显区别,无腺腔,冬眠期细胞膨大,呈多边形,免疫组化呈强阳性,可见棕黄色颗粒状表达;发情期细胞萎缩,可见腺腔,免疫组化呈弱强阳性;排卵后,腺体导管部的管腔缩小,腺体细胞增多,免疫组化呈阴性。

图4 冬眠期输卵管(40×10)Fig.4 Oviduct in hibernation (40×10)
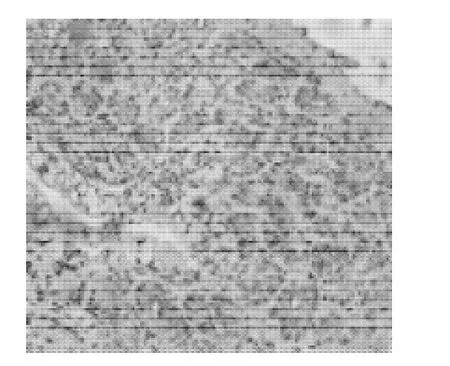
图5 发情期输卵管(40×10)Fig.5 Oviduct in oestrus (40×10)

图6 排卵后输卵管(40×10)Fig.6 Oviduct after ovulation (40×10)
3 结 论
以蛋白作为免疫原制备多抗的研究非常广泛,技术也日趋完善。影响多克隆抗体制备是否成功及效价高低的因素很多,对免疫原的选择尤为关键。长白山林蛙OGP是林蛙在繁殖期输卵管急剧膨大,上皮细胞和腺体组织极其发达而大量分泌产生的,林蛙排卵前OGP在输卵管组织中含量达到最高,因此必须控制在排卵前提取才可能保证OGP的提取量。本研究采用经Sepharose Fast Flow阴离子交换柱和Sephadex G-100凝胶层析柱对纯化的OGP作为免疫原,不仅符合纯度要求而且灵敏度高,从而获得了特异性强、效价较高的针对林蛙OGP的多抗。两次免疫之间的间隔的选择对免疫结果也具有很大的影响。本实验结果显示,间隔1~2周免疫的动
物产生了很好的免疫应答,所产生抗体的ELISA效价达1:64000,也证明设计的OGP抗原是正确的。采用正常排卵前雌性长白山林蛙血清、头部多糖、皮肤分泌液进行特异性实验,证明免疫产生的抗体是特异性的。通过获得了高效价的特异性的OGP抗体。为下阶段的研究提供了重要的实验材料,特别是为长白山林蛙输卵管分泌细胞免疫学定位与鉴定,细胞体外培养产物中OGP的检测与提取提供研究依据。
长白山林蛙输卵管壁由黏膜上皮、固有层和浆膜构成。上皮层细胞分杯状细胞和纤毛上皮细胞两种,此阶段上皮层以杯状细胞为主,多层排列,黏膜下方有一层薄的结缔组织,有少量的微血管和间质纤维。固有层主要由单管状腺构成,管状腺的导管部和分泌部无明显区别,无腺腔,腺体细胞属开放型细胞,管状腺经过上皮细胞突起开口于管腔。冬眠期固有层单管状腺腺体细胞内都充满黏液,黏液致密,腺细胞境界不清,细胞有融合现象;发情期当卵子通过输卵管时,向卵子分泌有效物质,将其包裹住,形成卵团。最外层为浆膜,为单层结缔组织。
免疫组化结果显示,冬眠期固有层单管状腺腺体细胞储存大量黏液,黏液中富含OGP,管状腺轮廓清晰,呈多边形,免疫组化呈强阳性,可见棕黄色颗粒状表达;黏膜上皮虽有分泌细胞,但并不含有OGP。发情期固有层单管状腺腺体细胞多数已分泌黏液,细胞变成扁平状,细胞境界清晰,单管腺结构清晰,可见腺体腺腔,但腺腔内仍储留有黏液,免疫组化呈阳性;OGP经黏膜上皮分泌,故在发情期黏膜上皮细胞内存在少量OGP,免疫组化呈弱阳性。排卵后固有层单管状腺腺体细胞的黏液排空,腺体导管部的管腔缩小,细胞增多,微血管增加,免疫组化呈阴性;黏膜层管腔面不规则,褶皱变短,似花瓣状,免疫组化呈阴性。
[1]李景林. 长白山区中国林蛙资源及其保护与增殖[J]. 资源开发与市场, 1999, 15(2): 15-16.
[2]魏刚, 徐宁. 长白山林蛙Rana Chensinensis四亚种性状组成成分分析[J]. 贵州科学, 1991, 14(1): 27-31.
[3]江苏新医学院. 中药大辞典(下册)[M]. 上海: 上海人民出版社, 2000: 1650-1977.
[4]赵文英, 侯振荣, 孙国忱, 等. 蛤蟆油的研究进展[J]. 沈阳药科大学学报, 1996, 13(1): 68-71.
[5]刘素琴, 邓英杰, 刘淑珍. 蛤蟆油活性部位的研究[J]. 沈阳药科大学学报, 1995, 12(4): 293-294.
[6]国家药典委员会编. 中华人民共和国药典[M]. 北京: 化学工业出版社, 2000: 165.
[7]王春霖. 蛤士蟆油甾体激素定量分析及药理作用[J]. 中药通报, 1985, 10(2): 44-46.
[8]林纪蛹. 中国林蛙和中华大蟾蜍输卵管睾酮分析[J]. 中草药, 1989, 20(7): 11-14.
[9]于中泽, 林纪娴, 廖静华. 中国林蛙与中华大蟾蜍输卵管雌二醇分析[J]. 中药材, 1989, 12(11): 17-18.
[10]杜景新, 王丽. 林蛙油、林蛙卵油的成分及开发利用[J]. 人参研究, 2003, 3(13): 18-19.
[11]高阳, 王勇. 林蛙油功能性饮料的研制[J]. 饮料工业, 2002, 5(6): 15-17.
[12]MATSUI M, KAKUT M, MISAKI A. Fine structural features of oyster glycogen: mode of multiple branching[J]. Carbonhydrate Polymers, 1996, 31(16): 227-235.
[13]刘传聚, 左嘉客. 输卵管特异性糖蛋白的研究进展[J]. 细胞生物学杂志, 1997, 19(4): 153-157.
[14]仲娜, 郝林华, 王小如. 糖蛋白药物研究进展[J]. 中国新药杂志, 2005 (12): 1400-1403.
[15]JIU B T Q G. About oviductas ranae, research on oviductas ranae oral[J]. Japanese Med Anal, 1934(18): 39-41.
[16]萨姆布鲁克 J, 拉塞尔D W. 分子克隆实验指南[M]. 北京: 科学出版社, 2002: 1256-1257; 1713-1720.
[17]朱平, 冯书章. 抗体实验技术[M]. 长春: 长春出版社, 1994: 127-154.
[18]何昭阳, 胡桂学, 王春凤. 动物免疫学实验技术[M]. 长春: 吉林科学技术出版社, 2002: 107.
[19]倪焕荣, 马大烈, 戴益民, 等. 免疫组织化学实验技术及应用[M]. 北京: 化学工业出版社, 1993: 61-62.
Preparation and Application of Polyclonal Antibodies against Oviduct Glucoprotein in Rana Chensinensis Changbaishanensis
CHEN Liang1,LAN Hai-nan2,ZHENG Xin2,LIU Jing-sheng1,*
(1. College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China;2. College of Animal Science and Technology, Jilin Agricultural University, Changchun 130118, China)
In order to prepare specific polyclonal antibodies against oviduct glucoprotein (OGP) in Rana Chensinensis Changbaishanensis, the crude fresh OGP-rich extract was purified by Sepharose fast flow anion exchange column and Sephadex G-100 gel column chromatography, and New-Zealand albino rabbits were immunized with the purified OGP for the generation of polyclonal antisera. The purification and identification of the polyclonal antisera obtained were performed using the caprylic acid-saturated ammonium sulfate method. The titer of the purified polyclonal antibodies was measured by enzyme linked immunosorbent assay to be 1:64000, which were characterized by high sensitivity, specificity and titer. Moreover, the polyclonal antibodies prepared in this study were used for the immunohistochemical localization and detection of OGP secreting cells in the oviduct of Rana Chensinensis Changbaishanensis, which was expected to lay an experimental foundation for determining OGP in the culture product of OGP secreting cells.
Rana chensinensis Changbaishanensis;oviduct glucoprotein;antibody;immunohistochemistry
TS201.2;TS218
A
1002-6630(2010)23-0123-05
2010-05-24
国家自然科学基金项目(30671536)
陈亮(1982—),男,硕士研究生,研究方向为水产品加工与贮藏。E-mail:6814799@163.com
*通信作者:刘景圣(1964—),男,教授,博士,研究方向为功能性食品。E-mail:liujs1007@vip.sina.com



