陈 龙,李文峰,令 博,明 建,2,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715)
金耳、银耳、木耳多酚提取及其抗氧化活性
陈 龙1,李文峰1,令 博1,明 建1,2,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715)
以金耳、银耳、木耳为原料,分别用80%丙酮、80%甲醇、乙酸乙酯、石油醚对3种食用菌多酚类物质进行提取。通过高效液相色谱法和体外清除自由基方法(DPPH法、O2-·清除能力和·OH清除能力),对3种食用菌多酚类物质的主要组成及体外抗氧化能力进行初步研究。结果表明,80%丙酮提取效果最好,3种食用菌中槲皮素含量相当,金耳和银耳中芦丁和表儿茶素含量较高,木耳中儿茶素和绿原酸含量较高;体外抗氧化结果显示3种食用菌提取液具有较强的自由基清除能力和Fe3+还原能力,其中对DPPH·与O2-·的清除能力较强,对·OH的清除能力较弱。
金耳;银耳;木耳;多酚;抗氧化
金耳(Tremella aurantialba)、银耳(Tremella fucitormis)、木耳(Auricularia aurricula)在分类学上都隶属于担子菌纲银耳目,其中金耳和银耳属银耳科,木耳属木耳科。研究显示3种食用菌都富含蛋白质、脂肪、膳食纤维、维生素,钙、磷、铁、硒等微量元素和生物活性物质[1-2],是营养丰富、味道鲜美的滋补食品。传统中药和现代医学研究表明:金耳具有化痰止咳、定喘调气、抗菌消炎的作用,能提高机体免疫力[3];银耳具有养胃生津、强心健脑、降血脂、防止动脉硬化、抑制肿瘤的功效[4];木耳也具有活血润燥、抗突变、降血压等保健功能[5]。
随着近几年人们对食品质量安全问题的日益重视,从天然植物资源中寻找高效的自由基清除剂已引起国内外学者的广泛关注,天然抗氧化剂取代合成类抗氧化剂已成为一种必然趋势[6-7]。多酚类物质作为一大类广泛存在于植物体内的复杂多元酚类化合物,具有较强的供氢和清除体内有害自由基的作用,作为功能性食品添加剂可被广泛用于食品和医药领域[8]。目前有关金耳、银耳和木耳功能性成分的研究主要集中于多糖类物质方面[9-11],而有关食用菌酚类物质及其抗氧化活性的研究报道还很少。本实验拟用80%丙酮、80%甲醇、乙酸乙酯、石油醚四种溶剂分别对3种食用菌酚类物质进行提取,通过高效液相色谱法和体外清除自由基方法对其主要组成及抗氧化能力进行研究,以便为金耳、银耳、木耳的深层次开发和应用提供理论依据。
1 材料与方法
1.1 材料与试剂
金耳(Tremella aurantialba):干制袋装金耳,昆明食用菌研究所;银耳(Tremella fucitormis):干制250g袋装银耳,四川省通江县巴山野生食品有限公司;木耳(Auricularia aurricula):干制250g袋装木耳,四川省通江县巴山野生食品有限公司。
儿茶素、绿原酸、表儿茶素、咖啡酸、芦丁、槲皮素 上海融禾医院科技有限公司;Folin-Ciocalteu试剂(F9252)、1,1-二苯基苦基苯肼(DPPH) 美国Sigma公司;甲醇(色谱级);其他试剂均为分析纯。
1.2 仪器与设备
JYL-A110型粉碎机 九阳股份有限公司;SPDM20A型高效液相色谱仪、UV-2450型紫外分光光度计日本岛津公司;XHF-D型高速分散器 宁波新芝生物科技股份有限公司;VDRTEX-5型旋涡混合器 其林贝尔仪器制造有限公司;HH-6型数显恒温水浴锅 金坛市富华仪器有限公司,RE-52AA型旋转蒸发器 上海亚荣生化仪器厂。
1.3 方法
1.3.1 材料预处理
将干制的金耳、银耳、木耳样品分别用粉碎机打碎,过60目筛后密封储存于阴凉干燥处备用。
1.3.2 食用菌多酚提取液的制备
参考Cheung等[12]方法,略有改动,准确称取3种食用菌各5.000g于250mL小烧杯中,分别以50mL 80%丙酮、80%甲醇、石油醚及乙酸乙酯为提取溶剂,用索氏抽提器不断回流提取3h,然后用旋转蒸发器将提取液在45℃浓缩至约20mL,用25mL棕色容量瓶定容并储存于-18℃以备后续测定。
1.3.3 总酚测定
1.3.3.1 多酚标准曲线的制作
称取25mg没食子酸,加入到25mL去离子水中,得到1mg/mL 的没食子酸溶液。吸取5mL 1mg/mL 的没食子酸溶液,定容至50mL容量瓶中,即得0.1mg/mL的没食子酸溶液,然后配成0、20、100、150、200、300、400、500、600μg/mL的没食子酸标液。取1mL各种浓度样品于1.5mL离心管中,12000×g离心15min。取适量的试管,加200μL样品,800μL去离子水,200 μL福林-酚试剂,让样品充分混合,避光保存6min,再加入2mL 7% Na2CO3溶液和1.6mL去离子水,黑暗中静置90min,最后用可见分光光度计于760nm出测定吸光度。以酚类物质浓度为横坐标,吸光度为纵坐标,绘制标准曲线(图1),求得线性方程:A=0.0036x-0.0459(R2=0.996)。
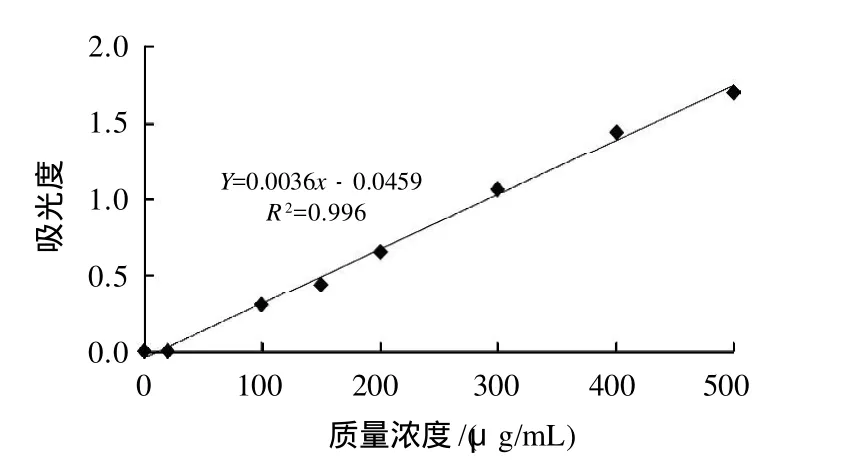
图1 没食子酸的标准曲线Fig.1 Standard curve of gallic acid
1.3.3.2 多酚含量测定
采用福林-酚比色法[13]。根据线性方程计算出3种食用菌提取液中总酚含量。
1.3.4 食用菌多酚的组成成分分析[14]
1.3.4.1 标准及样品溶液的配制
标准溶液的配制:准确称取标准品没食子酸、儿茶素、绿原酸、表儿茶素、咖啡酸、芦丁和槲皮苷各10.0mg,用甲醇溶解并分别定容在10mL棕色容量瓶中,配制成1mg/mL的标准贮备液。标准贮备液置于4℃冰箱中保存,使用时稀释成所需要浓度。
样品的制备:取提取好的食用菌多酚1mL,用有机膜过滤,甲醇定容至10mL,备用。
1.3.4.2 色谱条件

图2 多酚类物质标准样品的高效液相色谱图Fig.2 HPLC chromatogram of mixed polyphenol standards
色谱柱为Thermo C18柱(250mm×4.6mm,5μm)。流动相条件:A泵为色谱甲醇;B泵为0.05%磷酸溶液。采用梯度洗脱,洗脱程序为0~10min,B由5%增加到50%;10~11min,B为60%;11~15min,B为60%;15~16min,B为70%;16~19min,B为70%;19~20min,B为80%;20~25min,B为100%。柱温30℃,进样量20μL,流速1.0mL/min,检测波长280nm。
1.3.5 食用菌多酚提取液抗氧化活性研究
1.3.5.1 样品还原能力的测定[15]
准确吸取1mL供试液于试管中,加入2.5mL 0.2mol/L pH6.6的PBS溶液、1mL 1%的铁氰化钾溶液混匀于50℃水浴20min后流水冷却,加入5mL 10%的TCA溶液混匀静置10min,最后加入2.5mL蒸馏水和0.5mL 0.1%的FeCl3溶液,混匀静置10min,以蒸馏水为空白在700nm处测光密度,光密度越大说明样品还原能力越强。
1.3.5.2 样品对DPPH自由基清除率的测定[16-17]
精确量取48mL0.1mg/mL DPPH溶液并定容在100mL容量瓶中,所得DPPH浓度为2×10-4mo1/L,在0~4℃避光保存备用。取1mL待测液及2mL DPPH溶液加入试管中,摇匀,避光放置30min,以溶剂为参比,于517nm测其吸光度Ac,并计算清除率。
清除率(G)/%=[1-(Ai-Aj)/Ac]×100
式中:Ac为2mL溶剂加2mL DPPH溶液的吸光度;Ai为2mL待测液加2mL DPPH溶液的吸光度;Aj为2mL待测液加2mL溶剂的吸光度。
1.3.5.3 样品对O2-· 清除率的测定[17]
向pH8.2、5.6mL 50mmol/L Tris-HCl 缓冲液中分别加入0.2mL不同浓度的实验样品提取液、BHT和VC溶液,于25℃保温10min,然后加入0.2mL、25℃预温的60mmol/L邻苯三酚,静置反应4min后,加10mol/L盐酸两滴终止反应,在320nm处测其吸光度A0,空白实验以等量蒸馏水代替样品溶液,测定其吸光度Ax。用5.6mL Tris-HCl缓冲液、0.2mL 0mmol/L HCl及0.2mL抗氧化剂溶液调零点,以扣除试样本身颜色的影响。按下式计算清除率。
清除率(S)/%=[(Ax-A0)/Ax]×100
式中:Ax为空白实验,以等量蒸馏水代替抗氧化剂溶液测定的吸光度;A0为加入样品以及其他各氧化剂溶液测定的吸光度。
1.3.5.4 样品对·OH清除率的测定[17]
取6mmol/L的FeSO42mL于试管中,加入6mmol/L水杨酸2mL,再滴加6mmol/L H2O22mL,摇匀后在510nm波长处测定其吸光度Ax。在上述反应体系中分别加入1mL样品液,再加蒸馏水6mL,摇匀,放置6min,在510nm波长处测定其吸光度A0,用6mmol/L FeSO42mL和6mmol/L H2O22mL和蒸馏水2mL配成溶液调零点,以扣除试样本身颜色的影响,并计算清除率。
清除率(S)/%=[(Ax-A0)/Ax]×100
式中:Ax为空白对照吸光度;A0为加入受试物后吸光度。
1.3.5.5 数据处理
以上所有试验均平行测定3次,试验结果用平均值±标准偏差表示。
2 结果与分析
2.1 3种食用菌提取液中酚类物质的含量和组成测定
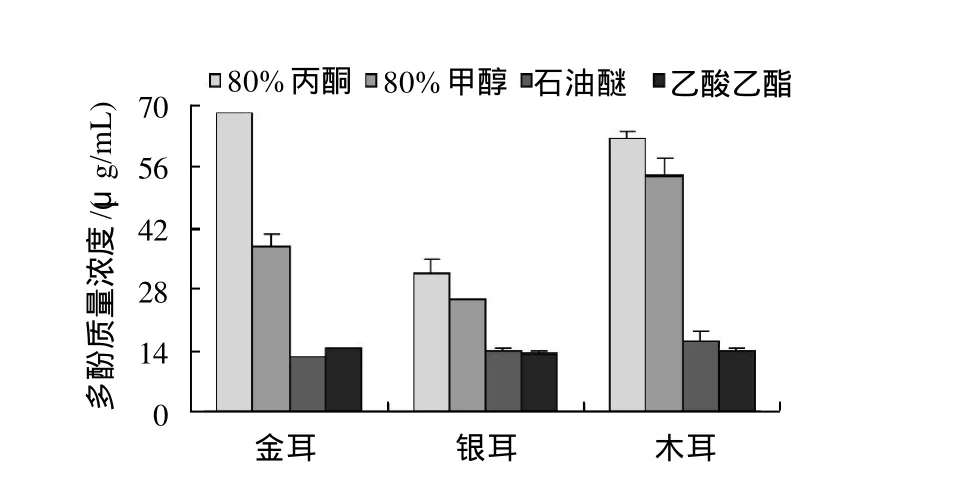
图3 不同提取剂对3种食用菌多酚提取效果的影响Fig.3 Effect of solvents on polyphenol extraction from three edible mushrooms
2.1.1 食用菌提取液中总酚含量的测定多酚类物质是发挥抗氧化作用的重要成分之一,试验通过福林酚法测定了提取液中酚类物质的含量,结果显示,80%丙酮和甲醇两种溶剂较石油醚和乙酸乙酯更适于金耳、银耳、木耳3种食用菌中酚类物质的提取,其中80%丙酮的提取效果最好。说明多酚类物质是一种极性化合物,在极性有机溶剂中有较大的溶解性[18]。
2.1.2 食用菌提取液中多酚类物质组成的测定
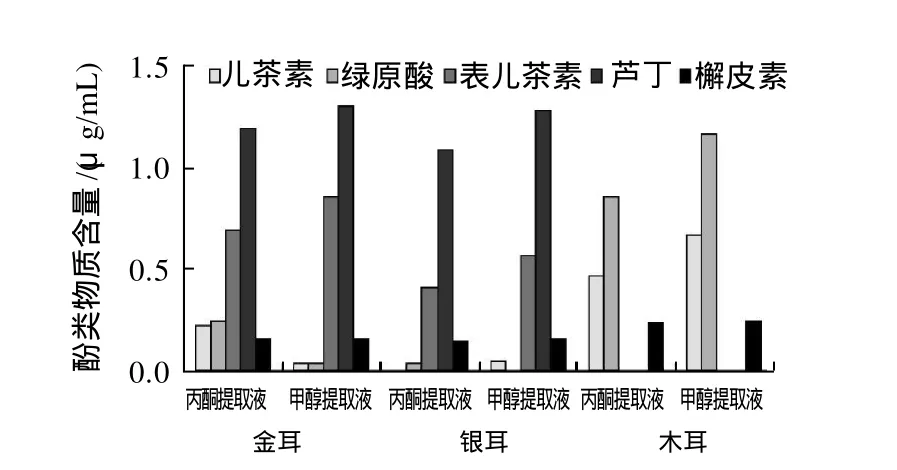
图4 3种食用菌多酚的高效液相色谱测定Fig.4 Polyphenol contents of different solvent extracts from three edible mushrooms
如图4所示,在选定的几种酚类物质标样中,3种食用菌酚类物质主要以儿茶素、绿原酸、表儿茶素、芦丁、槲皮素为主,不同溶剂提取液中酚类物质的种类和含量略有不同。3种食用菌中槲皮素含量大致相当,其中金耳和银耳中芦丁和表儿茶素含量较高,而木耳中含有较多的儿茶素和绿原酸, 整体来看80%甲醇对没食子酸、儿茶素、绿原酸、表儿茶素、咖啡酸、芦丁和槲皮素7种酚类物质的提取效果略好于80%丙酮,但就总酚提取率的角度来讲却是80%丙酮更好,根据文献[19-20]可知,多酚是一大类物质的总称,提取液中还可能含有除本试验所选标样之外的其他酚类物质,如香豆素、香草酸等,因此提取液中总酚含量与其多酚物质组成之间并无直接的相关性。
2.2 提取液抗氧化活性的测定
2.2.1 提取液的还原力
通过还原力测定可以检测样品是否为良好的电子供体,还原力强的样品能够提供更多的电子,还原能力越强,抗氧化性越强。由图5可知,食用菌提取液的还原力大小为80%丙酮>80%甲醇>石油醚>乙酸乙酯。总体来看,木耳多酚提取液还原力最强,银耳多酚提取液还原力最弱。
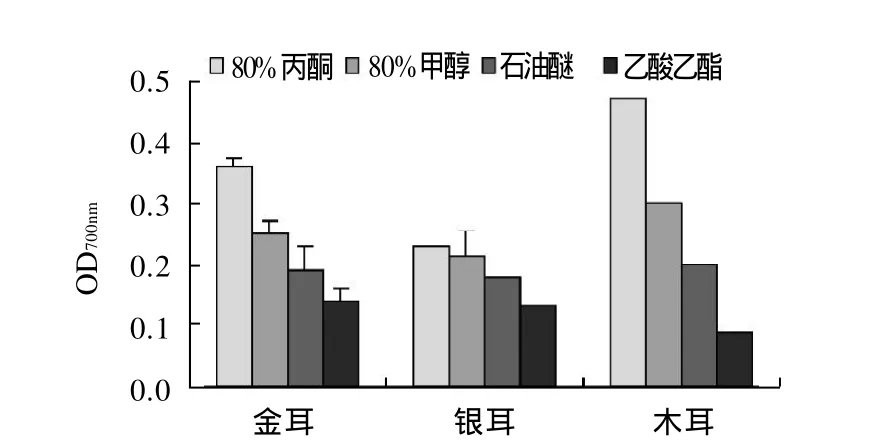
图5 不同溶剂提取3种食用菌多酚的还原力Fig.5 Effect of solvents on polyphenol reducing power from three edible mushrooms
2.2.2 提取液对DPPH自由基的清除能力
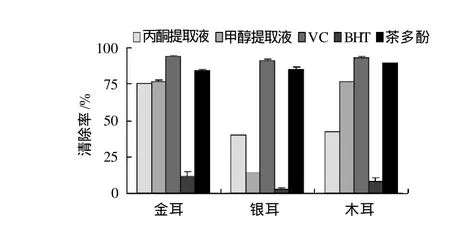
图6 3种食用菌多酚与VC、BHT、茶多酚清除DPPH自由基能力对比情况Fig.6 Comparison of DPPH radical scavenging capacity of differentsolvent extracts from three edible mushrooms, VC, BHT, and tea polyphenols
DPPH自由基在有机溶剂中是一种稳定的自由基,呈紫色,在517nm处有强吸收,当有自由基清除剂存在时,DPPH自由基的游离电子被配对,使其颜色变浅,最大吸收波长处吸光度变小,且这种颜色的变化程度与配对电子数成化学计量关系,因此可通过测定最大吸收处吸光度的变化来评价自由基清除剂的清除能力。由图6可知,3种食用菌多酚提取液均具有较好的DPPH自由基清除能力,其中金耳提取液的清除能力最强,木耳次之,银耳最弱,与对照组相比,其DPPH自由基清除能力较VC与茶多酚弱,但远大于BHT的清除能力。根据贾贵东等[21]研究,不同溶剂多酚提取液中酚类物质组成、含量及自由基清除能力均存在一定差异,所以食用菌多酚提取液DPPH自由基清除能力与其总酚浓度并不成正比。
2.2.3 提取液对O2-·的清除能力
在邻苯三酚的自氧化过程中会有O2-·产生,此自由基既是邻苯三酚氧化的中间产物,又能加速邻苯三酚的自氧化进程,因此通过测定待测物质对邻苯三酚自氧化的抑制作用,可以判定其对O2-·的清除能力。由图7可知,3种食用菌多酚提取液对O2-·均具有较好的清除作用,其中金耳的清除能力最大,银耳次之,木耳最小。
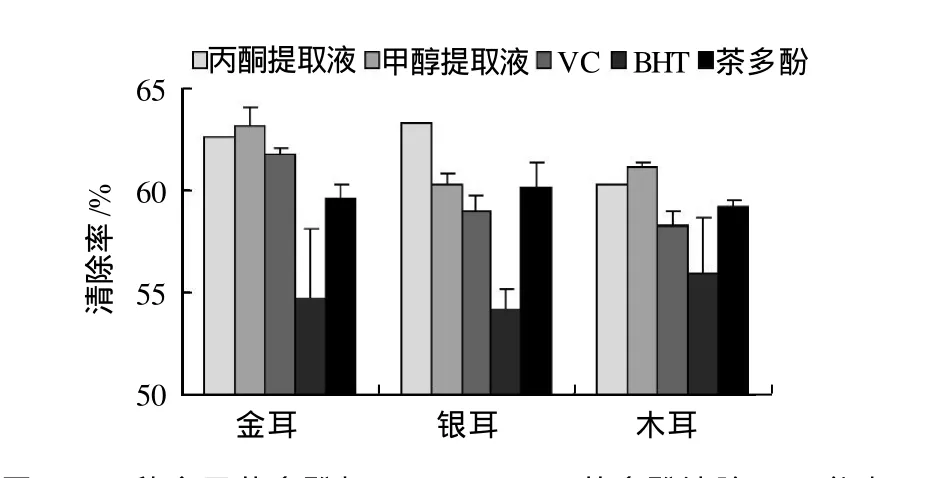
图7 3种食用菌多酚与VC、BHT、茶多酚清除O—2·能力对比情况Fig.7 Comparison of superoxide anion radical scavenge capacity of different solvent extracts from three edible mushrooms, VC, BHT, and tea polyphenols
2.2.4 多酚对·OH的清除能力
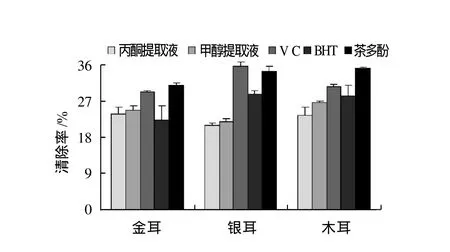
图8 3种食用菌多酚与VC、BHT、茶多酚清除·OH能力对比情况Fig.8 Comparison of hydroxyl radical scavenge capacity of different solvent extracts from three edible mushrooms, VC, BHT, and tea polyphenols
根据Fronton反应原理生成的·OH进攻水杨酸分子的苯环,产生2,3-二羟基苯甲酸,通过分光光度法测定其含量,以此来衡量待测物质清除·OH的能力。由图8可知,3种食用菌对·OH的清除能力均较弱,80%甲醇提取液清除能力略大于80%丙酮,其中木耳提取液对·OH清除能力较强,金耳与银耳相当,与阳性对照样品相比3种食用菌的清除能力均较弱,这可能与·O H的清除机制有关。
3 结 论
3.1 在80%丙酮、80%甲醇、石油醚和乙酸乙酯4种溶剂中,80%丙酮和80%甲醇两种溶剂较石油醚和乙酸乙酯更适于金耳、银耳、木耳3种食用菌酚类物质的提取,其中以80%丙酮溶液提取效果最佳。
3.2 通过液相色谱分析可知,3种食用菌中主要含有儿茶素、绿原酸、表儿茶素、芦丁、槲皮素5种酚类物质,不同溶剂所得提取液中的酚类物质的种类和含量略有不同。金耳和银耳中含有较多的芦丁和表儿茶素,儿茶素和绿原酸含量较少。木耳中含有较高的儿茶素和绿原酸,且3种食用菌中槲皮素的含量相当。
3.3 金耳、银耳、木耳3种食用菌酚类物质提取液中,木耳多酚提取液还原力最强,金耳次之,银耳最弱,三者对DPPH自由基、O2-·、·OH均具有较好的清除能力,其中对DPPH自由基与O2-·的清除能力较强,对·OH的清除能力较弱。与3种阳性对照样品相比它们的自由基清除能力普遍低于VC和茶多酚,但高于BHT,这可能与BHT为脂溶性抗氧化剂有关。金耳、银耳、木耳3种食用菌多酚提取液均具有较好的抗氧化能力。
[1]周玲. 药食两宜金耳与膳食[J]. 食用菌, 2002, 24(5): 38.
[2]周才琼, 周玉林. 食品营养学[M]. 北京: 中国计量出版社, 2006, 343.
[3]徐锦堂. 中国药用真菌学[M]. 北京: 北京医科大学与中国协和医科大学联合出版社, 1997: 436-447.
[4]杨萍, 张震. 银耳的功能性及发展前景[J]. 食品研究与开发, 2009, 30(7): 179-180.
[5]谷绒, 万国福, 车振明. 木耳多糖的研究进展[J]. 食品研究与开发, 2006, 27(6): 167-169.
[6]SUN Jian, YAO Jinyan, HUANG Shaoxi, et al. Antioxidant activity of polyphenol and anthocyanin extracts from fruits ofKadsura coccinea(Lem.) A.C. Smith[J]. Food Chemistry, 2009, 117(2): 276-281.
[7]许钢. 红薯中黄酮提取及抗氧化研究[J]. 食品与生物技术学报, 2007, 26(4): 22-27.
[8]郭新竹, 宁正祥. 天然酚类化合物及其保健作用[J]. 食品工业, 2002 (3): 28-29.
[9]高观世, 侯波, 吴素蕊, 等. 金耳多糖化学与生物活性研究进展及对研究的思考[J]. 中国食用菌, 2007, 26(4): 8-10.
[10]邓云霞, 瞿伟菁. 金耳胞外多糖体外抗氧化作用研究[J]. 食用菌学报, 2007, 14(3): 47-49.
[11]李雪华, 龙盛京. 木耳多糖的提取与抗活性氧的研究[J]. 食品科学, 2001, 22(3): 26-29.
[12]CHEUNG L M, CHEUNG P C K, OOI V E C. Antioxidant activity and total phenolics of edible mushroom extracts[J]. Food Chemistry, 2003, 81(2): 249-255.
[13]李巨秀, 李利霞, 曾王旻, 等. 燕麦多酚化合物提取工艺及抗氧化活性的研究[J]. 中国食品学报, 2010, 10(5): 14-21.
[14]BARROS L, DUE?AS M, FERREIRA I C F R, et al. Phenolic acids determination by HPLC-DAD-ESI/MS in sixteen different Portuguese wild mushrooms species[J]. Food and Chemical Toxicology, 2009, 47 (6): 1076-1079.
[15]JAYAPRAKASHA G K, SINGH R P, SAKARIAH K K. Antioxidant activity of grape seed (Vitis vinifera) extracts on peroxidation modelsin vitro[J]. Food Chemistry, 2001, 73(3): 285-290.
[16]牛鹏飞, 仇农学, 杜寅. 苹果渣中不同极性多酚的分离及体外抗氧化活性研究[J]. 农业工程学报, 2008, 4(3): 238-242.
[17]徐银峰, 于春光, 王斌, 等. 海带抗氧化多酚的制备及活性研究[J].浙江海洋学院学报: 自然科学版, 2010, 29(1): 44-48.
[18]陈根洪. 藤茶总多酚的提取及其抗氧化活性研究[J]. 食品科学, 2011, 32(6): 127-130.
[19]张梅梅, 郑维发, 赵艳霞, 等. 正交实验法优化桦褐孔菌多酚类物质的提取工艺研究[J]. 菌物学报, 2010, 29(5): 760-766.
[20]沈恒胜, 陈君琛, 汤葆莎, 等. 栽培料纤维转化与食用菌酚类抗氧化营养的关系[J]. 福建农业学报, 2007, 22(4): 337-340.
[21]贾贵东, 杨建雄, 王莉. 芦丁与绿原酸协同抗氧化活性研究[J]. 陕西师范大学学报: 自然科学版, 2010, 38(5): 37-38.
Extraction and Antioxidant Activity of Polyphenols fromTremella aurantialba,Tremella fucitormisandAuricularia aurricula
CHEN Long1,LI Wen-feng1,LING Bo1,MING Jian1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China;
2. Chongqing Special Food Programme and Technology Research Center, Chongqing 400715, China)
The polyphenols inTremella aurantialba,Tremella fucitormisandAuricularia aurriculawere extracted with 80% acetone, 80% methanol, ethyl acetate and petroleum ether, respectively, and their major components and antioxidant activity were determined using high performance liquid chromatography (HPLC) andin vitroDPPH, hydroxyl and superoxide anion radical scavenging assays, respectively. The results revealed that 80% acetone showed the highest extraction efficiency of ployphenols.Tremella aurantialba,Tremella fucitormisandAuricularia aurriculahad similar quercetin content. The contents of rutin and epicatechin were higher inTremella aurantialbaandTremella fucitormisthan those inAuricularia aurricula.Auricularia aurriculacontained relatively more chlorogenic acid. All investigated extracts from the three edible mushroom species had a strong ability to scavenge free radicals, especially DPPH and superoxide anion radicals and reduce Fe3+.
Tremella aurantialba;Tremella fucitormis;Auricularia aurricula;polyphenol;antioxidant activity
TS201.2
A
1002-6630(2011)20-0052-05
2011-06-23
重庆市科技攻关项目(CSTC 2011AC1010);西南大学博士基金项目(SWU109005);中央高校基本科研业务费专项(XDJK2009C044)
陈龙(1988—),男,硕士研究生,研究方向为食品化学与营养学。E-mail:chanloong2007@163.com
*通信作者:明建(1972—),男,副教授,博士,研究方向为食品化学与营养学。E-mail:mingjian1972@163.com



