王俊亮,肖苏尧,陈运娇,陈雪香,汤 杰,曹 庸
(华南农业大学食品学院,广东 广州 510642)
广林9号桉叶多酚抗氧化活性研究
王俊亮,肖苏尧,陈运娇,陈雪香,汤 杰,曹 庸*
(华南农业大学食品学院,广东 广州 510642)
采用不同极性有机溶剂对广林9号桉叶提取物进行系统萃取分离,用福林-酚法测定各组分的总酚含量,以1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)(ABTS)、还原能力3种体外抗氧化活性方法测定了桉叶各组分的抗氧化活性。结果表明,不同萃取组分中,乙酸乙酯组分总酚含量最高,达到502.67mg/g;其对DPPH自由基和ABTS+·的清除能力和还原能力也最强,优于阳性对照物茶多酚,其清除两种自由基的IC50分别为0.097mg/mL 和0.034mg/mL;通过总酚含量与抗氧化活性比较发现,其抗氧化活性与总酚含量成正相关,由此判断桉叶提取物的抗氧化活性成分主要为多酚类物质;桉叶粗提物中多酚含量达到30%以上,与茶叶粗提物中多酚含量相当,具有开发意义。
桉叶;多酚;抗氧化能力;1,1-二苯基-2-三硝基苯肼(DPPH);2,2'-联氮-双-(3-乙基苯并噻唑啉-6-磺酸) (ABTS)
桉树是桃金娘科桉属(Eucalyptus)植物的通称,具有生长快、适应自然环境能力强、抗病虫害、经济价值高等特点,是世界三大速生树种之一[1-2]。我国近年来在华南、广西等地大面积种植桉树,桉树已经成为中国造纸业和林业中的生力军,而同时产生大量桉叶,桉叶除部分用于提取桉叶油以外,多数未加利用,综合利用度很低。现代研究表明,桉叶中除含有挥发性芳香油以外,还含有大量黄酮类化合物、酰基间苯三酚衍生物、非挥发性萜类及其苷类、鞣质等活性物质[3],因此系统地对桉叶中活性物质进行研究,并加以开发应用,可以极大地提高桉树的经济价值。有研究表明,已从蓝桉中分离出抗氧化活性较强的多种多酚物质[4-6],本实验室的前期工作表明,桉叶粗提物多酚含量达到30%左右,与茶叶粗提物多酚含量相当,且抗氧化活性强[7]。因此本研究在前期工作的基础上,对桉叶粗提物进行系统的分离,利用福林-酚比色法[8-9]对多酚含量进行分析,并通过抗氧化活性检测进行活性跟踪。
目前,天然产物的抗氧化能力检测方法主要有化学测定法和细胞评价方法,其中化学测定方法有以脂质过氧化为基础的测定方法、清除自由基为基础的测定方法、对抗氧化酶活性的影响、DNA氧化损伤的测定等方法,由于天然抗氧化物种成分复杂,抗氧化作用机制无法用单一机制解释,因此常常需要用两种或两种以上抗氧化活性评价方法[10]。对于天然抗氧化剂的初步筛选,基于清除自由基基础的1,1-二苯基-2-三硝基苯肼(DPPH)法、2,2'-联氮-双-(3-乙基苯并噻唑啉-6-磺酸) (ABTS)法与其他抗氧化方法相比操作简单、快速、稳定,不需要特殊的检测设备,这两种方法都是基于分光光度法来测定样品的抗氧化活性,在国内外有着广泛的应用。而铁离子还原能力可以间接表明样品抗氧化能力,操作简单、稳定。因此,本实验主要采用DPPH法、ABTS法和铁离子还原能力法对桉叶不同萃取组分进行体外抗氧化活性检测,以期为桉叶抗氧化活性物的筛选及综合开发桉树叶资源提供一定参考。
1 材料与方法
1.1 材料与试剂
广林9号桉叶,2009年9月采于湛江,自然晾干,粉碎后取40~60目进行实验。
乙醇、石油醚、氯仿、正丁醇、乙酸乙酯、VC、过硫酸钾、福林-酚试剂、三氯乙酸、铁氰化钾、Na2CO3、磷酸氢二钠、磷酸二氢钠均为分析纯;50%多酚含量的茶多酚 潮州翼龙有限公司;DPPH、ABTS美国Sigma公司。
1.2 仪器与设备
U-3010紫外-可见分光光度计 日本日立公司;R204旋转蒸发器 上海申生科技有限公司; KQ-500B型超声波清洗器 昆山市超声仪器有限公司; FD-1PF冷冻干燥机 北京德天佑科技发展有限公司、MK-3酶标仪美国Thermo Labsystems 公司。
1.3 方法
1.3.1 桉叶成分的提取分离
桉叶粗提物的制备[7]:称取桉叶粉末100.0g,加入20倍体积的70%乙醇溶剂,超声波提取两次,每次30min,减压抽滤,合并滤液,减压旋转蒸发溶剂后,用蒸馏水定容到100mL。
粗提物的系统萃取分离:对上述粗提物依次用石油醚、氯仿、乙酸乙酯、正丁醇等不同极性溶剂进行萃取,萃取物用减压旋转蒸发后冷冻干燥,冷藏备用。
1.3.2 多酚含量的测定(福林-酚比色法)[8-9]
标准曲线的绘制:准确称取真空干燥至质量恒定的没食子酸标准品44.3mg,用水溶解并定容100mL。以此溶液配成质量浓度8.86、17.72、35.44、52.16、70.88、88.60μg/mL的溶液。分别取上述不同质量浓度溶液1mL加到10mL比色管中,然后依次加入1mL去离子水,0.5mL已稀释2倍的福林-酚试剂,1.5mL 26.7g/100mL的Na2CO3溶液,最后用水定容至10mL,室温反应2h,用分光光度计测定其在760nm波长处的吸光度。由吸光度对质量浓度进行回归,求得标准曲线。
试样测定:准确称取适量试样,用水溶解,质量浓度在0.1mg/mL左右。取1mL样品加到10mL比色管中,依次加入去离子水1mL、福林-酚试剂0.5mL、26.7g/100mL Na2CO3溶液1.5mL,然后用水定容至10mL,室温反应2h,用分光光度计测定其在760nm波长处的吸光度。测定的吸光度代入标准曲线,求得试样中总多酚的含量,以没食子酸含量计。
1.3.3 清除DPPH自由基能力的测定[10-11]
分别将各相萃取物用甲醇配成0.02、0.05、0.08、0.11、0.14、0.17、0.20mg/mL系列梯度样品质量浓度,取上述配好样品0.2mL 及1 × 10-4mol/L DPPH溶液3.8mL加入同一具塞试管中摇匀,在室温密闭静置30min,用纯溶剂作参比,用分光光度计测定其在517nm波长处的吸光度。根据公式(1)计算每种样品对DPPH自由基的清除率。
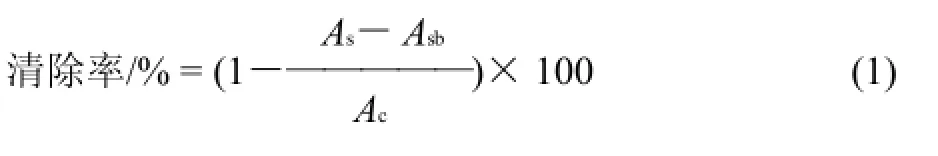
式中:As为加0.2mL样品液后DPPH溶液的吸光度;Asb为0.2mL样品液+3.8mL溶剂(甲醇)后的吸光度; Ac为0.2mL溶剂(甲醇)+3.8mL DPPH溶液的吸光度。
以上述方法测定其清除率,根据回归分析求出清除率达到50%时的样品质量浓度即IC50。
1.3.4 清除ABTS+·能力测定[12-14]
将5mL的7mmol/L ABTS和88μL的140mmol/L过硫酸钾混合,在室温、避光的条件下静置过夜(12~16h),形成ABTS储备液,使用前用10mmol/L pH7.4的磷酸盐缓冲液稀释成工作液,使其在室温下于条件734nm波长处的吸光度为0.70±0.02。分别将各相萃取物用甲醇配成0.01、0.02、0.03、0.04、0.05、0.06、0.07mg/mL系列梯度样品质量浓度,测定时在96孔微量滴定板的每孔中加入200μL的ABTS工作液,再加入10μL的样品,以200μL ABTS工作液+10μL溶剂为空白,混合10s,于6min后读取405nm波长处的吸光度A,根据式(2)计算每种样品对ABTS+·的清除率。
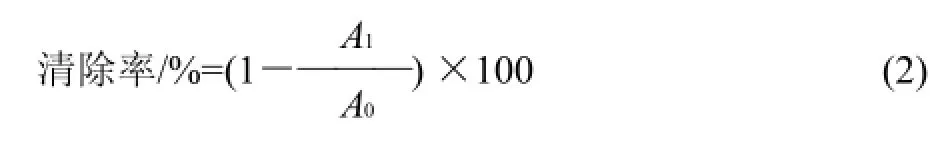
式中:A1为200μL ABTS工作液+10μL样品液后的吸光度;A0为200μL ABTS工作液+10μL甲醇后的吸光度。
1.3.5 还原能力测定[15-16]
在2.5mL pH6.6的磷酸盐缓冲液中加入用甲醇配成0.02、0.04、0.06、0.08、0.10、0.12、0.14mg/mL系列梯度质量浓度的不同桉叶萃取物样液2.5mL、1%的铁氰化钾溶液2.5mL,混合物在50℃恒温20min后,再加入2.5mL 10%的三氯乙酸溶液,然后以3000r/min离心分离10min,取上层清液5mL加蒸馏水5mL和0.1% FeCl3溶液lmL,在波长700nm处测定吸光度,吸光度越高,还原能力越强。
2 结果与分析
2.1 桉叶不同萃取物总酚含量测定结果
以没食子酸质量浓度(μg/mL)为横坐标,吸光度为纵坐标,得回归方程:y=0.0096χ+0.0271(R2=0.9981)。样品中总酚的含量在标准曲线中查出相应的值,总酚含量以没食子酸的相对量表示。
从表1可见,桉叶提取物不同溶剂萃取物中,乙酸乙酯总酚含量最大,其次为正丁醇、水相,而石油醚相、氯仿相总酚含量较小,不同溶剂系统萃取分离对桉叶多酚能够起到一定的分离效果,从桉叶粗提取物多酚含量可以看出,其多酚含量达到30%以上,与茶叶粗提物中茶多酚含量相当,桉叶原料丰富,因此大量开发桉叶多酚将具有十分重要意义。
2.2 桉叶不同萃取物清除DPPH自由基能力
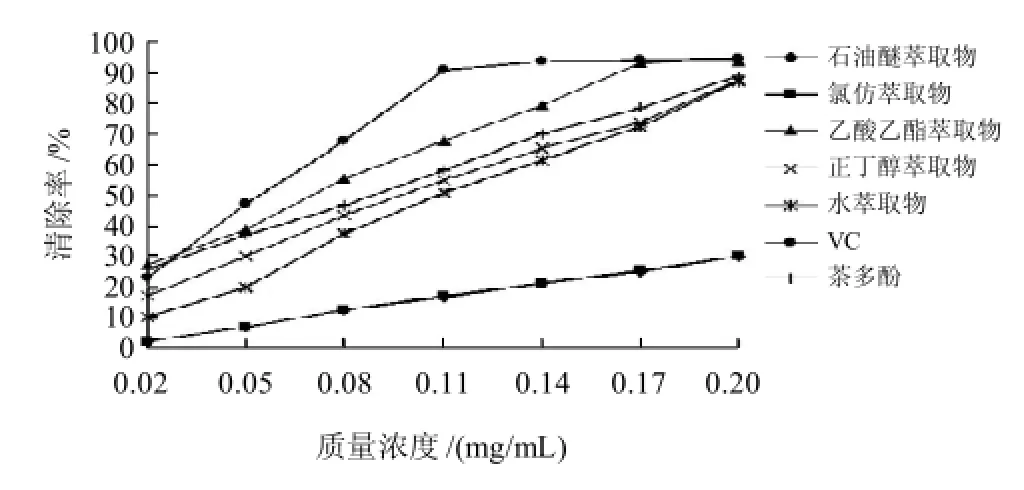
图1 桉叶不同萃取物清除DPPH自由基能力Fig.1 DPPH radical scavenging activity of the crude ethanol extract and its fractions
如图1所示,同一样品随着样品质量浓度增大,其清除DPPH自由基能力逐渐增大,且VC质量浓度在达到0.11mg/mL后,其清除率趋于平缓,达到最大。而乙酸乙酯萃取物在质量浓度达到0.17mg/mL时,其清除率接近VC,且达到最大。由此可见,桉叶不同萃取物中,乙酸乙酯萃取物清除DPPH自由基能力最强,且清除能力大于茶多酚,与VC接近。通过SPSS软件回归分析,得出其IC50为0.097mg/mL,可信区间为0.077~0.111mg/mL。
2.3 桉叶不同萃取物清除ABTS+·能力
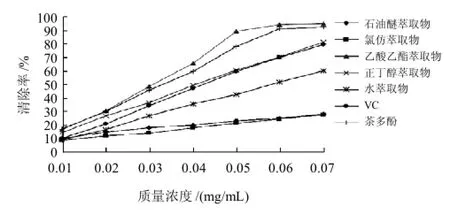
图2 桉叶不同萃取物清除ABTS+·能力Fig.2 ABTS radical scavenging activity of the crude ethanol extract and its fractions
如图2所示,同一样品随着样品质量浓度增大,其清除ABTS+·能力逐渐增大,而乙酸乙酯萃取物在质量浓度达到0.05mg/mL时,其清除率趋于平缓,且达到最大值。桉叶不同萃取物中,乙酸乙酯萃取物清除ABTS+·能力最强,且清除能力大于茶多酚和VC。通过SPSS软件回归分析,得出其IC50为0.034mg/mL,95%可信区间为0.029~0.037mg/mL。
2.4 桉叶不同萃取物还原能力
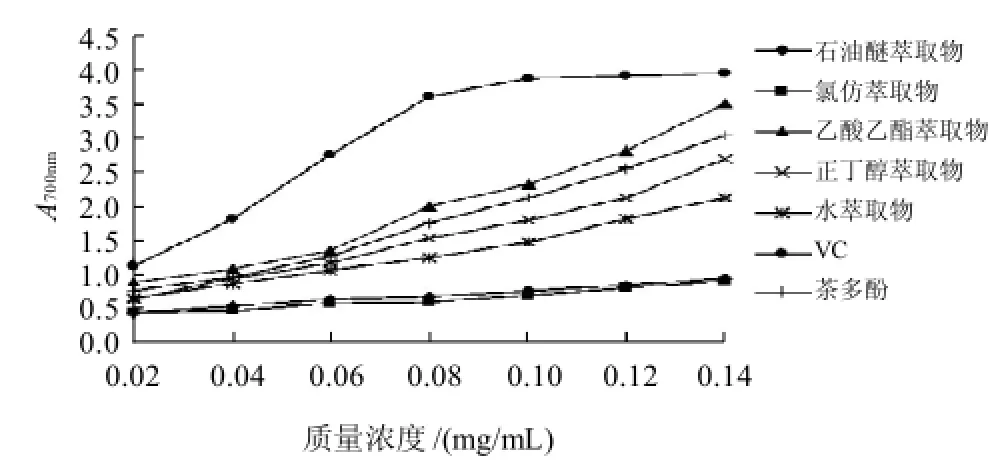
图3 桉叶不同萃取物对铁离子的还原能力曲线Fig.3 Ferric ion reducing power of the crude ethanol extract and its fractions

表1 桉叶不同萃取物总酚含量Table1 Total phenloic contents of the crude ethanol extract and its fractions
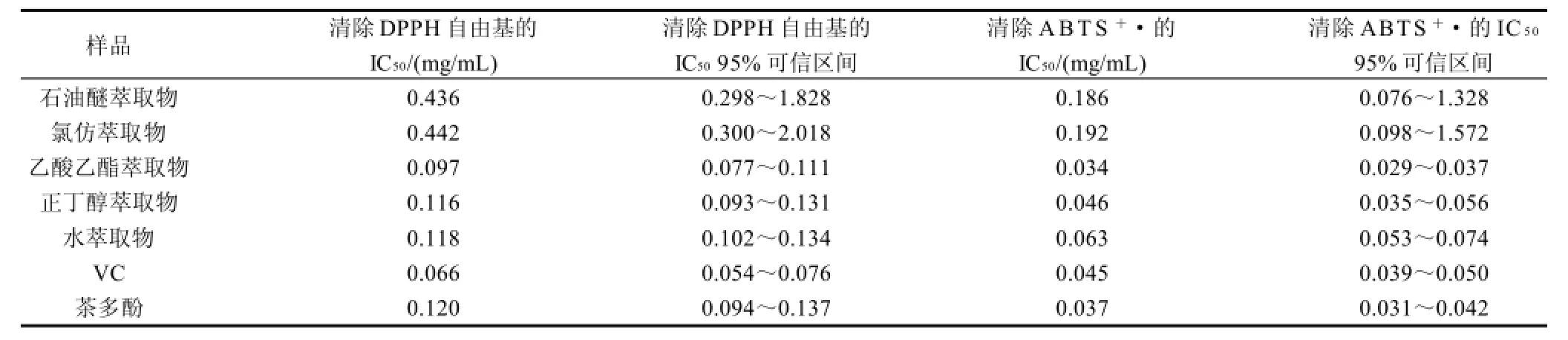
表2 桉叶不同萃取物对DPPH自由基、ABTS+·的IC50值Table2 IC50values of the crude ethanol extract and its fractions against DPPH and ABTS radicals
由图3可知,同一样品随着样品质量浓度越大,其吸光度越大,即还原能力越强,且VC在质量浓度达到0.08mg/mL后,其吸光度趋于平缓,即还原能力达到最大;桉叶不同萃取物中,乙酸乙酯萃取物还原能力最强,其还原能力大于茶多酚,最接近VC;VC在反应体系中吸光度较大,可能是VC在此体系中较易提供电子。
2.5 桉叶不同萃取物清除DPPH自由基、ABTS+·能力比较
桉叶萃取物不同质量浓度条件下对DPPH自由基体系,ABTS+·体系的清除作用有所不同,同一萃取物在一定的质量浓度范围内,样品质量浓度越高,其清除率越高,抗氧化活性越强。通过SPSS软件算出桉叶不同萃取物对两种自由基清除能力的值见表2。桉叶不同萃取物中,乙酸乙酯萃取物清除DPPH自由基和ABTS+·的IC50最小,即抗氧化活性最强;由于反应体系不同,其对两种自由基清除能力也有所不同,但两种方法具有很好的相关性。桉叶石油醚萃取物和氯仿萃取物清除DPPH自由基和ABTS+·的IC50的95%可信区间较大,可能是因为这两个组分在所做样品质量浓度范围内清除率较小,所求IC50误差就较大,95%可信区间大。
2.6 桉叶不同萃取物多酚含量与其抗氧化能力分析
为比较桉叶不同萃取物抗氧化能力与其总酚含量关系,以桉叶不同萃取物清除DPPH自由基和ABTS+·的IC50的倒数与其总酚含量为纵坐标作图,IC50倒数值越大,其抗氧化能力越强。抗氧化能力与其多酚含量关系见图4。总酚含量越多,抗氧化能力越强,其抗氧化能力与其总酚含量成正相关,因此可以判断桉叶中起抗氧化作用的物质为多酚类物质。且桉叶不同萃取物抗氧化能力强弱为:乙酸乙酯萃取物>正丁醇萃取物>水萃取物>石油醚萃取物>氯仿萃取物。抗氧化强的组分主要存在于中等极性和极性大的组分中,这也与多酚的性质相关。石油醚萃取物主要是极性小的脂溶性物质,氯仿萃取物主要是糖类和蛋白,多酚含量少,因此抗氧化活性也低。

图4 桉叶不同萃取组分抗氧化活性与其总酚含量关系Fig.4 Positive correlation between total phenolic content and antioxidant activity for the crude ethanol extract and its fractions
3 结论与讨论
本实验结合总酚含量和抗氧化活性评价对桉叶抗氧化物进行系统研究,研究表明桉叶中含有大量多酚,粗提取物中多酚含量达到30%以上,与茶叶粗提取物中多酚含量相当,通过体外抗氧化活性测定表明,其抗氧化活性与其总酚含量成正相关,初步的系统萃取分离对桉叶抗氧化物有较好的分离效果,且得到总酚含量最高,抗氧化活性最强的乙酸乙酯组分,其抗氧化活性较50%多酚含量的茶多酚强,与VC接近,因此桉叶多酚具有很高的开发价值;DPPH法、ABTS法和铁离子还原法对桉叶抗氧化物体外抗氧化活性评价有较好的相关性,3种方法在一定质量浓度范围内都随样品质量浓度增大,抗氧化活性增强,DPPH法、ABTS法对于桉叶抗氧化活性的评价快速、稳定、准确,因此可以将其作为桉叶抗氧化物活性评价及抗氧化活性物质筛选的评价方法。
桉叶资源丰富、总酚含量高、抗氧化活性强,如果能用DPPH法、ABTS法这两种活性评价方法对桉叶乙酸乙酯组分进行活性跟踪分离纯化,分离出其抗氧化活性物质,确定其起抗氧化活性的物质基础,开发食品抗氧化剂或者抗氧化保健品,对于桉叶的综合利用将具有十分重要的意义。
参考文献:
[1]宋永芳. 我国桉树资源的利用与展望[J]. 林产化工通讯, 1998(4): 3-7.
[2]韩锦光, 何金桓. 桉树资源利用[C]//林业部桉树研究中心. 国际桉树学术研讨会论文集. 北京: 中国林业出版社, 1992: 153-162.
[3]付文卫, 赵春杰. 桉属植物的化学成分与生物活性[J]. 外国医药: 植物药分册, 2003, 18(2): 51-58.
[4]AMAKURA Y, YOSHIMURA M. Marker constituents of the natural antioxidant eucalyptus leaf extract for the evaluation of food additives[J]. Biosci Biotechnol Biochem, 2009, 73(5): 1060-1065.
[5]NAKAGAWA K, HAYASHI S, AMAKURA Y. Hydrolyzable tannins as antioxidants in the leaf extract of Eucalyptus globulus possessing tyrosinase and hyaluronidase inhibitory activities[J]. Food Sci Technol Res, 2009, 15 (3): 331-336.
[6]AMAKURAA Y, UMINOA Y, TSUJIA S. Constituents and their antioxidative effects in eucalyptus leaf extract used as a natural food additive[J]. Food Chemistry, 2002, 77: 47-56.
[7]田宏. 尾巨桉叶抗氧化活性成分的研究[D]. 长沙: 湖南农业大学, 2009.
[8]凌关庭. 抗氧化食品与健康[M]. 北京: 化学工业出版社, 2004: 81-84.
[9]曹炜, 索志荣. Folin-Ciocalteu比色法测定蜂蜜中总酚酸的含量[J].食品与发酵工业, 2003, 29(12): 80-82.
[10]刘微微, 任虹, 曹学丽, 等. 天然产物抗氧化活性体外评价方法研究进展[J]. 食品科学, 2010, 31(17): 415-419.
[11]KUMARAN A, UMARAN A, KARUNAKARAN R J. Antioxidant and free radical scavenging activity of an aqueous extract of Coleusaromaticus [J]. Food Chemistry, 2006, 97(1): 183-186.
[12]朱玉昌, 焦必宁. ABTS法体外测定果蔬类总抗氧化能力的研究进展[J]. 食品与发酵工业, 2005, 31(8): 77-80.
[13]仇菊, 任长忠, 李再贵. 杂粮醋的抗氧化特性研究[J]. 食品科技, 2009, 34(1): 218-227.
[14]MILLER N J, RICE-EVANS C A, DAVIES M J, et al. A novel methodfor measuring antioxidant capacity and its application to moni-toring the antioxidant status in premature neonates[J]. Sci, 1993, 84: 407-412.
[15]吕树祥, 宋诗莹, 武文洁. 芝麻提取物抗氧化性能研究[J]. 中国食品添加剂, 2004(1): 70-72.
[16]SHON M Y, CHOI S D, KAHNG G G, et al. Antimutagenic antixidant and free radical scavenging activity of ethyl acetate extracts from white, yellow and red onions[J]. Food and Chemical Toxicology, 2004, 42: 659-666.
Antioxidant Activity of Polyphenol Extracts from Leaves of E. grandis×E. urophylla Guanglin No. 9
WANG Jun-liang,XIAO Su-yao,CHEN Yun-jiao,CHEN Xue-xiang,TANG Jie,CAO Yong*
(College of Food Science, South China Agricultural University, Guangzhou 510642, China)
Crude ethanol extract from the leaves of E. grandis×E. urophylla Guanglin No. 9 was fractionated by repeated extractions sequentially with solvents of different polarity into petroleum ether-soluble, chloroform-soluble, ethyl acetatesoluble, n-butanol-soluble fractions and residue. Total phenolic contents in the six samples were determined by Folin-Ciocalteu method. Meanwhile, their antioxidant activity was tested by in vitro ABTS, DPPH and FRAP assays. The results indicated that among the samples, the ethyl acetate-soluble fraction showed the highest total phenolic content, 502.67 mg/g, and the strongest ABTS and DPPH scavenging activity and reducing power activity, which were better than those of VC. The IC50 values of the fraction against DPPH and ABTS radicals were 0.097 mg/mL and 0.034 mg/mL, respectively. Moreover, a positive correlation between total phenolic content and antioxidant activity was observed for all the samples. This indicates that polypehnolics are mainly responsible for their antioxidant activity. The crude ethanol extract exhibited a total phenloic content (over 30%) similar to that of its counterpart from tea. This study demonstrates that the crude ethanol extract has a high exploitation potential.
eucalyptus leaf;polyphenol;antioxidant activity;DPPH;ABTS
Q946
A
1002-6630(2012)01-0020-05
2011-02-18
国家林业公益性行业科研专项(201104003-03)
王俊亮(1984—),男,硕士研究生,研究方向为食品化学与营养。E-mail:wjl3333@163.com
*通信作者:曹庸(1966—),男,教授,博士,研究方向为天然产物与功能性食品开发。E-mail:caoyong2181@scau.edu.cn



