郑 华,彭 辉,林 捷,*,吕雪娟
(1.华南农业大学食品学院,广东 广州 510642;2.广东汤臣倍健生物科技股份有限公司,广东 珠海 519040;3.华南农业大学分析测试中心,广东 广州 510642)
蛋黄是一个含蛋白质、脂肪及水的杂合体系,由于蛋白质的存在,蛋黄具有良好的黏性、起泡性及乳化性等功能特性,被广泛用于食品工业[1]。蛋白质的变性会导致蛋黄诸多加工特性如乳化性和流变性的改变。禽蛋在腌制过程中,由于高浓度食盐的作用,导致咸蛋黄出现了收缩凝固硬化,经高温熟化后还出现出油起沙等现象[2],腌制使禽蛋的理化指标[3]、蛋黄的品质、脂肪等成分发生了变化[4-5],是否导致蛋黄中蛋白质分子结构发生改变,国内外的研究均鲜见报道。目前用于蛋白质结构分析方法主要有X射线衍射、圆二色谱(circular dichroism,CD)、核磁共振(NMR)等技术,但这些技术在蛋白质分析时均存在局限性,X射线衍射技术需要获得合格的晶体,核磁共振技术只能测定小分子蛋白质结构,圆二色谱技术只能应用在很窄浓度范围内的澄清溶液中[6]。蛋黄体系中蛋白质含量>15%,且多为大分子结构,很难获得蛋白质单晶体。傅里叶变换红外光谱(FT-IR)技术是一种研究蛋白质变性过程中二级结构变化的有效、简捷的方法[7],能够根据蛋白质等生物大分子对应的红外光谱特征吸收峰谱型、强度、频率等谱学参数的变化,来分析其结构的变化。本研究通过SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)、差示扫描量热(DSC)、FT-IR等技术对腌制蛋黄进行分析测试,研究禽蛋在腌制过程中蛋白质结构发生的变化。
1 材料与方法
1.1 材料与试剂
新鲜鸭蛋(产蛋后5d以内) 广东开平市旭日蛋品有限公司。
考马斯亮蓝R-250 国药集团化学试剂有限公司;5,5’-二硫代二硝基苯甲酸盐(DTNB,分析纯) 美国Sigma公司;低分子质量标准蛋白 日本TaKaRa公司。
1.2 仪器与设备
DSC Q10差示扫描量热仪 美国TA公司;UV1240紫外分光光度计 日本岛津公司;Vertex70傅里叶变换红外光谱仪 德国Bruker公司;TGL-16A高速离心机 江苏常州朗越公司;XHF-I高速均质机 上海金达公司;DYY-12C三恒多用电泳仪 北京六一公司。
1.3 方法
1.3.1 稻草灰腌制法
稻草灰5.0kg、食盐1.75kg、水3.0kg,用于腌制300枚新鲜蛋。将食盐、稻草灰混匀,加水充分搅拌直到具有较强的黏性,形成灰浆。将挑选好的鸭蛋在灰浆内滚一层,放置在密闭容器中腌制。
1.3.2 蛋黄中食盐含量测定
采用硝酸银滴定法。
1.3.3 蛋黄可溶性蛋白质含量测定
采用考马斯亮蓝测定法。
标准曲线制作:将牛血清蛋白(BSA)配制为0~100μg/mL的5个梯度标准溶液,加入0.1mg/mL考马斯亮蓝G-250染色液,在595nm波长处测定吸光度,绘制标准曲线。
样品处理:取蛋黄样品1g加0.05mol/L Tris-HCl缓冲溶液(pH6.5)50mL,用高速均质机5000r/min均质2min,然后用高速离心机10000r/min高速离心20min,取上清液,于595nm波长处测定吸光度。样品中蛋白质含量计算如式(1)。
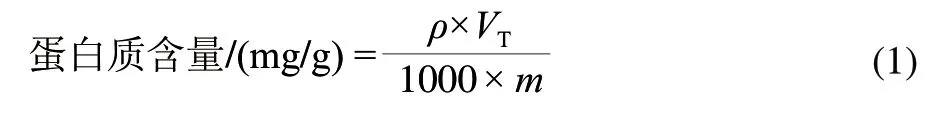
式中:ρ为标准蛋白含量/(μg/mL);VT为提取液总体积/mL;m为样品质量/g。
可溶性蛋白干基含量计算:湿基含量是指蛋黄中可溶性蛋白的质量占蛋黄总质量的质量分数;干基含量是指蛋黄中可溶性蛋白的质量占蛋黄总固体干物质质量的质量分数。
1.3.4 蛋黄蛋白质的巯基测定[8]
称取1.0g蛋黄样品加入0.1mol/L磷酸缓冲液(pH8.0)定容至25mL。取1mL样品液与3mL磷酸缓冲液(pH8.0)混合均匀,加入40μL Ellman试剂(40mg DTNB溶于10mL 0.1mol/L、pH8.0的磷酸盐缓冲液),显色30min,测定412nm波长处的吸光度。以不加样品而加Ellman试剂为空白对照,以不加Ellman试剂而加样品溶液测其浑浊度。巯基计算如式(2)。
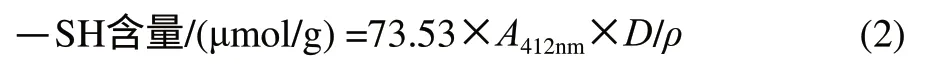
式中:A412nm为加DTNB时样品的吸光度减去不加DTNB时样品的吸光度;ρ为蛋白质质量浓度/(mg/mL);D为样品稀释倍数。
1.3.5 蛋黄蛋白质的SDS-PAGE分析
SDS-PAGE参考Laemmli[9]的方法:5%分离胶和12%浓缩胶。
样品处理:取3g蛋黄加蒸馏水27mL,5000r/min均质1min,然后12000r/min常温离心10min,上清液采用考马斯亮蓝法测定蛋白质含量。用样品溶解液调整到蛋白质质量浓度1mg/mL,置沸水浴3min使蛋白质变性,取15μL蛋白质样品进行电泳。
电泳条件:先采用120V电压电泳至分离胶,后提高电压至200V至电泳结束。采用考马斯亮蓝R-250染色液(m(考马斯亮蓝R-250)∶V(甲醇)∶V(冰乙酸)=0.1∶25∶10)进行染色过夜。用含40%甲醇及10%冰乙酸的洗脱液脱色。
1.3.6 蛋白质的DSC测定
通过前期对新鲜蛋黄理化指标的分析,水分含量为47%。将咸蛋黄样品水分调整到新鲜蛋黄的水平,以万分之一电子天平精确称取蛋黄样品15mg置于铝盘,用空白铝盒作对照,样品从20℃扫描到90℃,升温速率5℃/min,根据峰面积和峰值温度分析蛋黄蛋白质的转变温度及热焓变ΔH。
1.3.7 FT-IR测定蛋白质二级结构
用干燥的空气连续吹扫样品仓,消除水蒸气的影响,精确称取蛋黄样品100mg蛋黄液平铺于水平衰减全反射附件(ATR)上进行全波段(4000~600cm-1)扫描,扫描次数为64次,分辨率为4cm-1。以相应的空气和水作为背景,扣除背景后得到红外光谱图。图谱采用Vertex70数据处理软件,所得的红外谱图与相同条件下水的光谱图进行差减,并以2000~1700cm-1处基本差减为一条直线为依据,从而得到相应蛋白质的红外谱图。差减后的谱图在1600~1700cm-1范围内进行满刻度偏转(full-scale deflection,FSD)处理,然后进行基线校正,得到分辨率较高的原谱。手动调整各子峰的峰高和半峰宽,对图谱进行曲线拟合,计算机多次拟合使残差小于0.01。拟合之后重叠在一起的不同谱带完全分开,根据其积分面积计算各二级结构的相对百分含量。
1.4 统计分析
运用SPSS13.0统计软件,进行多重比较分析,数据通过LSD统计检验。
2 结果与分析
2.1 蛋黄中食盐含量的变化
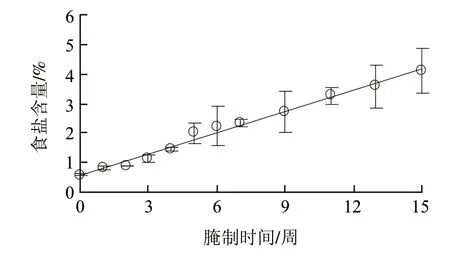
图1 腌制过程中蛋黄食盐含量变化Fig.1 Change in salt content of egg yolk during salting
由图1可知,在整个腌制过程中,蛋黄中食盐含量呈现缓慢升高的趋势。将食盐含量对腌制时间进行线性回归,得到食盐含量随时间的模拟方程,而回归曲线的一阶导数即为食盐的渗透速率。蛋黄的模拟方程为一次函数,拟合方程为Y= 0.2385X+0.5803(R2=0.99),所以蛋黄中的食盐渗透速率基本不变。
2.2 蛋黄中可溶性蛋白含量分析

图2 不同腌制阶段可溶蛋白质含量变化Fig.2 Soluble protein content of egg yolk at different time
可溶性蛋白指能够以小分子状态溶于水或其他溶剂的蛋白。由图2可知,咸蛋腌制过程中,可溶蛋白质的含量呈现缓慢上升趋势,这个结果与蛋黄中食盐含量的变化呈现正相关,这是由于蛋白质在一定食盐浓度范围内具有盐溶作用,从而导致腌制过程中可溶性蛋白质含量增加。图2中出现一个有趣的现象,即在腌制的第3周,蛋黄中可溶性蛋白质的干基含量比未腌制(新鲜)时还低,这可能是因为在腌制过程中,随着蛋黄的脱水(新鲜蛋黄水分含量47.2%,腌制至第3周时为24.5%),使蛋黄中部分可溶性蛋白质流失到蛋清中,低浓度食盐的盐溶作用所产生的可溶性蛋白质甚至少于所流失的部分,从而致使蛋黄中总的可溶性蛋白质含量有所减少。随着蛋黄水分的流失,蛋黄逐渐凝固硬化,使蛋黄失去流动性。蛋黄中蛋白质在食盐的盐溶作用下进一步被溶出,导致腌制后期可溶性蛋白质含量增加。蛋黄可溶性蛋白含量的增加,与蛋黄中食盐的离子强度及蛋黄的颗粒结构有关。蛋黄颗粒主要以高密度脂蛋白-卵黄高磷蛋白通过钙-磷桥形成复合物的形式存在,腌制过程中随着食盐浓度增加,导致维持颗粒结构的钙-磷桥中的Ca2+被Na+取代,从而破坏了蛋黄的颗粒结构,使可溶性的卵黄高磷蛋白被溶出[10]。
2.3 蛋黄蛋白质的巯基含量
二硫键是维持蛋白质高级结构主要的次级键之一,在许多物理、化学及其他作用的条件下,二硫键会被破坏,形成巯基,从而破坏蛋白质的空间结构。在腌制过程中,食盐是否会对蛋黄蛋白质的二硫键产生作用,从而发生巯基的变化,如图3所示,在实验所检测的几个不同的阶段,蛋黄蛋白质中的巯基含量发生了变化。在第3周时,巯基含量明显高于其他阶段,随着腌制时间的延长,巯基含量又会呈现明显的降低。在腌制过程中,随着蛋黄中食盐含量的增加,维持蛋白质空间结构的二硫键在食盐作用下被破坏而断裂,生成巯基,且在第3周时达到最大值,而随后巯基含量逐渐减少。巯基减少的原因可能是以下因素所导致:首先由于蛋黄脱水,使蛋黄逐渐失去流动性,蛋白质浓度升高,且蛋黄中食盐含量也逐渐增加(图1),蛋白质在食盐的进一步作用下,使巯基在新作用力的作用下又结合形成新的二硫键。腌制过程中蛋白质二硫键与巯基之间的变化规律与蛋黄的水分含量、食盐含量等因素之间的关系还有待进一步的研究。

图3 不同时间腌制蛋黄蛋白质的巯基含量变化Fig.3 Change in sulfhydryl content of egg yolk at different time
2.4 蛋黄蛋白质SDS-PAGE分析
以标准蛋白SDS-PAGE的相对迁移率作对照,根据样品的相对迁移率,计算得到各组分的分子质量。由图4可知,标准蛋白的分子质量区间为14.0~97.2kD。在电泳图谱中发现含量较高的蛋白质条带分子质量为32、46、56kD。对照各样品的电泳结果发现,所有电泳条带均清晰可见,且各电泳条带几乎不存在差异,即使是新鲜蛋样品与腌制到第15周的样品也不例外。结果表明,腌制过程中尽管食盐对蛋黄蛋白质的空间结构造成了一定程度的改变,但并未对蛋白质的肽链结构发生作用,即使是腌制到第15周,蛋白质的肽链结构与未经腌制时几乎是相同的,腌制中食盐并未导致蛋白质的肽链发生断裂或聚合而生成新的蛋白质组分。
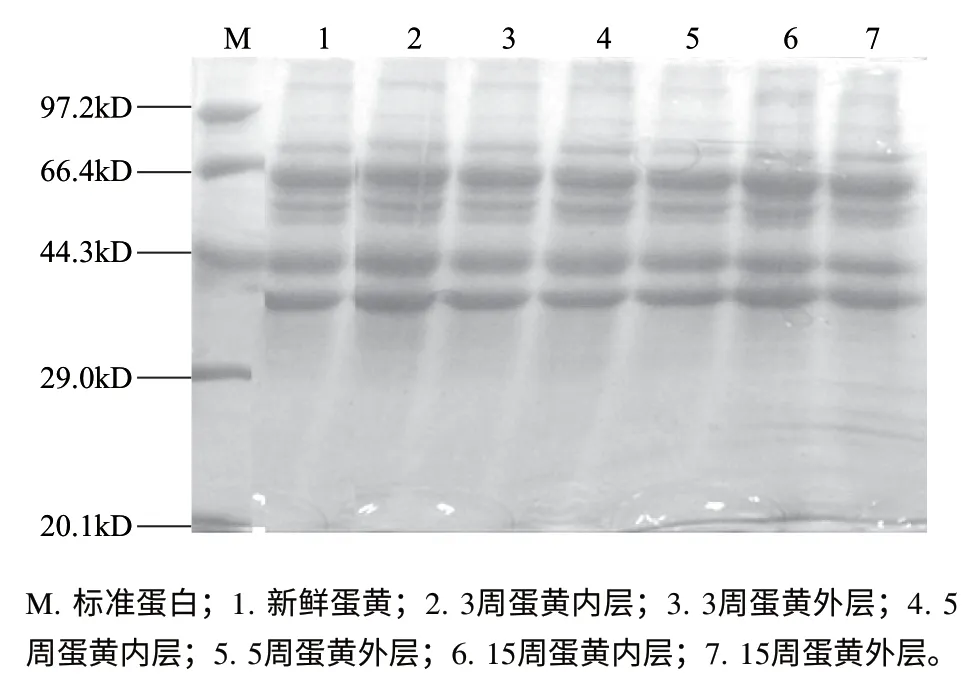
图4 不同腌制时间蛋黄蛋白质的SDS-凝胶电泳图Fig.4 SDS-PAGE pattern of fresh duck eggs with different portions and duck eggs salted for different lengths of time
2.5 蛋黄蛋白质DSC分析
蛋白质是一类与生命直接相关的生物大分子,在正常情况下以紧密折叠结构存在。天然蛋白质分子受到某些物理或化学因素作用时,常出现生物活性丧失,或某些物理、化学常数发生改变,这种现象称为蛋白质的变性,蛋白质的变性常伴随着热力学参数的变化[11]。而蛋白质的热变性温度和焓变是反映蛋白质变性的主要热力学参数。如表1可知,新鲜蛋黄样品有一个明显的最大变性温度为79.06℃的吸热峰值出现,这个峰代表着低密度脂蛋白(LDL)和高密度脂蛋白(HDL)的总蛋白变性峰,腌制后的蛋黄峰值区间在79.04~82.09℃之间。蛋黄浆液里的LDL对热较敏感,而相比之下HDL和卵黄磷蛋白有更强的耐热性。蛋黄腌制以后的变性温度会升高(P<0.05),总焓变代表样品中未变性蛋白质的比例。新鲜蛋黄蛋白质的焓变值为0.833J/g,而腌制以后的总焓变明显下降(P<0.05),说明蛋白变性的程度加深。蛋白质在高水分环境中更容易变性,主要是由于加热使水分子运动加剧,导致蛋白质的次级键断裂。但也有研究[12]表明,具有高比例的疏水基团或高紧密结构的蛋白质具有较高的焓变温度。
表1 腌制不同时间蛋黄蛋白质的焓变值和变性温度(±s, n=3)Table 1 Tmax and enthalpy of proteins from duck eggs salted at different time(±s, n=3)

表1 腌制不同时间蛋黄蛋白质的焓变值和变性温度(±s, n=3)Table 1 Tmax and enthalpy of proteins from duck eggs salted at different time(±s, n=3)
腌制时间/周 蛋黄样品部位 T max/℃ ΔH/(J/g)0内层 79.06±0.02 0.833±0.043外层 79.06±0.02 0.833±0.043 3内层 82.09±0.23 0.419±0.112外层 80.09±0.61 0.428±0.124 15 内层 79.04±0.08 0.199±0.111外层 80.57±0.08 0.287±0.096
2.5 蛋黄蛋白质的FT-IR光谱分析
酰胺Ⅰ带(1600~1700cm-1)的红外吸收主要与C=O的伸缩振动有关,Jackson等[13]将1600~1639cm-1指认为β折叠、1640~1650cm-1为γ-随机结构(C=O与水形成氢键)、1650~1658cm-1为α螺旋结构、1661~1700cm-1为T转角结构。本研究结合Miranda[14]的研究结果,进一步将1600~1625cm-1指认为β1,即蛋白质分子间的强相互作用氢键;1690~1700cm-1为β2,即蛋白质分子间形成的非平面弱氢键(偶极子转换引起的)作用;β1+β2为蛋白质分子间的总相互作用氢键;1626~1639cm-1为分子内β折叠氢键,α螺旋+β折叠为蛋白质分子内总相互作用氢键,代表蛋白质分子的紧密程度。

表2 腌制过程中蛋黄蛋白质二级结构变化Table 2 Variation of secondary structure constitution during salting
如表2所示,新鲜蛋黄蛋白质二级结构组成为:β折叠32.7%,其中β113.34%、β2含量较低仅为1.16%、α螺旋41.97%、T转角17.46%,不含γ无规则卷曲结构。蛋黄中的蛋白质二级结构以α构象为主,α螺旋+β折叠构象含量约占总构象的75%,即蛋白质分子内总相互作用的氢键较强。新鲜蛋黄与腌制后的蛋白质均未有γ卷曲结构出现。蛋黄在腌制过程中,二级结构中氢键变化较为明显,腌制成熟过程蛋白质的α螺旋+β折叠结构含量下降明显,成熟以后(第5周)几乎无变化。而咸蛋黄呈现起沙现象的初期(第3周)出现外部含量明显低于内部蛋黄,这是由于外部脱水作用比内部强烈,导致外部氢键减弱明显,而内部变化缓和,和新鲜蛋较为接近。
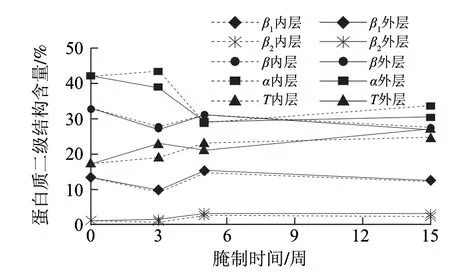
图5 蛋黄内外层不同腌制阶段的二级结构变化Fig.5 Change in secondary structure of egg yolk during salting
由图5可知,蛋黄内、外两层各结构变化规律相似,主要是由腌制过程中渗透脱水引起的,成熟后(第5周)各二级结构变化逐渐缓慢。α螺旋在各结构中变化最明显,在第5周急剧下降到最低后又缓缓上升;T转角在腌制的4个阶段持续上升,但速度较缓慢。
而对于β1、β折叠是先减小后增大再减小的趋势。在腌制到成熟时(第5周),蛋白质二级结构的变化最明显,所有结构都发生很大的变化,β折叠、β1、β2和T转角结构增加,α螺旋结构减少,说明食盐导致蛋白质分子间的作用力发生了明显变化。α结构含量减少的同时T转角结构增加较明显,即在这个过程中α螺旋大部分转化为T转角结构。蛋白质的二级结构指的是蛋白质分子局部区域内,多肽链沿一定方向盘绕和折叠的方式,主要是由分子内的氢键维系的局部空间排列,包括α螺旋、β折叠、转角、无规卷曲等。蛋白质的变性是指蛋白质在某些物理和化学因素作用下,其特定的空间构象会改变而导致蛋白质理化性质的改变和生物活性的丧失,其实质是蛋白质二级结构发生变化[15]。
3 结 论
腌制15周过程中蛋黄可溶性蛋白质含量增加,表明腌制过程蛋白质存在盐溶现象;巯基含量在食盐作用下也发生变化,表明蛋白质亚基受到食盐作用的影响;DSC扫描表明盐分对蛋黄蛋白质的耐热性有促进作用;食盐没有对蛋白质肽链结构产生影响,蛋黄中含量较大的为分子质量32、46、56kD的3种蛋白质条带,而各阶段的条带无明显差异。食盐导致蛋白质的二级结构发生较大变化,新鲜蛋黄蛋白质的二级结构以α螺旋和β折叠结构为主,腌制以后α-、β-结构部分转化为T转角。通过FTIR光谱对腌制过程中咸蛋黄中蛋白质二级结构的分析发现,腌制过程导致了咸蛋黄蛋白质发生了二级结构的改变,即是蛋白质发生了变性。
[1]FENNEMA O R.Food chemistry[M].2nd ed.New York∶ Marcel Dekker Inc, 1985.
[2]彭辉, 林捷, 肖丹华, 等.咸蛋黄成熟机制及品质影响因素研究进展[J].食品研究与开发, 2011(3)∶ 181-184.
[3]邱思.咸蛋黄制备过程中理化指标变化规律的研究[J].食品工业,2011(11)∶ 53-55.
[4]黄娟, 林捷, 郑华, 等.腌制方法对鸭蛋黄成分变化及品质影响[J].食品科技, 2012(4)∶ 60-64.
[5]彭辉, 林捷, 郑茵, 等.腌制过程咸蛋黄的脂质特性研究[J].食品工业科技, 2012(1)∶ 91-93.
[6]谢孟峡, 刘媛.红外光谱酰胺Ⅲ带用于蛋白质二级结构的测定研究[J].高等学校化学学报, 2003(2)∶ 226-231.
[7]卢雁, 张玮玮, 王公轲.FTIR用于变性蛋白质二级结构的研究进展[J].光谱学与光谱分析, 2008(1)∶ 88-93.
[8]BEVERIDGE T, TOMA S J, NAKAI S.Determination of SH- and SS-groups in some food proteins using Ellman’s reagent[J].Food Science, 1974, 39∶ 49-51.
[9]LAEMMLI U K.Cleavage of structure proteins during the assembly of the head of bacteriophage T4[J].Nature, 1970, 227∶ 680-685.
[10]CAUSERET D, MARTRINGE E, LORIENT D.Ionic strength and pH effects on composition and microstructure of yolk granules[J].Journal of Food Science, 1991, 56∶ 1532-1536.
[11]卢雁, 李向荣.蛋白质变性机理与变性时的热力学参数研究进展[J].化学进展, 2005(5)∶ 905-910.
[12]ARNTFIELD S D, MURRAY E D, ISMOND M A H.Effect of salt on the thermal stability of storage proteins from fababean (Vicia faba)[J].Journal of Food Science, 1986, 51∶ 371-377.
[13]JACKSON M, MANTSCH H H.The use and misuse of FT-IR spectroscopy in the determination of protein structure[J].Critical Reviews in Biochemistry and Molecular Biology, 1995, 30∶ 95-120.
[14]MIRANDA K G C.Structure-guided encapsulation of model proteins into biocompatible polymers[D].Rio Piedras∶ Universidad de Puerto Rico, 2001.
[15]何建川, 邵阳, 张波.蛋白质和变性蛋白质二级结构的FTIR分析进展[J].化学研究与应用, 2012(8)∶ 1176-1180.



