张炽坚,王 强,唐秋实,刘英菊,孙远明,唐允健,雷红涛,*
(1.农业部农产品贮藏保鲜质量安全风险评估实验室,广东省食品质量安全重点实验室,广东 广州 510642;2.华南农业大学理学院,生物材料研究所,广东 广州 510642)
近年来,除草剂在我国用量逐渐增加,极大地提高了劳动效率和劳动产量,但部分除草剂在环境中稳定性强,残留时间久,对生态环境和农产品安全产生危害或风险,逐渐引起人们关注[1]。异丙甲草胺(metolachlor)化学名称为N-2-乙基-6-甲基苯基-N-(1-甲基-2甲氧基乙基)氯乙酰苯胺,是我国目前生产和使用量最大的除草剂品种之一,其残留可通过食物链进入动物体或人体[2],虽未有现实例子证明其致癌性[3],但美国环境保护局将其归类为潜在致癌性物质。国标GB/T 5009.174—2003《花生、大豆中异丙甲草胺残留量的测定》规定异丙甲草胺在花生和大豆中的最高残留限量为0.5mg/kg,农业行业标准NY 775—2004《玉米中烯唑醇、甲草胺、溴苯腈、氰草津、麦草畏、二甲戊乐灵、氟乐灵、克百威、顺式氰戊菊酯、噻酚磺隆及异丙甲草胺最大残留限量》则规定异丙甲草胺在玉米籽粒中的最高残留限量为0.1mg/kg。目前,针对异丙甲草胺的分析方法主要有薄层色谱法[4]、高效液相色谱法[5]、气相色谱法[6]等。薄层色谱法的灵敏度比较低;高效液相色谱法和气相色谱法灵敏度高、测定准确,是目前测定异丙甲草胺的主要方法,但仪器设备昂贵,对实验人员专业技能要求高。
免疫分析法以其灵敏、准确、前处理简单、高通量等优点,越来越多地用于农药残留检测[7]。但是,除草剂作为小分子半抗原物质,不具有免疫原性,需要化学衍生或重头合成合适的半抗原,然后还需化学偶联制备出人工抗原才能免疫动物,除草剂抗体的制备过程较大分子全抗原物质的抗体制备步骤更为繁复,其中半抗原的设计、合成及人工全抗原的制备成为影响除草剂抗体制备、免疫分析方法建立的关键。Schlaeppi等[8]采用重头合成法,经过六步化学反应,获得苯环上带一个羧基的异丙甲草胺半抗原,尽管制备出了抗体,但半抗原合成步骤过于复杂,对生物分析工作者难度较大,不易实施;Feng等[9]亦建立了异丙甲草胺的酶联免疫检测方法,检测限只有10ng/mL,但没有进行实际样品检测;而国内尚未见关于异丙甲草胺免疫检测方法的研究报道。
本实验以异丙甲草胺为对象,使用3-巯基丙酸(3-MPA)为衍生剂,用一步法合成含羧基的异丙甲草胺半抗原(MMPA),可大大简化半抗原的制备步骤,随后将半抗原偶联载体蛋白后免疫动物以获得异丙甲草胺多克隆抗体,进而建立异丙甲草胺间接竞争酶联免疫吸附(indirective competitive enzyme-linked immunosorbent assay,icELISA)分析方法,并将该方法应用于环境水样品中异丙甲草胺的检测,以期为异丙甲草胺的快速检测提供一种新的生物分析方法。
1 材料与方法
1.1 材料与试剂
异丙甲草胺(97.7%) 山东滨州农药厂;牛血清白蛋白(BSA)、卵清白蛋白(OVA) 上海伯奥生物技术有限公司;辣根过氧化物酶标记羊抗兔IgG抗体 武汉博士德生物工程有限公司;二环已基碳二亚胺(DCC)、N-羟基琥珀酰亚胺(NHS)、3-巯基丙酸(3-MPA)、弗氏完全佐剂与弗氏不完全佐剂 美国Sigma公司;其余试剂均为市售分析纯。
1.2 仪器与设备
DRX-400/600核磁共振仪 德国Burker公司;UV2550紫外-可见分光光度计 日本岛津公司;MK3多功能酶标仪、Wellwash MK2洗板机 美国Thermo公司;96孔聚苯乙烯酶标板 江苏海门市三和通明玻璃仪器总厂;6K-15高速冷冻离心机 德国Sartorius公司。
1.3 方法
1.3.1 抗原的合成与鉴定
1.3.1.1 异丙甲草胺半抗原的合成
将170 mg ( 0 . 599 mmol ) 异丙甲草胺、62mg(0.0593mmol)3-MPA、110mg(1.964mmol)KOH依次加入10mL乙醇溶液中,搅拌状态下回流4h,过滤、减压脱溶得到异丙甲草胺半抗原(MMPA)粗品,用8mL 5%的NaHCO3溶液溶解粗品,然后用6mol/L的HCl溶液调pH值至3.0,乙酸乙酯萃取(5mL×3),合并有机相,冰水洗(20mL×3),有机相用无水Mg2SO4干燥,最后硅胶层析纯化(展开剂为苯-1,4-二氧六环-冰乙酸(90:10:1,V/V)),得MMPA纯品150.3mg,得率为71%。1H-NMR (600MHz,Methanol-d4,TMS):δ 1.23(d,J=7.8Hz,3H),1.25(t,J=7.2Hz,3H),2.20(s,3H),2.59(t,J=6.6Hz,2H),2.63(m,2H),2.79(t,J=7.8Hz,2H),3.31(s,3H),3.47(m,1H),3.66(dd,J1=10.2Hz, J2=6.0Hz,1H),3.83(s,2H),4.45(m,1H),7.16(d,J=7.8Hz,1H),7.23(d,J=7.2Hz,1H),7.28(dd,J=7.8Hz,J=7.2Hz,1H)。
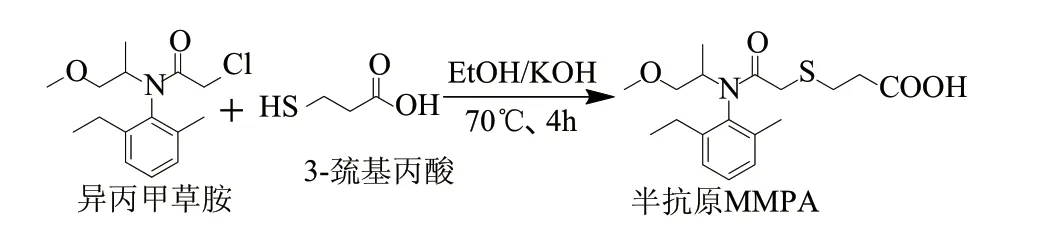
图 1 异丙甲草胺半抗原的合成路线Fig.1 Synthesis of metolachlor hapten MMPA
1.3.1.2 异丙甲草胺人工抗原的制备与鉴定
采用活泼酯法[10]将异丙甲草胺半抗原与BSA偶联制备出免疫抗原MMPA-BSA,与OVA偶联制备包被抗原MMPA-OVA,产物用0.9%生理盐水在4℃条件下透析3d以除掉未反应的半抗原,之后紫外光谱法鉴定半抗原与载体蛋白是否有效偶联[11],分装并于-20℃保存。
1.3.2 异丙甲草胺抗体的制备
选用2kg左右新西兰大白兔,初次免疫时将500μg免疫原与弗氏完全佐剂等体积乳化后,进行背部多点注射。每隔4周加强免疫一次,加强免疫的乳化剂选择不完全佐剂。4次免疫后8d取全血,1mL分装后于-20℃保存。
1.3.3 间接竞争ELISA的建立
用棋盘滴定法确定最佳包被原质量浓度和抗体工作质量浓度[12],抗原抗体用量少的实验组合为最佳工作条件,建立间接ELISA检测方法[13-14]。每孔加入50μL标准质量浓度梯度的异丙甲草胺和优化好的一定质量浓度的抗体,采用Origin 7.5软件的四参数Logistic模型拟合,异丙甲草胺的半抑制浓度定义为50%抑制浓度(IC50)、检出限(limit of detection,LOD)定义为10%的抑制浓度(IC10),检测范围定义为20%~80%抑制浓度(IC20~IC80)[15]。
1.3.4 特异性评价
以结构类似物的交叉反应率来评价抗体特异性[16]。采用间接竞争ELISA程序在同等条件下依次建立异丙甲草胺结构类似物的ELISA曲线,求出各自的抑制率为50%时的标准品浓度,用IC50表示。计算交叉反应率:
CR/%= [IC50(异丙甲草胺)/IC50(结构类似物)] ×100。
1.3.5 水样采集、分析和添加回收实验
水样采自华南农业大学鄱阳湖,添加异丙甲草胺质量浓度为20、40、60、80ng/mL,经过滤纸过滤后,用所建立的icELISA方法对水样中的异丙甲草胺进行测定,计算加标回收率。
2 结果与分析
2.1 异丙甲草胺抗原合成
异丙甲草胺分子质量只有283.8D,本身不具备免疫原性,属于半抗原物质,不能直接用于动物免疫。对于半抗原物质制备抗体,首先需要将其与载体蛋白连接,制备出人工完全抗原[17]。由于异丙甲草胺分子上没有合适的活性基团,很难直接与蛋白偶联,因此需要通过一定长度的手臂结构进行蛋白与半抗原的连接,以便半抗原更好暴露给免疫细胞识别;为了尽可能保留异丙甲草胺大部分立体特征和电子特性,偶联所需的含羧基空间手臂除了从氯原子处衍生外,也可从N-乙氧丁基处衍生。但后者衍生方法会导致侧链上减少一个强吸电子的氧原子,可能导致半抗原的电荷分布状态发生变化,与异丙甲草胺的电性相似性降低,而且合成路线复杂,故本实验未采用。本实验选择碳链较短的廉价3-MPA作为衍生剂,一步反应即可完成,半抗原的合成路线非常简便,且是母化合物的Cl原子被替换成O原子,Cl和O电负性接近,较好的保持了目标分子原有特征[18-19]。经核磁鉴定表明半抗原合成成功。
将半抗原与BSA共价结合制备免疫原,经紫外扫描鉴定(图2),半抗原在波长250~260nm处有较强吸收,BSA在250nm波长处几乎无吸收,而MMPA-BSA在250nm波长处表现出一定吸收;此外半抗原在230nm波长处有强吸收峰,BSA在210nm波长处左右有强吸收峰,而MMPA-BSA的强吸收峰处于波长210nm~230nm之间,其吸收曲线既不同于BSA也不同于半抗原的吸收曲线,是一种BSA和半抗原的累加吸收特征曲线。因为透析后不存在游离的异丙甲草胺半抗原,所以这种累加的吸收特征为MMPA-BSA偶合物所贡献出,而非游离异丙甲草胺半抗原和BSA累加贡献,说明人工抗原MMPA-BSA合成成功[16]。同理推断包被抗原MMPA-OVA也合成成功(图3)。
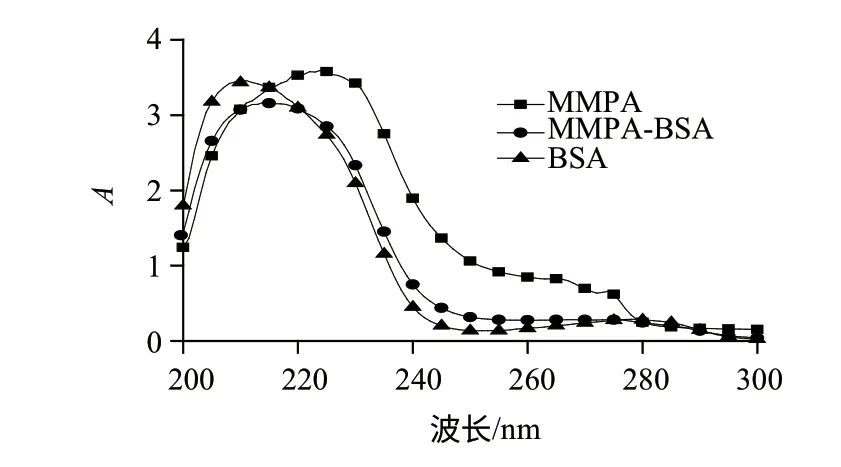
图 2 MMPA、BSA、BSA-MMPA的紫外吸收曲线Fig.2 UV spectrum of MMPA, BSA, BSA-MMPA

图 3 MMPA、OVA、MMPA-OVA的紫外吸收曲线Fig.3 UV spectrum of MMPA, OVA, OVA-MMPA
2.2 间接竞争ELSIA法的建立
2.2.1 抗体效价及工作质量浓度
[12]及棋盘滴定法测定抗体效价与工作质量浓度。本次实验免疫了两只兔子,其中一只兔的效价很高,达到1/10000,本实验后续工作均用此高效价兔血清。棋盘滴定确定包被抗原的工作质量浓度为0.05μg/mL,抗血清稀释倍数为10000倍。
2.2.2 标准曲线
确定好包被抗原工作质量浓度、抗血清稀释倍数后,制作异丙甲草胺的标准曲线。其IC50为34.3ng/mL,最低检测限IC10为6.3ng/mL,检测范围(IC20~IC80)为12.3~99.2ng/mL,并且在检测范围内,线性方程为y=-0.8079x+2.0712,R2为0.996。该灵敏度和检测范围可以满足GB/T 5009.174—2003及NY 775—2004对异丙甲草胺最高残留限量的检测要求。
2.2.3 特异性评价
抗体特异性用交叉反应率来表示(表1),交叉反应率越低,抗体特异性越强。抗体分别与S-(-)-异丙甲草胺、丁草胺、丙草胺、乙草胺、异丙草胺、甲磺隆、莠去津进行icELISA检测。抗体与丁草胺、丙草胺、乙草胺的交叉反应率为0.5%,与异丙草胺、甲磺隆、莠去津等几乎无交叉反应,特异性很好。
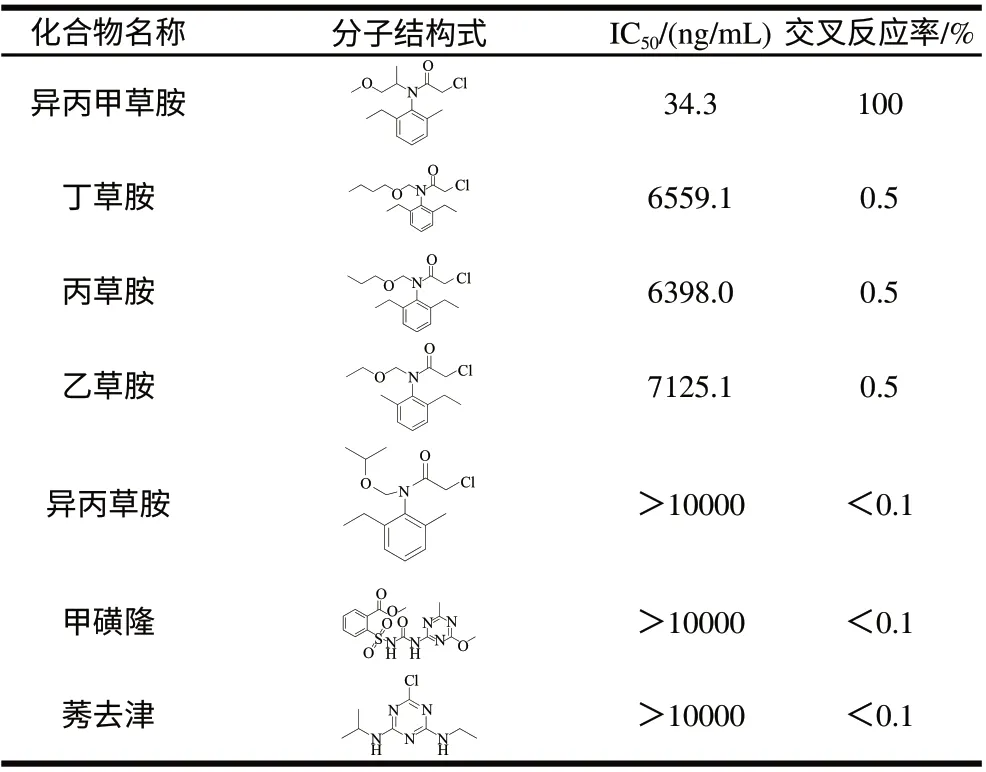
表1 抗体与异丙甲草胺结构类似物的交叉反应率Table 1 Cross-reactivity of metolachlor antibody towards other related compounds
2.2.4 添加回收实验
在水样中添加质量浓度为20、40、60、80ng/mL水平下,异丙甲草胺的平均回收率为89.5%~107.9%,相对标准偏差为9.2%~14.5%(表2),表明该法准确度和精密度都较高。

表2 异丙甲草胺在水样中的添加回收实验(n=8)Table 2 Recovery of metolachlor in water samples (n=8)
3 结 论
本实验采用一步法合成异丙甲草胺半抗原,大大简化了半抗原的制备方法,成功制备出特异性、灵敏度较好的异丙甲草胺抗体。利用所获抗体,建立了一种特异性检测除草剂异丙甲草胺的icELISA方法,将该法用于添加水样检测,结果可靠、灵敏、简便,可用于环境水样中异丙甲草胺的分析与检测。
参考文献:
[1] 屠海云, 姜荷, 李玮. 气相色谱-质谱法测定粮谷中5种除草剂残留[J]. 食品科学, 2010, 31(16): 217-219.
[2] 梅梅, 杜振霞, 陈芸. QuEChERS-超高效液相色谱串联质谱法同时测定土壤中5种常用除草剂[J]. 分析化学, 2011(11): 1659-1664.
[3] LAWRUK T S, LACHMAN C E, JOURDAN S W, et al. Determination of metolachlor in water and soil by a rapid magnetic particle-based ELISA[J]. J Agr Food Chem, 1993, 41(9): 1426-1431.
[4] QUEIROZ M E C, LANCAS F M. Analytical methods for the determination of alachlor, metolachlor, simazine and atrazine mobility in soils[J]. Journal of Environmental Science and Health: Part B, 2000, 35(4): 467-476.
[5] VRYZAS Z, TSABOULA A, MOURKIDOU E P. Determination of alachlor, metolachlor, and their acidic metabolites in soils by microwave-assisted extraction (MAE) combined with solid phase extraction (SPE) coupled with GC-MS and HPLC-UV analysis[J]. Journal of Separation Science, 2007, 30(15): 2529-2538.
[6] GAYNOR J D, MACTAVISH D C, HAMILL A S. A GC/MSD method for the analysis of metolachlor in cabbage, broccoli, and tomato[J]. Commun Soil Sci Plan, 1992, 23(13/14): 1549-1558.
[7] WANG Yuzhen, YANG Hong, WANG Bin, et al. A sensitive and selective direct competitive enzyme-linked immunosorbent assay for fast detection of SudanⅠin food samples[J]. J Sci Food Agr, 2011, 91(10): 1836-1842.
[8] SCHLAEPPI J M, MOSER H, RAMSTEINER K. Determination of metolachlor by competitive enzyme immunoassay using a specific monoclonal antibody[J]. J Agr Food Chem, 1991, 39(8): 1533-1536.
[9] FENG P C C, HORTON S R, SHARP C R. A general method for developing immunoassays to chloroacetanilide herbicides[J]. J Agr Food Chem, 1992, 40(2): 211-214.
[10] WANG Lili, SANG Yaxin, WANG Xianghong. Enzyme-linked immunosorbent assay for okadaic acid: investigation of analytical conditions and sample matrix on assay performance[J]. J Aoac Int, 2011, 94(5): 1531-1536.
[11] GUO Ming, PANG Shuoquan. Synthesis characterization and immunoassay of the artificial antigen for cadmium(II)[J]. Asian J Chem, 2009, 21(7): 5621-5631.
[12] WANG Junping, YU Guichun, SHENG Wei, et al. Development of an enzyme-linked immunosorbent assay based a monoclonal antibody for the detection of pyrethroids with phenoxybenzene multiresidue in river water[J]. J Agr Food Chem, 2011, 59(7): 2997-3003.
[13] ZHAO Jing, LI Gang, YI Guoxiang, et al. Comparison between conventional indirect competitive enzyme-linked immunosorbent assay (icELISA) and simplified icELISA for small molecules[J]. Anal Chim Acta, 2006, 571(1): 79-85.
[14] SHENG Jianwu, HE Miao, SHI Hanchang. A highly specific immunoassay for microcystin-LR detection based on a monoclonal antibody[J]. Anal Chim Acta, 2007, 603(1): 111-118.
[15] LEI Hongtao, SHEN Yudong, SONG Lijun, et al. Hapten synthesis and antibody production for the development of a melamine immunoassay[J]. Anal Chim Acta, 2010, 665(1): 84-90.
[16] LEI Hongtao, LIU Jin, SONG Lijun, et al. Development of a highly sensitive and specific immunoassay for determining chrysoidine, a banned dye, in soybean milk film[J]. Molecules, 2011, 16(8): 7043-7057.
[17] PARRA J, MERCADER J V, AGULLO C, et al. Generation of anti-azoxystrobin monoclonal antibodies from regioisomeric haptens functionalized at selected sites and development of indirect competitive immunoassays[J]. Anal Chim Acta, 2012, 715: 105-112.
[18] YE Jiangqiang, SHAO Hongxia, MA Dingyuan, et al. A monoclonalantibody-based ELISA for the detection of human FADD (fasassociated death domain)[J]. Biotechnol Appl Bioc, 2008, 50(3/4): 143-146.
[19] KIM Y J, CHO Y A, LEE H S, et al. Investigation of the effect of hapten heterology on immunoassay sensitivity and development of an enzyme-linked immunosorbent assay for the organophosphorus insecticide fenthion[J]. Anal Chim Acta, 2003, 494(1/2): 29-40.



