陈 臣,罗顺菁,*,刘成梅,邹常春,汪志宇,王文飞
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学资产管理处,江西 南昌 330031)
对氯甲基苯甲酸链接的莱克多巴胺人工抗原的合成与鉴定
陈 臣1,罗顺菁1,*,刘成梅1,邹常春2,汪志宇1,王文飞1
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学资产管理处,江西 南昌 330031)
采用对氯甲基苯甲酸(CBA)为链接臂,用混合酸酐法将莱克多巴胺(RAC)与牛血清白蛋白(BSA)偶联制备人工抗原(RAC-CBA-BSA),通过紫外、红外、电泳鉴定抗原合成成功;再以卵清蛋白(OVA)为载体蛋白合成包被抗原(RAC-CBA-OVA),测定其与抗体的亲和力和抑制率。间接竞争ELISA结果以对CBA为链接臂合成的包被抗原对应的抗体滴度为7047.3、IC50为17.05ng/mL,结果表明,CBA可以用于RAC人工抗原的合成,使用RAC-CBA-OVA作为包被抗原可以提高ELISA检测灵敏度。
莱克多巴胺;对氯甲基苯甲酸;ELISA灵敏度;人工抗原
莱克多巴胺(RAC)具有营养重分配,降低胴体脂肪,提高瘦肉率,同时使动物增重的作用[1-2]。但是人类过量食用(超过1.25μg/(kggd))含有该残留的畜产品会引发食物中毒,表现为恶心、呕吐、心悸、头疼、目眩等[3-4],对患有高血压、青光眼、糖尿病等疾病的患者则可能危及生命。RAC在中国被禁止使用于饲料添加,是中国食品安全委员当前发布的第一批82种禁止在饲料、动物饮用水和畜禽水产养殖过程中使用的药物和物质之一。在体育比赛中,RAC可以增强运动员、动物(如马)肌肉,提高运动成绩,国际奥委会已将其列为禁用药物。
目前对于RAC的检测方法主要有气质联用(GC-MS)[5-6]、高效液相色谱(HPLC)[7]以及液质联用(LC-MS)[8-9]等方法,这些方法准确、科学,但对操作者的专业要求较,仪器昂贵,且维护费用较高,不利于推广应用。酶联免疫吸附检测法(ELISA)是一种基于抗原抗体反应和酶化学反应的快速检测方法,灵敏度高、特异性强、样品前处理简单,不需要昂贵的仪器设备,对操作人员的专业要求相对较低,非常适于现场监控和大批量筛选。
RAC人工抗原是研制酶联免疫吸附检测试剂的首要基础,对于提高RAC检测的灵敏度及准确性,有重要的影响。异源性ELISA检测中,由于抗体对包被抗原的识别减弱,使得待测物能与抗体结合机会增加,与包被抗原充分竞争,从而能检测较低浓度的待测物,提高检测灵敏度。且免疫半抗原与包被半抗原的差异性越大,检测灵敏度越高[10]。半抗原的结构对ELISA检测灵敏度的影响,从高到低依次为连接位点、链接臂结构、链接臂长度。目前针对连接位点、链接臂结构、链接臂长度对RAC ELISA检测灵敏度的影响的研究未见报道。
本实验是针对链接臂结构对ELISA检测灵敏度影响进行研究。链接臂的选择首先必须考虑其结构有利于进行蛋白质与RAC的偶联反应;其次根据Wright等[11]提出的理论,链接臂越长,产生高特异性抗体的可能性越低,因此链接臂的长度必须合适;最后要求合成抗原纯化方便。对氯甲基苯甲酸(CBA)易溶于无机相,在半抗原合成中,未参加反应的CBA遇水便可析出,方便除去,而未反应的RAC也可以在随后的透析中被除去,抗原纯化方便。本实验使用对CBA作为链接臂,通过混合酸酐法制备人工抗原,探索对CBA作为链接臂制备RAC人工抗原的方法及条件,并对其进行初步鉴定。再与以戊二酸酐为链接臂制备的包被抗原(RAC-SA-OVA)比较不同半抗原对ELISA检测灵敏度的影响。
1 材料与方法
1.1 材料、试剂与仪器
RAC(生物纯) 武汉华美公司;CBA(分析纯) 强中化工有限公司;牛血清白蛋白(BSA)、卵清蛋白(OVA)美国Sigma公司;N,N-二甲基酰胺(DMF)、1,4-二氧六环、三正丁胺、氯甲酸异丁酯、无水乙醇等试剂均为分析纯。
320-S pH计 梅特勒-托利多仪器有限公司;各种规格的移液枪 芬兰雷勃公司;磁力搅拌器 德国IKA公司;WH-3漩涡混匀议 上海沪西分析仪器厂有限公司;SHZ-82气浴恒温振荡器 荣华仪器设备有限公司;DU640紫外-可见分光光度计 美国Beckmen公司;蛋白质电泳仪 美国Bio-Rad公司;MK3酶标仪、NICOLIT5700红外光谱仪 美国热电公司;可拆酶标板美国康宁公司;冷冻干燥机 美国Labconco公司。
1.2 方法
1.2.1 RAC人工抗原的合成
称取34mg RAC溶于4mL DMF-1,4-二氧六环(体积比1:1)溶液中,加入20.5mg CBA,磁力搅拌室温下反应过夜,加入10μL三正丁胺,冰浴反应10min,取出反应物至室温,加入7μL氯甲酸异丁酯,室温下反应2h;称取130mg BSA、45mg OVA分别溶解于10mL DMF-PBS-蒸馏水(体积比1:1:2)中;分别取5mL BSA、OVA溶液,0℃冰浴备用,各取600μL RAC-CBA溶液以每1滴/50s的速率分别滴加至BSA、OVA溶液中,期间用0.1mol/L NaOH溶液调整pH8.0左右,冰浴反应4h,反应液1000r/min离心10min,取上清4℃透析3d。冷冻干燥至粉末备用。
1.2.2 全抗原的鉴定
1.2.2.1 全抗原红外光谱扫描
分别称取干燥的RAC-BSA全抗原2mg和KBr 200mg放入玛瑙钵中,在红外灯的照射下将混合物研磨均匀后,装入压片模具中,在8t压力下压制10min,压制成厚度为1mm的透明KBr压片,同样方法制备BSA和RAC的KBr压片后,用红外光谱仪进行扫描,得到红外光谱图。
1.2.2.2 全抗原紫外光谱扫描及偶联比的计算
将RAC、BSA、OVA和两种全抗原RAC-BSA、RAC-OVA用PBS稀释成一定浓度的溶液,然后用DU460紫外扫描仪在波长200~400nm处进行紫外扫描,得到紫外吸光图谱。根据公式(1)进一步计算出两种全抗原的浓度比,即偶联比(c1/c2)[12]。
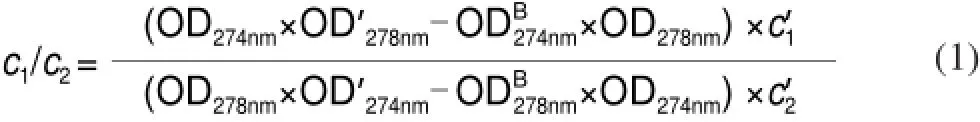
式中:OD274nm为全抗原在RAC最大吸收波长处的光密度;OD’278nm为BSA在其最大吸收波长处的光密度;ODB274nm为BSA在RAC最大吸收波长处的光密度;OD278nm为全抗原在BSA最大吸收波长处的光密度;OD’274nm为RAC在其最大吸收波长处的光密度;ODB278nm为RAC在BSA最大吸收波长处的吸光度;c’1为RAC标准物的浓度;c’2为BSA标准物的浓度。
1.2.2.3 全抗原SDS-PAGE电泳
用蒸馏水分别稀释RAC、BSA、OVA和两种全抗原RAC-BSA、RAC-OVA,煮沸5min再冰浴5min,1000r/min离心5min,取上清。5%浓缩胶、16%分离胶,电极缓冲液为250mmol/L,Tris-HCl(pH8.3),甘氨酸0.1% SDS。起始恒定电流2.1mA/cm浓缩样品,溴酚蓝进入分离胶后,将电流调制3.0mA/cm,电压为60V,直至溴酚蓝条带距封底胶约0.5cm时停止电泳,用0.025g/mL的考马斯亮蓝(R-250)染色,用25%的甲醇和10%的冰乙酸制成脱色液脱色至背景清晰。用凝胶成像仪得到电泳图[13]。
1.2.3 动物免疫
采用以戊二酸酐为链接臂制备的RAC-SA-BSA免疫原免疫小鼠制备抗血清。具体方法为:初免将人工抗原与弗氏完全佐剂1:1混合,采用皮下多点注射,免疫5周龄的雌性Balb/c小鼠;二免、三免、四免使用弗氏不完全佐剂替换弗氏完全佐剂与抗原1:1混合,同样方法免疫Balb/c小鼠。四免后断尾取血并用ELISA法检测。
1.2.4 不同包被抗原对抗体亲和力的影响
用间接ELISA法对比两种包被抗原与抗体的亲和力。具体如下: RAC-SA-OVA、RAC-CBA-OVA稀释至5μg/mL包被酶标板,每孔100μL,4℃静置过夜后用1% PBST洗涤;加入380μL 3%脱脂牛奶封闭酶标板,37℃温育1h后洗涤;加入100μL梯度稀释的抗体,抗体稀释度为1:800~1:51200倍比稀释,37℃温育1h后洗涤;加入100μL酶标羊抗小鼠IgG,37℃温育1h后洗涤;加入100μL TMB显色液,37℃温育15min;加入50μL 2mol/L的H2SO4溶液终止显色,用酶标仪检测其在波长450nm处OD值为阳性值。抗体滴度OD值为1.0时的抗体稀释度。
1.2.5 不同包被抗原对ELISA检测灵敏度的影响
用间接竞争ELISA法检测不同包被抗原对ELISA检测灵敏度的影响。将1.2.4节中加梯度稀释抗体一步改为加入50μL质量浓度为0、4、10、20、40、100、140、200ng/mL RAC标准品及50μL最佳工作质量浓度的RAC单抗,其余步骤相同,计算抑制率(IR)。半数抑制率IC50为抑制率达到50%时的竞争品质量浓度。

式中:OD为加入竞争品孔的OD值;OD0为竞争品质量浓度为0孔的OD值。
2 结果与分析
2.1 全抗原红外光谱扫描结果
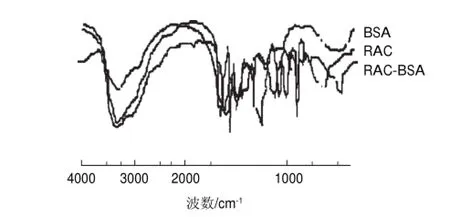
图 1 RAC、BSA和RAC-BSA红外扫描光谱图Fig.1 IR spectra of RAC, BSA and RAC-BSA
如图1所示,对比BSA和RAC-BSA人工抗原的红外光谱图在3500~2600cm-1和1900~1500cm-1区域出现了类似的吸收峰,且明显呈现蛋白质吸收特点:3297cm-1处的胺基NüH吸收峰、1666cm-1和1549cm-1的两个酰胺谱带[14]等,判断应该是BSA中氨基酸产生的特征峰;同时,对照RAC和RAC-BSA人工抗原的红外光谱图发现它们在830cm-1附近有类似的吸收出现,且BSA的红外光谱图不具备这个特点;另外在RAC-BSA全抗原的红外光谱图中还能找到1000~1280cm-1处出现的由于RAC与BSA偶联而产生的CüN伸缩振动吸收峰。综上所述,可以得出结论在RAC-BSA的KBr压片中含有RAC和BSA,且RAC-BSA人工抗原偶联成功。
2.2 全抗原紫外光谱扫描结果
如图2所示,RAC和BSA的最大吸收峰分别在波长为274nm和278nm处;而RAC-BSA全抗原的最大吸收峰在波长为276nm处,与BSA比较,波峰左移,证明人工抗原偶联成功。同样,RAC和OVA人工抗原的紫外光谱图中看到相同情况,RAC-OVA全抗原的最大吸收与OVA比较同样向左偏移,证明RAC-OVA人工抗原也偶联成功。
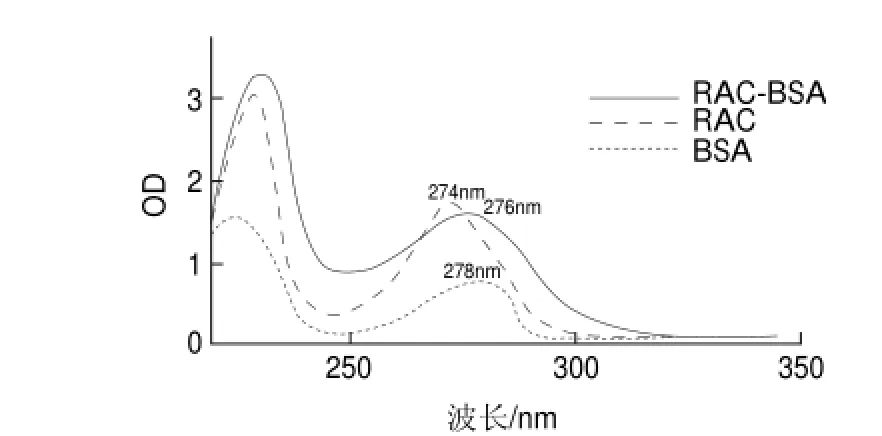
图 2 RAC、BSA和RAC-BSA紫外扫描光谱图Fig.2 UV spectra of RAC, BSA and RAC-BSA
2.3 偶联比的计算结果
RAC-BSA全抗原偶联比为17.6:1;RAC-OVA全抗原的偶联比为4.4:1。
2.4 全抗原SDS聚丙烯酰胺凝胶电泳结果
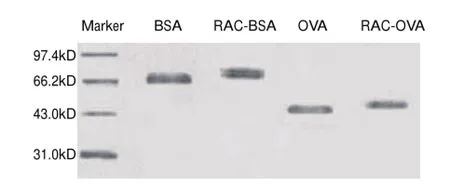
图 3 人工抗原SDS-PAGE图Fig.3 Identif i cation of artif i cial antigens by SDS-PAGE
如图3所示,RAC-BSA全抗原的泳动速度小于BSA,可见RAC-BSA全抗原的分子质量大于BSA,由此可以证明RAC与BSA已经偶联成功,同时,RAC-BSA全抗原的条带在其相应位置出现了一定程度的弥散现象,这是因为每一个BSA分子和RAC小分子偶联的数目并不完全相同。使用紫外凝胶成像系统分析软件分析后,得出BSA的分子质量约66.2kD, RAC-BSA全抗原的分子质量大约为73.5kD,全抗原中RAC与BSA的偶联比约为18.9:1,与紫外扫描结果基本一致。OVA的结果为4.5:1,与紫外扫描结果基本相符。
2.5 抗体效价检测结果
在包被抗原浓度等其他ELISA条件相同时,改变包被抗原种类,则其在波长450nm处的OD值反映了不同包被抗原对抗体的亲和力,OD值越高,亲和力越高。图4为两种包被抗原间接竞争ELISA法中对应的抗体稀释曲线。相同抗体稀释度下,RAC-SA-OVA的OD值略高于RAC-CBA-OVA,由图计算二者的抗体滴度分别为17325.6和7047.3。由于与免疫半抗原具有不同的链接臂,降低了人工抗体对链接臂部分的识别,因此RACCBA-OVA对抗体的亲和力略小于RAC-SA-OVA[15]。
提高ELISA检测的灵敏度是优化ELISA检测方法的重要手段。图5所示为间接竞争ELISA的抑制曲线,在相同抑制率下,RAC-CBA-OVA组的竞争品质量浓度低于RAC-SA-OVA组。同时,半数抑制率IC50为判断ELISA灵敏度的重要参数,包被RAC-CBA-OVA的ELISA检测的IC50为17.05ng/mL低于包被RAC-SA-OVA的20.90ng/mL。由于CBA-OVA在ELISA检测过程中与抗体结合力下降,使得抗体与RAC作用几率增加,检测的抑制率被提高,因此使用RAC-CBA-OVA做ELISA检测包被抗原对检测提高灵敏度有所帮助[16]。

图 4 两种包被抗原间接竞争ELISA的抗体稀释曲线图Fig.4 Antibody dilution curves obtained using two different coating antigens
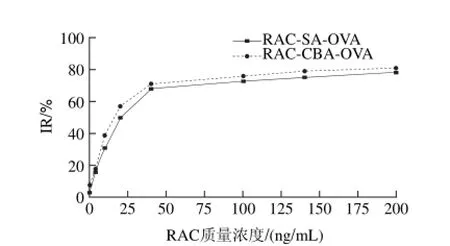
图 5 两种包被抗原间接竞争ELISA的抑制曲线Fig.5 ELISA inhibition curves obtained using different coating antigens
3 讨 论
食品中残留的农药、抗生素及其他人为添加的有害成分的分子质量普遍小于1kD,这些小分子物都属于半抗原,即虽然具有抗原性,但不具备免疫原性,这是因为根据小分子半抗原与大分子载体偶联,即人工抗原[17]。小分子物质的免疫分析研究的关键在于合成出高质量的人工抗原。BSA和OVA由于具有稳定的理化性质、良好的溶解性以及具有较多容易修饰的官能团,而被普遍认为是比较合适的人工抗原载体蛋白,同时,人工抗原合成之后,对其进行相应的鉴定是十分必要的,本实验中对人工抗原的鉴定主要目的在于判断抗原是否偶联成功、偶联率的计算以及人工抗原的纯度鉴定。通过红外吸收光谱法、紫外吸收光谱法、SDS-PAGE凝胶电泳对合成的人工抗原进行综合鉴定,表明对CBA作为链接臂的RAC人工抗原合成成功。同时,以对CBA为间接臂合成的RAC-BSA人工抗原其偶联比与常用的以戊二酸酐连接的人工抗原偶联比接近,且符合Schneider等[18]提出的有关人工免疫原最适宜偶联比应在10:1~20:1之间的要求,故可用于全抗原的合成。
根据有关包被抗原对ELISA检测灵敏度影响的相关报道[19],以对CBA为链接臂合成的RAC-OVA的偶联比也较为适宜。同时,由于CBA和戊二酸酐在合成人工抗原时结合位点相同,而其结构和长度并不相同,两者对比,能直观地反映人工抗原链接臂在ELISA检测灵敏度中的影响。Kim等[10]的报道中提到,改变包被抗原链接臂能在一定程度上减少连接臂对ELISA检测灵敏度的干扰,实验结果表明,在以RAC-SA-BSA为免疫原的体系中,包被抗原RAC-CBA-OVA的亲和力低于RAC-SAOVA,却拥有更高的灵敏度,这是由于包被抗原与免疫抗原所采用的链接臂不同,减少了对抗体中链接臂部分识别的干扰,故对提高ELISA检测灵敏性有积极作用。
[1] SHELVER W L, SIMINTH D J, BERRY E S. Production and characterization of a monoclonal antibody against the β-adrenergic agonist ractopamine[J]. Journal of Agricultural and Food Chemistry, 2000, 48: 4020-4026.
[2] GABIOLA C, CALONGE M A G, PORTILLO M P, et al. Validation of a method for the determination of salbutamol in animal urine by gas chromatography-mass spectrometry and its application to treated lamb samples[J]. J Microcolumn Separations, 1996, 8: 361-364.
[3] VANOOSTHUYZE K E I, ARTS C J M, PETEGHEM C H V. Development of a fast and simple method for determination of β-agonists in urine by extraction on empore membranes and detection by a test strip immunoassay[J]. Journal of Agricultural and Food Chemistry, 1997, 45: 3129-3137.
[4] SHELVER W L, SMITH D J. Determination of ractopamine in cattle and sheep urine samples using an optical biosensor analysis:comparative study with HPLC and ELISA[J]. Journal of Agricultural and Food Chemistry, 2003, 51: 3751-3721.
[5] SHEN S H, OYANG J, BAEYENS W R G, et al. Determination of β-agonists by ion chromatography with direct conductivity detection[J]. J Pharmaceutical and Biomedical Analysis, 2005, 38: 166-172.
[6] REGUEIRO J A G, PEREZ B, CASADMONT G. Determination of clenbuterol and salbutamol in urine by capillary gas chromatography with capillary columns of 100 μm[J]. J Chromatogr A, 1993, 655: 73-76.
[7] POLETTINIA A, MONTAGNA M, HOGENDOORN E A, et al. Applica-bility of coupled-column liquid chromatography to the analysis of β-agonists in urine by direct sample injection 1. Development of a single-residue reversed-phase liquid chromatography-UV method for clenbuterol and selection of chromatographic conditions suitable for multi-residue analysis[J]. J Chromatogr A, 1995, 695: 19-31.
[8] JOSEFSSON M, SABANOVIC A. Sample preparation on polymeric solid phase extraction sorbents for liquid chromatographic-tandem mass spectrometric analysis of human whole blood: a study on a number of beta-agonists and beta-antagonists[J]. J Chromatogr A, 2006, 1120: 1-12.
[9] SPYRIDAKI M H, VONAPARTI P K A, VALAVIANI P, et al. Doping control analysis in human urine by liquid chromatographyelectrospray ionization ion trap mass spectrometry for the Olympic Games Athens 2004: determination of corticosteroids and quantif i cation of ephedrines, salbutamol and morphine[J]. Anal Chim Acta, 2006, 573: 242-249.
[10] KIM Y J, CHO Y A, LEE H S, et al. Investigation of the effect of hapten heterology on immunoassay sensitivity and development of an enzyme-linked immunosorbent assay for the organophosphorus insecticide fenthion[J]. Analytica Chimica Acta, 2003, 494(1/2): 29-40.
[11] WRIGHT A, TAO M H, KABAT E A, et al. Antibody variable region glycosylation: position effects on antigen binding and carbohydrate structure[J]. EMBO J, 1991, 10(10): 2717-2723.
[12] TIJSSEN P. Practice and theory of enzyme immunoassays[M]. New York: Elsevier Amsterdam, 1985: 27.
[13] SAMBROOK J, RUSSELL D W. Molecular cloning: a laboratory manul[M]. 3rd ed. New York: Cold Spring Harbor Laboratory Press, 2002.
[14] 陈奎治, 彭亦如, 林伟, 等. 光谱分析法研究八羧酸酞菁铝配合物与牛血清白蛋白的结合作用[J]. 光谱学与光谱分析, 2007, 27(9): 84.
[15] ZHANG Q, WANG L, AHN K C, et al. Hapten heterology for a specific and sensitive indirect enzyme-linked immunosorbent assay for organophosphorus insecticide fenthion[J]. Analytica Chimica Acta, 2007, 596(2): 303-311.
[16] BUTLER J E. Enzyme-linked immunosorbent assay[J]. Journal of Immunoassay, 2000, 21(2): 165-209.
[17] LANDSTEINER K. The specificity of serological reactions[M]. Boston: Harvard University Press, 1945: 78-86.
[18] SCHNEIDER P, HAMMOCK B D. Influence of the ELISA format and the hapten-enzyme conjugate on the sensitivity of an immunoassay for S-triazine herbicides using monoclonal antibodies[J]. Agric Food Chem, 1992, 40(3): 525-530.
[19] 罗舜菁, 钟寒燕, 刘成梅, 等. 氯霉素免疫抗原及包被抗原的制备[J].食品科学, 2010, 31(10): 91-94.
Synthesis and Characterization of Ractopamine Antigen Linked by 4-Methylbenzoic Acid
CHEN Chen1,LUO Shun-jing1,*,LIU Cheng-mei1,ZOU Chang-chun2,WANG Zhi-yu1,WANG Wen-fei1
(1. State Key Laboratory of Food Science and Technolog, Nanchang University, Nanchang 330047, China;2. Asset Management Department, Nanchang University, Nanchang 330031, China)
The mixed anhydride method was used to prepare artif i cial antigen through the conjugation between ractopamine (RAC) and bovine serum albumin (BSA) in the presence of 4-chloromethyl benzoic acid (CBA). The prepared artif i cial antigen was identif i ed by IR, UV and SDS-PAGE. RAC-CBA was also conjugated with OVA to form a coating antigen. The aff i nity and inhibitory activity of the coating antigen were measured. This study suggests that CBA can be used to prepare artif i cial RAC antigens. Meanwhile, CBA conjugated with RAC to form coating agent improves the sensitivity of ELISA.
ractopamine;4-chloromethyl benzoic acid;ELISA sensitivity;artif i cial antigens
S859.84
A
1002-6630(2013)01-0180-05
2011-10-07
江西省科技支撑计划项目(2010BNA09500)
陈臣(1982ü),男,硕士,研究方向为营养与食品卫生。E-mail:jordan0297@vip.sina.com
*通信作者:罗顺菁(1969ü),女,副教授,硕士,研究方向为食品安全。E-mail:luoshunjing@yahoo.com.cn



