王文婷,邬应龙
(四川农业大学食品学院,四川 雅安 625014)
魔芋葡甘聚糖(konjac glucomannan,KGM)是一种优良的天然高分子化合物,属于理想的膳食纤维。已有研究表明KGM对人体能起到一定的保健作用[1],它具有减肥、降低餐后血糖水平、降低血胆固醇含量及调节脂质代谢等生理功能[2-5]。但对氧化魔芋葡甘聚糖(OKGM)的研究大量集中于其加工方法及相关理化性质如流变性、胶凝性等[6-7],最近有报道表明其具有一定的免疫功能[8],而OKGM对机体肠道微环境影响的相关研究鲜见报道。十二指肠为小肠第一段,消化吸收能力较强,本实验以此为代表,通过检测饲喂添加不同剂量OKGM的高脂饲料的C57BL/6J小鼠的十二指肠形态考察OKGM对高脂饮食小鼠的小肠功能的影响,并通过16S rDNA的变性梯度凝胶电泳(DGGE)技术研究OKGM对高脂饮食小鼠肠道菌群的影响,从而为探索OKGM的生理功能并将其应用于功能性食品的开发提供实验依据。
1 材料与方法
1.1 材料与试剂
E.Z.N.A®Stool DNA Kit 美国Omega公司;Tris美国Sigma公司;甲叉双丙烯酰胺、丙烯酰胺、去离子甲酰胺、尿素(分析纯) 美国Amresco公司;OKGM 四川农业大学食品学院功能性食品实验室自制,将KGM经H2O2氧化降解而得到[9]。
1.2 仪器与设备
WH-866涡旋混合器 江苏太仓华美生化仪器厂;5415D高速离心机 德国Eppendorf公司;Bio-Rad PCR仪、Bio-Rad DGGE系统 美国Bio-Rad公司;DYY-8C型电泳仪 北京六一仪器厂。
1.3 方法
1.3.1 动物分组与管理
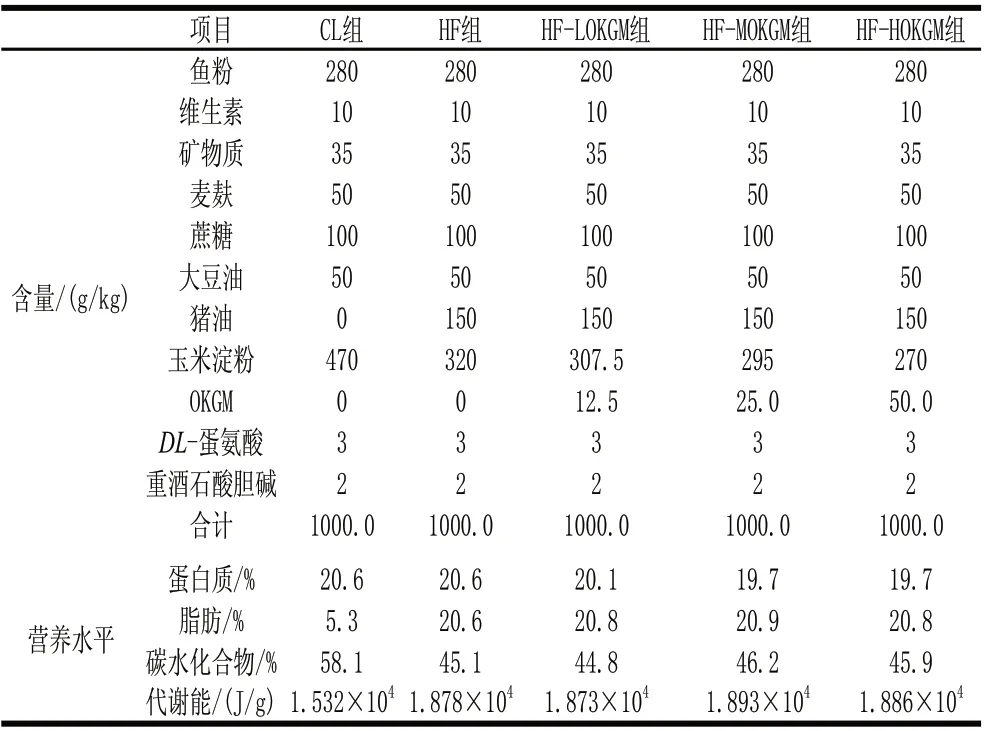
表 1 饲料组成及营养水平Table 1 Diet composition and nutrition levels
健康雄性C57BL/6J小鼠,购自四川大学实验动物中心,饲喂基础饲料1周后,选择60只体质量为(21±2)g的小鼠随机分成5组:高脂对照组(HF组)、基础对照组(CL组)、添加低剂量(12.5g/kg)OKGM高脂饲料组(HF-LOKGM组)、添加中剂量(25.0g/kg)OKGM高脂饲料组(HF-MOKGM组)及添加高剂量(50.0g/kg)OKGM高脂饲料组(HF-HOKGM组),每组12只,每笼2只。小鼠自由采食、饮水,10h:14h昼暗交替,饲养12周。各组小鼠饲料组成及营养水平见表1[10-12]。
1.3.2 粪样及十二指肠的采集
第12周末,取小鼠新鲜粪便,迅速装入灭菌1.5mL离心管中,于-20℃保存,备用。小鼠只供给饮水,禁食12h后处死,然后迅速取出小鼠肠组织,于各组小鼠十二指肠部位取长约1~2cm肠段,用甲醛缓冲液固定。
1.3.3 肠绒毛的检测
将固定的小鼠十二指肠进行HE染色,采集图像并测量肠绒毛高度与隐窝深度。
1.3.4 肠道微生物DNA的提取
采用美国Omega公司的E.Z.N.A®Stool DNA Kit试剂盒提取,提取的DNA于-20℃保存,备用。
1.3.5 肠道微生物16S rDNA的V3区PCR扩增
选取16S rDNA通用引物[13]:上游引物为5’-CGC C C G G G G C G C G C C C C G G G C G G G G C G G G G G C A CG G G G G G A C T C C T A C G G G A G G C A G C A G T-3’,携带GC夹板;下游引物为5’-GTATTACCGCGGCTGCTGGCAC-3’。采用25μL PCR反应体系:ddH2O 10.5μL、2×mix 12.5μL、上游引物和下游引物各0.5μL、DNA模板1μL。PCR扩增程序为:95℃预变性5min;94℃变性30s,56℃退火30s,72℃延伸1min,35个循环;72℃延伸7min。产物用2%琼脂糖凝胶电泳检测,用Bio-Rad凝胶成像系统拍照。
1.3.6 变性梯度凝胶电泳(DGGE)分析
采用Bio-Rad Dcode系统进行DGGE。DGGE条件参考文献[14]稍作改动:凝胶梯度为35%~65%,使用1×TAE缓冲液,60℃、200V预电泳10min,100V固定电压电泳16h。采用硝酸银染色[15]并拍照。
1.3.7 数据及图像处理
数据采用SPSS16.0统计软件进行分析。DGGE指纹图谱通过Quantity One 4.6.2软件,采用UPGMA进行相似性聚类分析,多样性指数用Shannon-Weiner指数(H’)表示,按照如下公式计算[16]:
H’=-∑PilnPi
式中:Pi=ni/H,ni为某一条带的峰高,H为泳道密度曲线所有的峰高的总和。
2 结果与分析
2.1 OKGM对高脂饮食C57BL/6J小鼠肠绒毛形态的影响
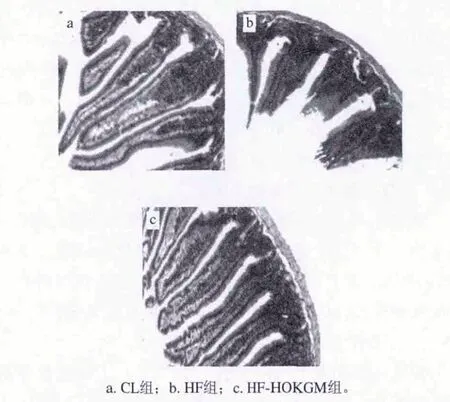
图 1 C57BL/6J小鼠十二指肠形态观察(HE染色,×100)Fig.1 Duodenal morphology of C57BL/6J mice (HE staining, × 100)
由图1可知,CL组小鼠十二指肠绒毛较长且完整,HF组小鼠肠绒毛脱落严重,而HF-HOKGM组肠绒毛较CL组短,但比HF组长且相对完整。
表 2 C57BL/6J小鼠十二指肠黏膜结构的变化(±s,n =12)Table 2 Structure changes of the duodenum mucosa of C57BL/6J mice(±s,n =12)
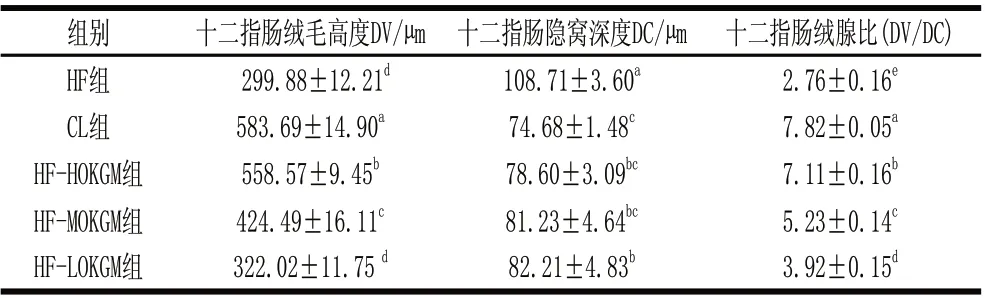
表 2 C57BL/6J小鼠十二指肠黏膜结构的变化(±s,n =12)Table 2 Structure changes of the duodenum mucosa of C57BL/6J mice(±s,n =12)
注:同列数据肩标不同小写字母表示有显着差异(P <0.05)。
组别 十二指肠绒毛高度DV/μm 十二指肠隐窝深度DC/μm 十二指肠绒腺比(DV/DC)HF组 299.88±12.21d 108.71±3.60a 2.76±0.16e CL组 583.69±14.90a 74.68±1.48c 7.82±0.05a HF-HOKGM组 558.57±9.45b 78.60±3.09bc 7.11±0.16b HF-MOKGM组 424.49±16.11c 81.23±4.64bc 5.23±0.14c HF-LOKGM组 322.02±11.75 d 82.21±4.83b 3.92±0.15d
由表2可见,CL组十二指肠绒毛高度显着大于其他组(P<0.05),HF组与HF-LOKGM组间无显着差异(P>0.05),而HF-LOKGM组、HF-MOKGM组和HF-HOKGM组3组间均差异显着(P<0.05);HF组十二指肠隐窝深度显着大于其他组(P<0.05),CL组、HF-HOKGM组和HF-MOKGM组3组间不存在显着差异(P>0.05);CL组绒腺比显着大于其他组(P<0.05),HF组显着小于其他组(P<0.05),而H F-H O K G M 组、H F-M O K G M 组 与H F-L O K G M 组 间 均 存在显着差异(P<0.05),呈现剂量效应。
2.2 OKGM对高脂饮食C57BL/6J小鼠肠道菌群的影响
2.2.1 C57BL/6J小鼠肠道菌群16S rDNA的V3区PCR扩增结果
以提取的微生物DNA为模板,进行PCR扩增,产物通过2%琼脂糖凝胶检测后发现,均能得到约200bp的目的产物,且条带清晰明亮,满足DGGE分析的要求,如图2所示。
图 2 C57BL/6J小鼠肠道菌群16S rDNA V3区扩增结果Fig.2 Amplification results of 16S rDNA V3 region from intestinal flora of C57BL/6J mice
2.2.2 C57BL/6J小鼠肠道菌群PCR-DGGE指纹图谱的建立与分析
C57BL/6J小鼠肠道菌群16S rDNA V3区片段的DGGE图谱的建立及其聚类分析和相似系数见图3、4和表3。

图 3 C57BL/6J小鼠肠道菌群16S rDNA扩增产物的DGGE图谱Fig.3 DGGE profile of 16S rDNA amplification products from intestinal flora of C57BL/6J mice
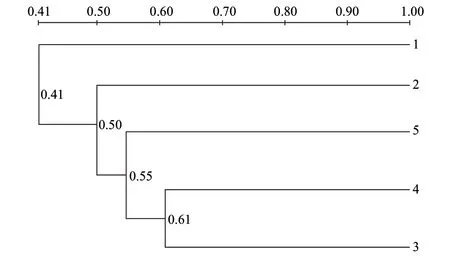
图 4 C57BL/6J小鼠肠道菌群的PCR-DGGE图谱的聚类分析Fig.4 Cluster analysis of the PCR-DGGE profile of intestinal flora in C57BL/6J mice
由图4可知,HF-HOKGM组与HF-MOKGM组相似度最高,被聚为一类,HF组与其他组相似度最低,不与其他组聚为一类。
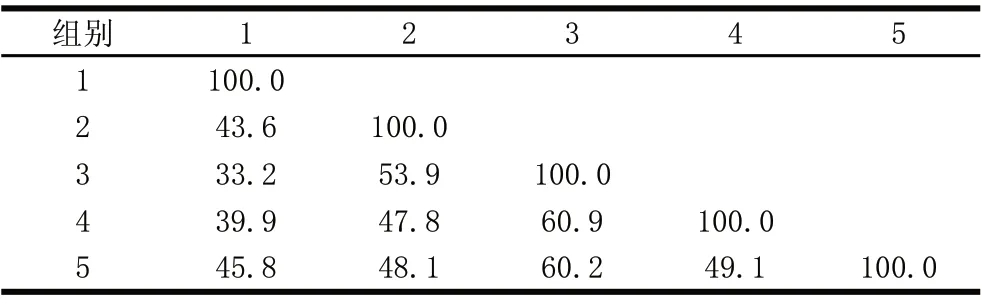
表 3 C57BL/6J小鼠肠道菌群的PCR-DGGE图谱的相似系数(q)Table 3 Similarity coefficients of the PCR-DGGE profile of intestinal flora in C57BL/6J mice
[17]知当0<q<25.0时,极不相似;当25.0≤q<50.0时,中等不相似;当50.0≤q<75.0时,中等相似;当75.0≤q<100.0时,极相似。由表3可知,CL组与HF-HOKGM组相似系数为53.9,属于中等相似,与HF组相似系数最小,为43.6,属于中等不相似,但与HFMOKGM组、HF-LOKGM组也属于中等不相似。这说明OKGM能改善高脂饮食C57BL/6J小鼠的肠道菌群构成,使其更相似于摄入基础饲料的对照组,而改善程度与OKGM添加量相关。
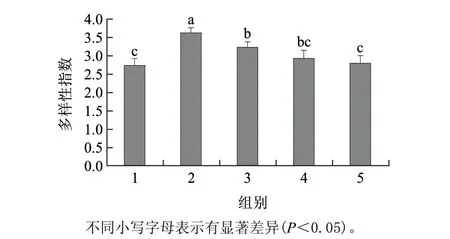
图 5 C57BL/6J小鼠肠道菌群的多样性指数Fig.5 Shannon diversity index of the PCR-DGGE profile of intestinal flora in C57BL/6J mice
由图5可见,CL组小鼠肠道菌群的多样性指数显着大于其他组,HF-LOKGM组、HF-MOKGM组与HF组的多样性指数无显着差异,但HF-HOKGM组的多样新指数显着大于HF组,说明适量OKGM能改善高脂饮食小鼠肠道菌群的多样性,维持菌群平衡。
3 讨 论
小肠的绒毛高度、隐窝深度等都是反应小肠消化吸收功能的重要指标,能够反映肠道的健康水平。绒毛高度增加可以使小肠吸收面积增大,利于营养物质的吸收。隐窝深度的减小说明绒毛上皮成熟细胞率上升,分泌功能增强。营养生理学的研究指出绒毛高度与隐窝深度的比值(绒腺比)表明小肠上皮细胞更新代谢程度,能够综合反映小肠的功能状况,有相关报道[18]也得到同样结论。本实验研究表明,与基础饲料对照组相比,高脂饮食C57BL/6J小鼠十二指肠绒毛高度、隐窝深度、绒腺比变化显着,损伤明显。而适量的OKGM能够使高脂饮食小鼠的肠绒毛高度增大,隐窝深度减小,绒腺比增大,减弱了肠黏膜的损伤。这可能由于高脂摄入引起小鼠小肠细胞脂质过氧化,导致了肠黏膜上皮细胞数量减少、绒毛变短脱落,而OKGM有较大的黏度,能覆盖在肠黏膜表面形成保护屏障[19]。
传统培养法仅能培养出少量肠道微生物,不能准确反映菌群的多样性。而变性梯度凝胶电泳(DGGE) 技术具有快速、可靠等优点,采用细菌通用引物扩增菌群总DNA的16S rDNA V3高变区,通过分析其核酸序列多样性而获知菌群多样性情况,与传统培养法相比能获得更丰富的菌群信息。近些年,聚合酶链式反应-变形梯度凝胶电泳(PCR-DGGE)技术也逐渐应用于食品中微生物的检测[20-21]。本实验通过PCR-DGGE技术研究OKGM对高脂饮食C57BL/6J小鼠肠道菌群的影响,结果表明高脂饮食会改变小鼠的肠道菌群,高脂对照组与基础对照组小鼠的肠道菌群为中等不相似,但饲喂了添加适量OKGM高脂饲料的小鼠的肠道菌群更相似于基础对照组;此外,高脂对照组小鼠的肠道菌群多样性指数显着小于基础对照组,而菌群多样性指数是反映菌群平衡的重要指标,通常该数值越大,菌群平衡就越难被破坏[22],这说明高脂饮食小鼠的菌群平衡可能更易被破坏,而与高脂对照组相比,OKGM高脂饲料组小鼠的肠道菌群多样性指数有所增大,尤其高剂量OKGM高脂饲料组与高脂对照组相比,差异显着。这可能是因为脂类代谢产生的副产物如硫化氢等破坏菌群赖以生存的微环境,使对机体有益的菌群的整体种类或个体数量减少而有害的菌群则相应增加[23-24],而OKGM可以作为一种外源性益生元增加有益菌的数量,同时它在降解成寡糖后又在不提供有害菌生长必需营养素的前提下与有害菌竞争性结合使得有害菌死亡[25]。
综上可见,OKGM能够减弱高脂饮食引起的小鼠肠黏膜损伤,起到保护小肠绒毛形态的作用,同时它还能够改善高脂饮食小鼠的肠道菌群,维持肠道菌群的多样性。OKGM在功能性食品开发领域中值得进一步研究。
参考文献:
[1] VUKSAN V, SIEVENPIPER J L, OWEN R, et al. Beneficial effects of viseous dietary fiber from konjac-mannan in subjects with the insulin resistances syndrome[J]. Diabetes Care, 2000, 23(l): 9-14.
[2] SOOD N, BAKER W L, COLEMAN C I. Effect of glucomannan on plasma lipid and glucose concentrations, body weight, and blood pressure: systematic review and meta-analysis [J]. Am J Clin N, 2008,88: 1167-1175.
[3] 姜靖, 钟进义, 林建维, 等. 魔芋多糖对小鼠胃肠组织胃动素与生长抑素的影响[J]. 营养学报, 2009, 31(5): 475-477.
[4] 林建维. 魔芋多糖对高脂饮食小鼠的降脂降糖作用与机理研究[D].青岛: 青岛大学, 2009: 16-21.
[5] VUSKEN V, JENKINS D J, SPADAFOR P, et al. Konjacmannan(glucomannan) improves glycemia and other associated risk factors for coronary heart disease in type 2 diabetes. A randomized controlled metabolic trial[J]. Diabetes Care, 1999, 22(6): 913-919.[6] 吴波, 陈运中, 徐凯, 等. 魔芋葡甘聚糖的氧化改性及其性质研究[J].粮油深加工及食品, 2008(5): 15-16.
[7] 庞杰, 李斌, 谢笔钧, 等. 氧化魔芋葡甘聚糖的结构研究[J]. 结构化学, 2004, 23(8): 912-917.
[8] 赵勤, 邬应龙. 氧化魔芋葡甘露聚糖对小鼠免疫功能影响的研究[J].营养学报, 2011, 33(5): 492-501.
[9] 叶凌, 邬应龙. 响应面法对漂白魔芋微粉制备工艺的优化研究[J].食品科学, 2008, 29(6): 151-155.
[10] RONALD L, RIOR P, WU Xianli, et al. Whole berries versus berry anthocyanins: interactions with dietary fat levels in the C57BL/6J mouse model of obesity[J]. J Agric Food Chem, 2008, 56(3): 647-653.
[11] YONGPIL H, JAEHO C, EUNHEE H, et al. Purple sweet potato anthocyanins attenuate hepatic lipid accumulation through activating adenosine monophosphate. activated protein kinase in human HepG2 cells and obese mice[J]. Nutrition Research, 2011, 31: 896-906.
[12] HYUN-SEUK M, HONG-GU L, JI-HYE S, et al. Antiobesity effect of PEGylated conjugated linoleic acid on high-fat diet-induced obese C57BL/6J (ob/ob) mice: attenuation of insulin resistance and enhancement of antioxidant defenses[J]. Journal of Nutritional Biochemistry, 2009, 20: 187-194.
[13] SERINO M, LUCHE E, GRES S, et al. Metabolic adaptation to a high-fat diet is associated with a change in the gut microbiota[J]. Gut,2011, 22: 1-11.
[14] MUYZER G, de WAAL E C, UITTERLINDEN A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Applied and Environmental Microbiology,1993, 59(3): 695-700.
[15] ORSOUW N J, LI D, VIJG J. Denaturing gradient gel electrophoresis(DGGE) increases resolution and informativity of Alu-directed interrepeat PCR[J]. Molecular and Cellular Probes, 1997, 11(2): 95-101.
[16] VANCE J M, JOYCE M S, RODERICK I M, et al. Molecular ecological analysis of dietary and antibiotic-induced alterations of the mouse intestinal microbiota[J]. Journal of Nutrition, 2001, 131(6): 1862-1870.
[17] PANGLOLI P, HUNG Y C, BEUCHAT L R, et al. Reduction of Escherichia coli O157:H7 on produce by use of electrolyzed water under simulated food service operation conditions[J]. Journal of Food Protection, 2009, 72(9): 1854-1861.
[18] MONGKOL S, KOHEN Y. Histological alterations of intestinal villi in chickens fed dried Bacillus subtilis var. matto[J]. Comparative Biochemistry and Physiology, 2002, 133(1): 95-104.
[19] 华朱鸣, 韩剑众, 曲道峰. 不同来源寡糖和小肽对饲喂高脂日粮小鼠小肠绒毛形态的影响[J]. 中国畜牧兽医, 2012, 39(9): 123-126.
[20] 丁文, 汪先丁, 高鹏, 等. 热处理辣椒酱贮藏过程中残留微生物分析[J]. 食品科学, 2012, 33(3): 146-150.
[21] 蓝蔚青,谢晶. PCR-DGGE指纹技术研究复合保鲜剂对冷藏带鱼贮藏期间微生物变化的影响[J]. 食品科学, 2012, 33(14): 255-260.
[22] 王新峰, 冷青文, 李志远, 等. 低聚糖对断奶羔羊瘤胃菌群的影响[J].动物营养学报, 2010, 22(5): 1396-1401.
[23] 任婷婷, 卢放根, 张尤历, 等. 高脂饮食对SD大鼠肠道菌群的影响[J]. 世界华人消化杂志, 2010, 18(25): 2694-2697.
[24] MATIAS S A R, GERARDO M N, MARK G M, et al. DNA damage and toxicogenomic analyses of hydrogen sulfide in human intestinal epithelial FHs 74 Int cells[J]. Environmental and Molecular Mutagenesis, 2010, 51(4): 304-314.
[25] 高启禹, 徐光翠, 李小英, 等. 寡糖对SPF大鼠生长性能及肠道菌群的影响[J]. 动物保健品, 2009(10): 96-97.



