侯晓荣,米红波,茅林春*
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
解冻方式对中国对虾物理性质和化学性质的影响
侯晓荣,米红波,茅林春*
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
比较了冷藏解冻、静水解冻、室温解冻、超声波解冻、微波解冻5种不同解冻方式对中国对虾物理和化学特性的影响,分析了中国对虾物理和化学特性之间的相关性。结果表明:解冻对虾肉色泽具有显着性变化,冷藏解冻后的对虾肌肉解冻损失率、蒸煮损失率、硫代巴比妥酸值还原值和羰基含量最低,Ca2+-ATP酶活性最高,为最适合中国对虾的解冻方法。中国对虾的化学性质和物理性质之间具有显着的相关性。
中国对虾;解冻方式;物理性质和化学特性;品质
冷冻作为肉制品和水产品方便有效贮藏方式,已经得到广泛的应用。但是在解冻的过程中,产品的感官及营养价值会受到严重的影响[1-2]。不恰当的解冻方式会造成产品的汁液流失、保水性下降、脂肪氧化、风味物质和蛋白质损伤等,从而严重影响产品的品质[3]。Chandirasekaran等[4]发现室温解冻与静水解冻很大程度上降低了牛肉的品质。采用冷藏解冻对猪肉品质的损害最低,且其物理化学性质与新鲜肉最接近,微波解冻大大增加了猪肉的解冻损失率、蒸煮损失率,同时提高了羰基含量和硫代巴比妥酸还原值(thiobarbituric acid reactive substances,TBARS)[5]。
中国对虾(Fenneropenaeus chinensis),又称东方对虾,属节肢动物门、甲壳纲、十足目、对虾科、对虾属,与墨西哥棕虾、圭亚那白虾齐名,并称世界三大名虾,是我国分布最广的对虾类。中国对虾因其营养丰富,滋味鲜美,且具保健功能,是我国重要的出口水产品[6-8]。本实验比较了冷藏解冻、静水解冻、室温解冻、超声波解冻、微波解冻5种不同解冻方式对中国对虾物理性质和化学性质的影响,以确定一种适合中国对虾的解冻方式。
1 材料与方法
1.1 材料与试剂
鲜活中国对虾购于中国杭州市农贸市场,对虾的平均体长为11.5~12.0 cm。
2-硫代巴比妥酸、盐酸胍 哈尔滨市万太生物药品公司;三氯乙酸 天津市津东精细化学试剂厂;2,4-二硝基苯肼 美国Sigma公司。
1.2 仪器与设备
SPSIC WSC-S型测色色差计 上海精 密科学仪器有限公司;BR4i型多功能冷冻离心机 法国Thermo Jouan公司;BL310、BS210S电子天平 北京赛多利斯技术有限公司;FSH-2AFS-2可调分散器(匀浆机) 金坛市梅香仪器有限公司;KQ5200E超声波清洗机 上海书培实验设备有限公司; G80F23EN2P-F6型微波炉中国格兰仕集团。
1.3 方法
1.3.1 解冻方法
将鲜活对虾,去头、去壳、去肠线,清洗干净,用滤纸吸干对虾表面的水分。去壳后虾仁的平均质量为(7.35±0.02)g,10只一组,装入聚乙烯自封袋(6 cm×4 cm)中,采用-35 ℃速冻,至虾的中心温度达到-18 ℃,然后放在在-22 ℃的冰箱中贮藏48 h。
1.3.1.1 冷藏解冻
取出5袋对虾放入4 ℃冰箱中解冻至虾肉中心温度为4 ℃。
1.3.1.2 静水解冻
取出5袋对虾浸没在800 mL的水中,初始水温为10 ℃, 控制水温(10±0.5) ℃,当虾肉中心温度为4 ℃时为解冻终点。
1.3.1.3 室温解冻
取出5袋对虾放在塑料托盘上,置于周围无热源的试验台上进行解冻,室内空气温度为14~18 ℃,虾肉中心温度达到4 ℃时,解冻结束。
1.3.1.4 超声波解冻
取出5袋对虾置于超声波清洗器中,浸没于600 mL的水中,水的温度10~12 ℃,电功率200 W,工作频率40 kHz,当虾肉中心温度达到4 ℃时,解冻结束。
1.3.1.5 微波解冻
取出5袋对虾置于微波炉中,功率为800 W,工作频率为2 450 MHz,虾肉中心温度达到4 ℃时即为解冻终点。
1.3.2 检测方法
1.3.2.1 解冻损失率
精确称量冻结前及解冻后虾肉的质量,按式(1)计算解冻损失率。

式中:m1为冻结前样品质量/g;m2为解冻后样品质量/g。
1.3.2.2 蒸煮损失率
精确称量5 g样品置于50 mL离心管中,放入沸水中蒸煮10 min后取出,室温冷却后吸干表面水分,称质量。按式(2)计算蒸煮损失率。
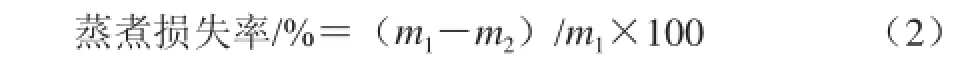
式中:m1为蒸煮前样品质量/g;m2为蒸煮后质量/g。
1.3.2.3 色泽
采用色差计室温条件下测定对虾的L*(明度)、a*(红色度)、b*(黄色度)值。每个处理测定3个样品,每个样品按一个方向旋转3次,测定3次。
1.3.2.4 TBARS的测定
虾肉TBARS的测定参照Sinnhuber等[9]方法,并作适当修改。准确称取0.3 g样品放入试管中,加入3 mL 0.67%硫代巴比妥酸溶液、17 mL 10%三氯乙酸溶液,混匀后沸水浴反应30 min,冷却。取5 mL冷却后样品加入等体积的氯仿,3 000 r/min离心10 min,取上清液4 mL加入等体积的石油醚,3 000 r/min离心10 min,取下层清液在532 nm波长处读取吸光度。TBARS值以每千克脂质氧化样品溶液中丙二醛的质量(mg)表示。
1.3.2.5 羰基含量
羰基含量的测定参照Oliver等[10]的方法并略加改动,方法如下:取1 mL 2 mg/mL的蛋白溶液放入50 mL离心管,每管中加入1 mL 10 mmol/L 2,4-二硝基苯肼,室温条件下静止1 h,每15 min旋涡振荡一次,加入1 mL 20%三氯乙酸后10 000 r/min离心5 min,弃清液,用1 mL乙酸乙酯-乙醇(体积比1∶1)洗沉淀3次除去没反应的试剂,加3 mL 6 mol/L盐酸胍溶液在37 ℃条件下保温15 min溶解沉淀,10 000 r/min离心3 min除去不溶物质,最后溶液在370 nm波长处测定吸光度。使用摩尔吸光系数22 000 L/(mol·mg)计算羰基含量,羰基含量表示为nmol/mg pro。蛋白质含量的测定采用双缩脲方法[11]。
1.3.3 Ca2+-ATP酶活性
Ca2+-ATP酶活性的测定采用南京建成生物工程提供的试剂盒进行测定。
1.4 统计分析
2 结果与分析
2.1 解冻损失率和蒸煮损失率

表1 不同解冻方式对虾肉解冻损失率和蒸煮损失率的影响Table 1 Influence of thawing methods on the thawing loss and cooking loss of Chinese shrimp
解冻损失率和蒸煮损失率是衡量虾肉蛋白保水性的重要指标[12],不同的解冻方式对虾肉的解冻损失率与蒸煮损失率的影响见表1。冷藏解冻的解冻损失率和蒸煮损失率最低,分别是1.86%和17.40%。室温解冻、冷藏解冻与超声波解冻在解冻损失率上没有显着性的差异(P>0.05)。微波解冻后虾肉的解冻损失率和蒸煮损失率最高,分别达到了5.07%和22.85%。与新鲜样品相比,对虾经过静水解冻、室温解冻、冷藏解冻、超声波解冻和微波解冻后蒸煮损失率显着增加(P<0.05),分别增加了32.87%、27.42%、26.55%、50.55%、66.18%。
虾肉在冷冻过程中形成冰晶,肌肉组织受到不同程度的挤压而发生变形,肌原纤维失水收缩,保持原有水分的能力下降[13]。冻结产品解冻时,内部冰晶融化成水,如果不能回复到原细胞中去,这些水分就变成汁液流出来,其中还含有氨基酸、盐类、维生素类等水溶性成分,汁液渗透导致产品的商品价值下降,同时渗出的汁液也将成为细菌优质的培养基。解冻过程肌肉蛋白发生变性,这些变性蛋白在蒸煮过程中更易发生聚集和热变性,使其保持水分的能力降低,蒸煮损失的增加[3]。微波解冻产生较高的解冻损失率和蒸煮损失率,可能是由于微波解冻时的温度较高,加剧了蛋白聚集和变形的程度,这种结果与之前的研究报道[4-5]一致。
2.2 色泽
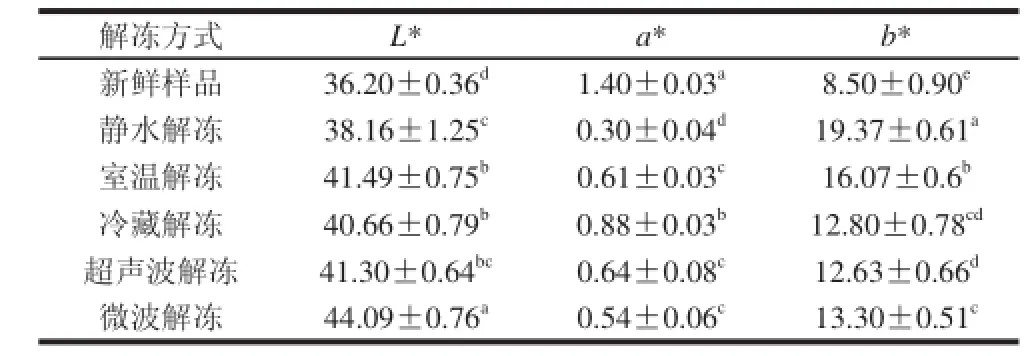
表2 不同解冻方式对虾肉色泽的影响Table 2 Influence of thawing methods on the color of Chinese shrimp
如表2所示,对虾经过解冻后L*值和b*值显着增加,a*值显着降低(P<0.05)。实验过程中发现中国对虾在解冻过程中出现成熟情况,这可能是由于水的热传导率为0.56 W/(m·K),而冰的热传导率为2.24 W/(m·K),热传导率的差异,使得冰的传热能力大大低于水,从而导致了解冻速率的不同,另一方面,在一般冻结食品中,并非所有的水都形成冰,仍约有5%~10%的水以液体状态存在,食品解冻时的溶质重新分布,使得这部分水以较高的浓度存在,对微波的吸收能力也较强,从而导致了解冻不均一和局部过热的问题[14]。
虾肉颜色是衡量对虾物理品质的重要指标,也是影响消费者购买力的最重要因素。在冷冻贮藏过程中,虾肉颜色会随着一系列的化学反应而发生变化,例如脂肪氧化和色素降解等[15]。研究发现蛋白变性和脂肪氧化引起冻藏的黑鲈鱼的L*值和b*值增加[16]。Tironi等[17]认为氧化反应程度和a*值的变化密切相关,随着冻藏时间的延长,大马哈鱼的a*值逐渐降低,而迷迭香的添加降低的肌肉氧化程度,使a*值变化缓慢。乌贼肉糜中脂肪氧化加速黄色 物质的形成[18]。在贮藏过程中肌肉发生的色素降解反应以及褐变反应而导致颜色快速变化是因为高铁肌红蛋白在肉的表面积累的结果[19]。
2.3 蛋白质和脂肪氧化

图1 不同解冻方式对虾肉羰基含量和TBARS值的影响Fig.1 Influence of different thawing methods on TBARS and carbonyl content in Chinese shrimp
羰基含量和TBARS值是蛋白质和脂肪氧化的重要评价指标[5]。由图1可以看出,对虾经过解冻后TBARS值显着性增加(P<0.05)。其中,冷藏解冻与 静水解冻后TBARS值增加较少,与新鲜样品相比分别增加了14.04%和16.72%,超声波解冻与微波解冻后的TBARS值增加较多,分别为1.12 mg/kg和1.22 mg/kg,与新鲜样品相比分别增加了82.5%和98.3%。对虾经过冷藏解冻后,羰基含量没有显着变化(P>0.05),而经过其他4种方式解冻后羰基含量显着性的增加(P<0.05),其中羰基含量增加最多的是微波解冻,其次是超声波解冻、室温解冻和静水解冻。超声波解冻和微波解冻后虾肉的TBARS值和羰基含量较高,主要的原因是由于解冻过程中温度较高[5]。
蛋白质和脂肪的氧化会导致蛋白质的功能下降,如蛋白质的保水性和凝胶强度。在冻藏中脂肪氧化和蛋白氧化密不可分,脂肪氧化的初级产物过氧化氢和次级产物丙二醛都能与肌肉中的蛋白反应,形成复合物,所以蛋白质氧化随着脂肪氧化的发生而发生[20-21]。此外,冷冻-解冻过程也会使抑制脂肪氧化的抗氧化酶类发生变性,活性丧失,进而发生脂肪的氧化。冻藏过程中形成的冰晶破坏了细胞,释放出脂肪氧化的前体物质特别是自由铁离子,它能参与分子氧的电子传递反应,产生一个过氧化物阴离子[22]。
2.4 Ca2+-ATP酶活性
Ca2+-ATP酶活性来源于肌球蛋白,表征其头部S-1的性质[23]。解冻后虾肉的Ca2+-ATP酶活性损失越大,说明解冻过程中肌球蛋白变性越严重。由图2可以看出,虾肉经过解冻后,Ca2+-ATP酶的活性显着下降(P<0.05)。经过静水解冻、室温解冻、冷藏解冻、超声波解冻、微波解冻后Ca2+-ATP酶的活性分别降低了47.15%、82.28%、28.76%、48.5%、51.13%。 室温解冻后Ca2+-ATP酶的活性最低,其次是微波解冻,冷藏解冻后Ca2+-ATP酶的活性最高。造成这一现象的原因可能是室温解冻时温度较高,虾肉蛋白变性严重,Ca2+-ATP酶的活性损失较大。Xia Xiufang等[24]报道了猪肉经过5次反复冷冻-解冻后Ca2+-ATP酶活性降低了44%。黑老虎虾(Penaeus monodon)和白老虎虾经过5次解冻后(Penaeus vannamei)Ca2+-ATP酶活性分别降低了16.4%和22.0%[25]。

图2 不同解冻方式对酶活性的影响Fig.2 Influence of different thawing methods on Ca2+-ATPase activity in Chinese shrimp
2.5 物理和化学特性之间的相关性分析

表3 虾肉物理和化学指标之间的相关系数(Table 3 Correlation coefficients ( )between physical and chemical properties of Chinese shrimp
表3是不同指标之间的关系,以期来说明采用不同解冻方式后,虾肉物理特性变化的机制。通过相关性分析,不同指标之间建 立相关关系。TBARS值与解冻损失率(r=0.656,P<0.01)、蒸煮损失率(r=0.821,P<0.01)和L*值(r=0.847,P<0.01)呈显着正相关性,与a*值(r=-0.484,P<0.05)呈显着负相关性。羰基含量与解冻损失率(r=0.820,P<0.0 1)、蒸煮损失率(r=0.863,P<0.01)和L*值(r=0.787,P<0.01)呈显着地正相关性。这说明蛋白质氧化和脂质氧化对虾肉的保水性、色泽有很大负作用。与其他解冻方式相比,微波解冻后虾肉的解冻损失率、蒸煮损失率、L*值最高,部分原因就微波解冻后虾肉的TBARS和羰基含量最高。
Ca2+-ATP酶活与解冻损失率(r=-0.532,P<0.05)、蒸煮损失率(r=-0.521,P<0.01)、L*值(r=-0.615,P<0.01)和b*值(b*=-0.699,P<0.01)呈显着地负相关性。与a*值(r=0.756,P<0.01)呈正相关。虾肉经过室温解冻和微波解冻后Ca2+-ATP酶活性较低,可能与其较高的解冻损失和蒸煮损失有一定的联系。
3 结 论
解冻方式对虾肉的物理化学特性具有显着的影响。不同的解冻条件下,对虾肌肉保水性、色泽、蛋白质和脂肪氧化、Ca2+-ATP酶的活性与对照组相比都具有显着差异(P<0.05)。冷藏解冻对虾肉品质的破坏作用最小,说明最适合中国对虾的解冻方法。而微波解冻对虾肉的物理化学性质影响最大,不适合用来解冻中国对虾。超声波解冻是近几年来新型的解冻方式,但是从本实验来看,超声波解冻对虾肉品质的影响也比较大,因此研究利用超声波解冻如何减少对虾肉的品质破坏是今后的研究方向。
[1] BENJAKUL S, VISESSANGUAN W, THONGKAEW C, et al. Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage[J]. Food Research International, 2003, 36(8): 787-795.
[2] 张芳, 张俊杰. 冻肉解冻技术发展综述[J]. 肉类工业, 2005(4): 7-10.
[3] 郭园园, 孔保华, 夏秀芳, 等. 冷冻-解冻循环对鲤鱼肉物理化学特性的影响[J]. 食品科学, 2011, 32(13): 125-130.
[4] CHANDIRASEKARAN V, THULAS G. Effect of different thawing methods on physicochemical characteristics of frozen buffalo meat[J]. Journal of Food Technology, 2010, 8(6): 239-242.
[5] XIA Xiufang, KONG Baohua, LIU Jing, et al. Influence of different thawing methods on physicochemical changes and protein oxidation of porcine longissimus muscle[J]. Food Science and Technology, 2012, 46(1): 280-286.
[6] 李姣. 中国对虾贮藏过程中肌肉蛋白质生化特性变化规律[D]. 杭州: 浙江工商大学, 2011.
[7] 陈丽花, 肖作兵, 周培根. 中国对虾蛋白质的营养价值评价[J]. 上海海洋大学学报, 2009, 18(1): 88-93.
[8] 刘志皋. 食品营养学[M]. 北京: 中国轻工业出版社, 1991: 76-258.
[9] SINNHUBER R O, YU T C. The 2-thiobarbituric acid reaction, an objective meas ure of the oxidative dete rioration occurring in fats and oils[J]. Journal of Japan Oil Chemists Society, 1977, 26(5): 259-267.
[10] OLIVER C N, AHN B, MOERMAN E J, et al. Age-related changes in oxidized proteins[J]. Journal of Biological Chemistry, 1987, 262(12): 5488-5491.
[11] GORNALL A G, BARDAWILL C J, DAVID M M. Determination of serum proteins by means of the biuret reaction[J]. Journal of Biological Chemistry, 1949, 177(2): 751-766.
[12] HUFF-LONERGAN E, LONERGAN S M. Mechanisms of waterholding capacity of meat: mechanisms of water-holding capacity of meat: the role of postmortem biochemical and structural changes[J]. Meat Science, 2005, 71(1): 194-204.
[13] SIDDAIAH D, SAGAR REDDY G V, RAJU C V, et al. Changes in lipids, proteins and kamaboko forming ability of silver carp (Hypophthalmichthys molitrix) mince during frozen storage[J]. Food Research International, 2001, 3 4(1): 47-53.
[14] 刘燕, 王锡昌, 刘源. 金枪鱼解冻方法及其品质评价的研究进展[J].食品科学, 2009, 30(21): 476-480.
[15] DIAS J, NUNES M L, MENDES R R. Effect of frozen storage on the chemical and physical properties of black and silver scabbard fish[J]. Journal of the Science of Food and Agriculture, 1994, 66(3): 327-335.
[16] TIRONI V, LAMBALLERIE M D, LE-BAIL A. Quality changes during the frozen storage of sea bass (Dicentrarchus labrax) muscle after pressure shift freezing and pressure assisted thawing[J]. Innovative Food Science and Emerging Technologies, 2010, 11(4): 56 5 -573.
[17] TIRONI V A, TOM˘S M C, ANON M C. Quality loss during the frozen storage of sea salmon (Pseudopercis semifasciata). Effect of rosemary (Rosmarinus off cinalis) extract[J]. LWT-Food Science and Technology, 2010, 43(2): 263-272.
[18] THANONKAEW A, BENJAKUL S, VISESSANGUAN W, et al. The effect of metal ions on lipid oxidation, color and physicochemical properties of cuttlefish (Sepia pharaonis) subjected to multiple freezethaw cycles[J]. Food Chemistry, 2006, 95(4): 591-599.
[19] BALLIN N Z, LAMETSCH R. Analytical meth ods for authentication of fresh vs. thawed meat: a review[J]. Meat Science, 2008, 80(2): 151-158.
[20] SOYER A, OZALP B, DALMIS U, et al. Effects of freezing temperature and duration of frozen storage on lipid and protein oxidation in chicken meat[J]. Food Chem istry, 2010, 120(4): 1025-1030.
[21] BOONSUMREJ S, CHAIWANICHSIRI S, TANTRATIAN S, et a l. Effects of freezing and thawing on the quality changes of tiger shrimp (Penaeus monodon) frozen by air-blast and cryogenic freezing[J]. Journal of Food Engineering, 2007, 80(1): 292-299.
[22] BENJAKUL S, BAUER F. Biochemical and physicochemical changes in catfish (Silurus glanis Linne) muscle as influenced by different freeze-thaw cycles[J]. Food Chemistry, 2001, 72(3): 207-217.
[23] ROURA S I, MONTECCIA C, GOLDEMBERG A L, et al. Biochemical and physicochemical properties of actomyosin from preand post-spawned Hake stored on ice[J]. Journal of Food Science, 1990, 55(3): 688-692.
[24] XIA Xiufang, KONG Baohua, LIU Qian, et al. Physicochemical change and protein oxidation in porcine longissimus dorsi as influenced by different freeze-thaw cycle[J]. Meat Science, 2009, 83(2): 239-245.
[25] SRIKER P, BENJAKUL S, VISESSANGUAN W, et al. Comparative studies on the effect of the freeze-thawing process on the physicochemical properties and microstructures of black tiger shrimp (Penaeus monodon) and white shrimp (Penaeus vannamei) muscle[J]. Food Chemistry, 2007, 104(1): 113-121.
Influence of Thawing Methods on Physico-chemical Changes of Chinese Shrimp (Fenneropenaeus chinensis)
HOU Xiao-rong, MI Hong-bo, MAO Lin-chun*
(School of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310058, China)
The objective of the present study was to elucidate the physico-chemical changes of Chinese shrimp treated with five different thawing methods including cold-storage thawing, water immersion thawing, ambient temperature thawing, ultrasonic thawing, and microwave thawing. Different thawing methods exerted significant effects on shrimp quality and among five thawing methods, cold-storage thawing caused the least thawing loss, cooking loss, carbonyl content, and thiobarbitric acid-reactive substances (TBARS) value and the highest Ca2+-ATPase activity. There were significant correlations between physical properties and chemical properties for Chinese shrimp.
Chinese shrimp; thawing methods; physicochemical properties; quality
S984.9
A
1002-6630(2014)04-0243-05
10.7506/spkx1002-6630-201404049
2013-05-28
侯晓荣(1988—),女,硕士研究生,研究方向为海产品加工。E-mail:houxiaorong.good@163.com
*通信作者:茅林春(1962—),男,教授,博士,研究方向为农产品保鲜与加工。E-mail:linchun@zju.edu.cn



