张 虹,都立辉,施荣华,刘 琴*
(南京财经大学食品科学与工程学院,江苏省粮油品质控制及深加工技术重点实验室,江苏 南京 210023)
植物乳杆菌NP_785232蛋白N端两个特定结构域在大肠杆菌中的诱导表达
张 虹,都立辉,施荣华,刘 琴*
(南京财经大学食品科学与工程学院,江苏省粮油品质控制及深加工技术重点实验室,江苏 南京 210023)
以植物乳杆菌KLDS1.0320的候选表面黏附蛋白NP_785232为研究对象,采用外源重组表达的方法大量制备其前两个结构域。应用聚合酶链式反应方法克隆NP_785232蛋白N端的前两个结构域,将克隆获得的片段连入表达载体pET30a中构建重组质粒pET30a/N2,该重组质粒转化大肠杆菌后,用终浓度为1 mmol/L的异丙基硫代半乳糖苷诱导重组菌,重组蛋白经HisTrap柱纯化后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,对电泳获得的目的大小的片段进行质谱鉴定。结果表明:获得的重组蛋白与NP_785232蛋白N端的前两个结构域完全相同。通过大肠杆菌表达系统可以有效表达植物乳杆菌KLDS1.0320的候选表面黏附蛋白NP_785232 N端的前两个结构域。
植物乳杆菌;NP_785232蛋白;聚合酶链式反应;诱导表达;纯化
乳酸菌能调节和维持人类及动物胃肠道微生态系统的平衡,并能通过直接或诱导性的在肠道内合成某些小分子活性物质来刺激和增强机体的免疫系统和抵抗力[1-2],从而改善机体的肠道健康状况。乳酸菌的益生功能已被广泛认可,现已作为重要的食品级益生菌广泛应用于食品、饲料、保健和医药等行业中[3]。乳酸杆菌在肠道内的黏附和定殖是其发挥益生功能的前提和基础,而黏附被认为是定殖的前提条件[4]。乳酸杆菌的黏附具有特异性[5],它可通过菌体细胞表面的黏附素与肠道细胞表面的受体特异性结合,这些表面黏附素包括细菌表面蛋白、细胞壁毛缘、脂磷壁酸和多糖等,其中文献报道的与黏附有关的乳酸菌表面蛋白有S-层蛋白、引物酶Sortase依赖蛋白和黏膜结合蛋白[6]等。近年来,不少研究者认为乳酸杆菌和某些病原菌能识别相同的宿主受体,两者对受体形成竞争性黏附[7]。有研究报道,卷曲乳酸杆菌ZJ001的菌体表层提取物S-层蛋白能明显地抑制出血性大肠杆菌和鼠伤寒沙门氏菌对人宫颈癌细胞的黏附[8]。乳酸菌具有的肠道黏附和定殖能力为其益生功能的发挥提供了先决条件。目前已经发现了许多能够促进黏附的乳酸菌分子[9],但在与乳酸菌相互作用的宿主分子方面,相关报道很少。乳酸菌调节宿主免疫能力的发现,促使研究者将目光投向了这一领域,渐渐有宿主互作分子方面的报道出现[10]。
将目的蛋白外源表达进行研究是蛋白质功能研究的重要方法之一。大肠杆菌系统是目前应用最广泛的蛋白质表达系统[11-12]。杨桂连等[13]使用thyA基因缺陷型E. coli X13成功表达了乳酸菌胞外蛋白水解酶基因。古英洪等[14]使用E. coli Rosetta-gami(DE3)pLysS成功表达了桃的多聚半乳糖醛酸酶抑制蛋白基因。黄茜等[15]通过对含有IF2、SUMO、GST、NusA和麦芽糖结合蛋白(maltose binding protein,MBP)融合标签的表达载体进行比较,发现胆盐水解酶(bile salt hydrolase,BSH)蛋白只有与融合标签MBP连接才能获得大量表达。
根据已公布的基因组注释信息发现,植物乳杆菌KLDS 1.0320能编码一种由6个结构域组成的NP_785232蛋白,初步推断该蛋白可能对其在动物肠道中的黏附具有一定作用。该蛋白由2 219个氨基酸组成,想要完整表达整个蛋白很难实现,进一步的多序列比对研究表明:该蛋白6个结构域的氨基酸序列同源性很高,且同源性较高区域的氨基酸排列顺序也基本相同,这些蛋白质一级结构的相似性暗示了其各个结构域可能具有相似的功能。因此,本实验从植物乳杆菌KLDS 1.0320中克隆出NP_785232蛋白N端的前两个结构域对应的基因(N2蛋白基因),构建该基因的原核表达重组质粒pET30a/N2。将这两个结构域构成的重组蛋白在大肠杆菌中大量表达,并利用HisTrap HP柱分离纯化His-N2重组蛋白。
1 材料与方法
1.1 菌株和载体
植物乳杆菌KLDS 1.0320、Escherichia coli DH5α、表达菌株Escherichia coli Rosetta(DE3)和表达质粒pET30a均由本实验室保存;重组表达质粒pET30a/N2由本实验构建。
1.2 试剂
限制性内切酶Nco I和Xho I、HSTMMix、T4 DNA连接酶和250 bp DNA Marker、凝胶纯化回收试剂盒 日本TaKaRa公司;AxyPrep质粒DNA小量试剂盒 爱思进生物技术有限公司;多功能DNA纯化回收试剂盒 北京百泰克生物技术有限公司;卡那霉素 美国Amresco公司;异丙基硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG) 加拿大Bio Basic公司;宽范围彩色预染蛋白质Marker 天根生化科技(北京)有限公司;HisTrap HP柱 美国GE公司;其他试剂均为分析纯。
1.3 仪器与设备
THZ-D型恒温振荡器 江苏太仓市强乐实验设备有限公司;无菌工作台 上海三发科技有限公司;数显恒温水浴锅 国华电器有限公司;高速台式离心机 上海安亭科学仪器厂;J-26XP落地式高速冷冻离心机 美国Beckman Coulter公司;LDZX-50FB立式压力蒸汽灭菌器 上海申安医疗器械厂;U-3900紫外-可见分光光度计 日本Hitachi公司;梯度PCR自动系列化分析仪东盛国际贸易有限公司;DYY-6C型电泳仪 北京六一仪器厂;JS-6800全自动凝胶成像分析仪 上海培清科技有限公司;JY92-Ⅱ超声波细胞粉碎机 宁波新艺超声设备有限公司;AKTA蛋白纯化系统 美国GE公司。
1.4 方法
1.4.1 N2蛋白基因大肠杆菌表达系统的构建
1.4.1.1 N2蛋白基因的聚合酶链式反应(polymerase chain reaction,PCR)扩增
根据NP_785232蛋白的基因序列设计引物,P1:ACACCATGGAAACGGCGATCGTAACGTATT;P2:CACCTCGAGTTATTACTGATAATAAACTTGTACAT CTGG,该引物由生工生物工程(上海)股份有限公司合成。以植物乳杆菌KLDS 1.0320基因组为模板,对NP_785232蛋白N端两个特定结构域基因进行PCR扩增。PCR反应体系如下:HSTMMix 25 μL,上、下游引物各1 μL(终浓度1 μmol/L),植物乳杆菌KLDS 1.0320基因组5 ng,加双蒸水至50 μL。反应条件为:95 ℃预变性5 min;95 ℃变性50 s、58 ℃退火30 s、72 ℃延伸2 min,共30个循环;72 ℃延伸5 min。反应结束后,取5 μL PCR反应液进行1.0%的琼脂糖凝胶电泳检测,并对N2蛋白基因的PCR反应液进行切胶回收。
1.4.1.2 N2蛋白基因与表达载体pET30a的连接
将携带有表达载体pET30a的E. coli菌株接种于Luria-Bertani(LB)液体培养基(含终质量浓度为50 μg/mL的卡那霉素)中,37 ℃培养过夜,然后提取质粒,以Nco Ⅰ、XhoⅠ双酶酶切,切胶回收得到N2蛋白基因PCR产物和表达载体pET30a。用多功能DNA纯化回收试剂盒对双酶切反应液分别进行纯化,按照表达载体和N2蛋白基因片段的物质的量比1∶3~1∶10的比例,用T4 DNA连接酶16 ℃过夜进行连接反应。
将上述连接液转化至自制的大肠杆菌感受态细胞DH5α中,在LB固体培养基(含终质量浓度为50 μg/mL的卡那霉素)上培养以筛选阳性重组体,同时以菌落为模板通过PCR扩增N2蛋白基因进行鉴定。从菌落PCR鉴定阳性的重组子中提取重组质粒,使用限制性内切酶Nco I和Xho I进行双酶切鉴定,将鉴定正确的重组质粒送生工生物工程(上海)股份有限公司进行测序验证。将验证正确的重组质粒pET30a/N2转化至E.coli Rosetta(DE3)表达菌株中。
1.4.2 N2蛋白基因在大肠杆菌中的诱导表达
1.4.2.1 IPTG诱导N2蛋白基因表达
将筛选获得的含有pET30a/N2重组质粒的E.coli Rosetta(DE3)菌株单菌落接种于5 mL LB液体培养基(含终质量浓度50 μg/mL的卡那霉素)中,37 ℃、200 r/min振荡培养过夜。吸取3 mL活化过夜的菌液体积分数1%接种于300 mL LB液体培养基(含终质量浓度50 μg/mL的卡那霉素)中,37 ℃、200 r/min振荡培养,直至OD600nm值在0.6~0.8。向培养液中加入300 μL浓度为1 mmol/L的IPTG进行诱导表达,继续培养9 h。加入IPTG之前取样一次,之后每隔1 h取样一次。同时以同样的方法诱导含有空载体pET30a的E. coli Rosetta(DE3)作为阴性对照。
1.4.2.2 电泳分析
将转化成功含有重组质粒pET30a/N2的E. coli Rosetta(DE3)重组菌用IPTG诱导表达后,取适量菌体破碎液上清进行十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDSPAGE)电泳以检测蛋白的表达情况,具体方法如下:将诱导0~9 h的菌液4 ℃、12 000 r/min离心1 min收集菌体,用生理盐水洗涤菌体两次后再用40 μL体积分数40%甘油和10 g/100 mL SDS的上样缓冲液重悬菌体沉淀,沸水浴中煮沸10 min。冷却后取15 μL上清液进行电泳分析[16]。
1.4.3 His-N2蛋白的分离纯化和鉴定
1.4.3.1 样品的制备
将诱导培养5 h的菌液4 ℃、12 000 r/min离心10 min收集菌体,用生理盐水清洗菌体3次,用1%初始培养液体积的His TrapTM柱结合缓冲液悬浮菌体,将菌悬液置于冰水混合物中,超声波破碎菌体细胞直至溶液澄清,超声参数为:200 W超声2 s间隙9 s。将破碎后的菌体溶液4 ℃、13 000 r/min离心30 min以除去不溶性物质,上清液用0.22 μm的滤膜过滤后上样于AKTA蛋白质纯化系统,使用HisTrap HP亲和色谱柱分离融合表达的His-N2蛋白。
1.4.3.2 His-N2蛋白的亲和层析纯化
按照His TrapTM柱的使用说明书进行操作。
1.4.3.3 His-N2蛋白的鉴定
将纯化获得的His-N2蛋白经SDS-PAGE电泳后,切取目的大小的胶带送交苏州普泰生物技术有限公司,采用NanoLC-ESI-MS/MS进行鉴定。
2 结果与分析
2.1 N2蛋白基因的扩增与序列测定

图1 N2蛋白基因的PCR扩增电泳图Fig.1 Electrophoresis of PCR amplification products of the first two domains of N2 gene
如图1所示,在1 200 bp附近有一条明亮的PCR扩增条带,同预期目的片段(1 242 bp)大小相符,表明已扩增出N2蛋白基因片段。
PCR扩增产物经切胶回收、Nco I和Xho I双酶切、纯化等处理后与双酶切表达载体pET30a进行连接,转化至DH5α大肠杆菌感受态细胞中,以筛选的阳性重组体为模板扩增N2蛋白基因,电泳结果与图1相同,说明重组质粒pET30a/N2已成功转化至DH5α大肠杆菌中。小量提取PCR扩增鉴定正确的重组体的质粒,用Nco I和Xho I进行双酶切鉴定结果如图2所示。
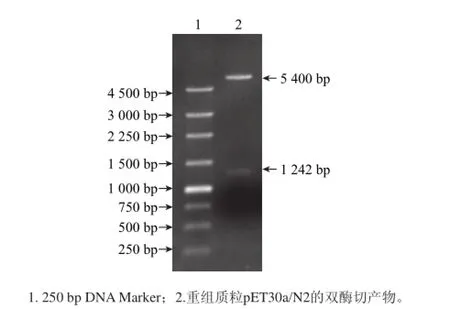
图2 重组质粒pET30a/N2的双酶切鉴定结果Fig.2 Identification of recombinant plasmid pET30a/N2 by double enzyme digestion
由图2可知,重组质粒经双酶切后出现两条带,一条带的大小在4 500 bp以上,为表达载体的线性条带,约为5 400 bp;另一条带为插入的N2蛋白基因片段,大小在1 200 bp左右。由此可以看出,N2蛋白基因已成功连入pET30a表达载体中。将提取的另一部分重组质粒送到生工生物工程(上海)股份有限公司进行测序,测序结果表明获得的N2蛋白基因PCR产物序列与GenBank公布(EU552054.1)的相同,因此成功构建了含有NP_785232蛋白N端两个特定结构域基因的原核表达重组质粒pET30a/N2。
2.2 N2蛋白基因诱导表达的SDS-PAGE电泳分析

图3 His-N2重组蛋白的SDS-PAGE电泳结果Fig.3 SDS-PAGE analysis of His-N2 protein
重组菌体破碎液上清的电泳结果如图3所示,含有重组质粒pET30a/N2的E. coli Rosetta(DE3)重组菌经IPTG诱导表达后,有明显的N2蛋白质条带出现,而含有空质粒pET30a的E. coli Rosetta(DE3)菌株在IPTG诱导过程中始终没有出现N2蛋白质条带,当诱导表达3、5、6、7 h时,N2蛋白的表达量较高,从8 h时开始有所下降,综合工作效率和实验成本等因素,本实验选择诱导表达5 h以制备足量的His-N2蛋白。
2.3 His-N2融合重组表达蛋白的分离纯化及其鉴定

图4 纯化后得到的蛋白溶液SDS-PAGE电泳结果Fig.4 SDS-PAGE analysis of the purified protein
HisTrap HP亲和色谱柱分离融合表达的His-N2蛋白时,在用洗脱缓冲液进行洗脱时,在280 nm波长处有一个明显的吸收峰,这说明诱导表达的蛋白能通过HisTrap HP柱进行亲和层析分离。SDS-PAGE电泳分析纯化获得溶液中的蛋白组成结果如图4所示。溶液中主要有两种分子质量不同的蛋白,第1条带为分子质量在135 kD左右的杂蛋白,第2条带为诱导表达的His-N2蛋白,分子质量在63~75 kD。

图5 His-N2表达蛋白的nanoLC-ESI-MS/MS鉴定结果Fig.5 NanoLC-ESI-MS/MS analysis of His-N2 protein
切取目的大小的第2条蛋白条带送交苏州普泰生物技术有限公司进行nanoLC-ESI-MS/MS鉴定的部分结果如图5所示,经数据库搜索比对,证实所测蛋白条带与NP_785232蛋白的氨基酸序列完全一致。表明NP_785232蛋白N端的前两个结构域在大肠杆菌中获得了正确表达。
3 结 论
本研究在成功构建含有NP_785232蛋白N端两个特定结构域基因的pET30a/N2重组质粒基础上,将其转化E.coli Rosetta感受态细胞,通过卡那霉素抗性筛选获得阳性重组菌,实现了His-N2重组蛋白的外源表达。但用HisTrap HP柱分离His-N2目的蛋白时,SDS-PAGE电泳发现:纯化获得的蛋白溶液中除含有His-N2目的蛋白外,还含有一种分子质量在135 kD左右的杂蛋白。究其原因,可能是His-N2蛋白在纯化过程中自发地形成了二硫键。因为超声过程中会产生大量的热和自由基,不仅对重组蛋白可能造成氧化损伤,也可能对人体健康不利[17]。同时,由于His-N2蛋白中含有半胱氨酸,破碎菌体时未在溶液中加入β-巯基乙醇或二硫苏糖醇以维持一个很强的还原环境,从而导致目的蛋白之间可能自发地形成了二硫键[18]。这在其他研究中也已被证实[19-20]。
本实验采用1 mmol/L的IPTG诱导时,含有His标签蛋白的NP_785232蛋白N端的前两个结构域能在大肠杆菌表达系统中有效表达,这为研究该植物乳杆菌KLDS1.0320的候选表面黏附蛋白的互作肠道分子奠定基础。
[1] CHON H, CHO I B, LEE E, et al. Immunomodulatory effects of specific bacterial components of Lactobacillus plantarum KFCC11389P on the murine macrophage cell line RAW 264.7[J]. Journal of Applied Microbiology, 2009, 107(5): 1588-1597.
[2] RESTA-LENERT S, BARRETT K E. Probiotics and commensals reverse TNF-alpha and IFN-gamma-in-duced dysfunction in human intestinal epithelial cells[J]. Gastroenterology, 2006, 130: 731-746.
[3] WASSENAAR T M, KLEIN G. Safety aspects and implications of regulation of probiotic bacteria in food and food supplements[J]. Journal of Food Protection, 2008, 71(8): 1734-1741.
[4] 都立辉, 刘芳, 鞠兴荣, 等. 与宿主相互作用的乳酸杆菌表面蛋白综述[J]. 食品科学, 2010, 31(7): 323-328.
[5] SZEKER K, BECZNER J, HALASZ A, et al. in vitro adhesion of lactic acid bacteria and Bifi dobacteria to Caco-2P and IEC-18 cells[J]. Acta Alimentaria, 2005, 34(1): 91-99.
[6] 汪海峰, 章文明, 汪以真, 等. 乳酸杆菌与肠道黏附相关表面因子及其机制的研究进展[J]. 动物营养学报, 2011, 23(2): 179-186.
[7] 章文明, 汪海峰, 刘建新. 乳酸杆菌益生作用机制的研究进展[J]. 动物营养学报, 2012, 24(3): 389-396.
[8] CHEN Xueyan, XU Jingjing, SHUAI Jianbing, et al. The S-layer proteins of Lactobacillus crispatus strain ZJ001 is responsible for competitive exclusion against Escherichia coli O157:H7 and Salmonella typhimurium[J]. International Journal of Food Microbiology, 2007, 115(3): 307-312.
[9] LEBEER S, VANDERLEYDEN J, de KEERSMAECKER S C J. Genes and molecules of lactobacilli supporting probiotic action[J]. Microbiology and Molecular Biology Reviews, 2008, 72(4): 728-764.
[10] ASONG J, WOLFERT M A, MAITI K K, et al. Binding and cellular activation studies reveal that toll-like receptor 2 can differentially recognize peptidoglycan from gram-positive and gram-negative bacteria[J]. The Journal of Biological Chemistry, 2009, 284(13): 8643-8653.
[11] 刘开泉. 利用原核系统表达富含二硫键蛋白质的探索与改进[D]. 泰安: 山东农业大学, 2011.
[12] 陈海琴, 徐志南, 汪诚, 等. 大肠杆菌无细胞蛋白质合成系统的初步研究[J]. 浙江大学学报: 工学版, 2007, 41(5): 843-847.
[13] 杨桂连, 秦守涛, 刘琼, 等. 乳酸菌胞外蛋白水解酶基因的克隆及在大肠杆菌中的表达[J]. 食品科学, 2010, 31(21): 254-257.
[14] 古英洪, 汤浩茹, 张义正. 桃PGIP蛋白基因片段的克隆、序列分析及在大肠杆菌中的表达[J]. 中国农业科学, 2008, 41(10): 3191-3199.
[15] 黄茜, 黄璐, 潘道东, 等. 重组融合蛋白MBP-BSH 在大肠杆菌中的表达及其纯化、功能鉴定[J]. 食品科学, 2012, 33(7): 198-203.
[16] 萨姆布鲁克 J, 拉塞尔 D W. 分子克隆实验指南[M]. 黄培堂, 王嘉玺,朱厚础, 等, 译. 3版. 北京: 科学出版社, 2002.
[17] SMAGOWSKA B, PAWLACZYK-ŁUSZCZYŃSKA M. Effects of ultrasonic noise on the human body: a bibliographic review[J]. International Journal of Occupational Safety and Ergonomics, 2013, 19(2): 195-202.
[18] 徐国恒. 二硫键与蛋白质的结构[J]. 生物学通报, 2010, 45(5): 5-7.
[19] ZHOU Cunshan, MA Haile, YU Xiaojie, et al. Pretreatment of defatted wheat germ proteins (by-products of fl our mill industry) using ultrasonic horn and bath reactors: effect on structure and preparation of ACE-inhibitory peptides[J]. Ultrasonics Sonochemistry, 2013, 20(6): 1390-1400.
[20] LI Yongwen, TONG Rui, XIA Hesheng, et al. High intensity focused ultrasound and redox dual responsive polymer micelles[J]. Chemical Communications, 2010, 46(41): 7739-7741.
Expression of the First Two Domains at N Terminus of NP_785232 Protein from Lactobacillus plantarum in Escherichia coli
ZHANG Hong, DU Li-hui, SHI Rong-hua, LIU Qin*
(Jiangsu Key Laboratory of Quality Control and Further Processing of Cereals and Oils, College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210023, China)
Lactobacillus plantarum KLDS 1.0320 adhesion surface protein NP_785232 was selected as the candidate in this work, and its first two domains at N terminus were subcloned and heterologously expressed in E. coli expression system. The purified recombinant protein was subsequently tested. PCR method was utilized to clone the first two domains at N terminus of the protein NP_785232, and the cloned fragment was ligated into the expression vector pET30a to construct a recombinant plasmid pET30a/N2, which was then transformed into E. coli. After being induced with a final concentration of 1 mmol/L IPTG, the recombinant protein was purified through HisTrap affinity chromatography and then analyzed by sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE). The polypeptide fragment with the right size in the SDS-PAGE was further identified by mass spectrometry. The results showed that the recombinant protein was exactly the same as the first two domains at N terminus of NP_785232 protein. Thus, we concluded that the first two domains at N terminus of NP_785232 protein was successfully heterologously expressed in E. coli expression system.
Lactobacillus plantarum; NP_785232 protein; polymerase chain reaction (PCR); expression; purifi cation
TS252.1
A
1002-6630(2014)05-0129-05
10.7506/spkx1002-6630-201405026
2013-04-09
国家自然科学基金青年科学基金项目(31101338);江苏省高校自然科学基金面上项目(11KJB550002);
南京财经大学研究生创新研究项目(M12067)
张虹(1987—),女,硕士研究生,研究方向为食品微生物与生物技术。E-mail:121615605@qq.com
*通信作者:刘琴(1968—),女,教授,博士,研究方向为食品化学。E-mail:liuq_s@yahoo.com



