管 笛,潘灿平,王 文,武会娟,*
磁微粒酶联免疫吸附法测定玉米中的伏马毒素B1
管 笛1,2,3,潘灿平3,王 文1,2,武会娟1,2,*
(1.北京市理化分析测试中心,北京 100089;2.北京市食品安全分析测试工程技术研究中心,北京 100089;3.中国农业大学理学院,北京 100094)
将磁微粒的偶联物替代酶标板作为固定相,用于酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)法检测玉米中的伏马毒素B1(fumonisin B1,FB1)。在直接竞争ELISA反应中,分别引入羊抗兔抗体-磁微粒、蛋白A-磁微粒,并比较二者替代效果。通过对检测方法的优化,使用羊抗兔抗体、蛋白A与磁微粒的偶联物作为固定相的检出限分别为0.024 μg/mL和0.030 μg/mL。羊抗兔抗体-磁微粒偶联物替代酶标板后具有更低的检出限,为常规ELISA法检测限的三分之一。玉米样品中FB1回收率范围在76.4%~110.6%之间,相对标准偏差小于11%。研究建立了一种灵敏度高、稳定性好的FB1检测方法。
磁微粒;酶联免疫吸附法;伏马毒素;玉米;蛋白A
伏马毒素(fumonisins)是20世纪80年代末期发现的一类由串珠镰刀菌(Fusarium moniliforme)产生的真菌毒素,目前已知有28 种衍生物,其中以伏马毒素B1(fumonisin B1,FB1)最为常见[1-2]。伏马毒素具有神经毒性、肺毒性、致癌性,可引起马脑白质软化症和猪肺水肿综合症,且与人类食管癌和肝癌的发生有密切关系[3-5]。国际癌症研究机构已将伏马毒素列为2B级致癌物,即人类潜在致癌物[6]。鉴于伏马毒素的危害性,世界各国对其进行严格限量。欧盟规定不同饲料中伏马毒素的推荐最高限量标准为5 mg/kg[7];美国食品药品监督管理局公布的食用谷物中伏马毒素的推荐最高限量为2 mg/kg[8]。
伏马毒素主要存在于谷物中,以玉米居多[9]。玉米是世界主要农作物之一,也是我国大部分地区食物和饲料的重要来源。因此,加强玉米及饲料中伏马毒素含量的测定,获知其污染程度,有利于保障我国人民食用安全及畜牧业稳定。
目前检测FB1的方法主要有高效液相色谱-荧光检测法[10-11]、高效液相色谱-质谱检测法[12-17]等仪器分析法,以及基于免疫学原理的酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)[18-19]、化学发光检测法[20-23]、胶体金免疫层析法[24-25]等。这些方法在保证食品及农产品安全方面发挥了重要的作用。本研究在传统ELISA法的基础上,引入超顺磁微粒,替代酶标板作为固相载体,使免疫反应从二维到三维立体反应,以期提高检测灵敏度,促进FB1检测技术的发展,对控制伏马毒素的污染具有重要意义。
1 材料与方法
1.1 材料与试剂
FB1标准溶液、牛血清白蛋白(bovine serum albumin,BSA)、3,3’,5,5’-四甲基联苯胺 美国Sigma-Aldrich公司;FB1多克隆抗体、FB1-HRP偶联物 美国Beacon公司;蛋白A-磁微粒偶联物、2.8 μm粒径磁微粒美国Invitrogen公司;羊抗兔抗体 北京科百奥生物科技有限责任公司;96孔可拆卸酶标板 美国Corning公司;其他试剂均为分析纯。
1.2 方法
1.2.1 磁微粒与羊抗兔抗体的偶联
取2.8 μm粒径磁微粒165 μL,用pH 9.5硼酸缓冲液洗涤2 次,弃去溶液;加入4 μL质量浓度为25 mg/mL的羊抗兔抗体,加pH 9.5硼酸缓冲液至终体积为150 μL,旋涡轻轻混匀,再加入100 μL含3 mol/L硫酸铵的pH 9.5硼酸缓冲液,摇床210 r/min,37 ℃反应18 h;用磁铁吸附磁微粒,弃去反应溶液,加入1 mL含0.5% BSA的磷酸缓冲液,摇床210 r/min,37 ℃反应1 h;利用磁铁吸附,弃去溶液;用含0.5% BSA的磷酸缓冲液洗涤2 次,加入330 μL 0.5% BSA、0.05%硫柳汞的磷酸缓冲液,4 ℃保存待用。
1.2.2 常规ELISA方法
将羊抗兔抗体溶于pH 9.5的碳酸盐缓冲液中至质量浓度为40 μg/mL,加入酶标板中,100 μL/孔,4 ℃过夜。磷酸-吐温溶液洗板3 次后,每孔加入200 μL 1.5% BSA封闭液,37 ℃孵育2 h。磷酸-吐温溶液洗板3 次后,每孔加入50 μL样品/标准品溶液,50 μL FB1-HRP偶联物,50 μL FB1抗体溶液,37 ℃反应15 min。磷酸-吐温溶液洗板5 次后,每孔加入100 μL显色液,37 ℃反应10 min后,每孔加入50 μL 2 mol/L硫酸终止反应,450 nm波长处测定吸收度。
1.2.3 基于羊抗兔抗体-磁微粒偶联物的ELISA方法
向96孔板每孔中加入200 μL 1.5% BSA溶液,37 ℃孵育2 h。磷酸-吐温溶液洗板3 次后,每孔加入50 μL样品/标准品溶液,50 μL FB1-HRP偶联物,15 μg羊抗兔抗体-磁微粒偶联物,50 μL FB1抗体溶液,放入摇床中,37 ℃,150 r/min,反应15 min。将96孔板磁力板上,放置1 min,待磁微粒完全吸附在板孔底部后,吸去反应液,并用磷酸-吐温溶液洗板3 次,每次每孔380 μL。每孔加入100 μL显色液,放入摇床中,37 ℃,150 r/min,反应10 min后,每孔加入50 μL 2 mol/L硫酸终止反应,450 nm波长处测定吸收度。
1.2.4 基于蛋白A-磁微粒偶联物的ELISA方法
方法步骤与1.2.3节相同,将15 μg羊抗兔抗体-磁微粒偶联物换成15 μg 蛋白A-磁微粒偶联物。
1.2.5 标准曲线建立与数据处理
取FB1标准品溶液质量浓度为0、0.02、0.06、0.2、0.6、1.2 μg/mL,利用以上方法分别建立标准曲线。溶液吸收度通过酶标仪在450 nm波长处测定,并作图。以抑制率为纵坐标(抑制率=A/A0×100,式中:A为含有FB1时的吸光度;A0为质量浓度为0时的吸光度),FB1质量浓度为横坐标。测定结果用非线性四参数逻辑斯蒂拟合。方法的检出限定义为90%抑制率时所对应FB1质量浓度。检测的线性范围定义为抑制率在20%~80%之间所对应的FB1质量浓度。
1.2.6 玉米样品中FB1回收率的测定
以不同质量浓度FB1添加于空白玉米粉样品中,称取20 g样品,并量取100 mL 70%甲醇溶液至一具塞三角瓶中。剧烈振荡3 min,静置3 min,待样品沉淀。用玻璃纤维滤纸过滤萃取液,并收集,取50 μL上样定量检测。
2 结果与分析
2.1 磁微粒用量的优化
磁微粒的用量对实验结果的准确性与稳定性具有很大的影响。由于磁微粒本身没有透光性,为棕色颗粒,加入量不当会造成本底吸光度过大,且因磁微粒的分布不均,造成不同程度的遮光现象,引起吸光度不稳定。因此本研究首先对加入不同量的磁微粒的本底吸光度进行研究,结果见表1。
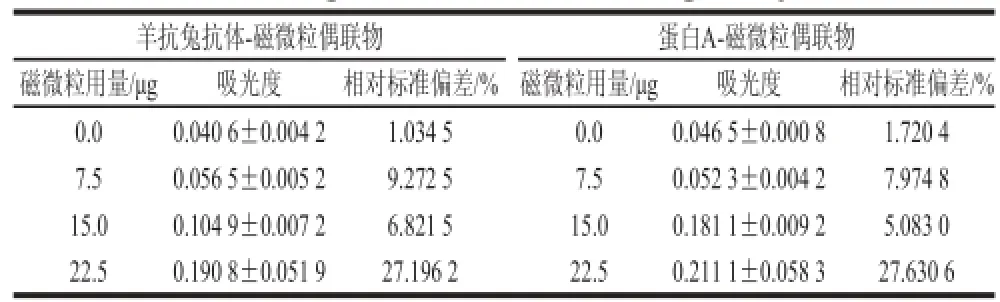
表1 磁微粒的本底吸光度Table 1 Background absorbanceof magnetic particles
由表1可知,随着加入磁微粒量的增加,透光性有一定减弱,吸光度随之升高。羊抗兔抗体-磁微粒偶联物的本底吸光度由0.040 6增加到0.190 8;蛋白A-磁微粒偶联物本底吸光度由0.046 5增加到0.211 1。同时磁微粒加入的增多,本底值相对标准偏差也升高,当加入22.5 μg磁微粒时,2 种磁微粒偶联物的相对标准偏差均大于20%。
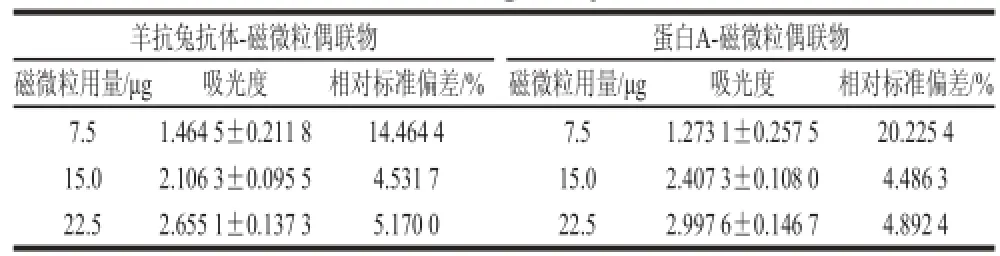
表2 磁微粒使用量对显色结果的影响Table 2 Effect of the amount of magnetic particles used on color reaction
由表2可知,对于2 种磁微粒偶联物来说,随着磁微粒用量的增大,其在450 nm波长处吸收度随之增大。但是磁微粒用量在7.5 μg时,显色结果的相对标准偏差较大。引起相对标准偏差变大的原因是磁微粒使用量较少,即在单位磁微粒上结合的免疫复合物较多,而在洗涤步骤中若有少量损失,由于标记酶的级联放大作用,会对显色结果产生较大影响,造成吸光度的不稳定。
因此,综合考虑本底吸光度和显色结果的影响,本研究选取15 μg作为羊抗兔抗体-磁微粒偶联物与蛋白A-磁微粒偶联物的最佳使用量。
2.2 洗板方式的选择
样品中游离的FB1(或标准品FB1)、FB1-HRP偶联物、抗体、蛋白A-磁微粒偶联物(羊抗兔抗体-磁微粒偶联物)在微孔板中进行竞争反应。与抗体-FB1/抗体-FB1-HRP偶联物结合在磁微粒上,为避免发生非特异性反应和降低背景值,通过磁铁吸附聚集,未结合物需经弃液、洗涤过程。若洗涤方式不当,有可能造成非结合物会洗涤不彻底,吸光度偏高,也可能造成磁微粒复合物损失,使结果不稳定。
本研究比较了洗板机洗涤和手动洗涤两种方式。洗板机洗涤方式为在96孔板下方加上一个相应的96孔磁力吸附板,经过吸液-加液-吸液的过程重复3 次。手动洗涤方式为:首先利用磁铁将磁微粒吸到微孔板底部一侧,再将微孔板放到相应的96孔磁力吸附板上,利用排枪在微孔磁微粒的另一侧将废液吸去,并加洗液至满孔,再将洗液吸去,重复3 次。为将液体充分吸净,在吸液过程中将微孔板抬起一定角度,有磁微粒的一侧高,保证液体均流向吸液一侧。通过测定标准品质量浓度为0、0.06、0.2、0.6、1.2 μg/mL时的显色结果,每个质量浓度重复3 次,比较两种洗板方式的洗板效果。结果见图1。由图1可知,利用洗板机洗板的方式,显色结果梯度不好,而且结果稳定性差,5 个质量浓度显色值相对标准偏差在12.57%~46.12%之间。结果不稳定的原因在于洗板机洗板时,磁微粒被磁铁吸附在底部均匀分开,而洗板机吸液吸力较大,且在板孔的中心部位吸取,这样会造成一定程度的磁微粒损失。手动洗板的方式结果呈现较好的梯度,且5 个质量浓度显色值相对标准偏差在1.37%~9.00%之间,结果稳定性好。结果稳定的原因在于洗板时,将磁微粒吸至一侧,而吸液、加液在板孔另一侧完成,整个过程磁微粒损失较小。
在洗板过程中,洗涤次数对结果也会产生一定的影响。洗板次数不够,FB1-HRP有残留,影响显色结果,洗板次数过多,不仅会造成磁微粒的损失,而且会增加额外操作时间。本研究采用上述提到的手动洗涤方式,对FB1标准品质量浓度为0、1.2 μg/mL的孔分别洗2、3、4、5 次,每次重复结果3 次,结果见表3。可知,随着洗板次数的增多,显色结果基本稳定,在第3次之后,干扰物已经基本洗净,考虑到洗板次数越多会延长检测时间,选取洗板3 次为最佳。
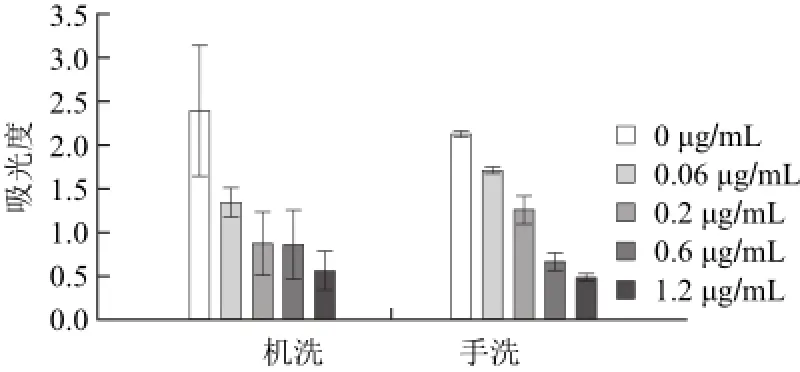
图1 不同洗涤方式的比较Fig.1 Comparison of different washing methods
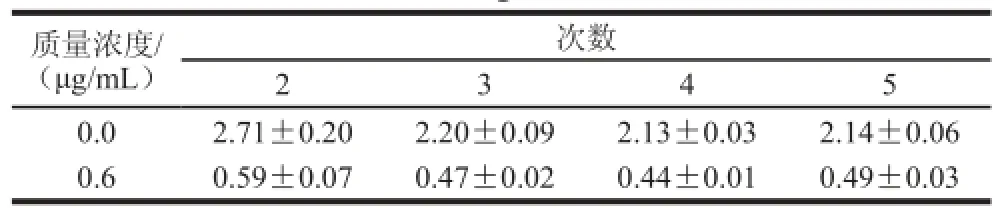
表3 洗涤次数对显色结果影响Table 3 Effect of washing number on color reaction
2.3 标准曲线的比较
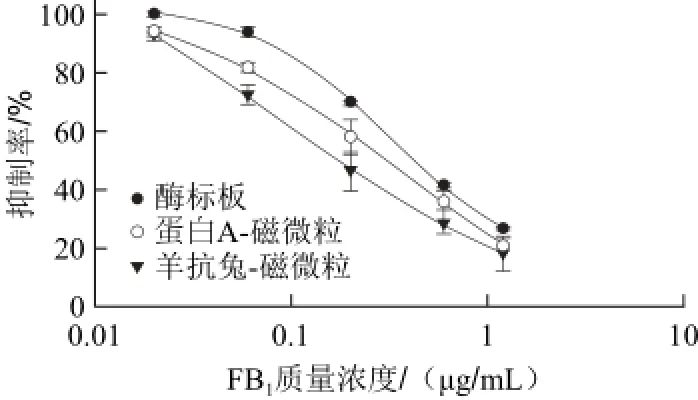
图2 标准曲线的比较Fig.2 Comparison of standard curves
本研究将蛋白A-磁微粒和羊抗兔抗体-磁微粒作为承载体,取代酶标板引入ELISA中,并分别建立标准曲线,与常规ELISA进行比较,结果见图2。在FB1质量浓度0~1.2 μg/mL范围内,承载体为酶标板,蛋白A-磁微粒、羊抗兔抗体-磁微粒的标准曲线表现出较好的拟合度,R2值均大于0.999。但是3 种方法的检出限有所不同。常规ELISA方法,即以酶标板作为承载体的检出限为0.076 μg/mL,蛋白A-磁微粒作为承载体的检出限为0.030 μg/mL,羊抗兔抗体-磁微粒作为承载体的检出限为0.024 μg/mL。由结果可知,磁微粒的引入,较常规ELISA法可以降低检出限,提升检测灵敏度,具体到本研究检出限仅为常规酶联免疫吸附法的三分之一。与常规酶标板作为承载体相比,磁微粒具有更大的比表面积,能提供更多结合位点,在溶液中较为均一分散,表面结合的抗体反应位点在溶液中充分暴露,降低了抗体与抗原结合的空间位阻。酶标板包被法中,抗原通过分子布朗运动和扩散运动到微孔板的速度较慢,而磁微粒可均匀分布在溶液中,更易于接近抗原,在液相中呈三维立体反应,从而加快与抗原的结合速度。综上,相较常规酶标板,在相同时间内,磁微粒的引入可使免疫反应更彻底,从而获得更高的灵敏度。
2.4 玉米样品中FB1添加回收率的测定
向空白玉米样品中添加一定量的FB1标准品,使终质量浓度为0.1、0.5 μg/mL和0.8 μg/mL。经过提取回收,利用酶标板、蛋白A-磁微粒、羊抗兔抗体-磁微粒作为承载体的方法分别测定并比较。
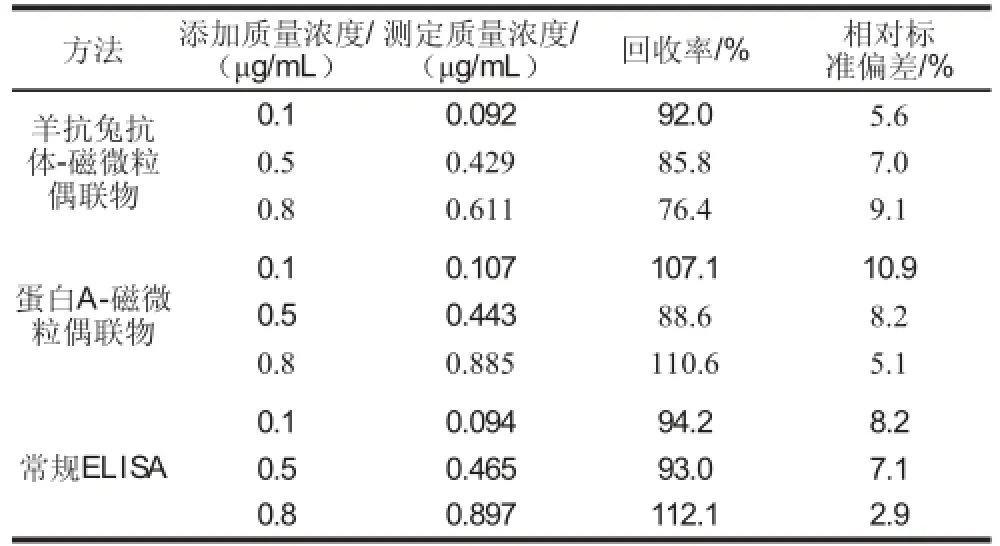
表4 玉米样品中FB1添加回收率测定Table 4 Recoveries of FB1in spiked corn samples
由表4可知,羊抗兔抗体-磁微粒偶联物的回收率范围在76.4%~92.0%之间,蛋白A-磁微粒偶联物的回收率范围在88.6%~110.6%之间,常规ELISA回收率范围在93.0%~112.1%之间。通过3 种不同质量浓度FB1玉米样品的应用研究,得到了很好的回收率,进一步证明磁微粒作为承载体能够用于玉米中FB1的ELISA检测。
3 结 论
本研究利用蛋白A-磁微粒、羊抗兔抗体-磁微粒替代酶标板作为固定相,用于ELISA检测玉米样品中的FB1。由于磁微粒能够提供更大的比表面积,更好的流动性,能够避免空间位阻,使抗原抗体在液相中呈三维立体反应,因此相较常规的酶标板,可使反应灵敏度得到提升。为了验证在玉米样品检测中的适用性,本研究对添加回收率进行测定,结果在76.4%~110.6%之间。综上所述,本研究成功建立了一种检测玉米中FB1的基于磁微粒的ELISA方法。
[1] CHEN Junping, MIROCHA C J, XIE Weiping, et al. Production of the mycotoxinfumonisin B1by Alternaria alternata f. sp. lycopersici[J]. Applied and Environmental Microbiology, 1992, 58(12): 3928-3931.
[2] VOSSA K A, SMITH G W, HASCHEK W M. Fumonisins: toxicokinetics, mechanism of action and toxicity[J]. Animal Feed Scienceand Technology, 2007, 137: 299-325.
[3] KELLERMAN T S, MARASAS W F O, THIEL P G, et al. Leukoencephalomalacia in two horses induced by oral dosing of fumonisin B1[J]. The Onderstepoort Journal of Veterinary Research, 1990, 5(4): 269-275.
[4] WILSON T M, ROSS P F, RICE L G, et al. Fumonisin B1levels associated with an epizootic of equine leukoencephalomalacia[J]. Journal of Veterinary Diagnostic Investigation, 1990, 2(3): 213-216.
[5] HARRISON L R, COLVIN B M, GREENE J T, et al. Pulmonary edema and hydrothorax in swine produced by fumonisin B1, a toxic metabolite of Fusarium moniliforme[J]. Journal of Veterinary Diagnostic Investigation, 1990, 2(3): 217-221.
[6] IARC-WHO. Some naturally occurring substances: fooditems and constituents, heterocyclic aromatic amines, and mycotoxins[C]//IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Lyon France, 1993: 445-466.
[7] The Commission of the European communttes. On the presence of deoxynivalenol, zearalenone, ochratoxin A, T-2 and HT-2 and fumonisins in products intended for animal feeding[J]. Official Journal of the European Union, 2006: 7-8.
[8] U.S. Food and Drug Administration Center for Food Safety and Applied Nutrition Center for Veterinary Medicine. Fumonisin levels in human foods and animal feed[S]. 2001.
[9] SYDENHAM E W, THIEL P G, MARASAS W F O, et al. Natural occurrence of some Fusarium mycotoxins in corn from low and high esophageal cancer prevalence areas of the Transkei, Southern Africa[J]. Journal of Agricultural and Food Chemistry, 1990, 38(10): 1900-1903.
[10] 王军淋, 胡玲玲, 蔡增轩, 等. 超高压液相色谱法同时检测玉米中的伏马毒素B1、B2、B3[J]. 食品安全质量检测学报, 2013, 4(1): 215-223.
[11] 李为喜, 郑床木, 武力, 等. 测定玉米中伏马毒素的免疫亲和层析净化高效液相色谱法[J]. 作物学报, 2012(3): 556-562.
[12] DALL’ASTA C, GALAVERNA G, AURELI G, et al. A LC/MS/ MS method for the simultaneous quantification of free and masked fumonisins in maize and maize-based products[J]. World Mycotoxin Journal, 2008, 1(3): 237-246.
[13] 廉慧锋, 赵笑天, 王蓉珍, 等. 超高效液相色谱-串联质谱法同时测定玉米、花生、麦仁中的9 种真菌毒素[J]. 食品科学, 2010, 31(20): 360-366.
[14] SOLFRIZZO M, GAMBACORTA L, LATTANZIO V M, et al. Simultaneous LC-MS/MS determination of aflatoxin M1, ochratoxin A, deoxynivalenol, de-epoxydeoxynivalenol, α and β-zearalenols and fumonisin B1in urine as a multi-biomarker method to assess exposure to mycotoxins[J]. Analytical and Bioanalytical Chemistry, 2011, 401(9): 2831-2841.
[15] GAZZOTTI T, ZIRONI E, LUGOBONI B, et al. Analysis of fumonisins B1, B2and their hydrolysed metabolites in pig liver by LCMS/MS [J]. Food Chemistry, 2011, 125(4): 1379-1384.
[16] GAZZOTTI T, LUGOBONI B, ZIRONI E, et al. Determination of fumonisin B1in bovine milk by LC-MS/MS[J]. Food Control, 2009, 20(12): 1171-1174.
[17] 宋欢, 廉慧锋, 赵笑天. 超高效液相色谱-串联质谱法同时测定玉米,花生, 麦仁中的9 种真菌毒素[J]. 食品科学, 2010, 31(20): 360-366.
[18] 王雨晨, 王君, 王元凯, 等. 伏马毒素B1单克隆抗体的制备及间接竞争ELISA方法的建立[J]. 上海交通大学学报: 农业科学版, 2011(2): 69-74.
[19] 刘师文, 何庆华, 邹龙, 等. 谷物中伏马菌素B1酶联免疫分析法的建立[J]. 食品科学, 2010, 31(18): 350-354.
[20] QUAN Ying, ZHANG Yan, WANG Shuo, et al. A rapid and sensitive chemiluminescence enzyme-linked immunosorbent assay for the determination of fumonisin B1in food samples[J]. Analyticachimicaacta, 2006, 580(1): 1-8.
[21] 权英, 詹月华, 张根华, 等. 谷物中伏马毒素B1化学发光酶免疫检测[J].中国公共卫生, 2011(5): 552-553.
[22] 王君, 王元凯, 严亚贤. 化学发光间接竞争ELISA检测伏马毒素B1方法的建立[J]. 上海交通大学学报: 农业科学版, 2012, 30(5): 45-50.
[23] 何庆华, 许杨, 刘师文. 直接竞争化学发光酶免疫法检测谷物中的伏马菌B1[J]. 食品科学, 2012, 33(22): 173-176.
[24] WANG S, QUAN Y, LEE N, et al. Rapid determination of fumonisin B1in food samples by enzyme-linked immunosorbent assay and colloidal gold immunoassay[J]. Journal of Agricultural and Food Chemistry, 2006, 54(7): 2491-2495.
[25] SHIU C M, WANG J J, YU F Y. Sensitive enzyme-linked immunosorbent assay and rapid one-step immunochromatographic strip for fumonisin B1in grain-based food and feed samples[J]. Journal of the Science of Food and Agriculture, 2010, 90(6): 1020-1026.
Development of a Magnetic Particle-Based Enzyme-Linked Immunosorbent Assay for Determining Fumonisin B1in Corn
GUAN Di1,2,3, PAN Can-ping3, WANG Wen1,2, WU Hui-juan1,2,*
(1. Beijing Centre for Physical and Chemical Analysis, Beijing 100089, China; 2. Beijing Engineering Research Center of Food Safety Analysis, Beijing 100089, China; 3. College of Science, China Agricultural University, Beijing 100094, China)
Magnetic particles (MPs) were used as the support to replace enzyme-linked immunosorbent assay (ELISA) plates for the determination of fumonisin B1(FB1) in corn. Goat anti-rabbit antibody and protein A-MP conjugates were utilized in a direct competitive ELISA format. Under optimized conditions, the limits of detection (LOD) for goat anti-rabbit antibody and protein A-MPs were 0.024 and 0.030 μg/mL, respectively. The goat anti-rabbit antibody MP conjugates exhibited a lower LOD which was only one third of that of conventional ELISA. The recoveries from spiked corn varied from 76.4% to 110.6%, with relative standard deviation (RSD) less than 11%. Overall, a sensitive and stable method for FB1has been developed in this paper.
magnetic particles; enzyme-linked immunosorbent assay; fumonisins; corn; protein A
TS207.4
A
1002-6630(2014)08-0208-04
10.7506/spkx1002-6630-201408041
2013-08-13
北京市市级财政项目(PXM2013_178305_000002)
管笛(1983—),男,助理研究员,博士,研究方向为食品安全与检测技术。E-mail:guandi@yeah.net
*通信作者:武会娟(1972—),女,副研究员,博士,研究方向为食品安全与检测技术。E-mail:sunnywhj@126.com



