韦献雅,殷丽琴,钟 成,章明海,牛应泽,*
DPPH法评价抗氧化活性研究进展
韦献雅1,殷丽琴1,钟 成2,章明海1,牛应泽1,*
(1.四川农业大学油菜研究中心,四川 成都 611130;2.四川农业大学玉米研究所,四川 成都 611130)
植物化合物或植物提取物的抗氧化活性的体外评价是研究功能因子的一个重要方面。1,1-二苯基-2-三硝基苯肼(1-diphenyl-2-picrylhydrazyl,DPPH)法常用于评价化合物或植物提取物的抗氧化活性,但由于没有一个标准化的方法,因而不同实验的结果难于相互比较。本文从DPPH法的原理、测定方法、检测波长、DPPH初浓度、反应时间、清除率计算公式、结果表达、评价指标等几个方面对DPPH法做归纳总结,分析几种外界因素对DPPH法的影响,有助于研究者提高认识,从而准确的开展研究工作。
DPPH法;自由基;抗氧化剂;抗氧化活性
近年来自由基生物学快速发展,广泛触及生命科学领域,其主要探究自由基的组成、清除和自由基对生物学系统的损害。目前已明确一系列由自由基造成的疾病机理,如动脉粥样化、神经变性、慢性抑郁症、癌症和生理学衰老[1]。抗氧化剂具有清除自由基的作用,对人体健康有益,已广泛用于食品工业中。体外评价和筛选物质抗氧化活性的方法有很多,如1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH)法、2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis(3-ethylbenzothi azoline-6-sulfonic acid) ammonium sal t,ABTS)法、氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC)法、铁离子还原法(ferric reducing antioxidant power,FRAP)法[2]等。与其他相比,DPPH法有稳定性好、灵敏度高、操作简单等优点[3-4]。DPPH法已在全世界范围内被广泛用于自由基清除能力的定量分析[2]。
Blois[5]最先报道了DPPH法,发现DPPH自由基能被硫代半胱氨酸和其他活性物质清除。此后,Brand-Williams 等[6]对DPPH法作了进一步修订,使之成为评价体外抗氧化活性的重要途径。然而到目前为止DPPH法并没有一个标准化的实验程序,尤其在反应时间、体积比、DPPH自由基初浓度、结果表达等方面,使得很难比较不同实验室、不同操作程序的结果[2,7-8]。本文主要从DPPH法的原理、 测定方法、检 测波长、DPPH自由基初浓度、反应时间、清除率计算公式、结果表达、评价指标等几个方面做归纳总结,并介绍几种外界因素对DPPH法的影响,以期为广大研究者提供一定的参考。
1 DPPH法原理
DPPH自由基是一种人工合成的、稳定的有机自由基,分子式为C12H12N6O6(Mr=394.32),其结构中含有3个苯环,1个N原子上有一个孤对电子(图1)[9]。其甲醇或乙醇溶液呈深紫红色,并在515~520 nm范围有最大吸收峰[5-6]。当向DPPH自由基溶液中加入自由基清除剂,孤对电子被配对,深紫色的DPPH自由基被还原成黄色DPPH-H非自由基形式,其褪色程度与所接受的电子数量成定量关系,因而可以通过吸光度的变化进行定量分析[10-11]。清除DPPH自由基是DPPH法的根据[12]。

图1 DPPH自由基的化学结构Fig.1 Chemical structure of DPPH free radical
根据反应机制可将评价抗氧化能力的方法基本分为两种:基于H原子转移(H-atom transfer, HAT)的反应和基于电子转移(electron transfer,ET)的反应[13-14]。以酚类物质(ArOH)为例,其清除DPPH自由基的反应有两种机制:直接提供酚的氢离子给DPPH自由基(HAT反应),见式(1);从酚(ArOH)或其酚阴离子(ArO·)转移电子到DPPH自由基(ET反应),见式(2)[15]。具体是哪一种途径取决于溶剂的特性和/或待测物质的氧化还原能力。一般在非极性溶液中HAT机制占优越性,但在极性溶液中,如乙醇、甲醇,DPPH自由基能和酚(ArOH)形成较强的氢键,从而ET机制占主要[16],二者也可同时发生[14]。

2 DPPH自由基清除率测定方法
测定DPPH自由基清除率的方法很多,使用最早、最频繁的是分光光度计法[5-6]。另外,针对不同的实验目的和材料,人们利用高效液相色谱技术(high performance liquid chromatography,HPLC)[17-20]、电子顺磁共振技术(electron paramagnanetic resonance,EPR)[21-22]、薄层层析技术(thin layer chromatography,TLC)[23-24]等开发了一些测定物质清除DPPH自由基活性的新型方法。
2.1 分光光度计法
DPPH自由基在517 nm波长附近有最大吸收峰,当DPPH自由基与抗氧化剂反应后,517 nm波长处的吸收值降低,其降低的程度与接收的电子(抗氧化剂清除自由基活性)呈定量关系,反应进程很容易通过分光光度计监测[5-6,25]。由于该方法简单、灵敏、快速,因此使用最广泛。DPPH自由基清除计算公式一般为:
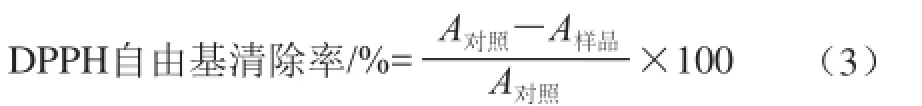
式中:A对照为未加样品的DPPH自由基吸光度;A样品为加入样品反应后的DPPH自由基吸光度。
2.2 HPLC
HPLC法是基于DPPH自由基吸收峰(PAs)的减少,来检测待测物质的DPPH自由基清除活性。通过比较反应前后DPPH自由基吸收峰(PAs)的变化,可灵敏地区分DPPH自由基吸收值的微小变化[17]。另外,通过HPLC法比较反应前后待测物中各组分的吸收峰变化,可以判断哪种组分的DPPH自由基清除活性高[20]。DPPH-HPLC法及DPPH-HPLC-MS法已成功用于筛选和鉴定复杂混合物质中的抗氧化成分[20,26]。但是对于批量实验,该方法可能会耗费大量时间。DPPH自由基清除率计算公式为:

式中:PA空白为未加样品的DPPH自由基吸收峰面积;PA样品为加入样品反应后的DPPH自由基吸收峰面积。
2.3 EPR
运用映照的修辞修辞格,将年幼时的“我们”与现在经历事件而走向不同的“我们”进行对照,展现岁月终使“我们”走向分离的残酷。
EPR是直接检 测和研究含有未成对电子的顺磁性物质的现代分析方法,具有简单、灵敏度高、样品不受破坏和无干扰等优点,是目前检测自由基最直接、有效的方法之一[22]。由于DPPH自由基是稳定的顺磁化合物,适合EPR检测。DPPH-EPR法直接测定自由基的浓度,显着提高了分析的准确性[21]。但由于成本较高,该方法使用并不常见。
3 DPPH法注意事项
3.1 检测波长
同一物质在不同波长下的吸收程度不一样,检测波长的选择关系到吸光度的准确性,影响实验结果的准确性。DPPH自由基的甲醇或乙醇溶液最大吸收波长在500~520 nm。统计大量文献后发现,使用频率最高的是515 nm[16,27-29]和517 nm[8,10,18,30-31],二者受青睐程度相当。也有使用516 nm[32]和518 nm[23]的。若对波长要求特别严格,可用扫描型分光光度计扫描DPPH自由基醇溶液的吸收光谱,确定最大吸收波长。
3.2 DPPH自由基初浓度的选择
关于DPPH自由基初浓度报道有很多(表1),没有统一的规定。有些研究者使用的DPPH自由基初浓度很高,导致反应体系中DPPH自由基吸光度超出了分光光度法的准确范围[33-34]。根据比尔定律,分光光度计的灵敏度范围在0.221~0.698,相当于透光率在20%~60%[33],对应的适宜DPPH自由基浓度应在25~70 μmol/L附近[8]。然而有很多人使用的DPPH自由基溶液浓度远超出了分光光度计的范围,甚至达到了300 μmol/L[23]和500 μmol/L[35]。Scherer等[2]在实验中使用的DPPH溶液吸光度在2~3之间,超出了分光光度计的准确范围,因而其数据结果被人质疑[36]。因此DPPH自由基初浓度不应超出分光光度计的准确范围[36]。

表1 DPPH自由基溶液的初始浓度Table 1 Initial DPPH radical concentrations from literature
3.3 反应时间

表2 DPPH法反应时间Table 2 Reaction time for DPPH assay
不同文献报道的DPPH法反应时间不同(表2)。有调查表明,大部分的DPPH法研究都是基于20~30 min的固定反应时间,而不是氧化还原反应达到平衡的总时间[42]。DPPH法看似简单,许多抗氧化剂与DPPH自由基的反应动力学不同,或者甚至不反应[29],反应达到平衡所需的时间也有所不同。如抗坏血酸与DPPH自由基的反应迅速,几乎在瞬间完成;而苯并噻二唑(benzothiadiazole,BTH)与DPPH自由基反应很缓慢,其吸光度在90 min的时间内持续降低[8],甚至需长达6h达到反应达平衡[29]。根据与DPPH自由基反应时间的长短,可将抗氧化物划分为快速(<30 min)、中速(0.5~1 h)和慢速(>1 h)3类[29]。如抗坏血酸、β-胡萝卜素、水溶性VE(Trolox)、没食子酸丙酯[8,43]、芝麻酚、α-生育酚[29]与DPPH自由基反应迅速,达平衡时间在30 min以内;阿魏酸、没食子酸、BHT[29]、(+)-儿茶素、(-)-表儿茶素[16]与DPPH反应缓慢,平衡时间在0.5~3 h。另外,大部分的天然植物提取物成分复杂,与DPPH自由基反应机制复杂,反应缓 慢[16]。
然而很多研究者并没有注意到反应时间的重要性,使用较短的时间,往往不足以使反应达到稳定状态[32],使得许多抗氧化剂的活性被错误估计。因此,在运用DPPH法前,很有必要进行混合体系的吸光度随时间变化的实验,以准确评估反应时间[8,43]。Teow等[44]发现反应液的吸光度在3 h左右才达到平衡,故将反应时间定为3 h。Azevedo等[38]每隔10 min测一次混合体系的吸光度,至30 min,从而确定反应达到平衡的时间。
DPPH法自1958年被Blois[5]提出后,在Brand-Williams等[6]的不断改进下,确定DPPH自由基清除率计算见公式(5)。

式中:A对照为未加样品的DPPH自由基吸光度,即DPPH自由基溶液+溶剂;A样品为加入样品反应平衡后的吸光度[5-6,20,29-30,36],即DPPH自由基溶液+样品溶液。
该计算公式适用于绝大多数情况,然而对于那些和DPPH在515 nm或517 nm处吸收光谱重叠的样品来说,样品本身的吸收对结果有一定影响,应该消除样品的影响,于是将上面公式中的A样品换成(A样品-A空白),A空白为样品的空白对照,即样品本身的吸光度[23,28,43,48],即样品溶液+溶剂。

因此,在使用DPPH法时应根据样品的吸收光谱,选择对应的清除率计算公式,确保实验结果的准确性。
4 DPPH自由基清除活性的评价指标
为了表示DPPH法的结果,并比较不同物质的抗氧化活性,人们开发了多种DPPH自由基清除活性指标,如半数抑制浓度IC50、自由基清除能力AE、Trolox当量等。常见指标及其计算公式、优缺点如下。
4.1 DPPH自由基清除率
DPPH自由基清除率(I)[28,49]是评价物质清除DPPH自由基活性的重要指标之一,其计算见公式(7)。

式中:A对照为对照组吸光度;A样品为样品与DPPH自由基反应平衡后的吸光度。自由基清除率越高,表明物质的抗氧化活性越强。该指标简单、方便,使用频率较高,但其易受样品颜色和纯度、DPPH自由基浓度、溶剂等因素影响;往往与半数效应浓度EC50或半数抑制浓度IC50联用。
4.2 DPPH自由基剩余率
DPPH自由基剩余率[32]表示反应体系中某一时刻剩余的DPPH自由基浓度与初始DPPH自由基浓度之比,其计算见公式(8)。

式中:c(DPPH自由基)t=0和c(DPPH自由基)t分别为t=0和反应过程中某一时刻t的DPPH自由基浓度。DPPH自由基剩余率越高,表明物质清除的DPPH自由基越少,抗氧化活性越弱。该指标要求准确测量反应时间和DPPH自由基浓度。
4.3 EC50或IC50
EC50为使DPPH自由基浓度降低50%的抗氧化剂浓度;IC50为DPPH浓度降到50%时的抗氧化剂浓度,二者的表达的意义相同。通过设置5~6个抗氧化剂浓度,制作浓度-清除率曲线,由于很多抗氧化剂浓度与DPPH自由基清除活性呈非线性关系,可通过GraphPad Prism®version 5.01、BleSq、OriginPro®8.5.1、SigmaPlot®12、BioDataFit®1.02和IBM SPSS Statistics®、Desktop 19.0等计算机程序中的回归模型,计算得到EC50/IC50值。EC50/IC50值越大,抗氧化活性越小。EC50/IC50被使用频率最高,但是其值随着DPPH初浓度变化[30-31,50]。
4.4 自由基清除能力
自由基清除能力( antiradical efficiency,AE)的计算见公式(9)。

式中:TEC50为抗氧化剂浓度在EC50时,反应达平衡所需的时间。
AE值越大,自由基清除能力越强。AE同时考虑了EC50和反应时间,被广泛用于DPPH法结果的表达。AE同时考虑了EC50和反应时间,被广泛用于DPPH法结果的表达。但是测量TEC50耗费时间,且反应平衡是一个缓慢的动态过程,判断平衡时间存在困难[9,16,28,50]。
4.5 Trolox当量抗氧化能力(Trolox equivalent antioxidant capacity,TEAC)
TEAC将给定物质的抗氧化能力与标准抗氧化物质Trolox比较。以Trolox为标准品,绘制Trolox浓度与DPPH自由基清除率的标准曲线;再将待测物质与DPPH反应,得到清除率值,计算得到与该清除率相当的Trolox浓度,进而得到TEAC值,单位为μmol TE/g。
TEAC值越大,抗氧化能力越强。是DPPH法最常用的指标之一[27,38]。
4.6 抗氧化剂活性指数(antioxidant activity index,AAI)AAI[2]的计算见公式(10)。

式中:IC50为半抑制浓度,结果不受DPPH浓度的影响,但是受抗氧化剂的浓度影响。使用较少。
4.7 抗氧化剂活性因子(antioxidant activity unit,AAU)
AAU[36]为完全清除1mol DPPH自由基所消耗的抗氧化剂摩尔数。计算见公式(11)。

式中:R为样品溶液与DPPH溶液的体积比;B为拟合方程的斜率;c为DPPH自由基的初始浓度;Mr为样品的相对分子质量。
AAU值越小,抗氧化剂清除自由基能力越强。AAU值不受样品和DPPH自由基浓度影响,但 是推到得到的公式中B为线性方程的斜率,公式本身有局限性;且还需知道样品的相 对分子质量,不适合测混合物和某些天然提取物的抗氧化活性。使用较少。
4.8 抗坏血酸当量(ascorbic acid equivalent antioxidant capacity,AEAC)
AEAC[30,51]表示100 g样品的抗氧化能力相当于多少mg抗坏血酸的。计算见公式(12)。

式中:Ac为对照组吸光度;As为反应液吸光度;AAA为抗坏血酸吸光度;ρAA为抗坏血酸(AA)质量浓度/(mg/mL);V提取液为提取液体积/mL。AEAC的另一个计算见公式(13)。

5 影响DPPH法结果的外界因素
DPPH法除了受到反应时间、DPPH初浓度、样品性质、计算公式、结果表达方式的影响[52],还受到光照、氧气、pH值、有机离子、无机离子等外界因素的影响[4]。
5.1 无机离子
Blois[5]1958年曾报道无机离子影响了DPPH自由基清除活性的准确测量。Al-Dabbas等[39]发现Na2S2O3和FeCl2能显着降低DPPH自由基的颜色强度,即具有清除DPPH自由基的活性。MgCl2、CaCl2、K2SO3和K2SO4轻微增加了DPPH自由基的颜色强度。K2HPO4、KH2PO4、KCl、KF、KBr、KSCN、KNO3、CaCO3、K2CO3、K2CrO4、MnCl2和NaCl在质量浓度为400 μg/mL时不影响DPPH自由基的颜色强度。另外,很多自由基清除剂如黄酮类物质容易螯合铁离子,以至不能准确评估其DPPH自由基清除活性[39]。Dawid owicz等[39]发现溶解抗氧化剂的溶液中,金属离子显着影响着未反应的DPPH自由基数量[32]。低价态的无机离子可能会干涉结果的准确性,在测定时需剔除或分别测定。为了得到植物提取物的真实DPPH自由基清除活性,应对其脱盐化。
5.2 有机化合物
Roberto[53]发现,纯的有机酸(乙酸、柠檬酸、苹果酸)没有DPPH自由基清除活性,但是当VC混合后,能显着增加VC的自由基清除效果,且呈现剂量效应。Dawidowicz等[32]发现系统中的乙酸乙酯、二恶烷降低了DPPH与BTH的反应动力学。
5.3 缓冲溶液
Al-Dabbas等[39]发现醋酸缓冲液在0.01~0.2 mmol/L范围内没有降低DPPH自由基的颜色,而磷酸缓冲液在超过0.05 mmol/L的浓度下,增强了DPPH自由基颜色。其认为醋酸缓冲液可用于任何提取物,而磷酸缓冲液使用则有所限制。
5.4 光照、氧气、pH值
Ozcelik等[4]发现,DPPH自由基甲醇溶液和DPPH自由基丙酮溶液在25℃的光照条件下放置120 min吸光度分别降低20%和35%,而在黑暗条件下放置150 min吸光度变化不明显。分别在21%含氧量和1%含氧量的条件下放置90 min,前者的DPPH自由基降解程度显着高于后者。在光下反应120 min,pH 4的甲醇缓冲液中的DPPH自由基吸光度降低了55%,pH 10丙酮缓冲液中的DPPH自由基吸光度降低了80%。因此光照、氧气、pH值会降低DPPH自由基的吸光度。
6 结 语
DPPH法是一种重要的检测天然植物提取物或化合物抗氧化活性的方法,操作简单,重复性好,受到广泛的欢迎。但是,DPPH法的结果容易受到多种因素的影响,为了准确评价某物质的清除DPPH自由基活性,应选择准确的反应时间、DPPH自由基初浓度、对应的计算公式和可靠的结果表达方式等。对于检测植物提取物的抗氧化活性,为排除提取液中各种离子及化合物等其他成分的影响,应对其进行脱盐化处理或纯化处理。DPPH法还受到温度、光照、氧气等自然因素影响,实验操作时要避光反应,DPPH自由基溶液现配现用。另外,反应体系中的H2O、H+含量,DPPH自由基与抗氧化剂溶液的体积比等也会影响着DPPH法的结果,但是其机理和规律研究还不够深入,值得进一步探索。DPPH自由基与抗氧化剂的反应过程和原理也值得进一步探究。到目前为止,还没有一个标准化的DPPH法,使得不同实验室的结果比较存在限制性。因此,DPPH法需要进一步完善和标准化,测定的抗氧化活性指标也需要统一。
[1] ANI V, VARADARAJ M C, NAIDU K A. Antioxidant and antibacterial activities of polyphenolic compounds from bitter cumin (Cuminum nigrum L.)[J]. European Food Research and Technology, 2006, 224(1): 109-115.
[2] SCHERER R, GODOY H T. Antioxidant activity index (AAI) by the 2,2-diphenyl-1-picrylhydrazyl method[J]. Food Chemistry, 2009, 112(3): 654-658.
[3] JIN Jie, LI Zhixi, ZHANG Feng. Scavenging function of mulberry vinegar extractives for 1,1-diphenyl-2-picrylhydrazyl (DPPH)[J]. Journal of Northwest Sci-Tech University of Agriculture and Forestry, 2006, 34(3): 135-137.
[4] OZCELIK B, LEE J H, MIN D B. Effects of light, oxygen and pH on the absorbance of 2,2-diphenyl-1-picrylhydrazyl[J]. Journal of Food Science, 2003, 68(2): 487-490.
[5] BLOIS M S. Antioxidant determinations by the use of a stable free radical[J]. Nature, 1958, 181: 1199-1200.
[6] BRAND-WILLIAMS W, CUVELIER M E, BERSET C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology, 1995, 28(1): 25-30.
[7] SUN T, HO C T. Antioxidative activities of buckwheat extracts[J]. Food Chemistry, 2005, 90(4): 743-749.
[8] SHARMA O P, BHAT T K. DPPH antioxidant assay revisited[J]. Food Chemistry, 2009, 113(4): 1202-1205.
[9] EKLUND P C, LÅNGVIK O K, WÄRNÅ J P, et al. Chemical studies on antioxidant mechanisms and free radical scavenging of lignans[J]. Organic and Biomolecular Chemistry, 2005, 3(18): 3336-3347.
[10] SHIMADA K, FUJIKAWA K, YAHARA K, et al. Antioxidative properties of xanthan on the autioxidation of soybean oil in cyclodextrin emulsion[J]. Journal of Agricultural and Food Chemistry, 1992, 40(6): 945-948.
[11] KUMARAN A, KARUNAKARAN R J. Antioxidant and free radieal seavenging activity of anaqueous extraet of Coleus aromaticus[J]. Food Chemstry, 2006, 97(1): 109-114.
[12] KARIOTI A, HADJIPAVLOU-LITINA D, MENSAH M L K, et al. Composition and antioxidant activity of the essential oils of Xylopia aethiopica (Dun) A. Rich. (Annonaceae) leaves, stem bark, root bark, and fresh and dried fruits, growing in Ghana[J]. Journal of Agricultural and Food Chemistry, 2004, 52(26): 8094-8098.
[13] KORDALI S, CAKIR A, MAVI A, et al. Screening of chemical composition and antifungal and antioxidant activities of the essential oils from three Turkish Artemisia species[J]. Journal of Agricultural and Food Chemistry, 2005, 53(5): 1408-1416.
[14] HUANG D J, OU B X, PRIOR R L. The chemistry behind antioxidant capacity assays[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6): 1841-1856.
[15] FOTI M C, DAQUINO C, GERACI C. Electron-transfer reaction of cinnamic acids and their methyl esters with the DPPH· radical in alcoholic solutions[J]. Journal of Organic Chemistry, 2004, 69(7): 2309-2314.
[16] VILLAÑO D, FERN˘NDEZ-PACHÓN M S, MOY˘ M L, et al. Radical scavenging ability of polyphenolic compounds towards DPPH free radical[J]. Talanta, 2007, 71(1): 230-235.
[17] CHANDRASEKAR D, MADHUSUDHANA K, RAMAKRISHNA S, et al. Determination of DPPH free radical scavenging activity by reversed-phase HPLC: a sensitive screening method for polyherbal formulations. Journal of Pharmaceutical and Biomedical Analysis, 2006, 40(2): 460-464.
[18] SUN L Q, DING X P, QI J, et al. Antioxidant anthocyanins screening through spectrum-effect relationships and DPPH-HPLC-DAD analysis on nine cultivars of introduced rabbiteye blueberry in China[J]. Food Chemistry, 2012, 132(2): 759-765.
[19] ZHAO G, PENG L, WANG S, et al. HPLC fingerprint: antioxidant properties study of buckwheat[J]. Journal of Integrative Agriculture, 2012, 11(7): 1111-1118.
[20] ZHANG Yuping, SHI Shuyun, WANG Yuanxi, et al. Target-guided isolation and puri cation of antioxidants from Selaginella sinensis by of ine coupling of DPPH-HPLC and HSCCC experiments[J]. Journal of Chromatography B, 2011, 879 (2): 191-196.
[21] WETTASINGHE M, SHAHIDI F. Scavenging of reactive-oxygen species and DPPH free radicals by extracts of borage and evening primrose meals[J]. Food Chemistry, 2000, 70(1): 17-26.
[22] ZALIBERA M, STAŠKO A, ŠLEBODOV˘ A, et al. Antioxidant and radical-scavenging activities of Slovak honeys: an electron paramagnetic resonance study [J]. Food Chemistry, 2008, 110(2): 512-521.
[23] AWAH F M, UZOEGWU P N, OYUGI J O, et al. Free radical scavenging activity and immunomodulatory effect of Stachytarpheta angustifolia leaf extract[J]. Food Chemistry, 2010, 119(4): 1409-1416.
[24] CIEŚLA Ł, KRYSZEŃ J, STOCHMAL A, et al. Approach to develop a standardized TLC-DPPH· test for assessing free radical scavenging properties of selected phenolic compounds[J]. Journal of Pharmaceutical and Biomedical Analysis, 2012, 70: 126-135.
[25] GIL M I, TOM˘S-BARBER˘N F A, HESS-PIERCE B, et al. Antioxidant activity of pomegranate juice and its relationship with phenolic composition and processing[J]. Journal of Agricultural and Food Chemistry, 2000, 48(10): 4581-4589.
[26] TANG D, LI H J, CHEN J, et al. Rapid and simple method for screening of natural antioxidants from Chinese herb Flos Lonicerae Japonicae by DPPH-HPLC-DAD-TOF/MS[J]. Journal of Separation Science, 2008, 31(20): 3519-3526.
[27] THAIPONG K, BOONPRAKOB U, CROSBY K, et al. Comparison of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts[J]. Journal of Food Composition and Analysis, 2006, 19(6/7): 669-675.
[28] LOCATELLI M, GINDRO R, TRAVAGLIA F, et al. Study of the DPPH·-scavenging activity: Development of a free software for the correct interpretation of data[J]. Food Chemistry, 2009, 114(3): 889-897.
[29] MISHRA K, OJHA H, CHAUDHURY N K. Estimation of antiradical properties of antioxidants using DPPH· assay: a critical review and results[J]. Food Chemistry, 2012, 130(4): 1036-1043.
[30] LIM Y Y, LIM T T, TEE J J. Antioxidant properties of several tropical fruits: a comparative study[J]. Food Chemistry, 2007, 103(3): 1003-1008.
[31] CHEN Z, BERTIN R, FROLDI G. EC50 estimation of antioxidant activity in DPPH· assay using several statistical programs[J]. Food Chemistry, 2013, 138(1): 414-420.
[32] DAWIDOWICZ A L, WIANOWSKA D,OLSZOWY M. On practical problems in estimation of antioxidant activity of compounds by DPPH· method (Problems in estimation of antioxidant activity)[J]. Food Chemistry, 2012, 131 (3): 1037-1043.
[33] AYRES G H. Evaluation of accuracy in photometric analysis[J]. Analytical Chemistry, 1949, 21(6): 652-657.
[34] SLOANE H J, WILLIAM S G. Spectrophotometric accuracy, linearity and adherence to Beer’s law[J]. Applied Spectroscopy, 1977, 31(1): 25-30.
[35] ELZAAWELY A A, XUAN T D, TAWATA S. Essential oils, kava pyrones and phenolic compounds from leaves and rhizomes of Alpinia zerumbet (Pers.) B.L. Burtt and R.M. Sm and their antioxidant activity[J]. Food Chemistry, 2007, 103(2): 486-494.
[36] DENG J, CHENG W Y, YANG G Z. A novel antioxidant activity index (AAU) for natural products using the DPPH assay[J]. Food Chemistry, 2011, 125(4): 1430-1435.
[37] BAYDAR N G, ÖZKAN G, YASAR S. Evaluation of the antiradical and antioxidant potential of grape extracts[J]. Food Control, 2007, 18(9): 1131-1136.
[38] AZEVEDO J, FERNANDES I, FARIA A, et al. Antioxidant properties of anthocyanidins, anthocyanidin-3-glucosides and respective portisins[J]. Food Chemistry, 2010, 119(2): 518-523.
[39] AL-DABBAS M M, AL-ISMAIL K, KITAHARA K, et al. The effects of different inorganic salts, buffer systems, and desalting of Varthemia crude water extract on DPPH radical scavenging activity[J]. Food Chemistry, 2007, 104 (2): 734-739.
[40] RUBERTO G, RENDA A, DAQUINO C, et al. Polyphenol constituents and antioxidant activity of grape pomace extracts from ve Sicilian red grape cultivars[J]. Food Chemistry, 2007, 100(1): 203-210.
[41] XU J, CHEN S, HU Q. Antioxidant activity of brown pigment and extracts from black sesame seed (Sesamum indicum L.)[J]. Food Chemisrty, 2005, 91(1): 79-83.
[42] MOLYNEUX P. The use of the stable free radical diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity[J]. Songklanakarin Journal of Science and Technology, 2004, 26(2): 211-219.
[43] LIU D H, SHI J, IBARRA A C, et al. The scavenging capacity and synergistic effects of lycopene, vitamin E, vitamin C, and b-carotene mixtures on the DPPH free radical[J]. Food Science and Technology, 2008, 41(7): 1344-1349.
[44] TEOW C C, TRUONG V D, MCFEETERS R F, et al. Antioxidant activities, phenolic and β-carotene contents of sweet potato genotypes with varying esh colours[J]. Food Chemistry, 2007, 103(3): 829-838.
[45] CUI Y, KIM D S, PARK K C. Antioxidant effect of Inonotus obliquus[J]. Journal of Ethnopharmacology, 2005, 96(1/2): 79-85.
[46] MEDA A, LAMIEN C E, ROMITO M, et al. Determination of the total phenolic, avonoid and proline contents in Burkina Fasan honey, as well as their radical scavenging activity[J]. Food Chemistry, 2005, 91(3): 571-577.
[47] YUAN Y V, BONE D E, CARRINGTON M F. Antioxidant activity of dulse (Palmaria palmata) extract evaluated in vitro[J]. Food Chemistry, 2005, 91(3): 485-494.
[48] LI H Y, DENG Z Y, ZHU H H, et al. Highly pigmented vegetables: Anthocyanin compositions and their role in antioxidant activities[J]. Food Research International, 2012, 46(1): 250-259.
[49] GUIL-GUERRERO J L, MART¸NEZ-GUIRADO C, REBOLLOSOFUENTES M M, et al. Nutrient composition and antioxidant activity of 10 pepper (Capsicum annuun) varieties[J]. European Food Research and Technology, 2006, 224(1): 1-9.
[50] S˘NCHEZ-MORENO C, LARRAURI J A, SAURA-CALIXTO F. A procedure to maesure the antiradical ef ciency of polyphenols[J]. Journal of the Science of Food and Agriculture, 1998, 76(2): 270-276.
[51] MAGALH‹E L M, SEGUNDO M A, REIS S, et al. Automatic method for determination of total antioxidant capacity using 2,2-diphenyl-1-picrylhydrazyl assay[J]. Analytica Chimica Acta, 2006, 558(1/2): 310-318.
[52] LITWINIENKO G, INGOLD K U. Abnormal solvent effects on hydrogen atom abstraction. 1. The reactions of phenols with 2,2-diphenyl-1-picrylhydrazyl(DPPH·) in alcohols[J]. The Journal of Organic Chemistry, 2003, 68(9): 3433-3438.
[53] ROBERTO L S. Organic acids influence on DPPH· scavenging by ascorbic acid [J]. Food Chemistry, 2008, 107(1): 40-43.
Advances in the DPPH Radical Scavenging Assay for Antioxidant Activity Evaluation
WEI Xian-ya1, YIN Li-qin1, ZHONG Cheng2, ZHANG Ming-hai1, NIU Ying-ze1,*
(1. Rapeseed Research Center, Sichuan Agricultural University, Chengdu 611130, China; 2. Maize Research Institute, Sichuan Agricultural University, Chengdu 611130, China)
in vitro evaluation of the antioxidant activity of plant compounds or plant extracts is an important aspect of functional factor research. The DPPH (1-diphenyl-2-picrylhydrazyl) radical scavenging assay is widely used for antioxidant activity evaluation of plant compounds and extracts. However, this method lacks a standardized program so that results from different experiments may be difficult to compare with each other. The present review presents a comprehensive overview of the principle, measurement procedure and wavelength, initial DPPH free radical concentration, reaction time, calculation of the scavenging rate, expression of results and evaluation indices. Several external factors influencing the DPPH assay are also discussed.
DPPH method; free radical; antioxidant; antioxidant activity
TS207.3
A
1002-6630(2014)09-0317-06
10.7506/spkx1002-6630-201409062
2013-06-25
四川省科技计划项目(12CGZHZX0712);四川省教育厅重点科技项目(11LD018)
韦献雅(1980—),女,博士研究生,研究方向为作物遗传育种。E-mail:442891531@qq.com
*通信作者:牛应泽(1955—),男,教授,博士,研究方向为作物遗传育种。E-mail:niuyz01@126.com



