甘凝岚,颜春荣,徐春祥
(江苏省产品质量监督检验研究院,江苏 南京 210007)
甲醛具有强烈的刺激性气味,对人体具有较高的毒性,长期接触对神经系统、肺、肝脏均有损害[1]。世界卫生组织将甲醛确定为致癌、致畸物质和公认的变态反应源[2],我国食品添加剂使用卫生标准中规定严禁将甲醛及其化合物用作食品添加剂[3-4]。近来不断有鸭血中发现甲醛的报道,在鸭血中加入甲醛,可使鸭血长时间保鲜,不易腐烂,与此同时,还可以促进蛋白质的凝固,提高鸭血韧度,起到增加口感的作用[5]。但甲醛极易残留在鸭血中大量小孔上,消费者在食用时并无法有效清洗鸭血中的残留甲醛,这必将对消费者造成极大的伤害。若残留物中超过10 mL的甲醛被人食用,则将直接威胁到生命安全。因此,为保障消费者食品安全,有必要针对鸭血中甲醛含量研究出快速、准确的高效液相色谱检测方法。
目前,常用的甲醛检测方法主要有分光光度法[6]、气相色谱法[7]、高效液相色谱法[8-11]、示波极谱法[12]、流动注射化学发光法等[13]。分光光度法由于前处理采用蒸馏法[14-17],操作不易控制,回收率较低;示波极谱法多用于公共场所空气中的甲醛的测定;流动注射化学发光法多用于密胺餐具浸泡液中甲醛的测定。与之相比,色谱法[18-21]多用于食品中甲醛的测定,具备准确度高、抗干扰能力强等特点[22],能够更好地对样品中目标物进行准确地定性、定量。目前在已有文献中,高效液相色谱法测定甲醛的前处理方法较为复杂,例如需要提取后再衍生化、需要精确调节衍生液pH值、衍生化时间过长等,本实验通过对提取条件和衍生条件等进行方法学研究,建立了适合用于鸭血中甲醛测定的高效液相色谱方法。
1 材料与方法
1.1 材料与试剂
所用水为煮沸10 min后冷却的超纯;所用器皿用水洗净后再于100 ℃烘箱内烘1~2 h。
甲醛标准溶液 国家标准物质中心;乙腈(色谱纯)、乙酸钠 国药集团化学试剂有限公司;2,4-二硝基苯肼(纯度≥99%) 上海试剂总厂第三分厂。
1.2 仪器与设备
2695型高效液相色谱仪(配有紫外检测器和Epower色谱工作站) 美国Waters公司;SB-520DT型超声波清洗机 宁波新芝生物科技有限公司;Avanti J-E型离心机 美国贝特曼库尔特公司;XS-205DU型电子天平瑞士梅特勒-托利多公司;XW-80A漩涡混合器 上海青浦沪西仪器厂;DK-98-Ⅱ电炉 天津市泰斯特仪器有限公司;HH-2恒温水浴锅 国华电器有限公司;IKA T18型匀浆机 广州仪科实验室技术有限公司。
1.3 方法
1.3.1 色谱条件
色谱柱:Waters SunFireC18(4.6 mm×250 mm,5 µm);流动相:甲醇-水(65∶35,V/V);流速:1 mL/min;检测波长:365 nm;柱温:30 ℃;进样量:10 µL。
1.3.2 样品处理
1.3.2.1 溶液配制
2,4-二硝基苯肼乙腈溶液:称取300 mg 2,4-二硝基苯肼用乙腈定容至500 mL,配制成0.6 g/L 2,4-二硝基苯肼乙腈溶液;衍生液:将配制好的2,4-二硝基苯肼腈溶液与超纯水按体积比1∶1混合均匀;缓冲溶液:称取2.64 g乙酸钠,以水溶解,加入1.0 mL冰乙酸,用水定容至500 mL。
1.3.2.2 样品提取
准确称取用匀浆机粉碎后的试样1 g(精确至0.01 g),于50 mL具塞离心管中,准确加入20 mL衍生液,涡旋混合均匀,40 ℃超声40 min后取出后冷却至室温。
1.3.2.3 样品净化
将提取液以8 000 r/min离心3 min,取适量上清液过0.45 µm微孔滤膜过滤,滤液供液相色谱测定。
1.3.3 标准曲线溶液的配制
分别吸取不同体积甲醛标准液,按1.3.2节所述衍生后,制成质量浓度为0.4、1、2、3、4、5、6 µg/mL标准曲线溶液,进行高效液相色谱紫外检测,根据样品的保留时间定性,以峰面积为纵坐标,以甲醛质量浓度为横坐标,绘制标准曲线。
2 结果与分析
2.1 衍生液的选择
2,4-二硝基苯肼是甲醛色谱分析中常用的衍生化试剂,易溶于有机酸、甲醇和乙腈,微溶于水。为了增加其溶解性一般采用稀盐酸作为介质。但甲醛与2,4-二硝基苯肼在弱酸性缓冲溶液中反应结果极不稳定,影响衍生化效率。本实验用乙腈配制2,4-二硝基苯肼,使衍生试剂有足够溶解性,保证衍生化效率。
实验比较了2,4-二硝基苯肼乙腈溶液-水(1∶1,V/V)、2,4-二硝基苯肼乙腈溶液-pH 5缓冲溶液(1∶1,V/V)、2,4-二硝基苯肼乙腈溶液-pH 2缓冲溶液(1∶1,V/V),分别对同一鸭血样品的甲醛衍生液进行测定。结果见图1。结果表明:超纯水的体系中甲醛的测定值最高;pH 2体系的甲醛测定值与pH 5体系接近,因此实验选用超纯水作为衍生化提取液。
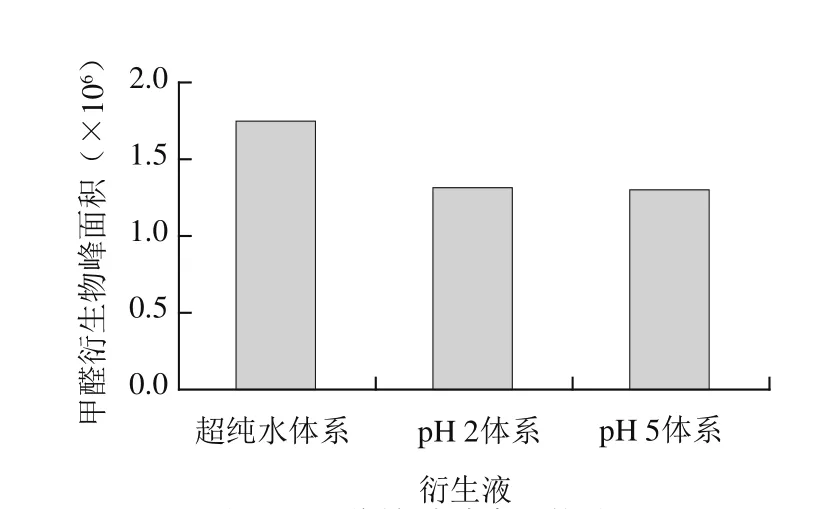
图1 不同衍生液实验结果Fig.1 Selection of optimal derivatization agent for formaldehyde
2.2 衍生反应时间的选择
实验研究了衍生时间分别为 20、30、40、50、60 min时,同一样品衍生液中甲醛的含量。检测结果见图2,结果表明,随着时间的延长测得甲醛衍生物的峰面积逐渐增大,在40 min后趋于平缓因此,实验选用40 min为样品衍生反应时间。
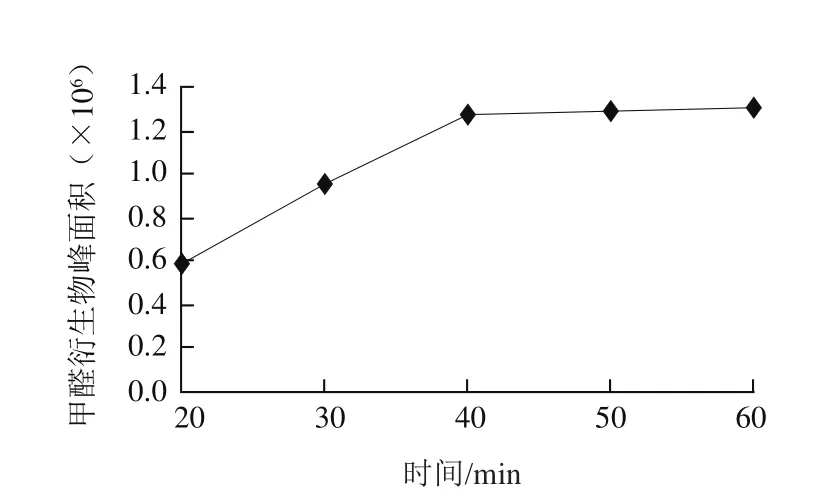
图2 衍生时间对反应的影响Fig.2 Selection of optimal derivatization time
2.3 方法验证
2.3.1 最低检出限和定量限
准确称取1 g空白样品,用20 mL衍生液提取后,以进样量10 µL基线噪音的3 倍为最低检出限计算,甲醛的最低检出限约为0.2 mg/kg。以进样量10 µL基线噪音的10 倍为最低定量限计算,甲醛的最低定量限约为0.5 mg/kg。
2.3.2 工作曲线和线性范围
分别吸取1.3.3节配制的系列标准工作液,按1.3.1节色谱条件上机测定,以峰面积Y对甲醛质量浓度X计算线性回归方程。在线性范围0.4~6.0 µg/mL,回归方程为Y=2.80×105X-2.51×104,线性相关系数0.999 7。
2.3.3 精密度实验
吸取标准工作液0.4、3.0 µg/mL和6.0 µg/mL,重复进样6 次,以峰面积计算精密度,结果见表1。相对标准偏差值介于1.95%~2.38%之间,精密度良好。
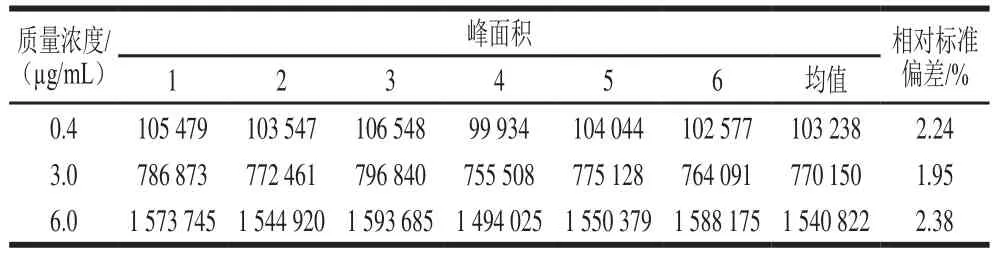
表1 精密度实验结果Table 1 Precision of the method
2.3.4 回收率
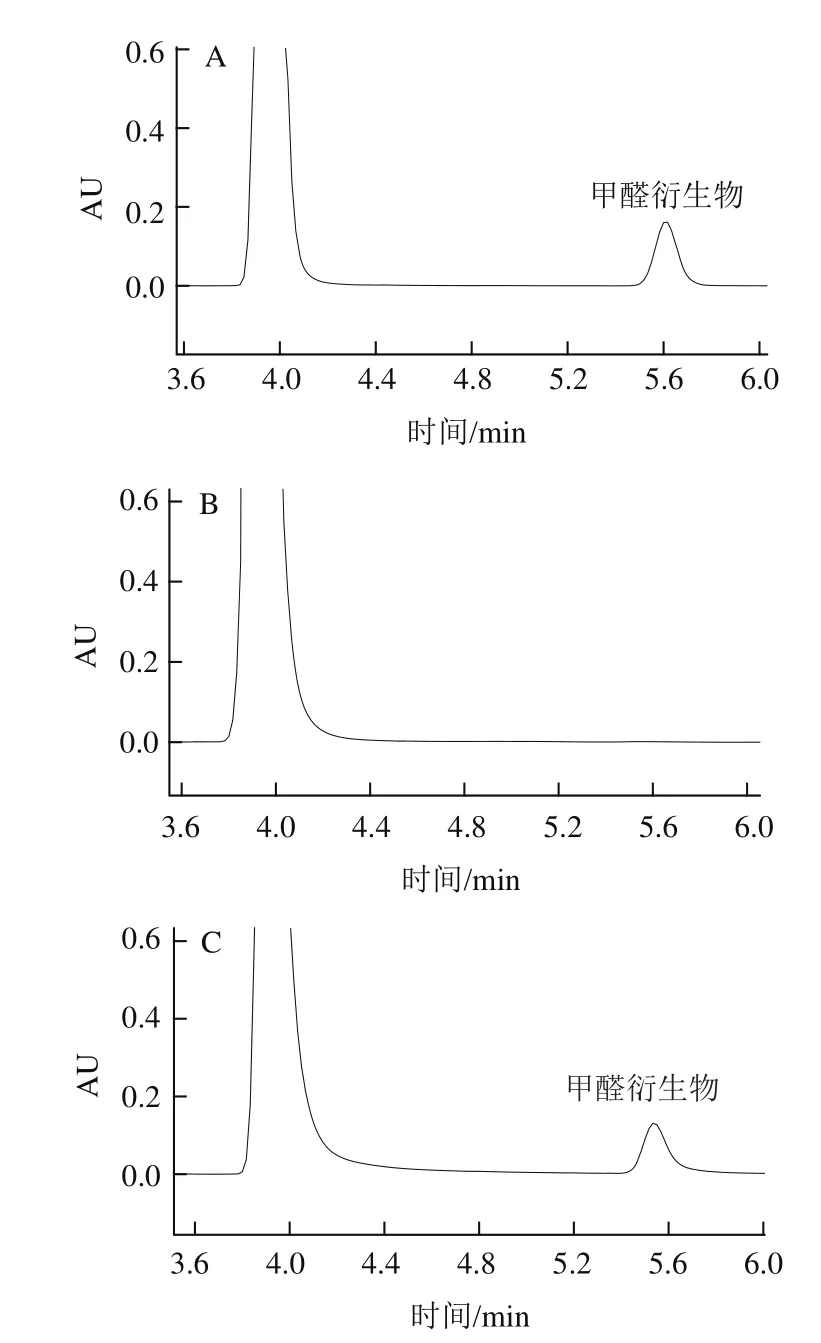
图3 3 mg/L甲醛标准溶液(A)、鸭血样品(B)、鸭血样品3 mg/L甲醛加标(C)色谱图Fig.3 Chromatograms of formaldehyde standard (3 mg/L) (A), duck blood product sample (B), spiked duck blood product sample (3 mg/L) (C)
取空白鸭血样品9 份,按低、中、高3 个水平加标,按照1.3.2节样品处理方法处理样品后,按1.3.1节色谱条件上机测定,色谱图见图3,测得甲醛的加标回收率见表2。回收率范围为85.1%~92.7%,相对标准偏差均小于5.0%,符合分析要求。
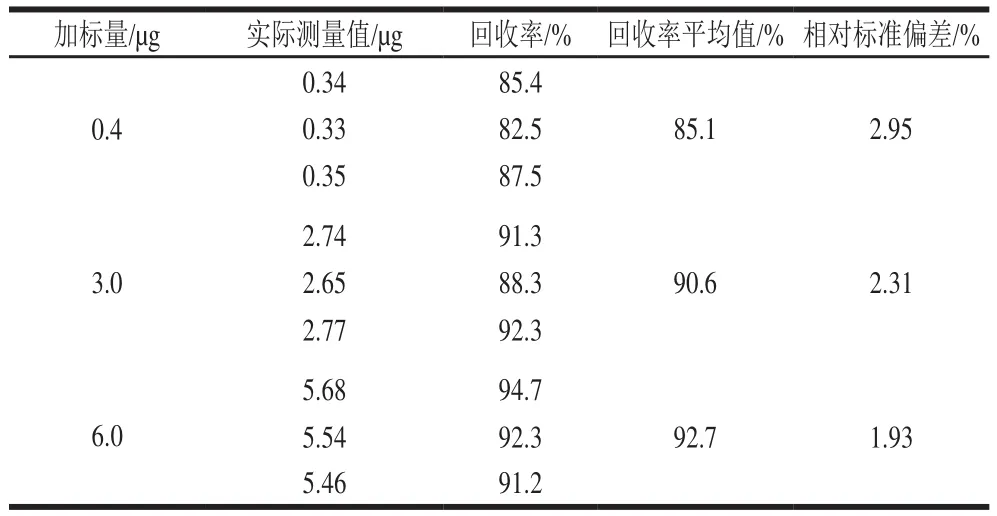
表2 样品加标回收率Table 2 Recovery of formaldehyde in spiked samples
2.4 未知样品中甲醛含量的测定
利用本方法对某市公安局提供的5 个批次的鸭血样品进行检测,检测结果见表3。由检测结果分析,未添加甲醛的血液样品未检出甲醛,可以排除血液甲醛本底的干扰,其余4 批次鸭血块均为阳性。且测得甲醛含量较高,可推断为人为添加甲醛的样品。

表3 实际鸭血样品中甲醛的含量(n=3)Table 3 Formaldehyde contents in real samples determined by the method (n=3)
3 结 论
本实验建立了柱前衍生、液相色谱-紫外检测器对鸭血进行检测。结果表明,本方法可以基本排除鸭血制品中本底值的干扰,若检出阳性样品,则人为添加的可能性极大。该方法无需调节衍生液pH值且提取与衍生化同时进行,大大缩短前处理时间,具有前处理操作简便、灵敏度高、专属性强、精密度高等优点,且本方法定量限达到0.5 mg/kg,可以为鸭血制品中甲醛的检测提供较为准确、可靠地分析方法,为鸭血制品的质量控制和安全评价提供科学依据。
[1]洪志强, 童智敏, 施健.甲醛对作业工人呼吸系统及肺功能影响[J].中国公共卫生, 2007, 23(7): 849-850.
[2]PEARON D.The chemical analysis of food[C].7th ed.New York:Churchill Livingstone, 1976: 40-41.
[3]GB 2760—2011 食品添加剂使用标准[S].
[4]张文德.食品中甲醛的来源及检测意义[J].中国食品卫生杂志,2006, 18(5): 455-459.
[5]关婕.海产品浸泡液中甲醛含量的测定[J].中国卫生工程学, 2002,1(1): 49.
[6]杜永芳, 柳淑芳, 马敬军, 等.测定水产品中甲醛含量的分光光度法研究[J].中国食品科学报, 2005, 5(3): 91-96.
[7]闫树刚, 刘慧, 朱力, 等.甲醛的快速检测方法之研究[J].中国农学通报, 2003, 19(3): 122-125.
[8]陈笑梅, 施旭霞, 朱卫建, 等.高效液相色谱直接测定甲醛衍生物反应条件的研究[J].分析化学, 2004, 32(11): 1489-1491.
[9]马敬军, 周德庆, 柳淑芳, 等.二硝基苯肼衍生-高效液相色谱法测定水产品中甲醛含量的研究[J].海洋水产研究, 2005, 26(1): 28-31.
[10]郑斌, 陈伟斌, 徐晓林, 等.液相色谱法测定水产品中游离甲醛含量的研究[J].浙江海洋学院学报: 自然科学版, 2006, 25(4): 355-358; 384.
[11]汤建春.高效液相色谱法测定水发食品中的甲醛[J].四川省卫生管理干部学院学报, 2004, 23(2): 89-90.
[12]罗靖, 蒲登荣, 张玉美, 等.酚酞试剂-示波极谱法测定公共场所空气中甲醛[J].预防医学情报杂志, 2010, 26(3): 238-240.
[13]嵇正平, 王俊, 韩静, 等.流动注射化学发光法测甲醛含量的研究[J].分析实验室, 2011, 32(8): 23-26.
[14]AOAC Of ficial method 931.08 formaldehyde in food[S].
[15]NY/T 1283—2007 香菇中甲醛含量的测定[S].
[16]DB33/T 555—2005 植物源食品中甲醛残留量的测定: 高效液相色谱法[S].
[17]SC/T 3025—2006 水产品中甲醛的测定[S].
[18]YAMAZAKI H, OGASAWARA Y, SAKAI C, et al.Studies on formaldehyde in lentinus edodes[J].Journal of the Food Hygiene Society of Japan, 1980, 21(3): 165-170.
[19]吕维影, 常洁, 姜秋实, 等.水发产品中甲醛测定方法的研究[J].中国现代实用医学杂志, 2004, 2(4): 20-21.
[20]GB/T 21126—2007 小麦粉与大米粉及其制品中甲醛次硫酸氢钠含量的测定[S].
[21]SN/T 1547—2011 进口食品中甲醛的测定液相色谱法[S].
[22]周群慧, 彭琨, 王洋.食品中甲醛测定新进展及各种方法的比较[J].食品科技, 2004, 29(10): 76-79.



