蔡颖慧,潘佩平,黄 潇,苏槟楠,王慕华
(1.山西省生物研究所,山西 太原 030006;2.山西省分析科学研究院,山西 太原 030006)
红曲霉(Monascus purpureus Went),散囊菌目中的一属子囊菌曲霉科真菌,可产生红曲色素、糖化酶、酯化酶和蛋白酶等各种酶类,广泛应用于食品着色、酿酒、食品发酵[1-2]。1979年日本学者发现红曲霉可产生Monacolin K,具有降胆固醇、降血压的功能[3]。此外,红曲霉还能产生抑菌物质、抗氧化、麦角固醇等多种活性物质[4-5]。近年来,不少研究致力于利用红曲霉代谢产物来治疗非酒精性脂肪性肝病及骨质疏松等多种疾病[6]。
琥珀酸(succinic acid),学名为丁二酸,是一种理想的风味增强剂,它的存在,可以减少酸味刺激感,入口而觉绵软。琥珀酸是合成许多高附加值产品的重要前体物质,在食品及化工行业广泛应用[7],由于化学法制备琥珀酸会对环境造成污染,近年来利用微生物发酵生产琥珀酸受到广泛关注[8-9]。
实验室从老陈醋用大曲中分离到1株红曲霉菌株Monascus purpureus M1,该菌株产酯化酶能力强。红曲霉酯化酶具有强的催化已酸乙酯的能力,酯化酶酶促反应产物在酿酒中起着重要的增香作用[10]。但目前关于对红曲霉产琥珀酸的动态变化规律研究尚少。
本实验将红曲霉传统功能与新的研究方面相结合,对Monascus purpureus M1产琥珀酸及酯化酶动态变化情况进行跟踪测定,寻找红曲霉发酵积累琥珀酸与酯化酶的最佳条件,为进一步研究实现琥珀酸和酯化酶的联产提供理论基础和数据支持,为红曲霉在食品发酵进一步开发应用提供参考。
1 材料与方法
1.1 菌株、试剂与培养基
菌株:红曲霉M1(Monascus purpureus M1),实验室分离自老陈醋用大曲。
琥珀酸(色谱纯) 美国Supelco公司;其余试剂均为分析纯。
斜面培养基(g/L):葡萄糖40、蛋白胨15、MgSO4•7H2O 1、K2HPO4•3H2O 1.5、琼脂20,pH值自然。
种子培养基(g/L):葡萄糖50、蛋白胨15、MgSO4•7H2O 1、K2HPO4•3H2O 1.5,pH值自然。
发酵培养基(g/L):葡萄糖50、可溶性淀粉60、蛋白胨15、MgSO4•7H2O 1、K2HPO4•3H2O 1.5,pH值自然。以上培养基0.1 MPa、121℃湿热灭菌20 min[11]。
1.2 仪器与设备
UV-2450 型紫外分光光度计 日本岛津公司;ZKSY-600智能恒温水浴锅 南京科尔仪器设备有限公司;1100系列高效液相色谱仪 美国惠普公司;JS-HS冷冻离心机 美国Beckman公司;PHS-3C型精密pH计上海雷磁仪器厂。
1.3 培养方法
种子培养:以5 mL无菌水洗下斜面培养的菌体,制成1×106个/mL的孢子悬浮液,取悬浮液5 mL接至装液量为50 mL/250 mL三角瓶的种子培养基中,30℃摇床振荡(180 r/min)培养2 d。
摇瓶培养:按10%接种量将培养好的种子液体,接至装液量为50 mL/250 mL三角瓶的发酵培养基中,30℃摇床振荡(180 r/min)培养10 d。
1.4 菌体干质量测定
每天取适量发酵液,经恒重滤纸过滤,将滤纸连菌体在105℃烘至恒质量,称量,即可求得菌体干质量[11]。
1.5 琥珀酸测定
将红曲霉发酵液与菌丝体分离,取5 mL红曲霉生长各阶段发酵液,超滤离心(PES膜,10 kD)[12]除去菌体后,取1 mL 上清液进行适当稀释即得到待测液。色谱条件:色谱分离柱:Eclipse XDB-C8(4.6 mm×150 mm,5 μm);保护柱:HP hypersil ODS C18(2.1 mm×20 mm,5 μm);流动相:0.005 mol/L pH 2.5硫酸水溶液;流动相流速:1 mL/min;检测器:可变波长检测器;进样量:10 μL;柱温:室温[13]。
1.6 酯化酶活力测定
将红曲霉发酵液与菌丝体进行分离,取5 mL 红曲霉生长各阶段发酵液,离心(10 000 r/min、10 min)除去菌体,取1 mL上清液进行适当稀释即得到待测液。
取稀释后的酶液0.5 mL,加入pH 6.0的磷酸缓冲液3.0 mL和2.5 mmol/L醋酸-α-萘酯0.1 mL,37℃保温15 min,加入固兰B盐0.4 mL,37℃保温10 min,以不加醋酸-α-萘酯空白管调零,立即在528 nm波长处测定光密度。酶活力定义:37℃、15 min水解醋酸-α-萘酯产生1 nmol α-萘酚所需的酶量,单位为U/mL[14]。
1.7 红曲霉培养条件优化
1.7.1 接种量的影响
接种量设置为8%、10%、12%(接种量均为体积分数,下同)。温度30℃、转速180 r/min培养9 d。
1.7.2 pH值的影响
发酵培养基初始pH值设置为2.5~7.5,温度30℃、转速180 r/min,培养6 d。
1.7.3 正交试验
根据单因素试验结果及发酵过程中的实际情况,进行适当调整,拟定不同因素水平。考察接种量、pH值、发酵温度、转速对产琥珀酸量及酯化酶活力的影响,寻找红曲霉发酵过程最佳组合,采用L9(34)正交试验。
1.7.4 菌形实验
将前培养过程中得到的不同形态(团状、丝状、颗粒状)的菌体以10%的接种量转接到初始pH 6.5的红曲霉发酵培养基,30℃、180 r/min培养6 d。
2 结果与分析
2.1 红曲霉生长曲线及琥珀酸含量变化规律
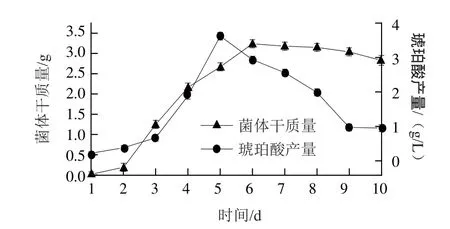
图1 红曲霉生长曲线及琥珀酸含量变化Fig.1 Growth curve of Monascus purpureus and changes in succinic acid production
由图1可知,红曲霉在3~6 d红曲霉的生长比较快,在第6天菌体干质量达到最大值3.24 g,之后菌体量就略微下降,说明红曲霉从第6天开始进入衰亡期。在红曲霉生长第2天即有琥珀酸的出现,随着时间的延长,琥珀酸含量逐渐增加,在红曲霉生长的第5天左右即达到最大值3.62 g/L,之后琥珀酸含量明显下降。
琥珀酸是三羧酸循环的中间体,霉菌中普遍存在丙酮酸羧化支路,代谢过程中琥珀酸脱氢酶活性减弱,琥珀酸积累,并且琥珀酸属于小分子物质,可以透过细胞膜释放到细胞膜外[15]。在本实验中琥珀酸质量浓度先增后减,由此推测,琥珀酸的产生主要是作为红曲霉三羧酸循环代谢途径的中间产物[16],它在不断生成也在不断消耗。
2.2 红曲霉产琥珀酸及酯化酶变化规律
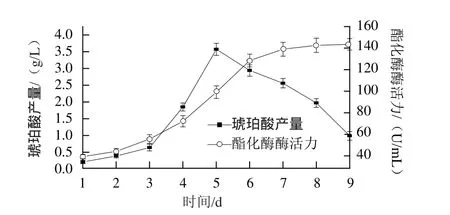
图2 红曲霉生长过程中琥珀酸含量及酯化酶活性的变化Fig.2 Changes in succinic acid and esterifying enzyme production during the growth of Monascus purpureus
由图2可知,红曲霉积累酯化酶与琥珀酸的最高峰并不在同一时期,琥珀酸在红曲霉生长的第5天达到最大值,而酯化酶在红曲霉的生长过程中不断的积累。酯化酶在酶学上是解酯酶的统称,包括脂肪酶和酯酶,同糖化酶一样,也是红曲霉产生的一种一级代谢产物[17],酯化反应中两种酶的比例对酯的生成产生影响。红曲霉酯化酶的代谢极为复杂,目前对其作用机理及代谢产物形成特点的报道甚少。
发酵第5天琥珀酸质量浓度最高,为3.57 g/L,此时酯化酶活力为99.14 U/mL,随后琥珀酸质量浓度下降,而酯化酶不断积累,总酶活力缓慢增加。发酵第6天,琥珀酸质量浓度2.94 g/L ,而酯化酶活力为128.5 U/mL,发酵至第9天,可达143.65 U/mL。随后琥珀质量浓度下降较为明显,而酯化酶活力增加缓慢。因而,为兼顾琥珀酸及酯化酶的产量,初步认为,发酵至第6天为最佳积累期。
2.2.1 不同接种量时红曲霉产琥珀酸及酯化酶变化规律
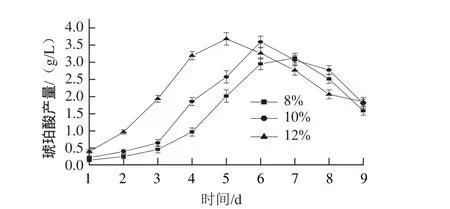
图3 不同接种量下红曲霉产琥珀酸变化规律Fig.3 Dynamics of succinic acid production with different inoculum size by Monascus purpureus
如图3所示,接种量为12%时,红曲霉产琥珀酸在第5天达到最高值3.68 g/L,但随后迅速下降,当接种量为10%和8%时,红曲霉产琥珀酸最高峰均有所延迟,第6天达到最高峰,下降速度也较为缓慢,琥珀酸最高质量浓度分别为3.59 g/L和2.95 g/L。
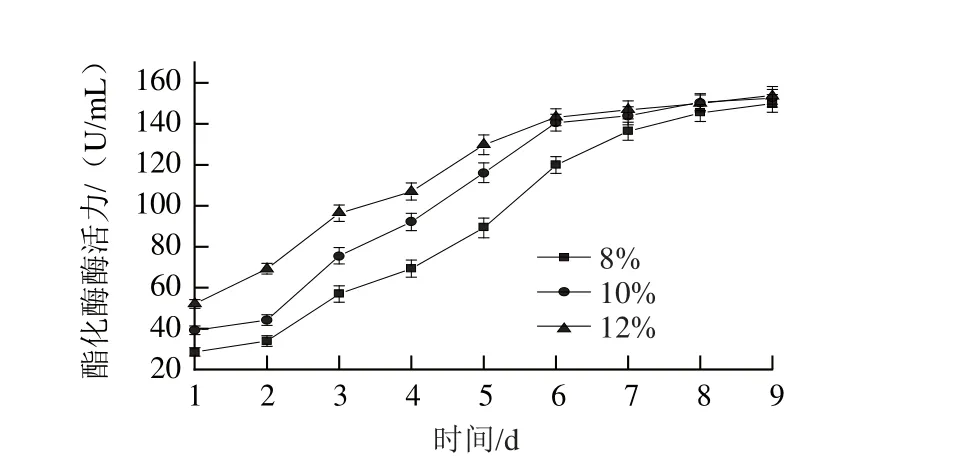
图4 不同接种量下红曲霉产酯化酶变化规律Fig.4 Dynamic changes in esterifying enzyme activities from Monascus purpureus with different inoculum sizes
如图4所示,红曲霉生长前期产酯化酶随着接种量的增加而有所提高,随着时间的增加,酯化酶积累速率有所下降,最终至红曲霉生长第9天,总的积累量极为接近。接种量为12%、10%、8%时,发酵至第5天,酯化酶总活力分别为129.78、116.14、89.20 U/mL;发酵至第6天,酯化酶总活力分别为143.22、140.65、119.91 U/mL。
接种量小,菌体生长缓慢,发酵周期延长,菌体活力低,诱导次级代谢产物产生的酶少,琥珀酸及酯化酶产量小。接种量大,菌体生长旺,较快达到稳定期,琥珀酸被菌体自身利用的速度加快,而且培养液黏度增加,影响后期产物积累。总的来看,琥珀酸质量浓度在第5~6天变化不大,而酯化酶变化较大。综合考虑,接种量10%、发酵第6天结束,可兼顾琥珀酸及酯化酶的积累。
2.2.2 pH值对红曲霉产琥珀酸及酯化酶的影响
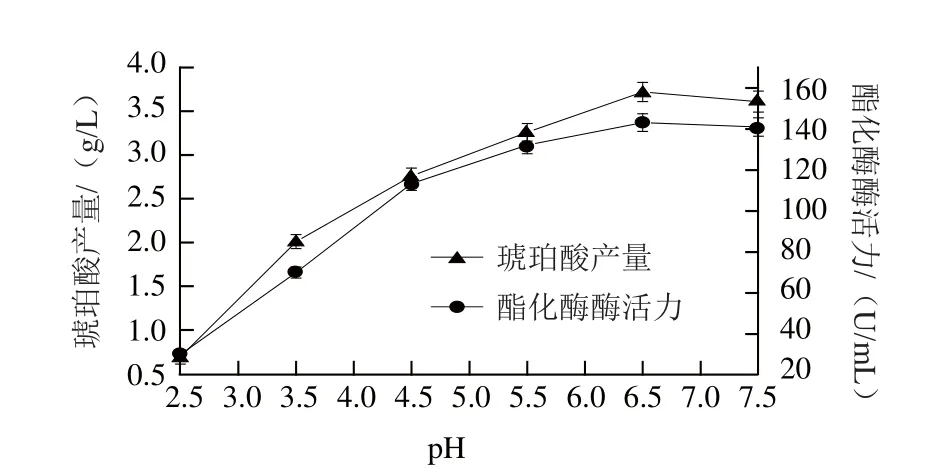
图5 不同pH值条件下红曲霉产琥珀酸含量及酯化酶活性变化Fig.5 Changes in succinic acid and esterifying enzyme production by Monascus purpureus at different initial pH values
发酵至第6天,测定培养基初始pH 2.5~7.5范围内红曲霉产琥珀酸含量及酯化酶活力,结果如图5所示。pH 2.5时,红曲霉产琥珀酸及酯化酶活力都比较低,随着pH值的升高,琥珀酸含量及酯化酶活力均提高。pH 6.5时,琥珀酸含量及酯化酶活力最高,分别为3.72 g/L和 143.62 U/mL。
很可能低pH值能够抑制三羧酸循环中一些关键酶(顺乌头酸酶、异柠檬酸脱氢酶)的活性,从而抑制了三羧酸循环,导致中间代谢产物琥珀酸的积累降低[18],同时也影响红曲霉生长代谢,最终导致酯化酶产量降低,并且低pH值还会破坏酯化酶的活性。另外,低pH值也可能影响红曲霉细胞膜所带电荷的状态,改变细胞膜的通透性,进而影响微生物对营养物质的吸收和代谢产物的排泄。实验还发现,低pH值还可以改变红曲霉在液体培养中的菌体形态,促进紧密菌团的形成。
2.2.3 正交试验结果
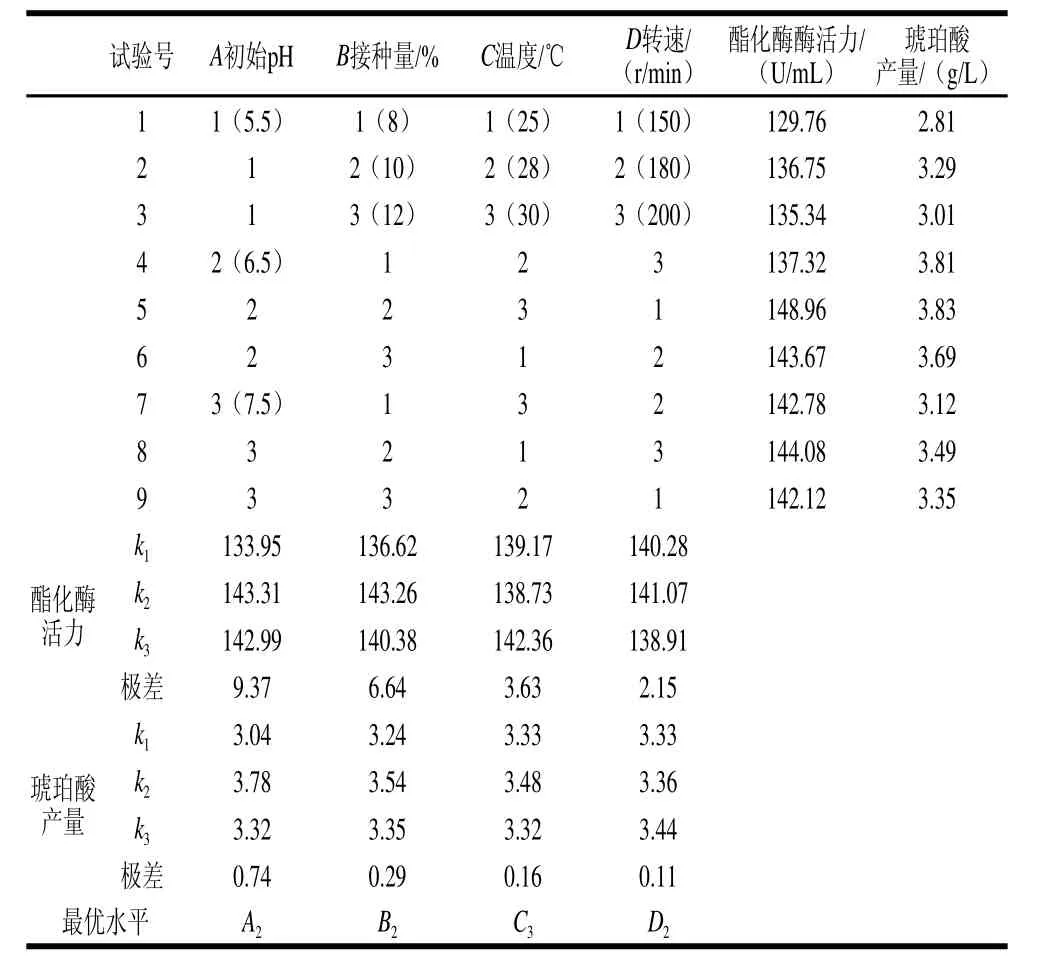
表1 正交试验设计与结果Table1 Orthogonal array design with experimental results
表1结果表明,在几个影响因子中,极差结果为A>B>C>D,说明初始pH值为影响红曲霉产琥珀酸及酯化酶的最主要因素,其次为接种量、温度和转速。正交试验得出的最优组合为A2B2C3D2,即接种量10%、初始pH 6.5、温度30℃、转速180 r/min。
2.2.4 菌体形态对红曲霉产琥珀酸及酯化酶的影响

表2 不同形态菌体产琥珀酸及酯化酶的差异Table2 Comparison of the abilities of different forms of Monascus purpureus to produce succinic acid and esterifying enzymes
相比于团状、丝状菌体,颗粒状菌体发酵液表观黏度较低,由表2可知,菌体呈颗粒状的红曲霉产琥珀酸及酯化酶的能力明显高于丝状及团状红曲霉,颗粒状菌体发酵状态下,琥珀酸积累量达到3.79 g/L,酯化酶活力可达到152.36 U/mL。而团状红曲霉30℃培养6 d后,琥珀酸的积累量仅为3.28 g/L,酯化酶活力仅达到117.72 U/mL。很多研究结果证明,在液体发酵过程中,丝状真菌的形态对产物的生产有很大的影响,菌体形态可以直接或间接地影响发酵过程,如改变传质、传氧或导致其他一些目前仍不清楚的原因,最终改变整个发酵的效果[19-21]。
3 结 论
本实验研究了红曲霉Monascus purpureus M1发酵产琥珀和酯化酶的变化规律,并对不同时间、接种量、pH值及菌体状态对红曲霉联产琥珀酸和酯化酶影响进行了分析。红曲霉生长至第6天菌体干质量达到最大,而琥珀酸在红曲霉生长的第5天即达到最高质量浓度,随后琥珀酸含量呈下降明显。因而,琥珀酸主要作为红曲霉三羧酸循环的中间代谢产物存在。酯化酶是红曲霉产生的一级代谢产物,在红曲霉生长过程中不断地积累。颗粒状菌体便于琥珀酸及酯化酶的积累。正交试验进一步表明,接种量为10%、初始pH 6.5、30℃、180 r/min发酵至第6天,可兼顾琥珀酸及酯化酶的积累。下一步将对Monascus purpureus M1联产琥珀酸和酯化酶进一步进行发酵工艺优化,增加琥珀酸和酯化酶的生成,为综合利用Monascus purpureus M1提供参考。
[1]童群义.红曲霉产生的生理活性物质研究进展[J].食品科学, 2003,24(1): 163-167.
[2]FENG Yanli, SHAO Yanchun, CHEN Fusheng.Monascus pigments[J].Applied Microbiology and Biotechnology, 2012, 96(6): 1421-1440.
[3]ENDO A.Monacolin K, a new hypocholesterolemic agent produced by a Monascus species[J].Journal of Antibiotics, 1979, 32(8): 852-854.
[4]HUANG C S, HU H H, TSAI Y M, et al.in vitro effects of Monascus purpureus on antioxidation activity during fermentation of Kinmen sorghum liquor waste[J].Journal of Bioscience and Bioengineering,2013, 115(4): 418-423.
[5]谭艾娟, 宁玮霁, 刘爱英, 等.红曲霉产麦角固醇液体发酵条件优化[J].食品科学, 2008, 29(9): 434-436.
[6]YANG C W, MOUSA S A.The effect of red yeast rice (Monascus purpureus) in dyslipidemia and other disorders[J].Complementary Therapies in Medicine, 2012, 20(6): 466-474.
[7]BEAUPREZ J J, de MEY M, SOETAERT W K.Microbial succinic acid production: natural versus metabolic engineered producers[J].Process Biochemistry, 2010, 45(7): 1103-1114.
[8]CHOTANI G, DODGE T, HSU A, et al.The commercial production of chemicals using pathway engineering[J].Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 2000,1543(2): 434-455.
[9]张敏, 马江锋, 徐冰, 等.利用木薯淀粉为原料发酵生产丁二酸的研究[J].中国酿造, 2011, 30(7): 29-32.
[10]陈帅, 郑佳, 刘琨毅, 等.红曲酯化酶促反应及其代谢产物特征[J].食品与发酵工业, 2012, 38(2): 47-51.
[11]周建建, 苏理, 赵双枝, 等.采用响应曲面法优化红曲霉发酵培养基组分[J].食品工业科技, 2012, 33(23): 152-158.
[12]ZHANG Yunjian, LI Qiang, ZHANG Yuxiu, et al.Clarification of succinic acid fermentation broth by ultrafiltration in succinic acid biorefinery[J].Journal of Zhejiang University-Science B: Biomedicine &Biotechnology, 2012, 13(2): 103-110.
[13]白冬梅, 杜国民, 赵学明, 等.反相高效液相色谱法测定产琥珀酸放线杆菌发酵液中的有机酸[J].分析化学, 2003, 31(12): 1496-1499.
[14]潘名志, 谭艾娟, 刘爱英, 等.红曲霉产酯化酶液体培养基研究[J].山地农业生物学, 2009, 28(1): 58-62.
[15]孙莹.霉菌SH-24好氧发酵产生琥珀酸的初步研究[D].烟台: 烟台大学, 2007.
[16]张洪勋, 罗海峰, 庄绪亮.琥珀酸发酵研究进展[J].微生物学通报,2003, 30(5): 102-106.
[17]YOSHIZAKI Y, SUSUKI T, TAKAMINE K, et al.Characterization of glucoamylase and α-amylase from Monascus anka: enhanced production of α-amylase in red koji[J].Journal of Bioscience and Bioengineering, 2010, 110(6): 670-674.
[18]HULAY A K, LEMAN T.Vancomycin antibiotic production and TCA-glyoxalate pathways depending on the glucose concentration in Amycolatopsis orientalis[J].Enzyme Microbial Technology, 2006, 38:727-734.
[19]KIM Y M, SONG H G.Effect of fungal pellet morphology on enzyme activities involved in phthalate degradation[J].Journal of Microbiology, 2009, 47(4): 420-424.
[20]SUN Hong, AIDUN C K, EGERTSDOTTER U.Effects from shear stress on morphology and growth of early stages of Norway spruce somatic embryos[J].Biotechnology and Bioengineering, 2010, 105(3):588-599.
[21]PAPAGIANNI M.Fungal morphology and metabolite production in submerged mycelial proeesses[J].Biotechnology Advances, 2004, 22:189-259.



