周 翔,姜 丽,宦 晨,安秀娟,郁志芳*
(南京农业大学食品科技学院,江苏 南京 210095)
自发气调对樱桃番茄果实蛋白表达变化的影响
周 翔,姜 丽,宦 晨,安秀娟,郁志芳*
(南京农业大学食品科技学院,江苏 南京 210095)
采用蛋白质组学方法研究自发气调(modified atmosphere,MA)对樱桃番茄果实保鲜的机理。经过双向电泳和基质辅助激光解吸电离飞行时间质谱析,鉴定出39 个差异蛋白(P<0.05),根据功能分为6 类:胁迫与防御蛋白(30.77%)、能量蛋白(25.64%)、细胞命运蛋白(15.38%)、成熟衰老蛋白(5.13%)、解毒蛋白(5.13%)和未分类蛋白(17.95%);蛋白功能分析的结果显示,MA增强了谷胱甘肽转移酶、NADP-苹果酸酶、真核转录起始因子5A-4和乙醇脱氢酶2的表达,抑制了水杨酸绑定蛋白2和1-氨基环丙烷-1-羧酸氧化酶的表达,表明MA能通过减缓乙烯合成速率以及提高樱桃番茄果实的抗胁迫能力,从而延缓成熟衰老。
自发气调;樱桃番茄;蛋白质组学;延缓成熟衰老
樱桃番茄(Solanum lycopersicum var. cerasiforme)又名迷你番茄、小番茄和圣女果等,富含番茄红素和VC,但是果皮薄、不耐贮运,容易发生采后损失。为了延长采后番茄的货架期,目前已经进行了多种处理对其保鲜的研究,包括自发气调(modified atmosphere,MA)[1]、低温[2]、和1-甲基环丙烯(1-methylcyclopropene,1-MCP)[3]等。MA是通过果蔬的呼吸作用调节平衡密封环境中的气体成分,延缓果蔬衰老的技术[4]。在对番茄进行MA的研究中,选取PVC塑料薄膜进行包装,在3~4 d之后,气体成分大约是3%~9% CO2和3%~9% O2,延缓了番茄的衰老[5]。但是MA保鲜存在一些问题,长时间的贮藏会导致腐烂率的上升[6]。
从生理生化和基因水平来阐释MA影响果蔬成熟衰老的研究已经很多,对其机理已经有了初步的了解。MA降低了紫果西番莲的乙烯合成、呼吸速率等代谢过程[6]。低氧也影响了番茄果实中多种基因的表达,包括热激因子、热激蛋白、发酵酶类、乙烯合成酶类等基因,其中热激蛋白17.7(heat shock protein 17.7,HSP 17.7)和HSP 21基因被低氧诱导,可能对维持细胞稳态具有重要的作用[7]。Imahori等[8]发现3% O2处理会增强番茄果实中丙酮酸脱羧酶、乙醇脱氢酶和乳酸脱氢酶活性以及累积乙醛和乙醇。总体来说,MA会降低有氧呼吸和乙烯合成的速率,增强抗胁迫能力以延缓果蔬的成熟衰老,但同时会增加无氧呼吸酶的活性以及乙醛和乙醇的含量,对果蔬有一定的危害。目前,还没有从蛋白质水平来研究MA对樱桃番茄果实蛋白表达的影响。
最近十几年,蛋白质组学逐渐成为一种研究果实发育和成熟的有效方法,包括高分辨率双向电泳、凝胶染色、质谱鉴定和数据库搜索。Rocco等[9]已经用蛋白质组学的方法比较了两种番茄在成熟衰老过程中的蛋白表达差异,并且Faurobert等[10]研究了樱桃番茄果皮蛋白在果实发育成熟过程中的变化。同时,卢丞文等[11]对番茄果实中蛋白质的提取和双向电泳进行了优化。Zhang Li等[12]发现热处理通过影响胁迫与防御、细胞结构、蛋白命运、能量代谢和成熟衰老蛋白来延缓桃子的成熟衰老。Shi等[13]用氮气处理橘子24 h,然后用蛋白质组学方法进行研究,发现无氧环境诱导了糖酵解酶、热激蛋白等蛋白的表达。因此,本实验采用蛋白质组学的方法进行研究,初步阐释MA影响樱桃番茄果实蛋白表达的机理。
1 材料与方法
1.1 材料
本实验中所研究的樱桃番茄为红熟期的“贵妃”,于2012年10月采摘自山东经预冷后运回实验室。选择果形整齐、大小均匀、无病虫害、无机械损伤,且成熟度为红熟期的果实作为研究材料,进行实验处理。
1.2 方法
1.2.1 处理方法
MA处理:将樱桃番茄随机分成2 组,每组180 个果实,将挑选后的果实随机分为3 份后再放置于经筛选获得的聚氯乙烯包装袋中,一组敞口,另一组封口,在低温(8±1)℃条件下贮藏。初始气体为大气成分,贮藏期间氧气体积分数逐步降低至第7天达到5%±1%,二氧化碳体积分数达到3%±1%,之后的贮藏期间氧气与二氧化碳体积分数保持相对稳定。在贮藏期间每隔7 d进行取样一份并且液氮冷冻,置于-20 ℃保存,以待进行双向电泳实验。重复3 次。
1.2.2 蛋白提取
根据Rocco[9]、Wang[14]等的方法略作修改。称取5 g的果实冻样,在研钵中充分研磨至粉末状态。加入10 mL的SDS缓冲液(pH 7.5,包含100 mmol/L三羟甲基氨基甲烷,30%蔗糖,2%十二烷基硫酸钠(sodium dodecyl sulfate,SDS),5% β-巯基乙醇),然后加入等体积的平衡酚(pH 7.9),混匀静置。在4 ℃、10 000 r/min的速率离心30 min。取上层酚相,加入4 倍体积的预冷乙酸铵-甲醇,剧烈摇晃,过夜沉淀蛋白。沉淀分别用预冷的甲醇和80%丙酮溶液清洗2 次,最后用预冷的纯丙酮清洗1 次,4 ℃条件下干燥后溶于裂解缓冲液,-20 ℃保存备用。
蛋白质沉淀中加入400 μL裂解液(7 mmol/L尿素、2 mmol/L硫脲、4% CHAPS(3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐,3-[(3-cholamidopropyl) dimethylammonio]propanesulfonate)、1%二硫苏糖醇、0.5%固相pH值梯度(immobilized pH gradient,IPG)缓冲液),4 ℃溶解过夜,用Bradford[15]方法定量蛋白质,按1 200 μg/gel的蛋白量进行上样。
1.2.3 双向电泳
第一向为等电聚焦实验。通过水化上样,将17 cm pH 5~8的IPG胶条浸泡在样品溶液中,操作完毕后按照设定程序(表1)进行等电聚焦。然后将IPG胶条分别置于含2% DTT和2.5%碘乙酰胺的平衡液(包含6 mmol/L尿素、75 mmol/L三羟甲基氨基甲烷、pH 8.8、体积分数20%甘油、4 g/100mL 十二烷基硫酸钠)中各平衡15 min,等待第二向垂直电泳。第二向为SDSPAGE。采用的胶浓度为12%,采用恒功率进行垂直电泳,先用1 W/gel跑1 h左右,改为15 W/gel进行电泳,直到溴酚蓝到达胶底部,停止电泳,取下凝胶。染色前,用超纯水清洗凝胶3 次,每次10 min。采用改进的考马斯亮蓝G-250胶体考染[16],即用改进的胶体考染液(包含0.02% CBB G-250、5%硫酸铝、10%乙醇和8%磷酸溶液)染色过夜,用蒸馏水冲洗凝胶一次,加入脱色液(10%乙醇和2%磷酸溶液)进行脱色,直到凝胶背景清晰,蛋白点明显可见为止。
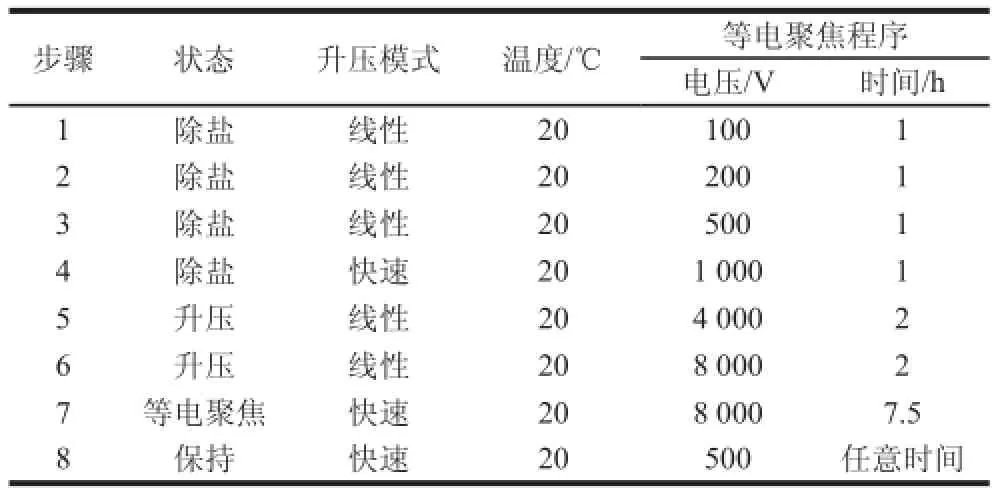
表1 17 cm线性胶条的双向电泳等电聚焦程序Table 1 The isoelectric focusing programof 2-DE with 17 cm liner strips
1.2.4 凝胶的图像采集与分析
脱色后的凝胶用Epson的2 400×4 800 dpi凝胶扫描仪采集图像,保存为TIFF格式的图像文件,并运用PDQuest 8.0.1软件进行图像分析。同一样品的3 张胶组成一个重复组,选择出重复性具有统计意义(t检验(P<0.05))且具有2倍以上表达差异的蛋白点做质谱分析。
1.2.5 质谱分析和数据库检索
切取双向电泳凝胶上的差异蛋白点,用超纯水清洗后送至上海博苑生物科技公司进行胶内酶解和双向电泳和基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption-ionization time of fl ight mass spectrometry,MADLI-TOF-TOF-MS)分析,得到的结果是经过数据库(NCBI)检索的蛋白质信息。
1.3 数据处理
采用Origin 7.5和Excel软件进行数据分析和作图。
2 结果与分析
本实验采用pH 5~8的IPG胶条进行等电聚焦,得到MA处理组和对照组的电泳图谱,见图1。PDQuest软件分析可见,每张电泳图谱上约有500 个蛋白点,且具有较好的重复性。经统计学分析,确定39 个具有2 倍及其以上差异的蛋白点(图2)。对差异蛋白表达量的数据进行统计分析,发现MA处理对于樱桃番茄果实蛋白的抑制作用大于增强作用(表2)。贮藏期间MA处理组较对照组有14 个蛋白的表达量得到了增强,25 个蛋白的表达得到了抑制,其中5 个蛋白点和9 个蛋白点在整个贮藏期间都表现出一致的增强和/或抑制作用。
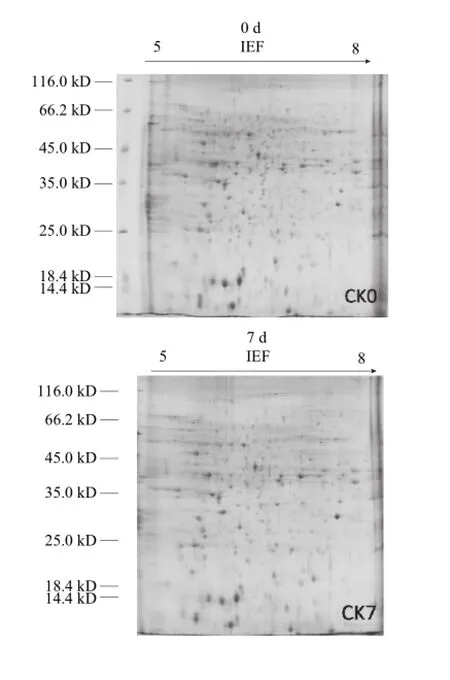


图1 樱桃番茄果实的双向电泳图谱。Fig.1 Representative spot maps of cherry tomato fruits
经过质谱鉴定和数据库搜索,差异蛋白共分为6 类,如图3所示。比例最高的是胁迫防御和能量代谢,其次为细胞命运蛋白和成熟衰老蛋白,表明MA处理主要影响了樱桃番茄果实成熟过程中胁迫与防御蛋白、能量蛋白、细胞命运蛋白和成熟衰老蛋白的表达,进而调节果实的成熟和衰老进程。
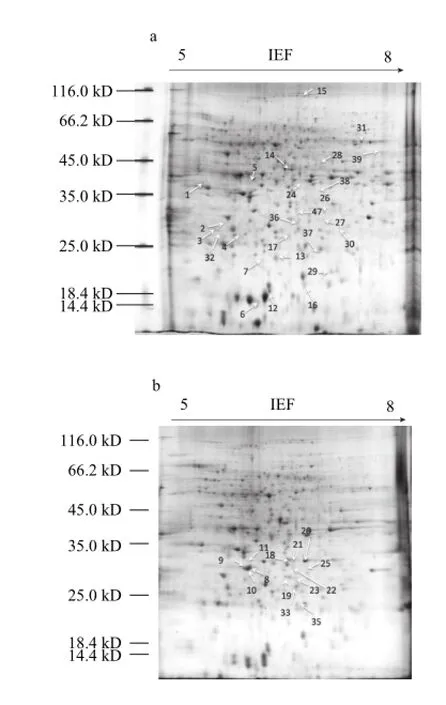
图2 标有39 个差异蛋白点的樱桃番茄果实双向电泳图谱Fig.2 Identification of 39 protein spots from cherry tomato fruits by 2-DE and MALDI-TOF-TOF-MS analysis

表2 樱桃番茄果实对照组和MA处理组效果差异蛋白点数Table 2 Numbers of differentially expressed proteins from 2-DE maps in the control and MA treated cherry tomato fruits during storage
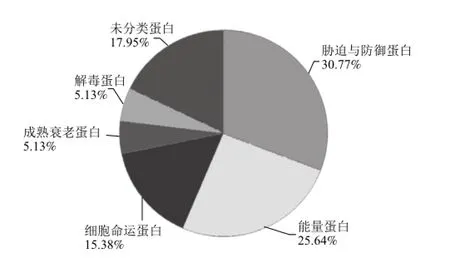
图3 对照组和MA处理组贮藏不同时期差异蛋白的功能分类Fig.3 Functional classification of differentially expressed proteins identified from the control and MA-treated cherry tomato fruits with different storage periods
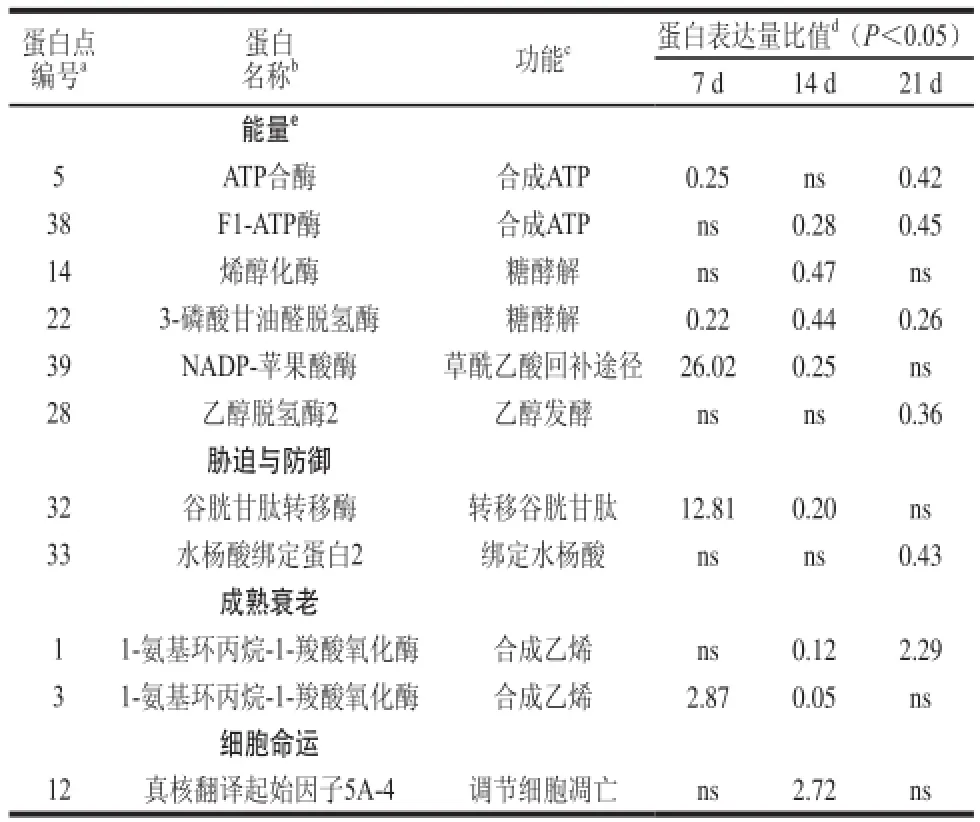
表3 对照组和MA处理组的樱桃番茄果实贮藏不同时间后的差异蛋白鉴定表Table 3 Identification of proteins in MA-treated cherry tomato fruits stored for 0, 7, 14 and 21 days when compared with the control fruits at the corresponding storage periods
能量蛋白包括:ATP合酶(spot 5)、ATP酶(spot 38)、烯醇化酶(spot 14)、磷酸丙糖异构酶(spot 17)、3-磷酸甘油醛脱氢酶(spot 22)、细胞质醛缩酶(spot 23)、细胞质乌头酸合酶(spot 15)、NADP-苹果酸酶(spot 39)、磷酸烯醇丙酮酸激酶(spot 21)和乙醇脱氢酶2(alcohol dehydrogenase 2,ADH 2,spot 28)。如表3所示,ATP合酶和ATP酶是参与ATP合成的酶,贮藏期间MA下调了这两种蛋白质的表达量。烯醇化酶、3-磷酸甘油醛脱氢酶参与了糖酵解途径,在贮藏过程中被MA下调。在第7天,NADP-苹果酸酶被MA处理诱导。作为乙醇发酵酶类,乙醇脱氢酶2被MA下调,说明MA处理抑制了糖酵解和ATP合酶的表达量,并且在一定程度上增强了乙醇发酵酶类的表达量。
胁迫与防御蛋白包括:ClpB1伴侣蛋白(spot 2)、小热激蛋白(spot 13)、过氧化物酶-2F(spot 16)、L-抗坏血酸S(spot 19)、过氧化氢酶(spot 30和31)、温度诱导膜脂蛋白(spot 6和spot 7)、类萌蛋白(spot 27)、Hop互作蛋白(spot 29)、谷胱甘肽转移酶(glutathione S-transferase,GST,spot 32)和水杨酸绑定蛋白2(salicylic acid-binding protein 2,SABP 2,spot 33)。如表3所示,GST参与了谷胱甘肽的转运过程,贮藏期间有增强表达的趋势,且第7天被MA显着上调。在贮藏过程中,MA处理组的SABP 2表达量相对于对照组有所下调。
细胞命运蛋白包括:真核转录起始因子5A-4(eukaryotic translation initiation factor 5A-4,eIF5A-4,spot 12)、丝氨酸蛋白酶前体(spot 26)、丝氨酸蛋白酶抑制剂(spot 4)、蛋白酶前体(spot 34)、依赖ATP的Clp水解蛋白酶3(spot 35)和蛋白酶(spot 37)。如表3,eIF5A-4是一种调控蛋白的启动子,在14 d后被MA处理上调。成熟与衰老蛋白包括:1-氨基环丙烷-1-羧酸氧化酶(1-aminocyclopropane-1-carboxylate oxidase,ACO,spot 1和spot 3)。如表3所示,这两种蛋白的表达量在第14天的时候被MA显着抑制。解毒蛋白包括:醛酮还原酶(spot 24)和乳酸谷胱甘肽酶(spot 25)。其余7个蛋白无法确定其具体功能,所以称为未分类蛋白。
3 讨论与结论
在生理生化水平上,MA能抑制紫果西番莲的呼吸强度和乙烯合成[6];在基因水平上,低氧能促进多种胁迫基因的表达[7]。在本研究中,MA对樱桃番茄果实蛋白表达的影响主要集中在4个代谢中,即能量代谢、胁迫反应、细胞命运和乙烯代谢。
3.1 MA对能量蛋白的影响
MA处理产生的低氧和高二氧化碳气体环境能抑制果蔬的呼吸强度[6],对樱桃番茄果实的能量代谢蛋白也产生了显着影响,包括ATP相关酶类、糖酵解、三羧酸循环和乙醇发酵酶类。ATP 合酶(spot 5)和F1-ATP酶(spot 38)是氧化磷酸化的酶类,参与ATP合成反应。贮藏期间MA处理使这两种酶表达量下调,抑制了ATP合成,降低了氧化磷酸化的强度。在本实验中,3-磷酸甘油醛脱氢酶(spot 22)和烯醇化酶(spot 14)的表达受到MA处理的抑制,这与以柑橘材料的研究发现无氧会抑制3-磷酸甘油醛脱氢酶和烯醇化酶的表达结果相似[13],说明MA处理会抑制糖酵解途径。
NADP-苹果酸酶(spot 39)催化苹果酸生成丙酮酸和NADPH,参与柠檬酸穿梭系统。果实衰老过程中,利用NADP-苹果酸酶产生的NADPH和丙酮酸来合成物质或产生能量,或者维持细胞内的pH值[17]。樱桃番茄贮藏期间MA处理使NADP-苹果酸酶表达量在第7天时上调,无氧也会促进柑橘材料中NADP-苹果酸酶的上调,这种变化可能会提高樱桃番茄果实抵抗胁迫的能力[13,18]。ADH参与了乙醇发酵反应,产生了乙醇。有研究发现低氧会诱导ADH基因的表达[7],同时在蛋白水平上无氧也会诱导ADH的表达[13],但在第7天和第14天,MA处理没有诱导樱桃番茄果实中ADH2(spot 28)的表达,可能是因为诱导了其他ADH同工酶。
3.2 MA对胁迫与防御蛋白的影响
GST(spot 32)催化谷胱甘肽共轭或谷胱甘肽过氧化物酶的活性,受高浓度的H2O2诱导[19]。通过GST对氧化胁迫激酶的调节作用,避免细胞遭受由H2O2介导的细胞死亡,说明GST参与了抗氧化反应[20],降低了H2O2浓度。本实验结果显示,MA处理增强了GST的表达,尤其是第7天的促进作用最强,说明GST在樱桃番茄果实的抗氧化过程中起到了重要的作用。据报道[21],低氧也能增强梨体内谷胱甘肽还原酶等抗氧化酶的活性,从而增强其抗氧化能力。
GST家族成员很多,一些GST被鉴定为SABP,其活性被水杨酸抑制[22]。本实验结果中,有一个关于水杨酸信号途径的蛋白SABP 2(spot 33)被鉴定出来。水杨酸会提高H2O2浓度、膜脂过氧化和对蛋白产生氧化伤害[23],而SABP 2沉默时会抑制水杨酸受体的活性[24]。MA处理抑制了SABP 2的表达,可能会弱化水杨酸对果实的作用,有利于延缓樱桃番茄果实的成熟衰老。
3.3 MA对细胞命运蛋白的影响
eIF5A-4(spot 12)是一种与细胞死亡有关的启动子元件,抵抗了细胞凋亡。在番茄果实中,eIF5A基因家族的4个成员都被表达,并且随着果实的成熟衰老,eIF5A-4的转录水平会提高,提高植物的抗胁迫能力,延迟采后番茄的软化和衰老[25]。贮藏第14天MA处理诱导了eIF5A-4的表达,增强了对细胞凋亡的抵抗作用,延缓了樱桃番茄果实的成熟衰老。
3.4 MA对成熟衰老蛋白的影响
作为一种植物激素,乙烯对果实的成熟衰老具有重要的作用,而ACC氧化酶是乙烯生物合成中重要的酶。有研究表明,MA能抑制乙烯的合成速率[6],同时低氧也会降低ACC氧化酶基因的表达[7]。在本实验中,樱桃番茄果实中的两个ACC氧化酶被鉴定出来,包括spot 1和spot 3。在贮藏过程中,MA处理总体上抑制了这两种蛋白的表达,影响了乙烯合成,从而影响樱桃番茄果实的的成熟衰老,这与低氧或者无氧条件下乙烯合成会受到抑制的研究结果吻合[26]。
总的来说,贮藏期间MA对樱桃番茄果实蛋白表达的影响主要包括:能量蛋白中增强了NADP-苹果酸酶的表达,抑制了糖酵解相关酶的表达;胁迫与防御蛋白中增强了GST的表达,抑制了SABP 2的表达;细胞命运蛋白中,增强了eIF5A-4的表达,抑制了细胞凋亡;成熟衰老蛋白中抑制了ACC氧化酶的表达。通过以上蛋白的综合作用,MA处理延缓了樱桃番茄果实的成熟衰老。
[1] 巩惠芳, 杜正顺, 汪良驹, 等. 气调处理延长草莓果实保鲜效应的研究[J]. 南京农业大学学报, 2009, 32(2): 35-39.
[2] AGOPIAN R G D, PERONI-OKITA F H G, SOARES C A, et al. Low temperature ind uced changes in activity and protein levels of the enzymes associated to conversion of starch to sucrose in b anana fruit[J]. Postharvest Biology and Technology, 2011, 62(2): 133-140.
[3] MASSOLO J F, CONCELLON A, CHAVES A R, et al. 1-Methylcyclopropene (1-MCP) delays senescence, maintains quality and reduces browning of non-climacteric eggplant (Solanum melongena L.) fruit[J]. Postharvest Biology and Technology, 2011, 59(1): 10-15.
[4] CALEB O J, MAHAJAN P V, OPARA U L, et al. Modelling the respiration rates of pomegranate fruit and arils[J]. Postharvest Biology and Technology, 2012, 64(1): 49-54.
[5] GEESON J D, B ROWNE K M, MADDISON K, et al. Modified atmosphere packaging to extend the shelf-life of tomatoes[J]. Journal of Food Technology, 1985, 20(3): 339-349.
[6] yUMByA P, AMBU KO J, SHIBAIRO S, et al. Effect of modified atmosphere packaging (MAP) on the shelf life and postharvest quality of purple passion fruit (Passif l ora edulis Sims)[J]. Jo urnal of Postharvest Technology, 2014, 2(1): 25-36.
[7] PEGORARO C, SANTOS R S D, KRÜGER M M, et al. Effects of hypoxia storage on gene transcript accumulation during tomato fruit ripening[J]. Brazilian Journal of Plant Physiology, 2012, 24(2): 141-148.
[8] IMAHORI y, MATUSHITA K, KOTA M, et al. Regulation of fermentative metabolism in tomato fruit under low oxygen stress[J]. Journal of Horticultural Science & Biotechnology, 2003, 78(3): 386-393.
[9] ROCCO M, D’AMBROSIO C, ARENA S, et al. Proteomic analysis of tomato fruits from two ecotypes during ripening[J]. Proteomics, 2006, 6(13): 3781-3791.
[10] FAUROBERT M, MIHR C, BERTIN N, et al. Major proteome variations associated with cherry tomato pericarp development and ripening[J]. Plant Physiology, 2007, 143(3): 1327-1346.
[11] 卢丞 文, 潘晓琪, 田慧琴, 等. 番茄果实中蛋白质的提取和双向电泳条件的优化[J]. 食品科技, 2010, 35(10): 196-200.
[12] ZHANG Li, yU Zhifang, JIANG Li, et al. Effect of post-harvest heat treatment on proteome change of peach fruit during ripening[J]. Journal of Proteomics, 2011, 74(7): 1135-1149.
[13] SHI J X, CHEN S, GOLLOP N, et al. E ffects of anaerobic stress on the proteome of citrus fruit[J]. Plant Science, 2008, 175(4): 478-486.
[14] WANG W, VIGNANI R, SCALI M, et al. A universal and rapid protocol for protein extraction from recalcitrant plant tissues for proteomic analysis[J]. Electrophoresis, 2006, 27(13): 2782-2786.
[15] BRADFORD M M. A rapid a nd sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254.
[16] PINK M, VERMA N, RETTENMEIER A, et al. CBB staining protocol with higher sensitivity and mass spectrometric compatibility[J]. Electrophoresis, 2010, 31(4): 593-598.
[17] SHAO Hongbo, LIU Zenghui, ZHANG Zhengbin, et al. Biological roles of crop NADP-malic enzymes and molecular mechanisms involved in abiotic stress[J]. African Journal of Biotechnology, 2011, 10(25): 4947-4953.
[18] LIU Z enghui, ZHANG Zhengbin, CHU Liye, et al. The corresponding relationship between roles of NADP-malic enzymes and abiotic stress in plants[J]. Emirates Journal of Food and Agriculture, 2010, 22(4): 239-249.
[19] MAT SYE P D, LAWRENCE G W, YOUSSEF R M, et al. The expression of a naturally occurring, truncated allele of an α-SNAP gene suppresses plant parasitic nematode infection[J]. Plant Molecular Biology, 2012, 80(2): 131-155.
[20] LUCHESE C, NOGUEIRA C W. Diphenyl diselenide in its selenol form has dehydroascorbate reductase and glutathione S-transferase-like activity dependent on the glutathione content[J]. Journal of Pharmacy and Pharmacology, 2010, 62(9): 1146-1151.
[21] LARRIGAUDIERE C, LENTHERIC I, PINTÓ E, et al. Shortterm effects of air and controlled atmosphere storage on antioxidant metabolism in conference pears[J]. Journal of Plant Physiology, 2001, 158(8): 1015-1022.
[22] CSIS ZÁR J, HORVÁTH E, VÁRY Z, et al. Glutathione transferase supergene family in tomato: salt stress-regulated expression of representative genes from distinct GST classes in plants primed with salicylic acid[J]. Plant Ph ysiology and Biochemistry, 2014, 78: 15-26.
[23] MUTLU S, KARADAGOGLU O, ATICI O, et al. Protective role of salicylic acid applied before cold stress on antioxidative system and protein patterns in barley apoplast[J]. Biologia Plantarum, 2013, 57(3): 507-513.
[24] KUMAR D, KLESSIG D F. High-affinity salicylic acid-binding protein 2 is required for plant innate immunity and has salicylic acid-stimulated lipase activity[J]. Proceedings of the National Academy of Sciences of the United S tates of America, 2003, 100(26): 16101-16106.
[25] WANG T W, ZHANG C G, WU W, et al. Antisense suppression of deoxyhypusine synthase in tomato delays fruit softening and alters growth and development[J]. Plant Physiology, 2005, 138(3): 1372-1382.
[26] PAUL V, PANDEY R, SRIVA STAVA G C. Ripening of tomato (Solanum lycopersicum L.). Part Ⅱ: Regulation by its stem scar region[J]. Journal of Food Science and Technology, 2010, 47(5): 527-533.
Proteomic Analysis of Cherry Tomato Fruits under Modified Atmosphere Conditions
ZHOU Xiang, JIANG Li, HUAN Chen, AN Xiu-juan, yU Zhi-fang*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095)
Proteomic analysis was used to understand the response mechanism of cherry tomato fruits during storage under modif i ed atmosphere (MA) conditions in this experiment. After two-dimensional electrophoresis and matrix-assisted laser desorption-ionization time of fl ight mass spectrometry (MALDI-TOF-TOF-MS), the results showed that there were 39 differently expressed spots (P < 0.05), including 6 functional proteins, stress response and defense (30.77%), energy (25.64%), cell fate (15.38%), ripening and senescence (5.13%), detoxif i cation (5.13%) and others (17.95%). Among these proteins, glutathione S-transferase (GST), NADP-malic enzyme, eukaryotic translation initiation factor 5A-4 (eIF5A-4) and alcohol dehydrogenase 2(ADH 2) were increased by MA treatment, while salicylic acid-binding protein 2 (SABP 2) and 1-aminocyclopropane-1-carboxylate oxidases (ACOs) were suppressed. This study indicated that the MA treatment of postharvest cherry tomato fruits could induce the stress response and suppress the ethylene metabolism to delay the ripening of cherry tomato fruits.
cherry tomato fruit; modif i ed atmosphere; proteomics; delaying ripening and senescence
TS255.3
A
1002-6630(2014)14-0234-06
10.7506/spkx1002-6630-201414045
2014-05-04
公益性行业(农业)科研专项(2014030232)
周翔(1990—),男,硕士研究生,主要从事采后果蔬蛋白质组学研究。E-mail:zhouxiang12390@126.com
*通信作者:郁志芳(1960—),男,教授,博士,主要从事采后生物学研究。E-mail:yuzhifang@njau.edu.cn



