赵 强,索有瑞*,李天才,赵海福,董晓宁
响应面法优化苦荞皮中总黄酮超声波提取工艺
赵 强1,2,索有瑞1,*,李天才1,赵海福3,董晓宁2
(1.中国科学院西北高原生物研究所,青海 西宁 810001;2.天水师范学院生物工程与技术学院,甘肃 天水 740001;3.甘肃农业大学动物医学院,甘肃 兰州 730070)
以苦荞皮为研究对象,在单因素试验基础上,采用Box-Behnken响应面试验设计法,对苦荞皮中总黄酮提取工艺条件进行研究,并对提取物进行高效液相色谱法检测。结果表明,影响苦荞皮中总黄酮含量的因素大小顺序为乙醇体积分数、液料比、回流时间、超声时间,最佳提取工艺为乙醇体积分数65%、液料比14∶1(mL/g)、回流时间1.6 h、超声时间28 min,苦荞皮中总黄酮最高含量为1.49520%,高效液相色谱法检测重复性良好。
苦荞皮;总黄酮;响应面法;高效液相色谱法
苦荞,又称鞑靼荞麦,是一种适合于在冷凉气候下生长的短季蓼科荞麦属双子叶药食兼用植物,在我国主要分布于甘肃、四川、云南、贵州等地。苦荞的性味甘苦、平、寒、有益气力,有利耳目,降气宽肠健胃的作用[1-3]。现代医学表明,苦荞中富含蛋白质、维 生素、矿物元素等,具有抗氧化、降三高、抗肿瘤等多种药理活性,其含有极为丰富的生物活性成分——黄酮类化合物,总黄酮含量为普通荞麦的10~100 倍[3-5]。黄酮类化合物主要是指结构为2-苯基色原酮的一类天然有机化合物,在植物体内通常与糖结合成苷类,小部分以游离态(苷元)的形式存在。近年来,有研究表明食用富含黄酮类的食物还可以降低癌症的发病率,增强人体免疫力,对糖尿病、高血压、冠心病、中风等疾病有辅助疗效[6]。我国苦荞常年播种面积约30万 ha,总产量约30万 t,资源丰富。苦荞皮作为苦荞制粉过程中的副产物,产率约为224 g/kg,亦富含黄酮类化合物,可作为一种廉价而丰富的总黄酮提取材料,具有较好的市场前景[7-8]。
目前,提取总黄酮的方法有恒温水浴振荡提取、有机溶剂浸提、碱性水或碱性稀醇提取以及酶法提取等,但这些方法提取时间较长,提取率较低[9]。而超声波辅助提取则是利用超声波在液体中的空化作用,加速植物有效成分迅速进入溶剂,从而提高提取效率,缩短提取时间[10-11]。本实验以苦荞皮为原料,采用统计软件Design-Expert中响应面法的Box-Behnken模式,对苦荞皮中总黄酮的超声波辅助提取工艺进行研究。
1 材料与方法
1.1 材料、试剂与仪器
苦荞皮(采集于甘肃省天水市农业高新科技园区规范化种植的苦荞),自然风干。
芦丁标准品(批号:F20051222) 国药集团化学试剂公司;95%乙醇、Al(NO3)3、NaOH、NaNO2均为分析纯。
1100型高效液相色谱仪 美国安捷伦公司;RE52-99型旋转蒸发器 上海亚荣生化仪器厂;Q-500DE型数控超声波清洗器 昆山市超声仪器有限公司;UV751GD型紫外-可见分光光度计、FA22048型电子天平上海精密科学仪器有限公司。
1.2 方法
1.2.1 芦丁标准工作曲线的绘制
准确称取0.200 8 g芦丁标准品,用三重水溶解,移入100 mL容量瓶中定容、摇匀。再次稀释,得到质量浓度为1.34 mg/L芦丁标准溶液。分别移取芦丁标准溶液0.50、1.00、1.50、2.00、2.50、3.00、3.50、4.00、4.50 mL和5.00 mL,置于50 mL容量瓶中,分别加入10.00 mL蒸馏水、3.00 mL 5% NaNO2溶液,6 min后加入6.00 mL 1% Al(NO3)3溶液,6 min后加入20.00 mL 4% NaOH溶液,15 min后定容、摇匀、静置。以三重水做空白对照,在510 nm波长处测其吸光度。以质量浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制芦丁标准曲线。
1.2.2 苦荞皮中总黄酮的制备
准确称取6.00 g干燥的苦荞皮,按设计的时间浸泡,在不同的温度与功率条件下超声振荡处理;采用索氏回流法提取苦荞皮中的总黄酮,将提取液转入旋转蒸发仪,减压浓缩至无醇味,转入100 mL锥形瓶,加入少许活性炭脱色,静置过夜,抽滤,将滤液按编号装入容量瓶,并定容至50 mL,静置待测定[12]。
1.2.3 苦荞皮中总黄酮含量的测定
以芦丁为标准品,用亚硝酸钠-硝酸铝显色法处理后,在510 nm波长处测其吸光度,计算苦荞皮中总黄酮的含量[12-15]。即将待测液2.00 mL于50 mL容量瓶内,分别加入10.00 mL蒸馏水、3.00 mL 5% NaNO2溶液,6 min后加入6.00 mL 1% Al(NO3)3溶液,6min后加入20.00 mL 4% NaOH溶液,15 min后定容、摇匀。以三重水做空白对照,在510 nm波长处,测其吸光度A。对照芦丁标准曲线,得出提取液中总黄酮质量浓度,最后计算出苦荞皮提取液中总黄酮含量,其计算公式为:

式中:c为苦荞中总黄酮质量浓度/(mg/mL);V为待测液的体积/mL;N为稀释倍数;m为苦荞皮的质量/mg。
1.2.4 苦荞皮中总黄酮的提取工艺
选取乙醇体积分数、液料比、超声时间、回流时间、浸泡时间、超声温度、超声功率、浸提液pH值8 个因素依次进行单因素轮换提取试验[10,15]。各因素的水平梯度设置分别为乙醇体积分数35%、50%、65%、80%、95%,液料比5∶1、10∶1、15∶1、20∶1、25∶1(mL/g),超声时间15、30、45、60、70 min,回流时间0.5、1.0、1.5、2.0、2.5 h,浸泡时间6、12、18、24、30 h,超声温度35、40、45、50、55 ℃,超声功率200、250、300、350、400 W,浸提液pH 4.0、5.0、6.0、7.0、8.0。根据单因素试验结果,采用极差分析法筛选出4 个主要影响因素。然后按照响应面法试验设计进行苦荞皮中总黄酮提取工艺优化,最后建立苦荞皮中总黄酮提取工艺。
1.2.5 响应面试验因素水平的选择
采用极差分析对8 组单因素水平进行筛选,最终选用乙醇体积分数、回流时间、超声时间、液料比4个因素为主要考察因素,进行响应面试验,按响应面试验设计进行总黄酮提取,试验因素与水平见表1。

表1 响应面试验因素与水平Table 1 Factors and levels used in response surface design
1.2.6 高效液相色谱(high performance liquid chromatography,HPLC)检测
以芦丁为标准品,将最佳工艺下提取的苦荞皮中的总黄酮进行高效液相色谱法测定,并且进行回收率的测定。
1.2.6.1 色谱条件
色谱柱:Zorbax eclipse XDB C18柱(4.6 mm×150 mm,5 μm);流动相:甲醇-0.2%磷酸溶液(65∶35,V/V);流速:1.0 mL/min;检测波长:254 nm;柱箱温度(30±1)℃;进样量:20 μL。
1.2.6.2 HPLC测定的工作曲线的绘制
准确配制质量浓度为0.025 0 mg/mL的芦丁标准液,静置备用。将其依次配成质量浓度为0.187 5、0.375 0、0.750 0、1.500 0、3.000 0 μg/mL的梯度溶液,进行HPLC检测。
2 结果与分析
2.1 芦丁标准曲线
根据系列质量浓度梯度的芦丁标准品在510 n m波长处测得的吸光度,以质量浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线,得回归方程:Y=7.121 4X+0.029 1,R2=0.999 8(n=8);在0.01~0.15 mg/mL范围内呈良好的线性关系。
2.2 单因素筛选试验

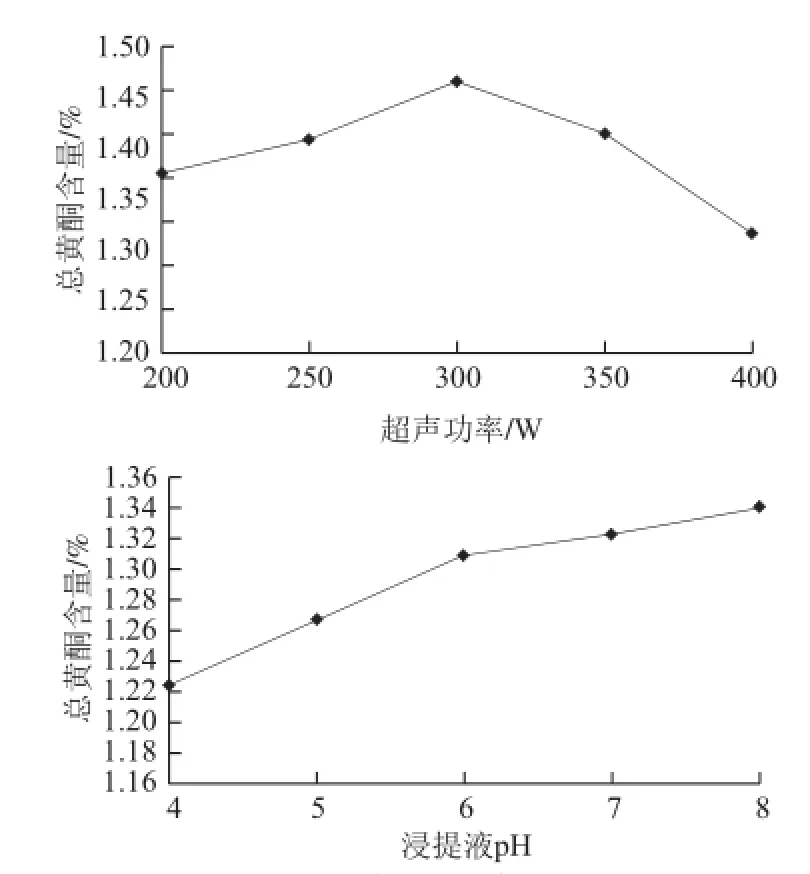
图1 单因素试验结果Fig.1 Results of single-factor experiments
由图1可知,所选8 个单因素的最佳值条件分别为乙醇体积分数65%、液料比15∶1(mL/g)、超声时间30 min、回流时间1.5 h、浸泡时间30 h、超声温度50 ℃、超声功率300 W、浸提液pH 8.0。
2.3 苦荞皮中总黄酮的响应面试验方案设计及结果

表2 响应面试验设计与结果Table 2 Experimental designs and results for response surface analysis
采用Design-Expert 7.0分析软件,利用Box-Behnken设计原理[16-17],以芦丁的含量为响应值,以A(乙醇体积分数)、B(回流时间)、C(超声时间)、D(液料比)4 个因素为自变量,进行响应面试验。设计四因素三水平(共29 个试验点,5 个中心点)的响应面试验,其设计及结果见表2。
表2中共有29 组试验,其中1~24 组是析因试验,25~29 组是中心试验。29 个试验点分别为析因点和零点;中心试验进行3 次,中心试验用以估计试验的误差,其中析因点为A、B、C和D所构成的三维空间的顶点,零点为区域的中心点。
2.4 不同因素对苦荞皮中总黄酮含量的影响
采用SAS RSREG程序对所得数据进行响应面分析,得到4 个因子与苦荞皮中总黄酮含量之间的模拟回归方程为:Y=-48.100 9+0.957 0A+18.159 2B+0.372 5C+1.904 9D+0.104 4AB+0.000 1AC+0.000 8AD-0.095 7BC-0.347 8BD+0.004 8CD-0.008 9A2-5.773 1B2-0.005 3C2-0.054 5D2。
对该回归模型进行差异显着性检验及方差分析,其结果见表3所示。

表3 响应面试验方差分析Table 3 Analysis of variance for the response surface regression model
由表3中方差分析结果可知模型P=0.041 3(P<0.05),表明回归模型达到显着水平,即各因素自身交互作用影响显着。但是误差项不显着,其决定系数R2=0.853 4,说明该模型与实际情况接近,即试验误差小,能充分反映出各因素与响应值之间的关系,因此,可以用该方程对实验结果进行分析。
由于各种因素之间存在着一定的交互作用,A、B、D和AB、AD、BD呈显着影响(P<0.05);而C、AC、BC、CD均呈不显着交互作用。从模型中回归方程系数显着性检验可知:二次项A2(P=0.001 4),D2(P= 0.009 4),即A2、D2为极显着影响(P<0.01)达到了极显着水平;B2(P=0.012 7),C2(P=0.032 7),P值均小于0.05,达到显着水平。
2.5 苦荞皮中总黄酮提取的响应面图分析



图2 各因素交互作用的等高线图和响应面图Fig.2 Contour and response surface graphs for the interactive effect between four factors
根据响应方程绘制的响应面曲面图和等高线图,响应面图形能直观地反映各因素和它们之间的交互作用对响应值的影响[18-20]。响应面图形是响应值Y与试验因素A、B、C、D相对应构成的三维空间曲线图,具体做法是将2 个因素固定在零水平,然后将剩下的2 个因素交互作用绘制成响应面曲线图,见图2。
从各因素之间两两相互作用的响应面图形观察,各因素间有较为强的交互作用,发现其中曲线走势越陡,其影响越显着;曲线走势越平滑,其影响越小。乙醇体积分数与回流时间、超声时间、液料比交互作用较为复杂,随着各因素的水平值增加,总黄酮含量会出现一个峰值;当再次持续升高各水平值时,总黄酮含量又会随之下降,其坡度相对平缓,说明提取量可以忍受处理条件的变异,但是不经济,因此仍选取最高点的提取条件为最佳;回流时间与超声时间和液料比的交互作用,超声时间和液料比的交互作用同样较为复杂,但在随着各因素的水平值的变化,总黄酮含量同样会出现一个峰值[21-25]。每个因素及其之间的交互作用对总黄酮含量的影响也存在差异,乙醇体积分数、回流时间、液料比、乙醇体积分数和回流时间、乙醇体积分数和液料比、回流时间和液料比对总黄酮含量的影响呈显着影响(P<0.05);而其余的均呈不显着交互作用。
本实验中各因素显着程度依次为乙醇体积分数(P=0.014 2)>回流时间(P=0.032 1)>液料比(P=0.041 1)>超声时间(P=0.715 7)。使用Design-Expert软件分析优化得到苦荞皮中总黄酮最佳模拟提取工艺为乙醇体积分数64.72%、液料比14.18∶1(mL/g)、回流时间1.59 h、超声时间28.12 min,在此工艺条件下,苦荞皮中总黄酮含量为1.49700%。考虑到实际操作过程中的局限性,对影响苦荞皮中总黄酮含量的的因素加以修正,修正后的工艺条件为乙醇体积分数65%、液料比14∶1(mL/g)、回流时间1.6 h、超声时间28 min,在该工艺条件下,苦荞皮中总黄酮含量为1.49270%。在该工艺条件下进行3 次平行实验,结果分别为1.494 30%、1.498 50%、1.492 90%,取其平均值为1.495 20%,与理论值误差为0.018 0%,说明响应面法优化模型能较好地预测苦荞皮中总黄酮含量,所得工艺条件比较可靠。
2.6 HPLC检测结果
在实验设定的色谱条件下,将芦丁标准品和在优化条件下提取的苦荞皮中总黄酮进行HPLC检测,其结果见图3。

图3 芦丁标准品(A)和样品(B)HPLC检测结果Fig.3 HPLC profiles of rutin standard (A) and sample (B)
由图3可知,将芦丁标准系列得到的标准曲线为色谱峰面积Y,对进样质量浓度进行线性回归分析可得:Y=70.299 0X-8.709 9,R2=0.999 7,0.375~25 μg/mL;芦丁标准品保留时间为9.625 min,范围为9.310~11.032 min。优化条件下提取的苦荞皮中总黄酮在9.457 min时出峰,峰形对称,与标样接近。平均回收率为99.58%、相对标准偏差为2.40%,表明HPLC检测精密度良好、重复性较好。
3 结 论
我国富产苦荞,但其利于目前仍局限于苦荞粉、苦荞挂面、苦荞茶等食品加工,苦荞皮主要作为枕心充填物和肥料使用,在对其总黄酮提取利用方面的研究还比较欠缺,尤其是对苦荞皮中总黄酮的响应面法提取工艺研究不多,通过本实验的数据分析,可以寻找到一种最有效的提取工艺,为苦荞皮资源的开发和研究提供实验数据[18]。在影响苦荞皮总黄酮提取工艺的各实验步骤中,采用乙醇-索氏抽提影响效果最为显着。在总黄酮提取剂中,从操作难易程度和成本角度考虑,虽然甲醇极性比乙醇大,沸点比乙醇低,但因甲醇有毒且不经济,丙酮挥发性较乙醇大,故选用乙醇作为总黄酮提取剂,其提取效果理想且相对安全。采用超声波振荡辅助索氏回流提取法,可使得植物细胞壁及整个植物体在瞬间被破碎,有效地加快了总黄酮溶解度,缩短了提取时间,提高了总黄酮得率,且操作简单易行。通过响应面法优化苦荞皮中总黄酮最佳提取工艺参数为乙醇体积分数65%、液料比14∶1(mL/g)、回流时间1.6 h、超声时间28 min,通过HPLC检测进一步验证了响应面法提取工艺的可靠性,并对提取物含量做了进一步准确测定,在该工艺条件下,苦荞皮总黄酮含量为1.495 20%。
[1] 刘春花, 高金锋, 王鹏科, 等. 超声波提取苦荞黄酮的工艺研究[J].西北农业学报, 2009, 18(1): 281-284.
[2] 韩丹, 王晓丹, 陈霞, 等. 苦荞麦制麦芽及其啤酒发酵工艺研究[J].食品与机械, 2010, 26(1): 125-128.
[3] 郭元新, 孙沛然, 李凤霞, 等. 发芽苦荞绿茶复合饮料的工艺研究[J].食品工业科技, 2012, 33(8): 271-273.
[4] KIM S L, KIM S K, PAR C H. Introduction and nutritional evaluation of buckwheat sprouts as a new vegetable[J]. Food Research International, 2009, 37: 319-327.
[5] 凌孟硕, 唐年初, 赵晨伟, 等. 苦荞麦萌发过程中营养物质的变化分布及磨浆提取工艺[J]. 食品科学, 2013, 34(22): 92-97.
[6] 穆婷婷, 韩玲, 李儒仁. 超声波萃取苦荞麸皮中总黄酮的工艺研究[J].食品科技, 2011, 36(6): 251-254.
[7] 王军, 王敏, 于智峰, 等. 响应曲面法优化苦荞麸皮总黄酮的提取工艺[J]. 西北农林科技大学学报, 2006, 34(12): 189-194.
[8] 王军, 王敏, 于智峰, 等. 基于响应曲面法的苦荞麸皮总黄酮提取工艺优化[J]. 农业机械学报, 2007, 38(1): 206-208.
[9] 郭京波, 王向东, 张燕, 等. 不同提取方法对苦荞黄酮提纯得率的影响分析[J]. 食品科学, 2006, 27(10): 433-436.
[10] 赵强, 余四九, 王廷璞, 等. 响应面法优化秃疮花中生物碱提取工艺及抑菌活性研究[J]. 草业学报, 2012, 21(4): 206-214.
[11] 李欣, 王步军. 两种苦荞黄酮的提取方法的优化及含量测定[J]. 食品科学, 2010, 31(6): 80-85.
[12] 钟秋平, 林美若. 黄皮果中总黄酮含量的测定及其黄酮种类的鉴别[J].食品科学, 2007, 28(8): 411-414.
[13] 董华强, 宁正祥, 崔志新, 等. 微波辅助提取多穗柯嫩叶黄酮工艺研究[J]. 农业工程学报, 2007, 23(2): 213-217.
[14] 钟秋平, 林美若. 黄皮果中总黄酮含量的测定及其黄酮种类的鉴别[J].食品科学, 2007, 28(8): 411-414.
[15] 赵海福, 魏彦明, 董晓宁, 等. 响应面法优化玉米须中芦丁的提取工艺及检测[J]. 草业科学, 2013, 30(6): 964-972.
[16] 傅珏生, 张健, 王振羽, 等. 实验设计与分析[M]. 6版. 北京: 人民邮电出版社, 2009: 347-392.
[17] 赵选民. 实验设计方法[M]. 2版. 北京: 科学出版社, 2006: 191-198.
[18] 施卫省, 罗小林, 曹新佳, 等. 苦荞麦黄酮含量萃取工艺的研究[J].中国农学通报, 2012, 28(15): 260-263.
[19] JUN Lu, CHI Zhou, OU Rong, et al. Optimization of microwaveassisted extraction of flavonoids from Cryptotaenia japonica Hassk using response surface methodology[J]. Advance Journal of Food Science and Technology, 2013, 5(3): 310-317.
[20] TANG Baokun, LEE Y J, LEE Y R, et al. Examination of 1-methylimidazole series ionic liquids in the extraction of fl avonoids from Chamaecyparis obtuse leaves using a response surface methodology[J]. Journal of Chromatography B, 2013, 933: 8-14.
[21] 任君安, 杨丽娜, 王雁, 等. 响应面分析法优化保加利亚玫瑰挥发油提取工艺[J]. 食品工业科技, 2013, 34(15): 196-200.
[22] 潘进权, 周鲜娇, 周培娴. 响应面法优化牛蒡根总黄酮提取工艺[J].食品工业科技, 2013, 34(12): 270-274.
[23] BAI X L, YUE T L, YUAN Y H, et al. Optimization of microwaveassisted extraction of polyphenols from apple pomace using response surface methodology and HPLC analysis[J]. Journal of Separation Science, 2010, 33(23/24): 3751-3758.
[24] 李娟, 曹泽虹, 李超, 等. 响应面法优化黑曲霉深层发酵产内切型菊粉酶工艺[J]. 食品科学, 2014, 35(9): 207-212.
[25] 王立志, 唐克华. 响应面法优化超声辅助提取金银木果实色素工艺[J].食品科学, 2013, 34(22): 48-52.
Optimization by Response Surface Methodoloy of Ultrasonic Extraction of Total Flavonoids from Tartary Buckwheat Hull
ZHAO Qiang1,2, SUO You-rui1,*, LI Tian-cai1, ZHAO Hai-fu3, DONG Xiao-ning2
(1. Northwest Institute of Plateau Biology, Chinese Academy of Sciences, Xining 810001, China; 2. College of Bioengineering and Technology, Tianshui Normal University, Tianshui 740001, China; 3. College of Veterinary Medicine, Gansu Agricultural University, Lanzhou 730070, China)
The ultrasonic extraction of total flavonoids from tartary buckwheat hull was optimized by response surface analysis with Box-Behnken design, and the flavonoid extract obtained was analyzed by high performance liquid chromatography (HPLC). The results showed that the extraction effi ciency of total fl avonoids was affected in decreasing order by ethanol concentration, liquid-to-solid ratio, refl uxing time and ultrasonication time, for which the optimal conditions were 65%, 14:1 (mL/g), 1.6 h and 28 min, respectively. Under the optimized conditions, the yield of total fl avonoids was 1.495 20%. The HPLC method used in this study was found to be highly repeatable.
tartary buckwheat hull; total flavonoids; response surface methodology; high performance liquid chromatography (HPLC)
TS202.3
A
1002-6630(2014)16-0064-07
10.7506/spkx1002-6630-201416012
2013-09-10
2013年甘肃省科技计划资助项目(1308RJZE305)
赵强(1982—),男,副教授,博士后,研究方向为西北特色生态经济植物资源利用与开发。
E-mail:zhaoq2000@163.com
*通信作者:索有瑞(1960—),男,研究员,博士,研究方向为天然药物化学。E-mail:yrsuo@nwipb.cas.cn



