王贵章,王贵禧,梁丽松,马庆华
桃果实芳香挥发物及其生物合成研究进展
王贵章,王贵禧*,梁丽松,马庆华
(林木遗传育种国家重点实验室,中国林业科学研究院林业研究所,北京 100091)
香气是反映桃果实风味品质的重要指标,近年来受到人们的广泛关注。现已从桃果实中鉴定出100多种挥发性香气成分,桃果实中芳香物质的合成受到遗传因素和外界环境等内外两类因素影响,相关酶控制其 生物合成过程。本文从桃果实的芳香挥发物的组成成分及对桃果实香气的贡献角度,对桃果实主要挥发性芳香物质及其生物合成途径和其中涉及的主要酶展开讨论,分析不同品种及成熟度、不同贮藏条件和栽培管理措施等采前和采后因素对桃果实香气成分和含量的影响,就桃果实芳香代谢存在的问题进行了分析,并对前景进行展望,以期对今后的桃果实香气相关研究提供参考。
桃果实;香气;生物合成;调控
桃(Prunus persica L.)是广为熟知的重要水果之一,源产自中国西部,在中国北纬23°~45°范围内广泛栽培种[1]。据联合国粮农组织(Food and Agriculture Organization of the United Nations,FAO)最新统计数据显示,我国的桃栽培面积已逾76.7万公顷,产量超过1 152万 t(2011年)[2]。桃树产业的迅速发展,无疑对相关科研工作的展开起到了有力的推动作用。香气是桃果实风味的重要组成部分[3],风味丧失会严重影响果实的感官品质,减少人们对果实的喜好程度,进而影响其经济价值。研究表明,低温可以明显延长桃果实的贮藏期,但是在低温贮藏条件下,果实容易发生冷害[4-5],伴随香气变淡或消失[6],导致果实食用品质下降,甚至不能食用。另外在追求产量和缩短供应周期的情况下,容易忽略果实风味和香气损失问题[7]。因此,如何在不影响果实其他风味、品质的前提下,改善果实的香气组成,调控果实芳香挥发物质的产生,成为桃果实育种上需要重点解决的课题之一。通过栽培管 理技术,改变贮藏条件及手段来改善果实风味品质正是当下热点研究内容,近年来国内外科学家在桃果实香气成分及其合成途径方面研究取得很大进展,鉴定出许多编码香气生物合成途径中的关键酶基因,且桃的全基因组草图已于2011年完成[8-9],这些工作的完成也为今后桃果实香气品质改良育种奠定了基础。本文通过对桃果实香气成分的种类、香气生物合成的代谢途径的阐述,以及对影响香气物质合成的不同品种、内外调控因素等方面的概述,提出了这一领域目前存在的问题并对未来发展前景进行了展望。
1 香气成分分类及对桃果实芳香风味构成的作用
水果中的香气成分大约有2 000 种,大致分为酯类、醛类、醇类、内酯类、萜类、酚类、酮类、醚类和一些含硫化合物等,其主要呈香物质因水果的不同而异,通常以酯类、醛类、醇类和萜类及挥发性酚类为主。水果的主要呈香物质,即特征效应化合物(character impact compounds)[10],是根据其对水果特征风味的贡献而言,通常以其阈值浓度和实际浓度来衡量,阈值浓度即挥发性物质能被人的嗅觉器官所能感知到的最低浓度[11];实际浓度和阈值浓度的比值为香味值,只有当挥发物的香味值大于1时,该物质才对果实的风味起作用,比值越大,贡献也越大[12]。不同类型的果实具有不同的特征香味,芳香挥发物的不同组合及比例决定了水果的特有香味[13]。在桃果实中鉴定出的芳香挥发物质已报道的超过100 种,主要是以呈青草型香味的醇类、醛类及花/果香型香味的酯类和内酯类成分为主[3,14-17]。
1.1 桃果实中青草香型(green aroma)挥发物
未成熟桃果实主要散发青草香味,青草型香气物质6碳醛类和6碳醇类[17-18]是未成熟桃和 油桃果实的主要呈味物质[19]。Sánchez等[15]在黏核不溶质桃“Granada”“Maruja”及离核溶质桃“MxR_01”、“RedCandem”果实中除了检测到传统的青草味挥发物2-己烯醛、3-己烯醛等外,还检测到戊醛、庚烯醛、及此前只在李和杏果实中检测到的庚二烯醛等脂质衍生物,这些挥发性成分的含量与果肉硬度高度相关,都在未成熟果实中积累。此结果与李杨昕等[20]的研究结果一致,在常温贮藏溶质桃大久保桃果实中,己醛、苯甲醛等青草型香气成分的含量随后熟过程的完成而减少,贮藏前期(1~2 d)明显高于中后期(3~4 d),同时果实硬度随贮藏时间延长而降低,果实迅速软化。另通过 对两种不同成熟期溶质水蜜桃的香气成分测定结果表明,醇类尤其是(Z)-3-己烯醇也是未成熟桃果实的主要香气成分,其含量随果实的成熟而降低[21]。另外有研究认为,一些长链物质如十八醛、二十二烷醇、二十四烷醇、角鲨烯及二十六烷醇等可能由于其长链结构,而对桃果实风味构成作用不大[16]。
1.2 桃果实中花/果香型(floral/fruity aroma)挥发物
酯类是影响桃特征风味的重要挥发物,人们所能感知到水果的芬芳味主要来自酯类[11]。乙酸己酯赋予果实果香味和甜香味,其风味阈值很低,仅为2 μg/kg[22],而其实际水平可达到359.55 μg/kg,因此对桃果实风味贡献较大[16],同时甲酯对不同水果的果味和甜香味也有一定贡献[22]。 Wang Yiju等[3]通过对50 个品种桃的挥发物质的测定发现,在检测到的19 种酯类物质中,乙酸乙酯、乙酸己酯和乙酸己烯酯占总酯含量的90%以上,但由于乙酸乙酯的阈值为13 500 μg/kg高于实际水平,因此认为它可能对桃果实风味的形成贡献不大[23]。李杨昕等[20]对常温贮藏的“大久保”桃果实香气进行了研究,从中共检测出29 种挥发性物质,发现在果实感官评价品质最高时,果实内主要的挥发性成分中酯类占总量的13.02%,其中比重最高的是戊二酸二丁酯,其次是己酯,乙酸己酯含量较低,但由于其较低的阈值浓度,因此对桃果实特征风味的形成仍有一定贡献。Cano-Salazar等[23]通过回归分析结合最小二乘法分析发现,桃果实风味与乙基-2-甲基丁酸甲酯、2-甲基丁基乙酸酯、乙酸己酯和戊基己酸酯的释放呈正相关。
1.3 桃果实中内酯类挥发物
继酯类物质之后,人们发现内酯也是桃香气的主要贡献化合物,它能赋予果实“桃味”(peach-like aroma)特征,对桃果实 的风味构成具有举足轻重的作用[24]。内酯类挥发物质在桃果实中普遍存在,一系列研究成果[3,25-26]表明,γ-癸内酯和δ-癸内酯是桃果实中最重要的内酯,它们能赋予桃果实强烈的果香气息,与γ-十二内酯和δ-十二内酯共同被定义为桃果实的特征效应化合物,与6碳醛、脂肪醇和萜烯类通过观感互作(sensory interaction)使桃果实呈现浓烈的桃果香味[27],而γ-庚内酯和γ-壬内酯则被认为是桃果香味具有次要贡献的内酯[28]。另有研究发现,在“Early Rich”、“Royal Glory”、“Sweet Dreamcov”和“Elegant Lady”4 个桃品种中,γ-己内酯的含量很高,超过内酯总含量的80%,因此γ-己内酯是这4 种黄肉桃中最重要的内酯[23],内酯类成分的不同和含量的差异使不同品种的桃呈现各自独特的风味特点。
1.4 桃果实中其他风味相关挥发性成分
除了以上3 类主要的呈香物质外,酮类和萜烯类物质也会影响桃果实的风味,如芳樟醇、(E)-β-大马酮、β-紫罗兰酮等[16]。以芳樟醇为主要代表的挥发性萜烯类物质是最丰富的芳香物质之一,是很多植物的主要呈香物质。葡萄是含有萜烯类物质的典型水果,如玫瑰香型品种中萜类挥发物质芳樟醇、橙花醇、香叶醇等为葡萄的特征芳香物质[29],Horvat等[13]将芳樟醇定为桃果实的主要呈味物质之一,它具有花香型香气特性。芳樟醇的含量随着桃果实的成熟而显着增加,其阈值较低,为6 μg/kg,而其实际水平远高于阈值,推测可能对油桃的风味影响较大[16],通过对95 个桃和油桃品种的挥发性成分检测发现,该物质在白肉和黄肉桃中含量无显着差异[30]。另外,(E)-β-大马酮有“苹果味”(apple-like)、β-紫罗兰酮呈“紫罗兰味”(violet-like),这两者阈值都比较低,尤其是(E)-β-大马酮阈值仅为0.002 μg/kg,在某些品种桃果实中的实际水平超过4 000 μg/kg[16],因此对桃果实果香型风味的形成有较大贡献。
2 桃果实香气成分的合成
桃果实中挥发物质的合成始于几条主要的代谢途径,根据香气合成的前体物质的不同,主要有脂肪酸、萜烯类、碳水化合物和氨基酸等,其生物合成也主要通过以下三大途径:脂肪酸途径,萜烯类途径及氨基酸途径(代谢通路图参考席万鹏[17]、Aragüez[7]、Sánchez[31]等)。
2.1 脂肪酸代谢途径和涉及的关键酶
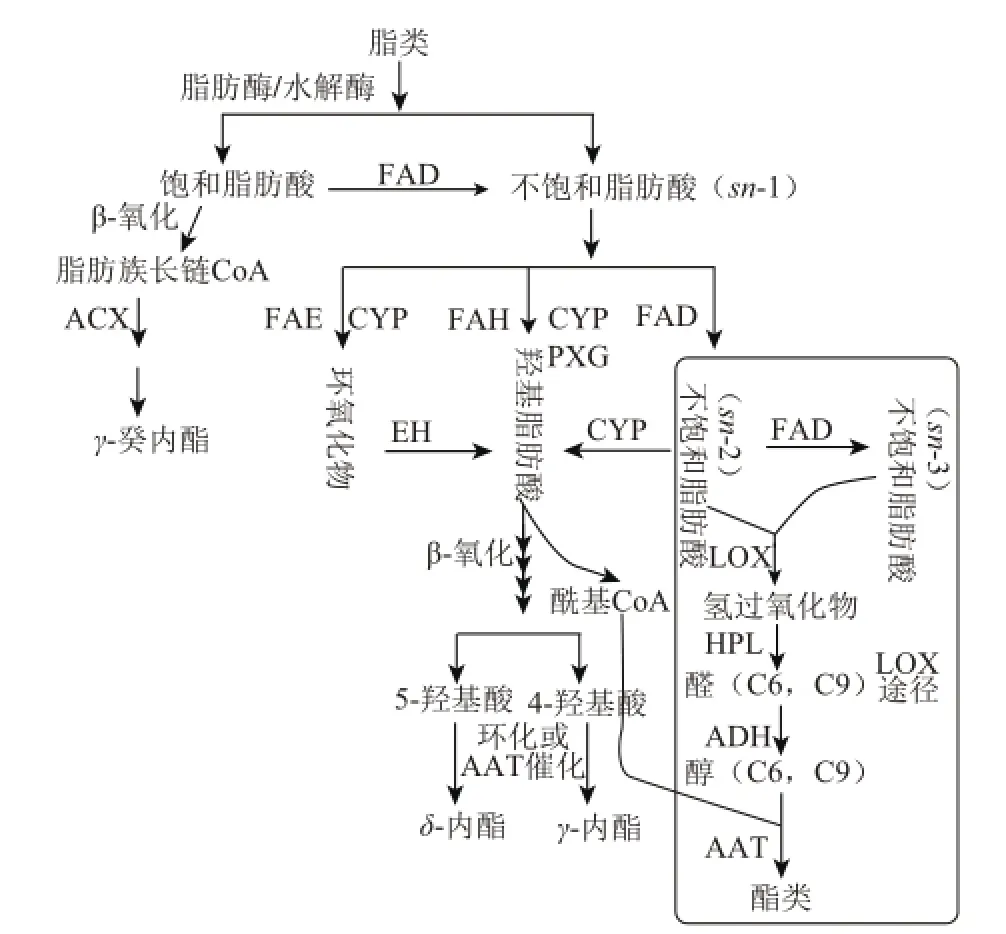
图1 脂肪酸途径及涉及的主要酶Fig.1 Enzymes involved in fatty acid pathways
脂肪酸是桃果实中芳香性挥发物质合成的主要前体物质,果实香气成分中直链脂肪族醇、醛、酮和酯类物质的合成在大程度上依赖于脂肪酸及其衍生物等前体物质的充足供应[7]。目前已知,桃果实中青草香型特征香气成分6-碳化合物的形成如己醛、(E)-2-己烯醛等,是以脂肪酸为前体,经过脂氧合酶(lipoxidase,LOX)途径和β-氧化等逐步过氧化、裂解及还原作用而形成的[32]。LOX是脂肪酸代谢的关键酶,LOX途径的最初反应是甘油酯等在脂肪酶的作用下,水解释放出游离的脂肪酸,其中的不饱和脂肪酸在脂肪酸去饱和酶(fatty aacid desaturases,FAD)、LOX、氢过氧化物裂解酶(hydroperoxide lyase,HPL)及醇脱氢酶(alcoholdehydrogenase,ADH)等一系列酶的催化下形成相应的6-碳醛和醇[33],最后在醇酰基转移酶(alcohol acyltransferase,AAT)的催化下形成酯类,AAT在醇变成酯的过程中起重要作用[18],它催化酰基与通过不同途径合成的各种醇类形成多类型的酯[7],因此是影响桃果实中酯类物质合成的关键酶(图1),在LOX途径中酯类合成中的酰基主要源于酰基CoA。
已知内酯的生物合成源于羟基脂肪酸,通过β-氧化形成4-或5-羟基酸,在自身环化或在AAT的催化下形成相应的内酯[31]。内酯合成的另外途径是饱和脂肪酸的β-氧化,过程中涉及的关键酶是乙酰辅酶A氧化酶(acyl-coA oxidase,ACX),在ACX的作用下,脂肪族的长链CoA氧化分解并逐步形成γ-癸内酯[34]。研究发现,环氧化物水解酶(epoxide hydrolase,EH)能水解许多芳香族环氧化物[35],在内酯代谢中,脂肪酸环氧化后由EH控制环氧化物环的断裂形成羟基脂肪酸[36],随后经过β-氧化等一系列反应,最终形成内酯。
2.2 萜烯类挥发物质代谢及关键酶
萜烯类化合物是植物芳香物质中的一大类群,其中单帖和少数倍半萜是许多植物香气的组成成分,一般是在萜类合成酶的作用下,由五碳前体物质异戊二烯骨架经一系列反应生成[37],因此萜烯类途径又称为异戊二烯途径,萜烯类又称为类异戊二烯化合物,桃果实中花香型香气成分芳樟醇、β-大马酮及β-紫罗兰酮也是通过此代谢途径合成[38](图2)。所有单萜的前体物质是牻牛儿基焦磷酸(geranylgeranyl pyrophosphate,GPP),而GPP生物合成的前体物质是异戊二烯二磷酸(isopentenyl pyrophosphate,IPP)或其异构体二甲基烯丙基二磷酸(dimethyl allyl pyrophosphate,DMAPP),根据异戊二烯结构骨架的数目不同,将萜烯类依次分为单萜、倍半萜、双萜、三萜等。这些五碳前体物质来源于2 条途径:一是发生于细胞质中的甲羟戊酸(mevalonate,MVA)途径,该途径的关键酶是3-羟基-3-甲基戊二酰基辅酶A还原酶(3-hydroxy-3-methylglutaryl-coenzyme A reductase,HMGR);二是发生在质体中的甲基赤鲜糖醇磷酸途径(methyl erythriotl phosphate,MEP),又称1-脱氧-D-木酮糖-5-磷酸(1-deoxy-D-xylulose-5-phosphate,DXP)途径,脱氧木酮糖磷酸盐还原异构酶(1-deoxy-D-xylulose-5-phosphate,DXR)是该途径的限速酶[39],两途径最后都在TPS(萜类合成酶)的作用下形成单萜、倍半萜、三萜类物质。MEP途径的萜类合成酶催化中催化单萜化合物形成的酶类引起人们的广泛关注,其中包括桃的特征香气物质之一芳樟醇形成的芳樟醇合酶(linalool synthetase,LIS);β-紫罗兰酮等脱辅基类胡萝卜素类物质的合成前体是类胡萝卜素,类胡萝卜素裂解双加氧酶(carotenoid cleaving dioxygenase,CCD)是催化合成类胡萝卜素的关键酶,这个酶是桃果实中倍半萜类挥发物合成的关键酶[40]。
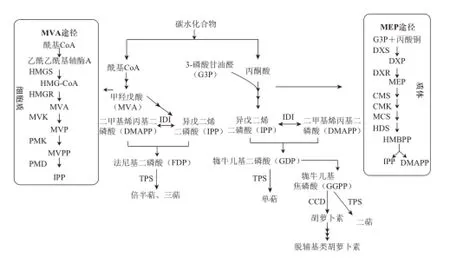
图2 桃果实中萜烯类化合物生物合成途径示意图Fig.2 Biosynthesis pathways of terpenes in peach fruits
2.3 源于氨基酸的香气合成途径
氨基酸途径以芳香族氨基酸为前体,是桃果实中芳香族香气物质合成的主要途径(图3)。桃果实中含有多种氨基酸,研究发现,其中甘氨酸、缬氨酸、苯丙氨酸等含量的变化与芳香成分有显着相关性,是果实中酯类合成的前体物质,对桃果实风味组成有较大影响[41]。苯丙氨酸解氨酶(phenylalanin ammonia lyase,PAL)催化主要底物L-苯丙氨酸,通过一系列的羟基化、酰基化和甲基化等反应,转变成挥发性芳香物质如苯乙醛、苯乙醇等[7],合成过程中可能参与的酶还有丙酮酸脱羧酶(pyruvate decarboxylase,PDC)、芳香族氨基酸氨基转移酶(aromatic amino acid aminotransferases,ArAT)、芳香族氨基酸脱羧酶(aromatic amino acid decarboxylase,ArAD)等[31]。桃果实中香气成分大部分为低碳原子数醇、酸、酯等化合物,而合成这些化合物的前体物质较大一部分来自氨基酸,通过氨基酸合成途径产生,常见的氨基酸类前体有丙氨酸、缬氨酸、亮氨酸、异亮氨酸、天冬氨酸、苯丙氨酸等,通过该途径生成的香气物质,主要是作为前体物质的氨基酸在转氨酶和丙酮酸脱氢酶的作用下,通过转氨基和脱羧基两步反应得到的[17]。桃果实中苯乙醛的合成可能是苯丙氨酸分别在ArAT和ArAD的作用下合成,并分别释放出氨气和,该途径在甜瓜中已经得到验证[42],在桃中苯丙醛的产生是否经由相同途径尚需实验验证。
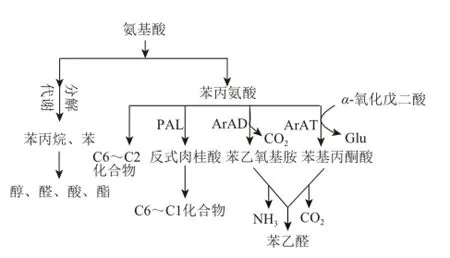
图3 源于氨基酸的芳香化合物合成途径Fig.3 Biosynthesis pathways of aroma volatiles derived from amino acids
3 香气物质形成的影响因素
3.1 品种和成熟度对桃果实风味的影响
遗传因素影响桃果实芳香风味物质组成及其质量浓度,不同品种的桃果实芳香物质种类和质量浓度存在差异。Wang Yiju等[30]通过对95 个品种的桃和油桃果实的调查发现,挥发物的成分和含量在很大程度上取决于果实的遗传背景,中外杂交种和日本品种其总挥发物和酯类物质的质量浓度要显着高于中国本土品种,其中白肉蟠桃的总酯类显着高于其他品种,白肉蟠桃的萜类物质明显高于白肉油桃。此外,在桃果实生长期和贮藏期的不同阶段,其主要风味物质质量浓度差异显着,内酯类芳香挥发性物质含量随桃果实成熟而增加,以γ-和δ-内酯的变化最大,成为成熟果实中主要呈香物质,而未成熟果实中6C醛和醇成为主要呈香物质[43]。“玉露”水蜜桃成熟过程中青草型香气n-丁二酮、戊醛、己醛、(E)-2-己烯醛、(E)-2-己烯醇和(Z)-3-己烯醇下降,而果香型香气(Z)-3-己烯基乙酸酯、γ-己内酯、γ-辛内酯、γ-癸内酯和δ-癸内酯的质量浓度则随果实成熟而增加[18]。桃属于呼吸跃变型果实,尤其是溶质桃采后快速软化,容易腐烂变质,影响市场销售,而成熟前采摘的桃果实不能完熟,因此达不到最佳风味状态及充分释放香气[44]。因此成熟度和采收时期对桃果实风味品质有着重要影响。鉴于不同发育阶段果实挥发性成分的差异,人们制定出了判断果实成熟度的香气标准[45-46],在发达国家桃果实采后运销期间,人们采用电子鼻无损检测等技术实时监控果实成熟过程中香气物质的含量变化,并将其作为判断果实成熟度的一个重要指标[47-49]。此外,根据品种间香气成分的差异,Montero-Prado等[50]建立了一套香气识别模式,该方法结合特定的实验可以有效识别桃品种。
3.2 果实部位对香气的影响
通过对白肉桃品种“Maura”不同部位芳香挥发物的测定发现,果皮的芳香成分的含量显着高于果肉等其他部位,而顶部和底部果肉中的挥发物主要是不饱和内酯和6碳化合物的相对浓度不同,内酯类成分在果肉中的分布依次是:顶部高于中部高于底部,且差异显着;苯甲醛浓度在靠近核仁部位最高,推测其可能由苦杏仁苷酶水解而来[51]。
3.3 贮藏条件对桃果实香气的影响
3.3.1 温度
采后贮藏过程中,温度对桃果实风味物质的变化有较大影响。在常温及4 ℃低温下的早熟桃“京春”挥发物中,低温下种类较常温少,浓度低,而青草香型物质如乙醛、癸醛和2-己烯醛等的含量高于常温[43]。Infante等[52]对4 个黄肉桃果实在0 ℃冷藏阶段成熟指标和香气品质进行评估,发现4 个品种的桃果实的冷藏寿命均受到果实品质降低的限制,其芳香挥发物组成和含量上差别较大,未成熟的桃果实并不具备桃果实的特有香气,但是随着采后成熟度的增加及采后处理方式的变化,其芳香成分也在含量及组成上存在差异。Zhang Bo等[53]研究发现,5 ℃冷害温度使桃果实的酯类和内酯类特征香气减少;0 ℃和8 ℃温度下(Z)-3-己烯醇浓度要高于5 ℃,乙酸己酯的产生显着受低温抑制。0 ℃贮藏2 周果实在货架期3 d时总酯的浓度最高,其次分别是8 ℃和5 ℃,可见温度和冷藏时间对桃果实香气成分的产生有显着影响。冷藏影响桃果实总挥发性成分的释放,经过-0.5 ℃贮藏40 d,“Royal Glory”中总挥发物的释放量是刚采收时的1.5 倍,冷藏后“Early Rich”和“Elegant Lady”桃中酯类物质占主要地位,冷藏20 d时酯类挥发量达到顶峰;乙基-2-甲基丁酸甲酯风味阈值很低,是影响桃果实风味的重要成分,采收初期的果实中并未检测到该物质,但在冷藏20 d的果实中发现了乙基-2-甲基丁酸甲酯,表明低温贮藏促进了该物质的释放[23]。
3.3.2 冷害和病害
研究发现,5 ℃条件下贮藏15 d和0℃条件下贮藏30 d后,大久保桃果实开始出现冷害症状,果实风味丧失,酯类香气合成受到抑制;而8 ℃冷锻炼和0 ℃条件下添加外源乙烯等方式,可以使果实完成后熟作用,风味得到较好的保持,特征香气的合成在一定程度上得到恢复[54]。5 ℃贮藏容易引发桃果实冷害,“湖景蜜露”桃在5 ℃贮藏2 周后,内酯和酯类物质的合成受阻,香味基本丧失;使用间歇升温处理后,明显促进了酯类物质的合成,香气品质得到改善[55]。除了冷害外,病虫害也影响果实的挥发性物质合成。研究发现,在受真菌病害和机械损伤的植物组织中,LOX活性迅速增加,挥发物(E)-2-己烯醛表现出抗真菌活性,可以控制褐腐病的发生,这种特性已经在李子上得到证实[56]。LOX是桃果实香气合成中脂肪酸途径的关键酶,(E)-2-己烯醛也是桃果实的特征香气物质,而关于病害损伤与果实芳香物质相互作用在桃果实上是否也存在,尚需具体实验来验证。
此外,气调贮藏和变动气调贮藏对桃果实的香气亦有影响,实验发现,气调贮藏和变动气调贮藏的果实风味指数均显着高于单纯低温冷藏的果实,货架期3 d后,变动气调贮藏果实具有浓郁的香气,且果实可以完成正常后熟软化[57]。
3.4 栽培管理对桃果实香气的影响
设施栽培与露天栽培条件对香气的成分和质量浓度均有影响,设施栽培桃果实中酯类和内酯类香气质量浓度较少,虽然醇类和醛类物质质量浓度较高,但是总挥发物的种类少于露天栽培桃[42]。李斌等[58]研究了不同时期套不同厚度果袋对果实香气品质的影响,发现盛花后50 d左右套一层橘黄色果袋能提高果实香气品质,适当光照对果香型香气γ-癸内酯的合成有明显促进作用。在采收前至少9周进行套袋管理,可有效保护桃果实免受病虫伤害,同时提高了果皮着色,果实的挥发性香气成分较不套袋果实有所增加[59]。Wang Yiju等[60]发现,不套袋桃果实的总挥发性成分的质量浓度及6碳化合物和酯类要显着高于套袋果实,在盛花后桃果实产生酯和内酯类挥发物的关键时期套袋,果实中γ-癸内酯、δ-癸内酯的质量浓度要显着低于不套袋果实,认为套袋可能导致桃果实风味降低。
采前的营养状况也是影响桃果实香气品质的重要因素。通过对多年生成熟肥城桃树施加有机肥料发现,有机肥对肥城桃果实香气成分和浓度的增加有促进作用,而且不同有机肥均能促进肥城桃果实中清香型香气向果香型香气酯类和内酯类的转化,从而提高果实的香气品质[61]。Toselli等[62]得出类似结果,施加有机堆肥的油桃果实,其芳樟醇含量高于施用无机肥的果实。浓度为2.6%~3.0%的叶面氮肥有助于油桃达到最佳品质[44],而缺氮则会使桃果实的香味变淡[63]。缺水胁迫会引发次生效应,果个变小,影响果实着色,果实更容易出现热损伤等情况[64]。缺失灌溉是应对当前缺水胁迫的一种有效手段,研究发现,在桃果实采收前50 d进行缺失灌溉,可以有效改善果实的感官品质,提高果实硬度、出汁率、脆度、甜度及增加水蜜桃风味[65]。尽管有研究报道桃果实风味与香气的释放呈正相关[66],且也有研究证实,亏缺灌溉有利于贮藏阶段苹果果实的香气积累[67],但是目前尚无水分胁迫对桃果实香气成分及其含量的影响的研究报道。修剪和蔬果能显着影响桃果实大小,进而提高果实的整体品质[64]。总之,桃果实的芳香挥发物的组成及含量是随着果实成熟、衰老而表现出的动态变化过程,除了受基因型等遗传因素及上述诸如施肥、灌溉等因素控制外,整修修剪、病虫害防治等栽培管理措施亦可通过影响桃树体生长发育和果实发育,进而间接影响果实香气等风味品质。
4 桃果实芳香代谢研究存在的问题及前景展望
桃果实芳香品质研究已经取得很大进展并日趋深入,目前已经鉴定出很多与桃果实特征香气相关的挥发物质,并且探索出了多条合成这些物质的生物代谢途,随着桃全基因组测序工作的完成,必将加快桃果实芳香代谢相关基因的鉴定和分离工作的脚步,但是相比其他模式植物,桃作为蔷薇科果树的模式植物,仍有大量的工作需要补充和完善。首先,一些挥发物的阈值浓度、权重尚待进一步研究确定,如烷烃类物质、酸类物质在桃果实挥发性成分中占相当部分比重[20,38],但是关于它们对桃果实特征香气的影响目前尚无定论;其次,已知果实特征风味的形成,并不是某一类或几类物质独立影响的,而是众多挥发物间相互作用的体现,此外桃果实香气还与硬度、出汁率、可溶性糖、酸度等风味指标表现出高的相关性[65-66],推测他们可能以某种方式相互作用,并由此影响桃果实的芳香品质,但是这种相互作用是如何实现的,及通过何种方式进行的等问题需要进一步探讨和验证;第三,尽管目前已经挖掘出了一些主要挥发物的合成途径和其中涉及的关键酶,但在关键底物和酶的鉴定上还有很多工作,包括锚定特定的底物和酶,通过正反实验确定特定底物和特定酶反应所产生的香气物质,完善桃果实香气合成路径;第四,桃果实品质基本是在采前生长发育阶段形成的,但目前关于采前培育阶段的管理对桃果实香气品质的影响方面重视不够,研究表明,加强采前栽培管理能够延长桃和油桃果实的采后贮藏寿命,减少因冷害引起的经济损失[6],且已有研究证实,栽培管理措施会影响桃果实香气成分的积累和释放[42,60,62],因此很有必要进行加强采收前期管理方面研究。
总之,桃果实香气生物合成的多样性及代谢调控的复杂性并存,如何通过调控酶的活性或底物的供应来调整桃果实的香气、及这些代谢相关酶和基因如何对外界刺激做出响应等方面研究,仍是项艰巨而长远的任务,关于桃果实香气合成途径的调节,尤其是转录和翻译水平的调控机制仍需要进一步探索,研究结果可为蔷薇科及其他科属果实的香气研究提供借鉴和参考,同时为通过分子辅助手段培育适合市场需求的新香型桃品种开辟新径。
[1] 汪祖华, 庄恩及. 中国果树志 桃卷[M]. 北京: 中国林业出版社, 2001: 2.
[2] FAO. Food and Agriculture Organization of the United Nations[DB/ OL].(2013-12). http://faostat.fao.org.
[3] WANG Yiju, YANG Chunxiang, LI Shaohua, et al. Volatile characteristics of 50 peaches and nectarines evaluated by HP-SPME with GC-MS[J]. Food Chemistry, 2009, 116(1): 356-364.
[4] 王友升, 王贵禧. 冷害桃果实品质劣变及其控制措施[J]. 林业科学研究, 2003, 16(4): 465-472.
[5] CANTÍN C M, CRISOSTO C H, OGUNDIWIN E A, et al. Chilling injury susceptibility in an intra-specific peach (Prunus persica L. Batsch) progeny[J]. Postharvest Biology and Technology, 2010, 58(2): 79-87.
[6] LURIE S, CRISOSTO C H. Chilling injury in peach and nectarine[J]. Postharvest Biology and Technology, 2005, 37(3): 195-208.
[7] ARAGÜEZ I, VALPUESTA V. Metabolic engineering of aroma components in fruits[J/OL]. Biotechnology Journal, 2013, doi: 10.1002/biot.201300113.
[8] ARÐS P, VERDE I, SOSINSKI B, et al. The peach genome[J]. Tree Genetics and Genomes, 2012, 8(3): 531-547.
[9] VERDE I, ABBOTT A G, SCALABRIN S, et al. The high-quality draft genome of peach (Prunus persica) identifies unique patterns of genetic diversity, domestication and genome evolution[J]. Nature Genetics, 2013, 45(5): 487-494.
[10] 李晓颖, 谭洪花, 房经贵, 等. 果树果实的风味物质及其研究[J]. 植物生理学报, 2011, 47(10): 943-950.
[11] 宋丽娟, 李雄伟, 陈琳, 等. 果实香气合成与遗传控制研究概述[J].果树学报, 2008, 25(5): 708-713.
[12] 张云涛, 董静, 王桂霞. 草莓香味的形成和香味育种[J]. 中国农业科学, 2004, 37(7): 1029-1044.
[13] HORVAT R J, CHAPMAN G W, RPBERTSON J A. Comparison of the volatile compounds from several commercial peach cultivars[J]. Journal of Agricultural and Food Chemistry, 1990, 81(1): 234-237.
[14] LI Xiaolei, KANG Luan, HU Jingjing, et al. Aroma volatile compound analysis of SPME headspace and extract samples from crabapple (Malus sp.) fruit using GC-MS[J]. Agricultural Sciences in China, 2008, 7(12): 1451-1457.
[15] SÁNCHEZ G, BESADA C, BADENES M L, et al. A non-targeted approach unravels the volatile network in peach fruit[J]. PLoS One, 2012, 7(6): e38992.
[16] EDUARDO I, CHIETERA G, BASSI D, et al. Identification of key odor volatile compounds in the essential oil of nine peach accessions[J]. Journal of the Science of Food Agriculture, 2010, 90(7): 1146-1154.
[17] 席万鹏, 郁松林, 周志钦. 桃果实香气物质生物合成研究进展[J]. 园艺学报, 2013, 40(9): 1679-1690.
[18] ZHANG Bo, SHEN Jiyuan, WEI Wenwen, et al. Expression of genes associated with aroma formation derived from the fatty acid pathway during peach fruit ripening[J]. Journal of Agricultural and Food Chemistry, 2010, 58(10): 6157-6165.
[19] LAVILLA T, RECASENS L, LOPEZ M L, et al. Maturity stages, including quality and aroma, in “Royal Glory” peaches and “Big Top”nectarines[J]. Journal of the Science of Food and Agriculture, 2012, 82(15): 1842-1849.
[20] 李杨昕, 王贵禧, 梁丽松. “大久保”桃常温贮藏过程中香气成分变化及其与乙烯释放的关系[J]. 园艺学报, 2011, 38(1): 35-42.
[21] 张晓萌. 桃果实成熟过程中香气成分形成及其生理机制研究[D]. 杭州: 浙江农业大学, 2005.
[22] ORTIZ A, GRAELL J, LÓPEZ M L, et al. Volatile ester-synthesising capacity in “Tardibelle” peach fruit in response to controlled atmosphere and 1-MCP treatment[J]. Food Chemistry, 2010, 123: 698-704.
[23] CANO-SALAZAR J, ECHEVERRÍA G, CRISOSTO C H, et al. Coldstorage potential of four yellow-fleshed peach cultivars defined bytheir volatile compounds emissions, standard quality parameters, and consumer acceptance[J]. Journal of Agricultural and Food Chemistry, 2012, 60(5): 1266-1282.
[24] CZERNY M, CHRISTLBAUER M, CHRISTLBAUER M, et al. Reinvestigation on odour thresholds of key food aroma compounds and development of an aroma language based on odour qualities of defined aqueous odorant solutions[J]. European Food Research and Technology, 2008, 228(2): 265-273.
[25] ZHANG Xiaomeng, JIA Huijuan. Changes in aroma volatile compounds and ethylene production during “Hujingmilu” peach (Prunus persica L.) fruit development[J]. Journal of Plant Physiology and Molecular Biology, 2005, 31(1): 41-46.
[26] 邓翠红, 李丽萍, 韩涛, 等. “京艳”桃果实香气成分的气相色谱-质谱测定[J]. 食品科学, 2008, 29(6): 304-307.
[27] CANO-SALAZAR J, LÓPEZ M L, ECHEVERRÍA G. Relationships between the instrumental and sensory characteristics of four peach and nectarine cultivars stored under air and CA atmospheres[J]. Postharvest Biology and Technology, 2013, 75: 58-67.
[28] VISAI C, VANOLI M. Volatile compound production during growth and ripening of peaches and nectarines[J]. Scientia Horticulturae, 1997, 70(1): 15-24.
[29] 李志文, 张平, 黄艳凤, 等. 贮藏保鲜中SO2伤害对红提葡萄香气组分的影响[J]. 西北植物学报, 2011, 31(2): 385-392.
[30] WANG Yiju, CHEN Feng, FANG Jinbao, et al. Effects of germplasm origin and fruit character on volatile composition of peaches and nectarines[J]. ACS Symposium Series, 2010, 1035: 95-117.
[31] SÁNCHEZ G, VENEGAS-CALERÓN M, SALAS J J, et al. An integrative “omics” approach identifies new candidate genes to impact aroma volatiles in peach fruit[J]. BMC Genomics, 2013, 14: 343. doi: 10.1186/1471-2164-14-343.
[32] BEEKWILDER J, ALVAREZ-HUERTA M, NEEF E, et al. Functional characterization of enzymes forming volatile esters from straw-berry and banana[J]. Plant Physiology, 2004, 135(4): 1865-1878.
[33] 徐文平, 陈昆松, 李方, 等. 脂氧合酶、茉莉酸和水杨酸对猕猴桃果实后熟软化进程中乙烯生物合成的调控[J]. 植物生理学报, 2000, 26(6): 507-514.
[34] XI Wanpeng, ZHANG Bo, LIANG Li, et al. Postharvest temperature influences volatile lactone production via regulation of acyl-CoA oxidases in peach fruit[J]. Plant Cell and Environment, 2012, 35(3): 534-545.
[35] ARAND M, HEMIMER H, DŰRK H, et al. Cloning and molecular characterization of a soluble epoxide hydrolase from Aspergillus niger that is related to mammalian microsomal epoxide hydrolase[J]. Biochemical Journal, 1999, 344: 273-280.
[36] PIRNA R, VECCHIETTI A, LAARI B, et al. Expression profiling of genes involved in the formation of aroma in two peach genotypes[J]. Plant Biology, 2013, 15(3): 443-451.
[37] 许燕华, 骆萍, 卢山, 等. 次生萜类生物合成的调控[J]. 中国科学基金, 2000, 14(4): 197-200.
[38] EDUARDO I, CHIETERA G, PIRONA R, et al. Genetic dissection of aroma volatile compounds from the essential oil of peach fruit: QTL analysis and identification of candidate genes using dense SNP maps[J].Tree Genetics & Genomes, 2013, 9(1): 189-204.
[39] MANUEL R C, ALBERT B. Elucidation of the methylerythritol phosphate pathway for isoprenoid biosynthesis in bacteria and plastids. a metabolic milestone achieved through genomics[J]. Plant Physiology, 2002, 130(3): 1079-1089.
[40] BRANDI F, BAR E, MOURGUES F, et al. Study of “Redhaven” peach and its white-fleshed mutant suggests a key role of CCD4 carotenoid dioxygenase in carotenoid and norisoprenoid volatile metabolism[J]. BMC Plant Biology, 2011, 11: 24. doi: 10.1186/1471-2229-11-24.
[41] 张梅. 设施桃果实香气组分及相关性研究[D]. 泰安: 山东农业大学, 2007.
[42] GONDA I, BAR E, PORTNOY V, et al. Branched-chain and aromatic amino acid catabolism into aroma volatiles in Cucumis melo L. fruit[J]. Journal of Experimental Botany, 2010, 61(4): 1111-1123.
[43] 陈华君, 马焕普, 刘志民, 等. 两种温度条件下早熟桃果实中挥发性物质成分分析[J]. 植物生理学通讯, 2005, 41(4): 525-527.
[44] CRISOSTO C H, COSTA G. The peach: botany, production and uses-preharvest factors affecting peach quality[M]. USA: CAB International, 2008: 536-544.
[45] ANGELIKA K, PETER P, BERNHARD B. Flavour compounds and a quantitative descriptive analysis of tomatoes (Lycopersicon esculentum Mill.) of different cultivars in short-term storage[J]. Postharvest Biology and Technology, 2004, 32(1): 15-28.
[46] ONG B T, NAZIMAH S A H, OSMAN A, et al. Chemical and flavour changes in jackfruit (Artocarpus heterophyllus Lam.) cultivar J3 during ripening[J]. Postharvest Biology and Technology, 2006, 40(3): 279-286.
[47] JIA Huijuan, OKAMOTO G, HIRANO K. Studies on the sensory evaluation of juice constituents of peach fruit[J]. Journal of Fruit Science, 2004, 21(1): 5-10.
[48] ZHANG Hongmei, WANG Jun, YE Sheng, et al. Application of electronic nose and statistical analysis to predict quality indices of peach[J]. Food Bioprocess Technology, 2012, 5(1): 65-72.
[49] HUI Guohua, WU Yuling, YE Dandan, et al. Study of peach freshness predictive method based on electronic nose[J]. Food Control, 2012, 28(1): 25-32.
[50] MONTERO-PARDO P, BENTAYEB K, NERÍN C. Pattern recognition of peach cultivars (Prunus persica L.) from their volatile components[J]. Food Chemistry, 2013, 138: 724-731.
[51] AUBERT C, MILHET C. Distribution of the volatile compounds in the different parts of a white-fleshed peach (Prunus persica L. Batsch) [J]. Food Chemistry, 2007, 102(1): 375-384.
[52] INFANTE R, FARCUH M, MENESES C. Monitoring the sensorial quality and aroma through an electronic nose in peaches during cold storage[J]. Journal of the Science of Food and Agriculture, 2008, 88(12): 2073-2078.
[53] ZHANG Bo, XI Wanpeng, WEI Wenwen, et al. Changes in aromarelated volatiles and gene expression during low temperature storage and subsequent shelf-life of peach fruit[J]. Postharvest Biology and Technology, 2011, 60(1): 7-16.
[54] 李杨昕. 大久保桃果实特征香气物质低温代谢障碍的基础研究[D].北京: 中国林业科学研究院, 2010.
[55] XI Wanpeng, ZHANG Bo, SHEN Jiyuan, et al. 2012. Intermittent warming alleviated the loss of peach fruit aroma-related esters by regulation of AAT during cold storage[J]. Postharvest Biology and Technology, 2012, 74(1): 42-48.
[56] NERI F, MARI M, BRIGATI S, et al. Fungicidal activity of plant volatile compounds for controlling Monilinia laxa in STONE fruit[J]. Plant Disease, 2007, 91(1): 30-35.
[57] 冯志宏, 赵迎丽, 闫根柱, 等. 变动气调贮藏保持大久保桃品质的研究[J]. 园艺学报, 2010, 37(2): 207-212.
[58] 李斌, 贾慧娟, 张晓萌. 果实采收前套袋对湖景蜜露桃果实品质的影响[J]. 植物生理与分子生物学学报, 2006, 32(3): 280-286.
[59] JIA Huijuan, ARAKI A, OKAMOTO G. Influence of fruit bagging on aroma volatiles and skin coloration of “Hakuho” peach (Prunus persica Batsch)[J]. Postharvest Biology and Technology, 2005, 35(1): 61-68.
[60] WANG Yiju, YANG Chunxiang, LIU Chunyan, et al. Effects of bagging on volatiles and polyphenols in “Wanmi” peaches during endocarp hardening and final fruit rapid growth stages[J]. Journal of Food Science, 2010, 75(9): 455-460.
[61] 罗华, 李敏, 胡大刚, 等. 不同有机肥对肥城桃果实产量及品质的影响[J]. 植物营养与肥料学报, 2012, 18(4): 955-964.
[62] TOSELLI M, BALDI E, MARANGONI B, et al. Effects of mineral and organic fertilization and ripening stage on the emission of volatile organic compounds and antioxidant acticity of “Stark Redgold”nectarine[J]. Acta Horticulturae (ISHS), 2010, 868: 381-388.
[63] DAANE K M, JOHNSON R S, MICHAILIDES T J, et al. Excess nitrogen raises nectarine susceptibility to disease and insects[J]. California Agriculture, 1995, 49(4): 13-18.
[64] KAYS S J. Preharvest factors affecting appearance[J]. Postharvest Biology and Technology, 1999, 15: 233-247.
[65] LOPEZ G, BEHBOUDIAN M H, ECHEVERRIA G, et al. Instrumental and sensory evaluation of fruit quality for ‘Ryan’s Sun’ Peach grown under deficit irrigation[J]. Hort Technolygy, 2011, 21(6): 712-719.
[66] ORTIZ A, LARA I, GRAELL J, et al. Sensory acceptance of CA-stored peach fruit. relationship to instrumental quality parameters[J]. Acta Horticulturae. 2008, 796: 225-230.
[67] MPELASOKA B S, HOSSEIN B M. Production of aroma volatiles in response to deficit irrigation and to crop load in relation to fruit maturity for “Braeburn” apple[J]. Postharvest Biology and Technology, 2002, 24(1): 1-11.
Recent Progress in Research on the Composition and Synthesis of Aroma Volatiles in Peach Fruits
WANG Gui-zhang, WANG Gui-xi*, LIANG Li-song, MA Qing-hua
(State Key Laboratory of Tree Genetics and Breeding, Research Institute of Forestry, Chinese Academy of Forestry, Beijing 100091, China)
In recent years, the aroma has caught wide attention as an important indicator for the flavor quality of peach fruits. Over 100 kinds of volatile aroma components have been identified from peach fruits. The aroma volatiles in peach fruits are affected by genetic factors and external environment. The key enzymes regulating the biosynthesis of aroma components have been demonstrated. Since the composition of aroma volatiles in peach fruits and their contributions to peach flavor have been reported, the major aroma volatiles and key enzymes involved in their biosynthesis in peach fruits are reviewed in this paper. The effects of preharvest and postharvest conditions such as maturity, variety, storage conditions and cultivation management measures on aroma components and contents are discussed. Finally, some issues concerning the aroma metabolism of peach fruits are also analyzed and future research prospects are proposed. In conclusion, we hope this paper could provide references for further studies on aroma volatile components in peach fruits.
peach fruit; aroma; biosynthesis; regulation
S662.1
A
1002-6630(2014)17-0278-07
10.7506/spkx1002-6630-201417053
2013-09-17
国家自然科学基金面上项目(31071834)
王贵章(1978—),女,博士研究生,研究方向为经济林产品采后贮藏保鲜。E-mail:wwgz2003@tom.com
*通信作者:王贵禧(1962—),男,研究员,博士,研究方向为经济林产品贮藏保鲜。E-mail:wanggx0114@126.com



