刘友华
新型琼脂扩散法检测食品中天然防腐剂ε-聚赖氨酸含量
刘友华
(福建省产品质量检验研究院,福建 福州 350002)
为分析食品中ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)含量,建立一种新型琼脂扩散法,并对分析条件进行优化,验证在检测食品中ε-PL含量时的有效性。结果表明,质量分数0.002%亚甲基蓝、0.75%琼脂、ε-PL溶液pH值为2.0、牛津杯加液量750 μL时检测结果最佳。本方法允许检测橙汁中ε-PL最低含量为2 mg/kg、糕点和猪肉火腿中最低为10 mg/kg。这种新型琼脂扩散法具有操作简便、使用成本低、专一性高等优点,可以广泛应用于ε-PL生产企业和食品工业。
ε-聚赖氨酸;检测;琼脂扩散法;亚甲基蓝;牛津杯;食品
ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是一种由链霉菌属的微生物以非核糖体合成方式积累的聚氨基酸,它由人体必需氨基酸赖氨酸通过α-羧基和ε-氨基形成酰胺键连接而成[1-3]。由于ε-PL是聚阳离子物质,它能够通过静电作用吸附到微生物表面,破坏其细胞膜并进而影响微生物生长繁殖,因此它能够抑制包括革兰氏阳性菌、阴性菌、真菌在内的多种微生物的生长繁殖[4-7]。此外,ε-PL具有很好的水溶性、热稳定性,并且无异味[8-9]。基于上述生物活性以及毒理实验证明的安全性[10-11],ε-PL已经被允许作为食品防腐剂在日本、韩国、美国等多个国家添加使用,它在常见食品中的添加量为50~500 mg/kg[2]。现在国内有多家科研单位进行ε-PL开发,其中几家单位的ε-PL项目已成功完成中试。国家卫生计生委于2014年4月批准ε-PL为食品添加剂新品种,添加量在150~250 mg/kg范围之内。然而到目前为止,还鲜见国内外检测食品中ε-PL含量的相关文献报道,我国也尚未制定食品中ε-PL的检测标准。为便于国家食品安全部门监管ε-PL在食品中的使用和相关企业推广ε-PL作为防腐剂在食品工业中应用,急需建立食品中ε-PL的检测方法。
目前ε-PL的检测方法均为检测发酵液中的ε-PL而建立的,主要有比色法和高效液相色谱(high performance liquid chromatography,HPLC)法[12-14]。但比色法并不适合检测食品中ε-PL含量,因为食品浊度通常很高,会影响比色测定。采用HPLC法来检测食品中ε-PL含量时,由于食品组分复杂,发现HPLC法不易将ε-PL和食品组分分开,从而影响检测的准确度,目前还在研究之中。琼脂扩散法是一种常用的定量方法,它的原理为:待测物质在平板上扩散时,能形成明显的扩散圈,扩散圈直径与待测物质含量对数值呈线性关系[15-17]。近来,在探索ε-PL生产菌株筛选方法的过程中,Nishikawa等[18]发现,由于ε-PL和碱性染料亚甲基蓝之间的静电作用,当ε-PL在含有亚甲基蓝的琼脂平板上扩散时,能形成清晰的扩散圈,并且ε-PL质量浓度的对数值与上述扩散圈直径之间有很好的线性关系。基于上述原理本实验建立一种新型琼脂扩散法,并且对此方法检测食品中ε-PL含量的适用性进行验证。
1 材料与方法
1.1 材料与试剂
ε-PL标品Ⅰ(约40 个赖氨酸残基,由Kitasatospora sp. NY 2-11发酵合成,纯度98%)、ε-PL标品Ⅱ(约30个赖氨酸残基,纯度99%) 日本Chisso公司;Nisin浙江银象生物工程有限公司;亚甲基蓝 美国Sigma公司;橙汁 汇源集团有限公司;糕点 市购;猪肉火腿 雨润控股集团。
1.2 仪器与设备
牛津杯(内径(6.0±0.1) mm、外径(7.8±0.1) mm、高(10±0.1) mm) 上海江星仪器有限公司。
1.3 方法
1.3.1 ε-PL储备溶液的制备
精确称取1 g ε-PL,溶解到100 mL溶剂中,5 mol/L盐酸溶液调节pH 4.0或pH 2.0,作为储备液。使用时,此储备液用pH 4.0或pH 2.0溶剂进一步稀释到所需ε-PL质量浓度。储备液在4 ℃条件下可保存1 周。
1.3.2 琼脂扩散法
灭菌后,待含有质量分数0.002%亚甲基蓝的琼脂溶液冷却到45 ℃,取10 mL琼脂溶液以无菌操作的方式加到培养皿中(100 mm×15 mm),凝固后作为琼脂平板。在琼脂平板上等距离安放牛津杯。将240 μL样品溶液加入各个牛津杯内,然后将平板转移到培养箱,在30 ℃条件下进行扩散,实验重复4 次。待牛津杯内的溶液扩散完毕,取下牛津杯,水平和垂直测量扩散圈直径,并记录平均值。
以ε-PL质量浓度对数值为自变量,相应的扩散圈直径为因变量,按下式计算回归直线方程:
Y=a×lgX+b
式中:X为ε-PL溶液质量浓度/(mg/L);Y为扩散圈直径/mm;a为回归直线斜率;b为回归直线截距。
本检测方法的准确度(被测量的测得值与其真值间的一致程度)以回归直线的斜率判断。斜率越大扩散性越好,反之越差。精密度(在规定条件下,对同一或类似被测对象重复测量所得示值或测得值间的一致程度)用来验证在给定ε-PL质量浓度范围内回归方程的有效性,以回归方程的回归系数来判断。标准曲线与Y轴截距可反映测定的灵敏度。
1.3.3 待测食品的处理
将待测食物浸泡20 min,均质后调节pH值为2.0,70 ℃加热10 min,10 000 r/min离心10 min,然后收集上清液作为食物浸液进行ε-PL含量检测。
1.4 数据处理
以ε-PL质量浓度对数值为自变量,对应的扩散圈直径为因变量,进行线性回归,计算回归方程。通过单因素方差分析各参数(斜率、灵敏度、R2、回收率)的平均值和标准偏差,通过Turkey法进行对比分析,显着性水平为P=0.05。所有的数据分析均采用Origin Profession 8.0软件包进行。
2 结果与分析
2.1 评估琼脂扩散法分析ε-PL含量
为研究食品中其他物质对琼脂扩散法的影响,按表1制备各种物质溶液,以1.3.2节平板扩散法进行实验,结果如表1所示;为研究扩散圈与ε-PL含量之间的线性关系,以蒸馏水为溶剂,配制一系列pH 4.0的ε-PL标准溶液(50、100、200、400、600、1 000 mg/L),对照为pH 4.0的蒸馏水,也在同样条件下进行扩散。结果如图1所示。
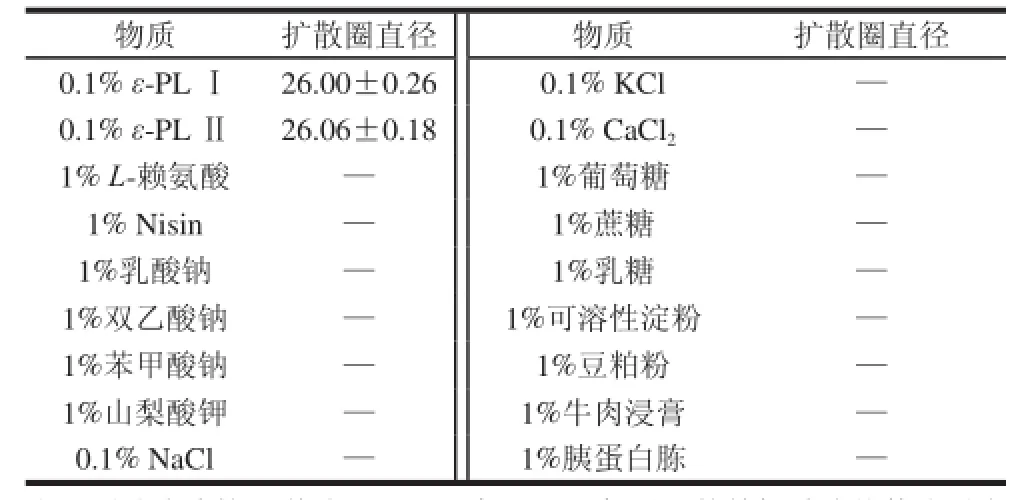
表 1 常见的防腐剂、金属盐、糖类物质、蛋白类物质在亚甲基蓝琼脂平板上的扩散Table 1 Diffusion of common preservatives, metal salts, saccharides,and proteins on agar plate containing methylene blue mm
ε-PL是一种聚阳离子物质,而亚甲基蓝是一种阳离子染料,当ε-PL在含有亚甲基蓝的琼脂平板上扩散时,由于ε-PL和碱性染料之间的静电排斥作用,可观测到扩散圈。结果如表1所示,L-赖氨酸(ε-PL的单体)、常用食品防腐剂以及其他物质均不会形成扩散圈。而ε-PL标品Ⅰ和ε-PL标品Ⅱ均形成清晰的扩散圈,并且两者之间的扩散圈直径差异不显着(P>0.05),说明ε-PL分子质量对扩散圈直径影响不明显。如无特殊说明,以下实验均采用ε-PL标品Ⅰ作为ε-PL样品。
如图1a所示,随着ε-PL质量浓度的增加,扩散圈直径逐渐增大,而对照没有扩散圈形成。在采用微生物琼脂扩散法检测Nisin过程中,Nisin在接种指示菌的平板上扩散时,会形成清晰的抑菌圈,并且Nisin质量浓度的对数值和抑菌圈直径之间有线性关系[16-17]。因此,对上述扩散圈直径和ε-PL质量浓度对数值进行线性回归分析,发现直线的回归系数达到0.996 8,说明两者之间有很好的线性关系(图1b)。
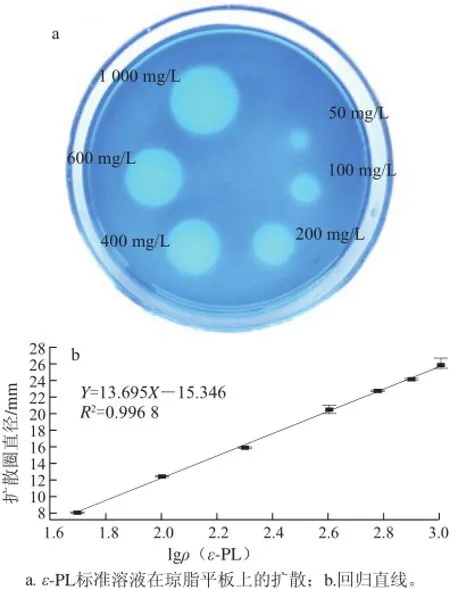
图 1 1 ε-PL在亚甲基蓝琼脂平板上的扩散作用Fig.1 Diffusion of ε-PL on agar plate containing methylene blue
2.2 琼脂扩散法分析条件的优化
分析食品中ε-PL需要较高的灵敏度,而初始的分析条件不能满足上述要求。参考微生物琼脂扩散法定量Nisin中的主要影响因素[15,17],选择不同质量分数的亚甲基蓝、琼脂、琼脂厚度、ε-PL溶液的pH值、牛津杯加液量为影响因素,优化琼脂扩散法检测食品中ε-PL的分析条件。
2.2.1 亚甲基蓝质量分数对琼脂扩散法的影响
将一系列pH 4.0的ε-PL标准溶液(100、200、300、400、600、800、1 000 mg/L)在分别含有不同质量分数亚甲基蓝(0.001%、0.001 5%、0.002%、0.003%、0.004%)的平板上进行扩散。结果如表2所示。
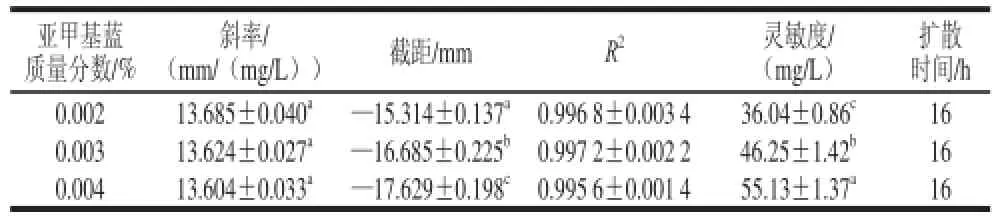
表 2 亚甲基蓝质量分数对琼脂扩散法的影响Table 2 Effect of methylene blue concentration on agar diffusion assay
扩散前,含有质量分数0.001%以上亚甲基蓝的平板颜色均为蓝色。扩散后,质量分数0.001%和质量分数0.001 5%亚甲基蓝平板上形成不清晰的扩散圈(边缘模糊)。推测可能0.001%和0.001 5%亚甲基蓝平板含有的正电荷染料太少,不能完全抵抗ε-PL的静电排斥作用,一些亚甲基蓝分子移动较快,而一些亚甲基蓝分子移动较慢,因此导致扩散圈边缘不清晰。
不同亚甲基蓝质量分数对应的斜率之间并没有显着差异(P>0.05),因此不同亚甲基蓝质量分数不会影响该方法的准确度。另一方面,发现随着亚甲基蓝质量分数的增加,灵敏度明显的下降。不同质量分数亚甲基蓝之间扩散时间的差异不大,均为16 h。因此,选择质量分数0.002%亚甲基蓝为琼脂扩散法检测发酵液和食品中ε-PL含量时的分析条件。
2.2.2 琼脂质量分数对琼脂扩散法的影响
将一系列pH 4.0的ε-PL标准溶液(100、200、300、400、600、800、1 000 mg/L)在分别含有不同质量分数的琼脂(0.50%、0.75%、1.00%、1.25%、1.50%、2.00%)平板上进行扩散。结果如表3所示。
当琼脂质量分数不小于0.75%时,平板上均形成了清晰的扩散圈;而对于琼脂质量分数为0.50%的平板,此条件下由于部分琼脂发生液化,导致扩散圈不清晰。随着琼脂质量分数的增加,回归直线斜率(彼此差异显着,P<0.05)逐渐下降(表3),因此降低琼脂质量分数会增加琼脂扩散法的准确性。而随着琼脂质量分数的减少,灵敏度逐渐增加;和2.00%琼脂相比,0.75%琼脂灵敏度增加了236.5%。除了质量分数0.75%琼脂的扩散时间为18 h,其他质量分数琼脂的扩散时间均为16 h。质量分数0.75%琼脂具有高的灵敏度和准确度,因此选择作为检测食品中ε-PL含量时的分析条件。
2.2.3 琼脂厚度对琼脂扩散法的影响
将一系列pH 4.0的ε-PL标准溶液(100、200、300、400、600、800、1 000 mg/L)在分别装有不同体积琼脂溶液(10、15、20、25、30 mL)的平板上进行扩散。结果如表4所示。

表 4 琼脂厚度对琼脂扩散法的影响Table 4 Effect of agar depth on agar diffusion assay
如表4所示,不同琼脂厚度对应回归直线斜率之间差异不显着(P>0.05),因此琼脂厚度不会影响该方法的准确度。然而,随着琼脂厚度的减小,灵敏度显着增加。和20 mL琼脂溶液相比,10 mL琼脂溶液的灵敏度增加了206%。15~30 mL琼脂溶液的扩散时间均为16 h,而10 mL琼脂溶液的扩散时间略微延长,为18 h。10 mL琼脂溶液是能够形成琼脂平板的最小琼脂溶液体积,它具有高的灵敏度和准确度,因此选择作为检测食品中ε-PL含量时的分析条件。
2.2.4 ε-PL溶液pH值对琼脂扩散法的影响
配制pH值分别为2.0、3.0、4.0、6.0、8.0的5 种ε-PL标准溶液(100、200、300、400、600、800、1 000 mg/L)在平板上进行扩散。
ε-PL的等电点为9.0[19],当ε-PL溶液pH低于9.0时,它会携带大量的正电荷,并且随着pH值降低,其所带正电荷的数量逐渐增加。因此ε-PL溶液的pH值会显着影响其在琼脂平板上形成的扩散圈大小。如表5所示,pH 4.0和pH 6.0的斜率之间没有显着差异;但是,和pH 4.0相比,pH 2.0、3.0、8.0的斜率显着下降(P<0.05)。另一方面,随着pH值下降,灵敏度显着增加,特别是pH值从3.0降到2.0,灵敏度增加了94.5%。并且扩散时间均为16 h,回归直线的R2值均较高,说明pH值对琼脂扩散法的扩散时间和精密度影响不明显。ε-PL的pH值低于2.0时,易发生降解,综合考虑选择pH 2.0作为检测食品中ε-PL含量时的分析条件。
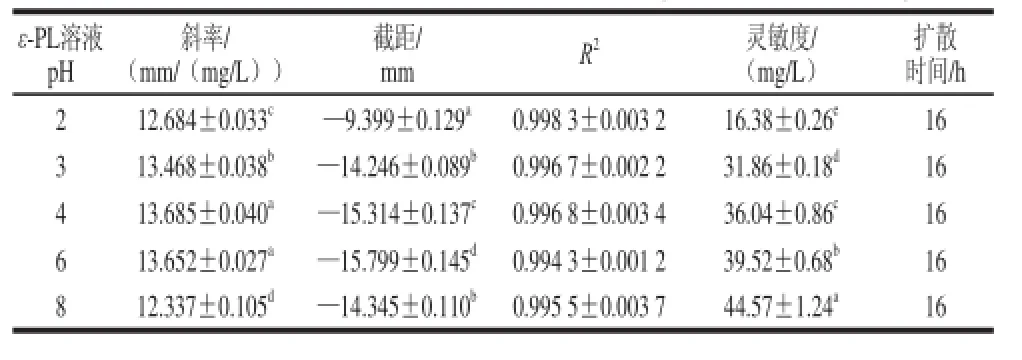
表 5 5 ε-PL溶液pH值对琼脂扩散法的影响Table 5 Effect off ε-PL solution pH on agar diffusion assay
2.2.5 牛津杯加液量对琼脂扩散法的影响
配制一系列pH 4.0的ε-PL标准溶液(50、100、200、300、400、600、800 mg/L),然后将250、500、750、1 000、1 250 μL ε-PL溶液分别在琼脂平板上扩散。由于牛津杯的最大加液量为250 μL,当加液量超过250 μL时,首先牛津杯中加入250 μL ε-PL溶液,扩散完后,再次加入250 μL,直到扩散完一定体积的ε-PL溶液。
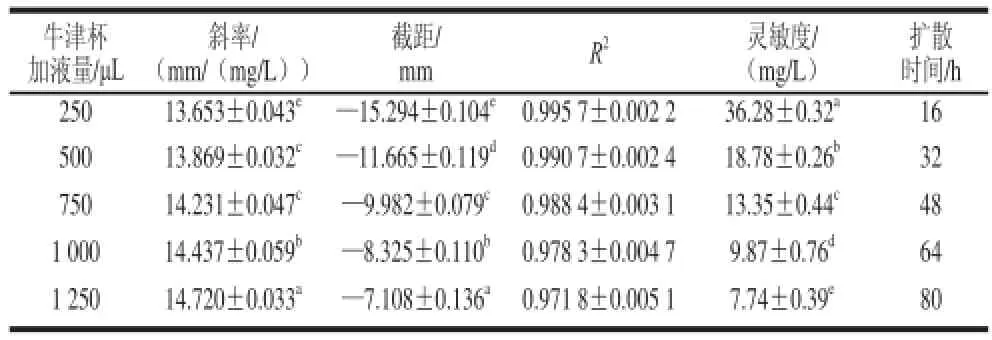
表 6 牛津杯加液量对琼脂扩散法的影响Table 6 Effect off ε-PL solution volume added to Oxford cup on agar diffusion assay
如表6所示,各牛津杯加液量的斜率均显着不同(P<0.05),随着牛津杯加液量增加,斜率显着上升,扩散时间逐渐延长,同时灵敏度显着增加(P<0.05)。但随着牛津杯加液量增加,R2有所下降。一个可接受的回归直线,其R2应该不小于0.98,因此尽管1 000 μL和1 250 μL牛津杯加液量有较高的灵敏度,但并不适合作为检测条件。综合灵敏度和精密度考虑,选择750 μL作为检测食品中ε-PL含量时的分析条件。
2.2.6 琼脂扩散条件的验证
为验证上述优化的检测食品中ε-PL条件的有效性,将750 μL一系列pH 2.0的ε-PL标准溶液(2、3、5、10、15、20、25、35、50 mg/L)在琼脂平板(质量分数0.002%亚甲基蓝、0.75%琼脂、琼脂溶液量10 mL)上进行扩散。
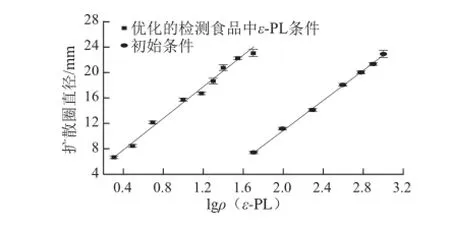
图 2 2 ε-PL标准溶液在不同分析条件下的回归直线Fig.2 Regression lines for ε-PL standards diffused under initial assay conditions
图2 显示了在初始和优化分析条件下,ε-PL标准溶液相对应的回归直线。优化的检测食品中ε-PL条件的准确度比初始条件增加了4.3%,检出限从36.11 mg/L提升到1.64 mg/L。优化的检测食品中ε-PL条件的R2值为0.989 6,说明此条件下也具有较高的精密度。由以上数据推测,在上述优化的分析条件下,琼脂扩散法可以高灵敏度检测食品中ε-PL含量。
相比于Itazhaki比色法和HPLC法,目前琼脂扩散法具有简便、灵敏度高的优点。Itazhaki比色法检测时间虽短,但是检测结果重复性差,并且由于食品大多有一定的浊度,此方法不适合测定食品中的ε-PL含量。HPLC法虽然重复性好,检测迅速,由于ε-PL与蛋白质的性质相近,不易将其与蛋白类似物质完全分开;此外HPLC法使用成本较高,不适合多数企业用户的使用。
2.3 琼脂扩散法检测食品中ε-PL含量
为研究琼脂扩散法检测食品中ε-PL含量的有效性,选择了3 种食品进行实验。橙汁用来代表液体食物,糕点用来代表固体淀粉质食物,猪肉火腿用来代表固体蛋白类食物。
2.3.1 食品组分对ε-PL在琼脂平板上扩散的影响
称取5 g糕点或猪肉火腿加到20 mL蒸馏水中,经处理,收集上清液。分别以蒸馏水、橙汁、5倍稀释糕点浸液、5 倍稀释猪肉火腿浸液为溶剂,制备一系列ε-PL标准溶液(2、3、5、10、15、20、25 mg/L)。结果如图3所示。
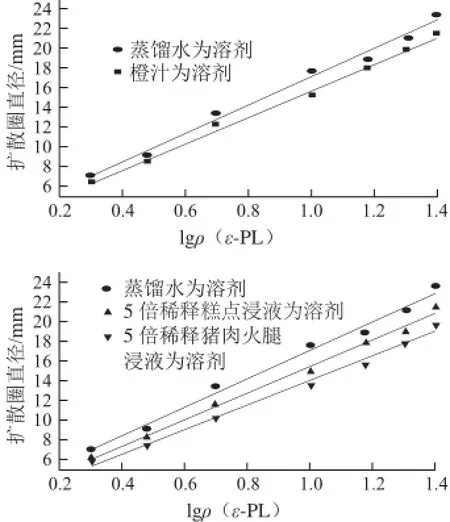
图 3 不同溶剂制备的ε-PL标准溶液相应的回归直线Fig.3 Regression curves calculated from the diffusion of ε-PL standards on agar plates
以蒸馏水、橙汁、5 倍稀释糕点浸液、5 倍稀释猪肉火腿浸液为溶剂制备的ε-PL标准溶液相应回归直线的R2值分别为0.988 2、0.991 3、0.990 6和0.985 6,这说明在2~25 mg/L ε-PL质量浓度范围,以食物浸液为溶剂时,扩散圈直径和ε-PL质量浓度对数值之间也存在很好的线性关系。同时发现同样质量浓度的ε-PL溶液,当以食物浸液为溶剂时,其扩散圈直径小于蒸馏水为溶剂时的扩散圈直径,推测可能食品中组分会阻挡ε-PL在琼脂平板上扩散。因此,为补偿食品组分对琼脂扩散法的影响,应该以一定稀释倍数不含ε-PL的食物浸液为溶剂制备ε-PL标准溶液,食品样品稀释相同的倍数,扩散后,食物样品的ε-PL含量从ε-PL标准溶液相应的回归直线计算得出。这种条件下,可以最低检测橙汁中2 mg/kg ε-PL、糕点和猪肉火腿中10 mg/kg ε-PL。
2.3.2 食品中ε-PL含量的评估
取50 mg ε-PL加入1 L橙汁中,混匀后调pH 2.0;以pH 2.0蒸馏水为稀释剂,将橙汁稀释5、10、20 倍;然后橙汁和稀释的橙汁溶液分别按上述步骤进行预处理;样品溶液在琼脂平板上扩散;最后样品ε-PL含量从以蒸馏水为溶剂制备的ε-PL标准溶液相对应回归直线计算得出。对于糕点和猪肉火腿,100 mg ε-PL直接和1 kg糕点或猪肉火腿均质,取5 g该食物,用pH 2.0蒸馏水分别稀释5、10、20、30、40、50 倍。其他分析步骤和2.3.1节相同。
当不能获得未添加ε-PL的食物时,若从以蒸馏水为溶剂制备的ε-PL标准溶液相应回归直线计算食物中ε-PL含量,会导致结果偏小。推测上层食品组分对ε-PL琼脂扩散的影响是由于食品成分高导致的,若适当稀释食物样品,可能能够减小食品组分对琼脂扩散分析的影响。对上述假设的有效性进行验证,结果如表7所示。
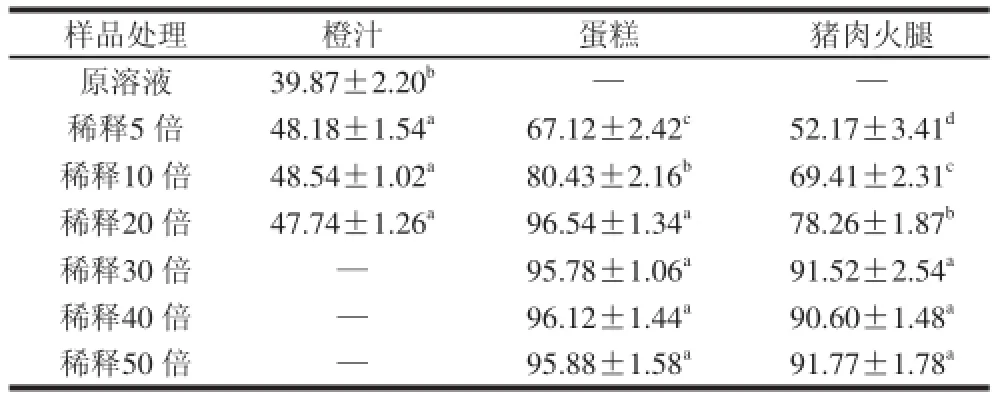
表 7 琼脂扩散法检测食品中ε--PPLL含量Table 7 Estimation off ε-PL in foods by agar diffusion assay mg/kg
由表7可知,随着稀释倍数的增加,食物中的ε-PL回收量逐渐上升,但当橙汁的稀释倍数高于5 倍、糕点的稀释倍数高于20 倍和猪肉火腿的稀释倍数高于30 倍时,ε-PL回收量变化不显着(P>0.05)。橙汁和蛋糕的ε-PL最大回收率高于95%,而猪肉火腿的最大回收率略低,为91.77%。猪肉火腿中较低的ε-PL回收量可能是由蛋白类物质对ε-PL的强烈吸附作用造成的,在微生物琼脂扩散法定量高蛋白食品中Nisin(一种多肽类防腐剂)含量时也发现类似现象[20]。以上数据证明了上述假设的正确性,即食品中ε-PL含量也可以通过以下步骤检测:根据待检食物样品的特点,将样品稀释到适当的倍数,例如液体饮料稀释5 倍,淀粉质食品稀释20 倍,而蛋白类食物稀释到30 倍;预处理后,食物浸液在琼脂平板上扩散;最后从以蒸馏水为溶剂标准溶液相应的回归直线计算食物样品中ε-PL的含量。
3 结 论
琼脂扩散法分析食品中ε-PL的最佳分析条件为:质量分数0.002%亚甲基蓝、0.75%琼脂、ε-PL溶液pH值为2.0、牛津杯加液量750 μL。食品成分会影响ε-PL在琼脂平板上的扩散,但这种干扰作用能够通过稀释样品的方式消除。通过适当的制备ε-PL标准溶液或稀释样品溶液,这种新型琼脂扩散法能够可靠地定量检测橙汁中最低2 mg/kg ε-PL、糕点和猪肉火腿中10 mg/kg ε-PL。
由于这种新型琼脂扩散法具有操作简便、使用成本低、专一性高等优点,因此可以用于ε-PL生产企业、食品工业以及其他ε-PL相关科学研究中ε-PL的检测。理论上,推测这种方法也可以用来检测其他聚阳离子物质,如聚精氨酸。此外,聚阴离子物质,如γ-聚谷氨酸(另一种微生物合成的另一种聚氨基酸),可能也可以用类似原理进行检测。因此,这种新型琼脂扩散法也为定性、定量其他聚阳离子和聚阴离子物质提供了一种新的研究思路。
[1] YAMANAKA K, MARUYAMA C, TAKAGI H. ε-Poly-L-lysine dispersity is controlled by a highly unusual nonribosomal peptide synthetase[J]. Nature Chemical Biology, 2008, 4(12): 766-772.
[2] SHIH I L, SHEN M H, van YI T. Microbial synthesis of poly (ε-lysine) and its various applications[J]. Bioresource Technology, 2006, 97(9): 1148-1159.
[3] SHIMA S, SAKAI H. Poly-L-lysine produced by Streptomyces partⅢ chemical studies[J]. Agricultural and Biological Chemistry, 1981, 45(11): 2503-2508.
[4] SHIMA S, MATSUOKA H, IWAMOTO T. Antimicrobial action of ε-poly-L-lysine[J]. Journal of Antibiotics, 1984, 37(11): 1449-1455.
[5] DELIHAS N, RILEY L W, BERKOWITZ J, et al. High sensitivity of Mycobacterium species to the bacterial activity by polylysine[J]. FEMS Microbiology Letters, 1995, 132(3): 233-237.
[6] HIRAKI J. ε-Polylysine, its development and utilization[J]. Fine Chemistry, 2000, 29(1): 25-28.
[7] KITO M, ONJI Y, YOSHIDA T, et al. Occurrence of ε-poly-L-lysinedegrading enzyme in ε-poly-L-lysine-tolerant Sphingobacterium multivorum OJ10: purification and characterization[J]. FEMS Microbiology Letters, 2002, 207(2): 147-151.
[8] YOSHIDA T, NAGASAWA T. ε-Poly-L-lysine: microbial production, biodegradation and application potential[J]. Applied Microbiology and Biotechnology, 2003, 62(1): 21-26.
[9] HIRAKI J. Basic and applied studies on ε-polylysine[J]. Journal of Antibacterial Antifungal Agents, 1995, 23: 349-354.
[10] HIRAKI J, ICHIKAWA T, NINOMIYA S, et al. Use of ADME studies to confirm the safety of ε-polylysine as a preservative in food[J]. Regulatory Toxicology and Pharmacology, 2003, 37(2): 328-340.
[11] FUKUTOME A, KASHIMA M, AIUCHI M. A combined chronic toxicity and carcinogenicity study of polylysine powder in rats by peroral dietary administration[J]. The Clinical Report, 1995, 29: 1416-1434.
[12] ITZHAKI R F. Calorimetric method for estimating polylysine and polyarginine[J]. Analytical Biochemistry, 1972, 50(2): 569-574.
[13] 程传荣, 田丰伟, 张灏, 等. 一种快速测定发酵液中ε-聚赖氨酸的方法[J]. 食品与发酵工业, 2009, 35(11): 133-136.
[14] KAHAR P, IWATA T, HIRAKI J, et al. Enhancement of ε-polylysine production by Streptomyces albulus strain 410 using pH control[J]. Journal of Bioscience and Bioengineering, 2001, 91(2): 190-194.
[15] 吴琼. 乳链菌肽效价测定方法的研究[J]. 食品科学, 1996, 20(6): 56-59.
[16] 焦世耀, 张兰威, 李春. 管碟法测定nisin效价的改进[J]. 食品科学, 2005, 26(7): 175-176.
[17] 张国只, 陈林海, 杨天佑, 等. 琼脂扩散法测定乳链菌肽效价的优化[J].食品科学, 2007, 28(3): 175-178.
[18] NISHIKAWA M, OGAWA K. Distribution of microbes producing antimicrobial ε-poly-L-lysine polymers in soil microflora determined by a novel method[J]. Applied and Environmental Microbiology, 2002, 68(7): 3575-3581.
[19] YOSHIDA T, NAGASAWA T. ε-Poly-L-lysine: microbial production, biodegradation and application potential[J]. Applied and Environmental Microbiology, 2003, 62(1): 21-26.
[20] TRAMER J, FOWLER G G. Estimation of nisin in foods[J]. Journal of the Science of Food and Agriculture, 1964, 15(8): 522-528.
A Novel Agar Diffusion Assay for Qualitative and Quantitative Estimation of ε-Polylysine in Foods
LIU Youhua
(Fujian Inspection and Research Institute for Product Quality, Fuzhou 350002, China)
A novel agar diffusion assay was developed, optimized, and validated for the analysis of ε-polylysine (ε-PL) in foods. Re sults showed that the optimum assay conditions were 0.75% agar, 0.002% methylene blue, pH of ε-PL solution adjusted to 2.0 and 750 μL of ε-PL solution allowed to diffuse on agar plate. This method allowed detection of ε-PL at levels as low as 2 mg/kg in orange-juice, and 10 mg/kg in cake and pork ham. This proposed agar diffusion assay can be widely used in ε-PL-production and food industry because of its simplicity, cost-effectiveness, and high specificity.
ε-polylysine; determination; agar diffusion assay; methylene blue; Oxford cup; food
TS207.3
A
1002-6630(2015)08-0225-06
10.7506/spkx1002-6630-201508042
2014-08-26
福建省科技计划重点项目(2014Y0015)
刘友华(1963—),男,高级工程师,学士,研究方向为食品检测与发酵工程。E-mail:775729188@qq.com



