曹静,路鹏霏,万学峰#
新疆医科大学第一附属医院1皮肤科,2肿瘤中心,乌鲁木齐 830000
恶性黑色素瘤简称恶黑,是一种来源于黑色素细胞的恶性肿瘤,主要发生于皮肤,也见于皮肤-黏膜交界处、眼脉络膜和软脑膜等部位,具有恶性程度高、进展快、转移早、预后差及病死率高等特点。皮肤恶性黑色素瘤约占皮肤恶性肿瘤的1%,病死例数占皮肤恶性肿瘤病死例数的80%以上[1]。近年来,恶性黑色素瘤的发病率在全世界呈上升趋势,在西方国家中尤为显着,目前已成为白种人最常见的恶性肿瘤之一[2]。近些年中国恶性黑色素瘤的发病率也逐渐上升,目前每年新发病例数2万余例[3]。喹啉酸磷酸核糖基转移酶(quinolinate phosphoribosyltransferase,QPRT)基因位于16 号染色体短臂,由35 421 个碱基对组成。QPRT 蛋白由297 个氨基酸组成,分子量为30 846 Da,是由3 个二聚体结合而成的六聚体,它是参与喹啉酸分解代谢的Ⅱ型磷酸核糖基转移酶家族成员[4]。喹啉酸是色氨酸-烟酰胺腺嘌呤二核苷酸途径的中间产物,也是一种对神经元作用很强的内源性神经毒素,QPRT 对维持喹啉酸在大脑中的稳态必不可少[5]。有研究表明,QPRT 对神经退行性改变的反应增加,与癫痫、阿尔茨海默病和亨廷顿病等神经退行性疾病的发病机制有关[6]。有文献报道,QPRT基因在甲状腺肿瘤、肝细胞肿瘤及血液系统肿瘤等肿瘤性疾病中发挥作用[7-9]。本研究通过生物信息学方法分析QPRT基因在恶性黑色素瘤中的表达及潜在生物学功能,现报道如下。
1 资料与方法
1.1 资料收集
应用癌症基因组图谱(The Cancer Genome Atlas,TCGA)(http://cancergenome.nih.gov/)和基因表达综合数据库(Gene Expression Omnibus,GEO)(https://www.ncbi.nlm.nih.gov/gds/)检索恶性黑色素瘤患者的临床资料,如基本特征、治疗过程、临床分期、病理类型、生存情况以及组织标本中QPRTmRNA 及蛋白表达情况等。
1.2 QPRT mRNA 表达水平分析
利用基因表达谱互动分析(Gene Expression Profiling Interactive Analysis,GEPIA)数据库对TCGA 数据库中恶性黑色素瘤组织和正常皮肤组织中QPRTmRNA 表达水平进行分析。利用UALCAN 数据库(http://ualcan.path.uab.edu/)对TCGA数据库中不同临床分期恶性黑色素瘤患者恶性黑色素瘤组织中QPRTmRNA 的表达水平进行分析。
1.3 生存分析
应用GEPIA 数据库分析不同QPRTmRNA 表达情况恶性黑色素瘤患者的预后。
1.4 QPRT 蛋白表达情况分析
应用人类蛋白质参考数据库(Human Protein Reference Database,HPRD)分析正常皮肤组织、原发性黑色素瘤组织及转移性黑色素瘤组织中QPRT 蛋白的表达情况。
1.5 蛋白质相互作用网络
应用GeneMANIA 数据库查找与QPRT 相互作用的蛋白。
1.6 基因功能分析
WebGestalt 是一个基因功能富集分析的在线网站,将与QPRT 相互作用的关键基因利用Web-Gestalt 进行基因本体(Gene Ontology,GO)分析,了解其参与的细胞组分、生物过程、生物功能。
1.7 统计学方法
采用SPSS 22.0 软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,两组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验。采用Kaplan-Meier 法绘制生存曲线,组间比较采用Logrank 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 恶性黑色素瘤组织和正常皮肤组织中QPRT mRNA 表达水平的比较
通过GEPIA 数据库在线分析TCGA 数据库中461 例恶性黑色素瘤组织和558 例正常皮肤组织中QPRTmRNA 表达水平,结果发现,恶性黑色素瘤组织中QPRTmRNA 表达水平明显高于正常皮肤组织,差异有统计学意义(P<0.01)。(图1)
2.2 不同临床分期恶性黑色素瘤患者恶性黑色素瘤组织中QPRT mRNA 表达水平的比较
基于UALCAN 数据库分析不同临床分期恶性黑色素瘤患者恶性黑色素瘤组织中QPRTmRNA表达水平,结果显示,Ⅰ、Ⅱ、Ⅲ和Ⅳ期恶性黑色素瘤患者恶性黑色素瘤组织中QPRTmRNA 表达水平比较,差异无统计学意义(P>0.05)。(图2)
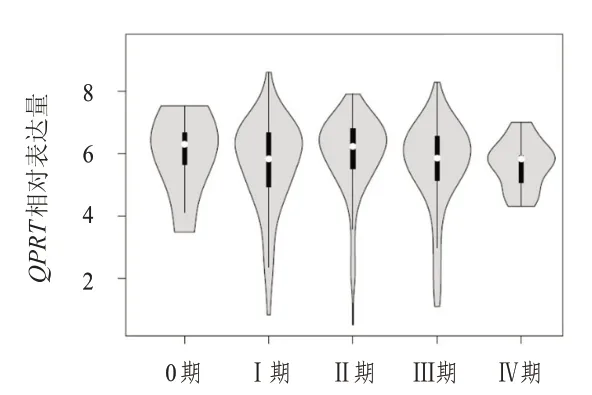
图2 不同临床分期恶性黑色素瘤患者恶性黑色素瘤组织中QPRT mRNA表达水平
2.3 不同QPRT mRNA 表达情况恶性黑色素瘤患者预后的比较
应用GEPIA 数据库分析不同QPRTmRNA 表达情况恶性黑色素瘤患者的预后,以QPRTmRNA表达水平的中位数为界将458 例恶性黑色素瘤患者分为QPRT 高表达组(n=229)和QPRT 低表达组(n=229),结果显示,QPRT 低表达组患者的总生存情况和无病生存情况均优于QPRT 高表达组,差异均有统计学意义(HR=1.3、1.3,P<0.05)。(图3)
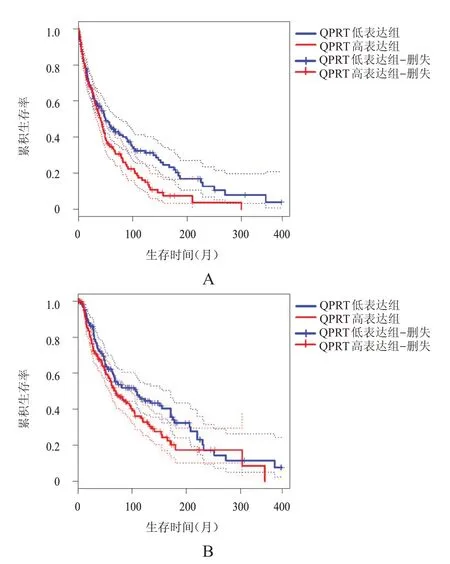
图3 不同QPRT表达情况恶性黑色素瘤患者的无病生存曲线和总生存曲线
2.4 恶性黑色素瘤组织中QPRT 蛋白表达情况
免疫组织化学检测结果显示,在正常皮肤组织中,QPRT 蛋白阴性表达(黑色素细胞中也为阴性),在恶性黑色素瘤组织中QPRT 蛋白呈强阳性表达,QPRT 蛋白主要在细胞质内均匀分布,呈棕褐色。在原发性黑色素瘤组织与转移性黑色素瘤组织中,QPRT 蛋白均为强阳性表达。(图4)
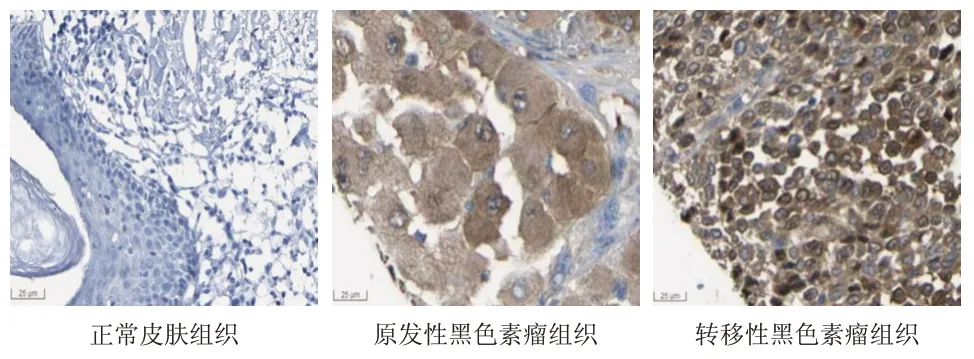
图4 正常皮肤组织和恶性黑色素瘤组织中QPRT蛋白表达情况(免疫组化染色,×400)
2.5 QPRT 蛋白相互作用网络预测及功能分析
GeneMANIA 数据库共筛选出20 个与QPRT 相互作用的蛋白质:AC009133.22、支链α-酮酸脱氢酶(branched chain alpha-keto acid dehydrogenase kinase,BCKDK)、丙酮酸脱氢酶激酶4(pyruvate dehydrogenase kinase 4,PDK4)、载脂蛋白C1(apolipoprotein C1,APOC1)、组织蛋白酶D(cathepsin D,CTSD)、PTB 结合核蛋白2(ribonucleoprotein,PTB binding 2,RAVER2)、加工前体4(processing of precursor 4,POP4)、ATP 结合盒转运蛋白亚家族C 成员1(ATP binding cassette subfamily C member 1,ABCC1)、PAT1 同源物1(PAT1 homolog 1,PATL1)、神经连接蛋白3(neuroligin 3,NLGN3)、抗氧化剂1 铜伴侣蛋白(antioxidant 1 copper chaperone,ATOX1)、TRAF3 结合蛋白2(TRAF3 interacting protein 2,TRAF3IP2)、甘氨酸脱氢酶(glycine decarboxylase,GLDC)、核蛋白1(nuclear protein 1,NUPR1)、纹蛋白4(striatin 4,STRN4)、核质蛋白α6(karyopherin subunit alpha 6,KPNA6)、核质蛋白β1(karyopherin subunit beta 1,KPNB1)、异柠檬酸脱氢酶1(isocitrate dehydrogenase 1,IDH1)、烟碱酸磷酸核糖基转移酶(nicotinate phosphoribosyltransferase,NAPRT)、烟酰胺磷酸核糖基转移酶(nicotinamide phosphoribosyltransferase,NAMPT),相互作用关系包括物理相互作用、共表达、共享蛋白质结构域、共定位等。(图5)
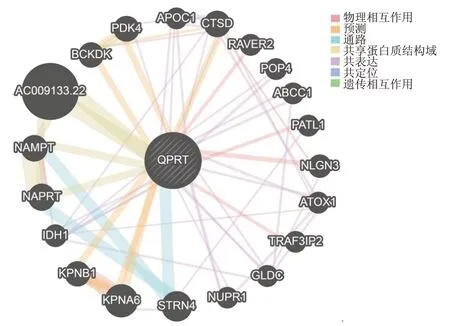
图5 GeneMANIA数据库分析QPRT相互作用蛋白
2.6 GO 功能分析
对上述基因参与的生物过程、细胞组分、分子功能进行分析发现,这些蛋白主要参与了代谢过程、生物调节、定位等生物过程;QPRT相关基因位于多种细胞组分中,包括细胞质、细胞膜、细胞外间隙、内膜系统等;分子功能包括蛋白结合、离子结合、核酸结合、参与转运体活动等。(图6)
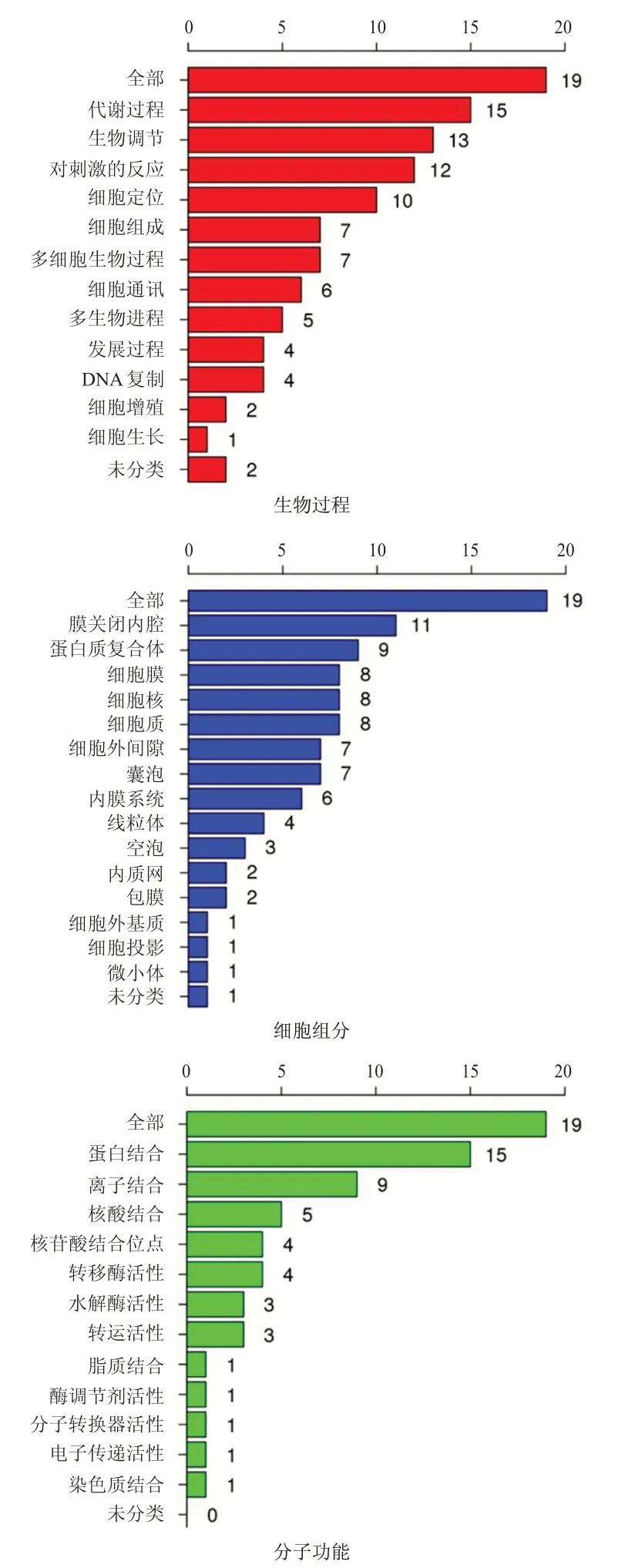
图6 与QPRT相互作用关键基因的GO功能富集分析
3 讨论
随着高通量测序技术及微阵列杂交技术的迅速发展,产生了大量基因数据,包含肿瘤表观组、基因组及转录组等信息。为了满足研究人员信息共享的需求,多个基因数据库应运而生,目前已广泛应用于基因表达定量分析,为肿瘤研究提供了良好的平台。本研究分析TCGA 数据库中的芯片数据,探索恶性黑色素瘤中QPRT的表达水平。高通量测序技术具有自动化、低成本等特点,研究结果可靠,可用于发现新的具有较大意义的基因。近年来,RNA、蛋白质等在肿瘤中异常表达的研究较多,然而QPRT 在恶性黑色素瘤中的作用尚不清楚。
烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD,又称NAD+),曾称为二磷酸吡啶核苷酸或辅脱氢酶Ⅰ或氧化型辅酶Ⅰ,可传递电子,是体内很多脱氢酶的辅酶,连接三羧酸循环和呼吸链,其功能是将代谢过程中脱下来的氢传递给黄素蛋白,参与多种代谢活动[10]。QPRT 可催化喹啉酸生成烟酸单核苷酸,是辅酶NAD 从头合成的前体,故QPRT 是调控三羧酸循环及呼吸链的重要酶。喹啉酸具有内源性神经毒性,既往研究已明确QPRT 在神经退行性疾病,如阿尔茨海默病、亨廷顿病等疾病中发挥重要作用。又有学者在孤独症谱系障碍(autism spectrum disorder,ASD)患者中发现QPRT基因变异,通过观察抑制QPRT功能后神经母细胞瘤细胞的变化得出,QPRT 对SH-SY5Y 神经母细胞瘤细胞分化具有很强的调控作用,且存在因果关系,提示QPRT 在ASD 的发病机制中起重要作用[11]。
近年来,除神经系统疾病外,QPRT 在肿瘤相关疾病中的作用也逐渐被发现。Hinsch 等[7]对甲状腺肿瘤患者的基因表达情况进行分析,结果发现,QPRT在滤泡性甲状腺腺瘤和滤泡性甲状腺癌中表达不同,并通过免疫组化法进行验证,得出65%的滤泡性甲状腺癌表达QPRT 蛋白,仅22%的滤泡性甲状腺腺瘤表达QPRT 蛋白,提示QPRT 参与甲状腺肿瘤的发生、发展过程,可能成为免疫组织化学筛查滤泡性甲状腺结节的潜在标志物。Sahm 等[12]对脑胶质瘤的研究发现,QPRT 不仅在神经退行性疾病中发挥作用,也参与胶质瘤的进展,肿瘤恶性程度越高,QPRT 的表达水平也越高,并且在放化疗后复发的胶质母细胞瘤中,QPRT 表达升高与预后不良有关。进一步研究发现,QPRT 高表达可增强肿瘤细胞对放化疗诱导的氧化应激的抵抗力,发挥抗凋亡作用,从而导致预后较差,提示QPRT 可能成为脑胶质瘤的潜在治疗靶点[13]。Wilms 肿瘤基因1(Wilms tumor gene 1,WT1)是一种转录因子,被认为是白血病的癌基因,QPRT是与WT1相关性最高的基因之一。Ullmark 等[8]研究QPRT 是否在白血病的发病中发挥作用,通过在白血病K562 细胞中过表达QPRT,发现细胞对抗白血病药物伊马替尼产生部分耐药性,也提示QPRT可能具有抗凋亡功能,这与上述关于胶质瘤细胞的报道一致。有研究发现,QPRT可能是乳腺癌的促癌基因,可通过影响肌球蛋白轻链磷酸化促进乳腺癌侵袭[14]。另有研究发现,QPRT 在乳腺癌中表达上调,尤其是在人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性乳腺癌中,明确了QPRT 是浸润性乳腺癌的独立预后因素,并且与免疫细胞浸润息息相关[15-16]。在结肠癌中同样发现QPRT 高表达与预后不良相关[17]。有研究发现,QPRT 蛋白在肝细胞癌患者组织间隙液中的表达水平明显低于健康者,提示该蛋白参与了肝细胞癌的发生过程,但具体作用机制尚需研究[9]。此外,也有基因表达分析的研究显示,QPRT基因在子宫平滑肌瘤中高表达,是正常子宫平滑肌的3.6倍[18]。
学者们逐渐开始关注QPRT基因在肿瘤相关疾病,尤其是恶性肿瘤相关疾病中的作用,但是在恶性黑色素瘤中的作用尚未有相关报道。本文通过整合公共数据库发现QPRT 在恶性黑色素瘤组织中高表达,且QPRT 高表达与预后不良相关,虽然QPRT基因表达水平在不同临床分期恶性黑色素瘤组织中未见明显差异,但仍可能是区分肿瘤良恶性的重要标志物。虽然目前现有数据提示QPRT基因与肿瘤临床分期、恶性程度无明确相关性,但其可对恶性黑色素瘤的诊断及预后评估提供参考,对肿瘤疗效评价的作用仍需进一步探讨。以上结果均提示QPRT基因参与恶性黑色素瘤的发生并发挥重要作用,猜测其可能的机制如下:①恶性黑色素瘤的恶性程度高,易发生侵袭、转移等恶性生物学行为,这正是肿瘤细胞增殖活跃的表现,该基因参与调控三羧酸循环及呼吸链反应,为机体提供能量,参与机体新陈代谢,因此有可能通过QPRT基因表达上调为肿瘤细胞提供更多能量,使肿瘤细胞增殖活跃,促进其快速进展、转移,导致预后不良。②结合既往学者研究,QPRT 高表达可增加肿瘤细胞对放疗、化疗的抵抗力,发挥抗凋亡作用,但其具体作用机制仍需进一步研究。
目前恶性黑色素瘤的治疗仍以手术为主,同时积极探索新的治疗方法,如免疫治疗和靶向治疗等。中国恶性黑色素瘤患者对靶向治疗的反应与西方人群类似,但对免疫治疗的反应不如西方人群[3],因此国内也在积极开展恶性黑色素瘤方面的研究,以打破传统治疗的束缚。本文通过生物信息学分析发现,QPRT基因在恶性黑色素瘤中明显高表达,可能成为潜在的治疗靶点;免疫组化法检测显示,QPRT在恶性黑色素瘤组织中呈强阳性表达,提示该蛋白有望成为筛查恶性黑色素瘤的生物标志物;同时QPRT基因高表达与预后不良相关,可为恶性黑色素瘤的预后判断提供新的参考依据。
综上所述,QPRT基因在恶性黑色素瘤中高表达,其高表达与恶性黑色素瘤患者的预后不良相关,可能成为筛查恶性黑色素瘤的标志物及治疗靶点。QPRT 可为恶性黑色素瘤的筛查诊断、靶向治疗及预后评估提供新的探索方向。由于本研究参考的数据库源于国外,而恶性黑色素瘤在不同人种、地区的发病率及类型差异较大,本课题组后续将进一步研究及验证QPRT基因在中国恶性黑色素瘤患者中的表达情况。



