吴玲霞,甄 莉
(山西医科大学第一医院皮肤科,山西太原 030001)
黄芪(Astragacus,AS)是多年生豆科植物蒙古黄芪或膜荚黄芪的干燥根[1],始载于《神农本草经》,以补中益气、升举清阳为主要功效,是补气的要药[2]。我科运用黄芪治疗荨麻疹疗效确切,但其作用机制尚不清楚。本实验旨在进一步观察黄芪对大鼠被动皮肤过敏反应(PCA)的抑制作用,初步探讨其可能的机制,从而为临床用药提供依据。
1 材料与方法
1.1 实验动物
Wistar大鼠 35 只,体重(160±20) g,雌雄兼用,购自山西医科大学生理实验室,分笼饲养于山西医科大学生理实验室。
1.2 药物与试剂
卵清蛋白(Sigma公司,批号A5253),白百破疫苗(武汉生物制品研究所,批号20080516-4),黄芪(豪州市万珍中药饮片厂,批号081226),富马酸酮替酚片(海南制药厂有限公司制药一厂,批号081101),伊文思蓝,甲苯胺蓝。
1.3 仪器
低速离心机SC-3610(科大创新股份有限公司中佳分公司),721型分光光度计(上海第三分析仪器厂)。
1.4 实验方法
1.4.1 动物分组 Wistar大鼠30只,随机分为模型组、酮替酚组、黄芪组。模型组:生理盐水2 ml/只;酮替酚组:0.7 mg/kg;黄芪组:5 g/kg。
1.4.2 大鼠同种PCA模型的构建及处理 各组药物均配制成2 ml溶液,灌胃给药,每天1次,连续7 d,第5天给药后在大鼠背中线两侧选取致敏点。取卵蛋白IgE抗血清生理盐水溶液(1∶1),于皮内注射0.1 ml/点。末次给药后1 h进行抗原攻击:即尾静脉注射0.5%伊文思蓝溶液1 ml(内含卵清蛋白30 mg)。30 min后将动物处死,分离背部皮肤。
1.4.3 蓝色反应斑光密度值测定 将蓝斑剪下,剪碎,加入丙酮-生理盐水(7∶3)混合液 4 ml,浸泡,离心,取上清液于 721型分光光度计610 nm处测定光密度值(OD值),取各组的平均光密度值,计算出抑制率。
抑制率=(1-用药组平均光密度值/模型组平均光密度值)×100%
1.4.4 病理组织学变化 标本固定,常规石蜡包埋,切片,苏木素-伊红染色,光镜下观察皮肤组织病理学变化。
1.4.5 脱颗粒肥大细胞计数 组织切片常规脱蜡,1%甲苯胺蓝染色,0.5%冰醋酸分化,显微镜下观察控制呈色,透明,封片。每张切片选取3个肥大细胞分布相对较多的视野,高倍镜下计数100个肥大细胞中的脱颗粒细胞数,计算脱颗粒百分率及抑制率。
肥大细胞脱颗粒率(%)=脱颗粒细胞数/肥大细胞总数×100%
肥大细胞脱颗粒抑制率(%)=(1-用药组脱颗粒率/模型组脱颗粒率)×100%
1.5 统计学处理
2 结果
2.1 病理组织学变化
光镜下模型组主要表现为真皮水肿,皮肤毛细血管及小血管扩张充血,淋巴管扩张及炎症细胞轻度浸润,水肿在真皮上部最明显。黄芪组及酮替酚组炎症程度均有改善。
2.2 黄芪对大鼠PCA的抑制作用(表1)
由表1可知,黄芪能够抑制大鼠同种PCA,与酮替酚比较,差异有统计学意义(P<0.05)。
表1 黄芪对大鼠PCA OD值的影响(±s)
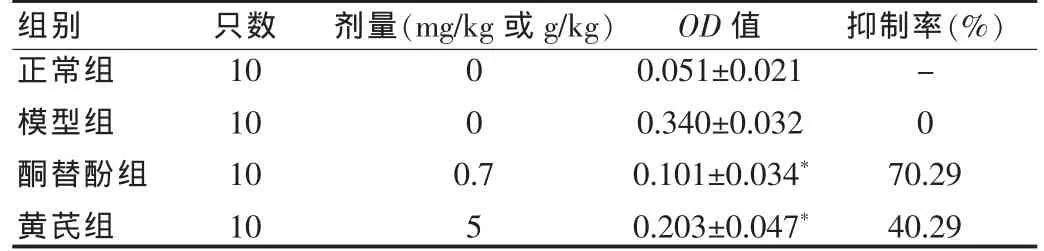
表1 黄芪对大鼠PCA OD值的影响(±s)
与模型组比较,*P<0.05
剂量(mg/kg 或 g/kg) 抑制率(%)正常组模型组酮替酚组黄芪组组别 只数1010101000-00.75 OD值0.051±0.0210.340±0.0320.101±0.034*0.203±0.047*70.2940.29
2.3 黄芪对肥大细胞脱颗粒的影响(表2)
正常的肥大细胞结构完整,圆形,显蓝色,边缘光滑,胞质内充满粗大的紫红色颗粒。模型组肥大细胞肿胀、变形,边缘不齐,胞膜破裂,颗粒脱出。由表2可知,与模型组比较,酮替酚组与黄芪组肥大细胞脱颗粒数明显减少(P<0.05),黄芪组与酮替酚组比较,差异有统计学意义(P<0.05)。
表2 黄芪对大鼠皮肤组织肥大细胞脱颗粒的影响(±s)

表2 黄芪对大鼠皮肤组织肥大细胞脱颗粒的影响(±s)
与模型组比较,*P<0.05
剂量(mg/kg 或 g/kg) 抑制率(%)组别 只数10101010正常组模型组酮替酚组黄芪组---00.710脱颗粒率(%)11.20±3.6562.80±4.3419.70±4.1630.70±3.8968.63*51.11*
3 讨论
荨麻疹是由于皮肤黏膜小血管扩张及通透性增加而出现的一种局限性的水肿反应,15%~20%的人一生中至少发作一次[3],且易反复发作,严重影响了患者的身心健康。荨麻疹的病因复杂,约3/4的患者找不到原因,故很难达到病因治疗。中医药治疗荨麻疹的疗效越来越受到国内外学者的充分肯定,但目前文献报道大多限于临床经验的总结,而在机制阐述方面尚需进一步发展。本实验通过大鼠同种被动皮肤过敏反应实验,证明黄芪对荨麻疹有抑制作用。
荨麻疹的发病机制尚不完全清楚,目前主要分为免疫性和非免疫性。免疫机制多为Ⅰ型超敏反应。Ⅰ型超敏反应的基本机制为:变应原进入机体后,即可诱导B细胞产生IgE抗体,IgE抗体与MC或(和)嗜碱粒细胞等靶细胞结合,使机体处于致敏状态。相同的抗原再次进入机体,与已结合在靶细胞上的IgE发生特异性桥连,促使肥大细胞脱颗粒释放组胺等化学介质[4],引起毛细血管扩张、血管通透性增加、平滑肌收缩、腺体分泌增加,产生一系列临床症状。非免疫机制是一些物质促使补体激活或直接刺激肥大细胞脱颗粒,释放介质。最近的实验与临床研究表明,该机制还可能涉及特异性抗体和T细胞[5-7]。无论免疫因素或非免疫因素,肥大细胞是荨麻疹发病过程中的主要效应细胞,其活化脱颗粒释放血管活性介质是荨麻疹发病的中心环节[8]。故通过修饰肥大细胞的生物学作用来缓和变态反应性疾病是目前变态反应性疾病的研究热点之一。酮替酚是临床上公认的介质释放抑制剂,能稳定肥大细胞膜,抑制肥大细胞脱颗粒。以酮替酚作为阳性对照组,通过大鼠皮肤肥大细胞脱颗粒实验发现:黄芪可明显减少由卵蛋白被动致敏的大鼠皮肤组织肥大细胞脱颗粒,所用剂量的作用效果较酮替酚弱。本实验论证了黄芪具有稳定肥大细胞的作用,可以通过减少被动致敏的肥大细胞脱颗粒而发挥抗Ⅰ型超敏反应的作用。
综上所述,黄芪治疗荨麻疹的主要作用机制可能是稳定肥大细胞膜,抑制肥大细胞脱颗粒释放炎症介质,为该药的临床应用提供了理论依据及良好的应用前景。
[1]国家药典委员会.中国药典[M].北京:化学工业出版社,1995:271.
[2]阴健,郭力弓.中药现代化研究与临床应用[M].北京:学苑出版社,1993:593.
[3]赵辨.临床皮肤病学[M].南京:江苏科学技术出版社,2001:613.
[4]顾瑞金.21世纪医师丛书:变态反应科分册[M].北京:中国协和医科大学出版社,2000:70.
[5]Hermes B,Zuberbier T,Haas N,et al.Decreased cutaneous expression of stem cell factor and of the p75 NGF receptor in urticaria[J].B Dermatol,2003,148(3):411-417.
[6]Gruber BL,Bacza ML,Marchese MJ,et al.Prevalence and functional role of anti-IgE autoantibodies in syndrome [J].J Invest Dermatol,1998,90(2):213-217.
[7]Sabroe RA,Greaves MW.The pathogenesis of chronic idiopathi urticarial[J].Arch Dermatol,1997,133(8):1003-1008.
[8]Tharp MD.Chronic urticaria:pathophysiology and treatment approaches[J].J Allergy Clin Immunol,1996,98(6):S325-330.



