弓培慧 贾晓云 申嘉欣 张岳琴 李秀辉 康娅楠 周 浩 白丽霞
新生儿败血症(neonatal sepsis,NS)是指由细菌、病毒、真菌或原虫等侵入新生儿血液循环,从而引起的全身炎症反应综合征,与血流动力学变化相关[1~3]。儿童败血症的发生率很高,尤其是在新生儿中,全世界估计有300万婴儿受到感染,病死率为11%~19%[4]。根据疾病发病的时间,分为早发败血症(early-onset sepsis,EOS)及晚发败血症(late-onset sepsis,LOS),EOS为新生儿出生72h内发生的败血症,超过72h后的败血症为LOS[5]。EOS是危及新生儿生命的严重疾病,早期临床表现无特异性,临床上诊断容易误诊或漏诊[6]。其发生的危险因素有早产、胎膜早破及绒毛膜羊膜炎[1]。
有研究发现,早产儿和足月儿败血症在临床高危因素、合并症、病原学等方面各有不同,早产儿比足月儿更易患EOS及引起并发症[7]。本研究回顾分析了2020年1月~2021年12月山西省儿童医院(山西省妇幼保健院)收治的早产儿及足月儿EOS的一般情况、临床特征、病原菌分布、实验室指标及并发症和转归情况,以期为预防、临床早期准确识别及治疗NS提供帮助。
资料与方法
1.临床资料:选取2020年1月~2021年12月山西省儿童医院(山西省妇幼保健院)收治的124例EOS患儿纳入研究,纳入标准:①出生<28天的新生儿;②符合NS的诊断标准,NS诊断参照《新生儿败血症诊断及治疗专家共识(2019年版)》[1];③诊断为EOS的患儿(发病年龄≤3天)。排除标准:①患有先天性代谢异常性疾病;②非疾病本身因素未能坚持治疗者或非败血症感染导致脏器功能不全的新生儿。本研究经山西医科大学第二医院医学伦理学委员会审查批准[伦理学审批号:(2019)YX第(255)号]。
2.研究方法:通过查阅124例EOS新生儿病历,根据胎龄(早产儿:28~37周,足月儿:≥37周)分为早产儿组(n=33)和足月儿组(n=91)。比较两组一般资料(包括性别、分娩方式及1min Apgar评分等)、临床表现、实验室指标(C反应蛋白最高值和降钙素原最高值,是目前研究NS常用指标[8])、病原菌、并发症及转归情况。

结 果
1.早产儿组和足月儿组一般资料比较:两组患儿在性别、1min Apgar评分及孕妇妊娠期高血压方面比较,差异有统计学意义(P<0.05);早产儿组女性占比高于足月儿组;1min Apgar评分低于足月儿组;孕妇有妊娠高血压占比高于足月儿组,详见表1。
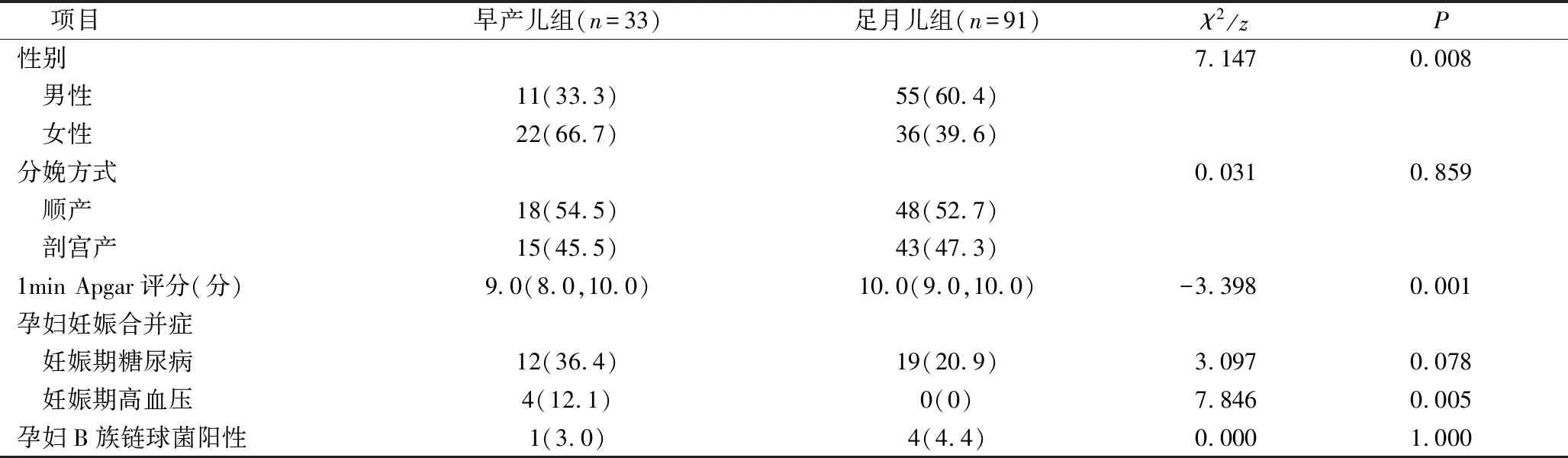
表1 早产儿组和足月儿组一般资料比较[n(%),M(Q1,Q3)]
2. 早产儿组和足月儿组临床特征和实验室指标比较:本研究中124例EOS患儿常见的临床特征有:新生儿肺炎(50.0%,62/124)、反应差(38.7%,48/124)、体温异常(26.6%,33/124)和黄疸(23.4%,29/124)。经比较发现,早产儿组肺炎和反应差的发生率均高于足月儿组,而黄疸的发生率低于足月儿组,差异有统计学意义(P<0.001)。两组患儿的实验室指标比较,差异无统计学意义(P>0.05),详见表2。
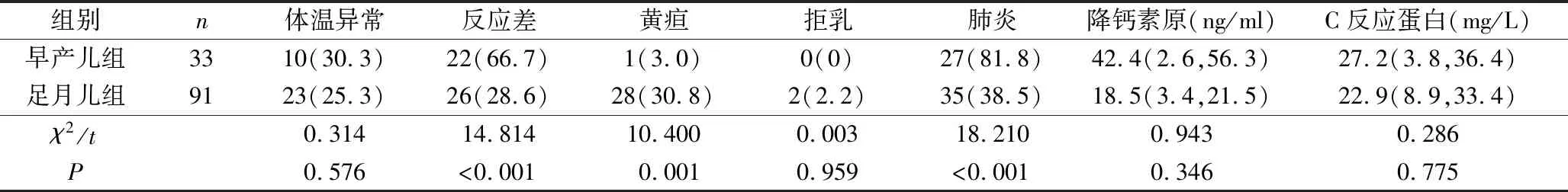
表2 早产儿组和足月儿组临床特征和实验室指标比较[n(%),M(Q1,Q3)]
3.早产儿组和足月儿组病原菌分布比较:124例EOS患儿血培养标本中一共培养出11例阳性,其中革兰阳性菌2例(18.2%)(表皮葡萄球菌2例),革兰阴性菌9例(81.8%)(大肠埃希菌4例、鲍曼不动杆菌2例、皮特不动杆菌1例、费氏柠檬酸杆菌1例、
新洋葱伯克霍尔德菌1例);早产儿组革兰阳性菌感染率高于足月儿组,而革兰阴性菌感染率低于足月儿组,但两组比较差异无统计学意义(χ2=0.588,P>0.05)。
4.早产儿组和足月儿组并发症比较:124例EOS患儿并发症均无感染性休克、弥漫性血管内凝血、心肌损害和肝功能损害。早产儿组有1例(0.8%)化脓性脑膜炎,5例(4.0%)呼吸衰竭;足月儿组无化脓性脑膜炎,有5例(4.0%)呼吸衰竭;两组并发症发生率比较,差异无统计学意义(χ2=3.380,P>0.05)。
5. 早产儿组和足月儿组转归比较:124例EOS患儿治愈114例,好转8例,未愈1例,其他1例。早产儿败血症组治愈率为97.0%,好转率为3.0%;足月儿败血症组治愈率为90.1%,好转率为7.7%,未愈率为1.1%,其他情况为1.1%;两组治愈、好转、未愈及其他情况比较,差异均无统计学意义(χ2=1.665,P>0.05)。
6. 多因素Logistic回归分析:将单因素分析差异有统计意义的变量进一步纳入多因素Logistic回归分析,结果显示,与男性比较,女性是早产儿EOS的危险因素;患肺炎是早产儿EOS发生的危险因素(P<0.05),详见表3。
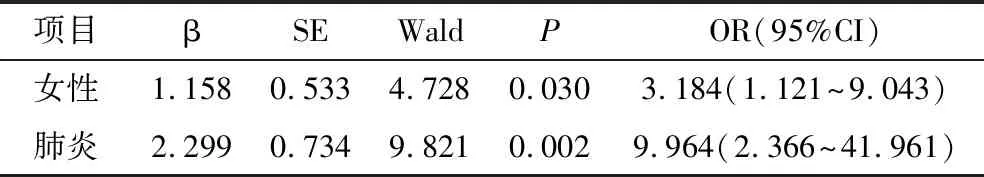
表3 早产儿EOS影响因素多因素Logistic回归分析
7.构建及验证列线图预测模型:结合以上独立影响因素构建预测模型,绘制列线图,该模型结果显示,与足月儿比较,上述影响因素引发早产儿EOS的最佳总分界值为414分,早产儿EOS的概率为72.2%,详见图1。采用Bootstrap法将研究中的样本进行1000次抽样,校准度显示,矫正曲线与理想曲线相近。校准曲线表明,模型的实际预测曲线与修正后的预测曲线吻合较好,Brier= 0.119,C指数为0.886,详见图2;模型内部验证ROC曲线显示,曲线下面积(area under the curve,AUC)为88.6%,敏感度为69.2%,特异性为93.9%,提示了该列线图模型预测早产儿EOS具有较高的预测效能,详见图3;决策曲线显示,模型的阈值概率范围为4%~100%,详见图4。
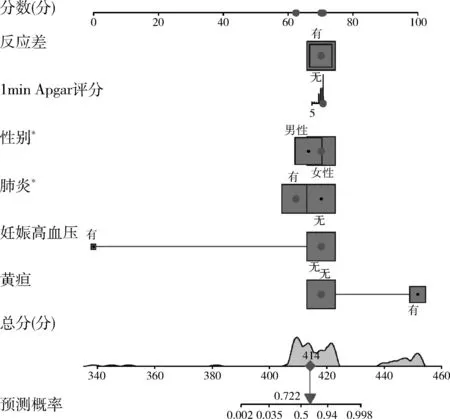
图1 早产儿EOS的风险列线图模型*差异有统计学意义
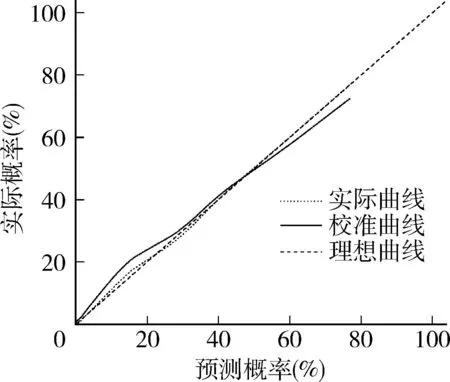
图2 预测早产儿EOS的风险列线图校正曲线验证
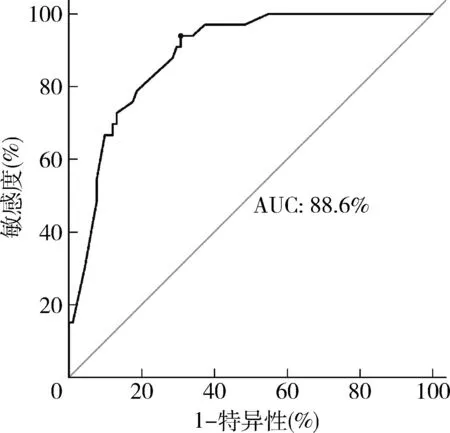
图3 预测早产儿EOS的风险列线图模型的ROC曲线
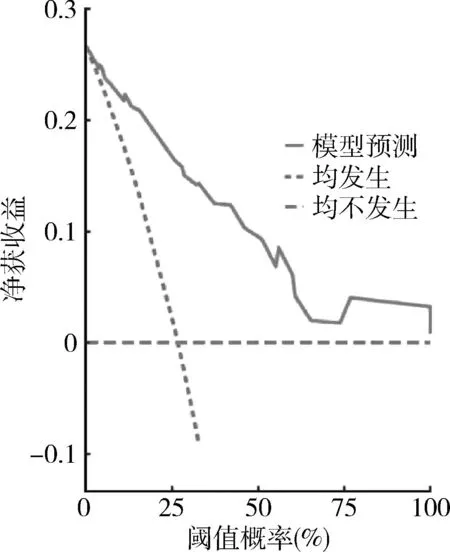
图4 预测早产儿EOS的风险列线图模型的决策曲线
讨 论
EOS是新生儿死亡的一个重要原因[9]。2005~2014年中国疾病预防控制中心进行的全国监测表明,早产儿EOS的发生率和病死率均高于足月儿[10];足月儿EOS病死率大约为20%,早产儿EOS病死率为50%[11]。本研究通过分析早产儿EOS的临床特征及危险因素,以期为预防早产儿EOS的发生和死亡提供科学参考依据。
本研究中早产儿组母亲有妊娠高血压的比例高于足月儿组,差异有统计学意义。提示母亲妊娠高血压可能对早产儿EOS的发生有影响。NS临床表现可出现反应差、皮肤水肿、拒乳、腹胀及黄疸等,但无特异性,且比较隐匿[12]。因此,临床医生如果发现患儿出现不能解释的异常临床表现应警惕败血症的发生[13, 14]。本研究结果显示,两组患儿临床表现中新生儿肺炎、反应差和黄疸具有较高的发生率,但早产儿组肺炎和反应差的发生率均高于足月儿组,可能与新生儿免疫系统发育不全、组织器官功能不成熟及对外界环境适应能力差有关[15]。研究表明,早产儿黄疸的发生率高于足月儿[16]。而本研究发现早产儿黄疸的发生率低于足月儿组,这可能与研究对象或研究样本量不同有关。
本研究结果显示,女性及新生儿肺炎与早产儿EOS的发生有关。相对于男性,女性容易患败血症。这与Jiang等[17]研究结果不同。此外,新生儿患肺炎是早产儿EOS发生的危险因素,因此,对于患肺炎的新生儿应警惕败血症的发生。
细菌是NS的主要病原菌,其中革兰阴性杆菌在我国EOS患儿中的检出率呈上升趋势,且逐渐成为EOS的重要致病菌[18,19]。本研究结果显示,EOS常见的病原菌为革兰阴性杆菌,这与既往文献[14,20,21]研究结果一致,其中大肠杆菌、鲍曼不动杆菌及表皮葡萄球菌比例相对较高,这与陈潇等[15]研究结果不同,提示败血症的病原菌因地区不同而有差异。临床医生应结合不同地区病原学分布特点,在血培养结果报告前,根据区域内常见败血症病原体及其药敏情况,合理指导早期经验性应用抗生素。B族链球菌是早发NS的主要原因,其检出率在EOS中有增高趋势[5,22,23]。本研究未发现有新生儿感染B族链球菌,分析其原因可能是,在妊娠35~37周对所有孕妇进行规范的B族链球菌筛查,降低了新生儿B族链球菌的感染。
列线图模型用于估计与某些风险因素相关的特定结果,本研究中构建了早产儿EOS的风险预测列线图模型,决策曲线显示阈值概率为4%~100%时,采用本列线图预测早产儿EOS的风险具有较高的净获益值,提示该列线图的临床预测效用较好,表明早产儿EOS的列线图模型对筛查早产儿EOS具有良好的准确性和鉴别性。
本研究通过早产儿组与足月儿组NS的临床特征比较,并利用列线图模型预测早产儿发生EOS的风险评估,为临床预防和治疗NS提供参考依据。本研究的局限性:本研究为单中心、回顾性分析建立列线图,结果存在一定的偏倚,未来还需要更多大样本量、多中心的前瞻性研究进行探索。
综上所述,本研究结果显示,女性、患肺炎早产儿EOS的风险较高,当女性新生儿患肺炎时临床应高度警惕败血症的发生。通过构建早产儿EOS列线图模型,可为临床预防早产儿EOS提供参考依据,预防和降低NS的发生。
利益冲突声明:所有作者均声明不存在利益冲突。



