林树楷, 李钢, 周奋, 王辉, 曾坚锋
(三亚中心医院 & 海南省第三人民医院 神经外科, 海南 三亚 572000)
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)又称自发性SAH,常因脑底或表面急性病变而引发血管破裂、血液大量渗入蛛网膜下腔继而引发多种临床综合征,约占脑卒中10.74%,国内居民发病率达15.18/10万人年[1]。腰大池外引流是神经外科公认的SAH患者常规疗法,脑脊液(cerebrospinal fluid ,CSF) 特征指标监测也常用于指导SAH术后患者临床治疗或功能恢复过程[1-2]。最新研究发现,腰大池外引流量存在诸多变化因素,其受患者病情、颅内压力等因素影响,而引流量的控制也会影响患者病情转归速率,继而反过来影响CSF特征指标的表达[3]。从代谢组学和分子生化学角度出发,探讨腰大池外引流量调控的人为“扰动”过程对其生物体系内源性代谢过程的客观影响,有助于指导临床医师实践操作[4]。既往关于腰大池外引流量和CSF指标的研究甚少,也尚未对CSF各成分进行系统性的检测分析,因此本研究综合纳入CSF常规指标、生化指标及血液激素指标,旨在全面探索腰大池外引流量对各指标的影响。
1 对象与方法
1.1 研究对象
选取2018年12月—2020年12月神经外科行腰大池外引流的SAH患者,SAH诊断标准符合《中国蛛网膜下腔出血诊治指南2019》[5],且据临床症状结合头颅影像检查确诊,同时符合生命体征平稳、头部无严重创伤史或手术史或合并脓毒血症者。排除不宜行腰大池外引流的患者(患颅高压、脑室铸型、梗阻性脑积水、中线结构显示不清等),排除并发症严重、意识障碍明显、二次开颅手术者,排除合并呼吸衰竭、心脏衰竭、休克等急重症者。共纳入SAH患者170例,根据单日的腰大池外引流总量分为低引流量组(<250 mL,n=79)和高引流量组(≥250 mL,n=91),2组患者的一般临床特征见表1。
1.2 研究方法
1.2.1治疗方案 腰大池外引流操作均由同一名医师完成,引流量根据患者颅内压检测值结合临床经验抉择。患者取侧卧位(头部向腹部屈曲,双腿同时保持屈曲),背部与床面保持垂直,选择准确的穿刺点(腰3和腰4间隙髂前上棘连线和棘突交点),行常规性消毒铺巾,利多卡因(1.0%浓度,3.0 mL)局部浸润麻醉,将穿刺针缓慢逐层深入蛛网膜下腔,落空感明显时有CSF流出,此时接入引流管并固定引流袋,留取3 mL送检;缓慢拔除腰穿针,局部加压并包扎,要求患者去枕平卧6 h。
1.2.2CSF取样及相关指标检测 2组SAH患者术后24 h内放置腰大池引流管,分别于术后第2天(首次)和第5天(末次)抽取CSF 4 mL,采用干化学分析法(FS5.1型分析仪,美国强生公司)进行CSF常规(白细胞计数)和生化[蛋白定性、糖定性、乳酸(lactic acid,LAC)及氯化物(chloride,CL)含量]检测。
1.2.3血样检测 2组SAH患者分别于术后第2天和第5天清晨空腹抽取静脉血检测常规、生化及激素指标[血小板(platelet,PLT)、肌酐(creatinine,Cre)、谷丙转氨酶(alaninetransaminase,ALT)、 谷草转氨酶(aspartate transaminase,AST)、LAC、降钙素原(procalcitonin,PCT)、CL、胱抑素C(cystatin proteinase inhibitor-c,CPI-C)、纤维蛋白原(fibrnogen,FIB)、C-反应蛋白(C-reactive protein,CRP)、血管紧张素(angiotensin,AT)、皮质醇激素(cortico steroid,CS)及促肾上腺皮质激素(adreno cortico hormone,ACTH),其中PLT计数、FIB及CRP采用Sysmex血液分析仪(北京万生园生物技术有限公司)检测,血清Cre、ALT、AST及LAC用全自动生化分析仪(济南童鑫生物科技有限公司)检测,PCT、CL、CPI-C及FIB采用全自动化学发光检测仪(Autolumo A2000)检测,AT、CS及ACTH等相关激素指标采用放射免疫法(MAGLUMI4000型放射免疫测定仪,中国海菲生物科技有限公司)检测[6-7]。
1.2.4一般临床资料 收集2组SAH患者住院期间的一般临床资料,包括年龄、性别、高血压病史、格拉斯哥昏迷量表(glasgow coma scale,GCS)评分、急性生理与慢性健康评分Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)评分、出血位置、手术类型、手术时间及患者手术后第2天和第5天的体温、心率及血压。
1.3 统计学分析
2 结果
2.1 一般临床资料
2组SAH患者性别、出血位置、手术类型、高血压病史、年龄、GCS评分、APACH Ⅱ评分及手术时间比较,差异无统计学意义(P>0.05)。见表1。
2.2 临床及血液学指标
2组SAH患者相同引流时间各临床指标比较,差异均无统计学意义(P>0.05);低引流量组SAH患者收缩压、心率、PLT计数、血清Cre、血清ALT及AST不同引流时间比较,差异均有统计学意义(P<0.05);高引流量组SAH患者收缩压、舒张压、心率、PLT计数、血清Cre、血清ALT及血清AST不同引流时间比较,差异均统计学意义(P<0.05)。见表2。
表1 低引流量组和高引流量组SAH患者的一般临床资料Tab.1 General clinical data of SAH patients in low and high drainage group
2.3 CSF常规指标
首次引流时,2组SAH患者CSF外观、蛋白定性、糖定性及白细胞计数比较,差异均无统计学意义(P>0.05);末次引流时,2组SAH患者CSF蛋白定性、糖定性及白细胞计数比较,差异均有统计学意义(P<0.05);与首次引流比较,2组SAH患者末次引流的CSF外观、蛋白定性、糖定性及白细胞计数等指标下降,差异均有统计学意义(P<0.05)。见表3。
2.4 CSF生化指标
首次引流时,2组SAH患者LAC、PCT、CL、CPI-C、FIB、CRP含量比较,差异均无统计学意义(P>0.05);末次引流时,高引流量组SAH患者LAC、PCT、CL、CPI-C、FIB及CRP含量均低于低引流量组,差异均有统计学意义(P<0.05);与首次引流时间点比较,2组SAH患者末次引流时上述6项指标均有下降,差异均有统计学意义(P<0.05)。见表4。
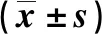
表2 低引流量组和高引流量组SAH患者不同引流时点临床及血液学指标Tab.2 Clinical features and hematological indexes of SAH patients with different drainage time point in low and high drainage
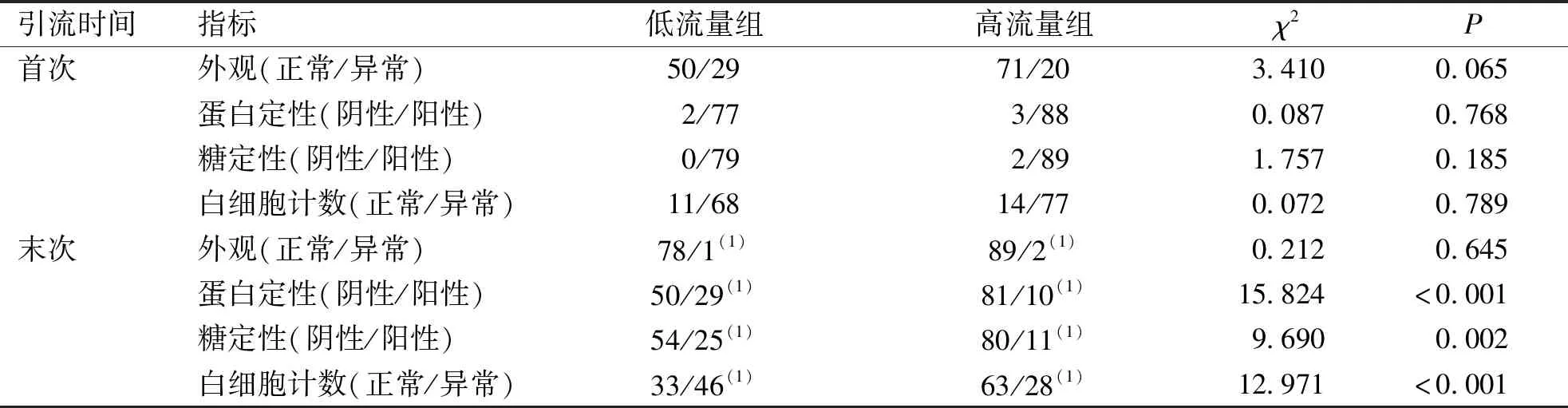
表3 低引流量组和高引流量组SAH患者不同引流时点CSF常规指标(n)Tab.3 CSF routine features of SAH patients with different drainage time points in low and high drainage group(n)
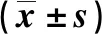
表4 低引流量组和高引流量组SAH患者不同引流时点的的CSF生化指标Tab.4 CSF biochemical features of SAH patients with different drainage time points in low
2.5 血清相关激素含量
血清相关激素含量结果显示,首次引流时,2组SAH患者AT、CS及ACTH含量比较,差异均无统计学意义(P>0.05);末次引流时,高引流量组SAH患者ACTH含量低于低引流量组,差异有统计学意义(P<0.05);与首次引流比较,末次引流时2组SAH患者3项指标均有下降,差异均有统计学意义(P<0.05)。见表5。
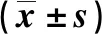
表5 低引流量组和高引流量组SAH患者不同引流时点的血清相关激素Tab.5 Serum hormones of SAH patients with different drainage time points in low and high drainage
3 讨论
随着老年人口基础快速扩增,因高血压、脑动脉硬化、颅内动脉瘤及血管畸形等因素而引发的SAH日益增加[8]。SAH患者的定量代谢组学是探索生物体系特殊疾病的生理时期受到刺激后而引发的小分子代谢产物含量改变的机制研究[9]。SAH术后患者因头部受多种侵入性操作影响,其机体存在多种生物标志物的含量改变[10]。腰大池外引流旨在降低颅内压力,从而改善脑血管痉挛或组织水肿风险[11]。一般来说,血性CSF是SAH术后患者早期特征性表现,同时CSF中多种特征指标会伴随患者转归过程而发生含量的渐变,精准调控腰大池外引流量可立即缓解患者不良症状,另一方面还有助于确保患者生命安全基础上加速疾病转归[12-13]。
本研究结果显示,SAH患者持续3 d腰大池外引流后,多项CSF常规指标有改善,证实腰大池外引流可一定程度释放部分神经损害因子[14]。CSF存在于硬膜囊的内循环中,因与神经细胞或脊髓细胞直接接触而可以反馈上述2部位损伤程度,也可能与SAH患者神经功能加速修复继而导致神经细胞代谢变化有关[15]。总的来说,通过CSF和血清指标监测可明确患者病情转归趋势及当前治疗方案的实效。本研究还表明,末次引流时高引流量组SAH患者蛋白定性阳性率、糖定性阳性率及白细胞计数异常率均要小于低引流量组,提示适当提升腰大池外引流量可加速CSF循环,通过代谢产物的及时释放、稀释,来缓解谷氨酸受体过刺激、脂质过氧化、钙离子超载等病理生理过程,继而显着影响CSF中蛋白质和糖化物检出含量[16-17]。同时,高引流量组SAH患者末次引流时,CSF中白细胞检出含量相对更低,说明腰大池外引流作为侵入性操作步骤,适当调增引流体积不会直接增加患者受应激的严重程度,反而会一定程度改善其免疫状态[18-19],但是患者免疫状态的改变是否因炎症状态改变而诱发,后续研究需进一步探究。
本研究结果还表明,SAH患者无颅内感染情况下,上述3项指标受外界因素影响相对较小,而手术操作、手术材料的置入及术中残留骨粉末引发的无菌性炎症反应亦不会导致上述3项指标发生显着改变[20-21]。尤其是PCT,作为一种无激素活性的降钙素前肽蛋白,绝大多数由甲状腺C细胞产生,是颅内细菌感染诊断的“金指标”,常用于指导医师预防性使用抗生素或调整使用剂量[22-23]。SAH患者CSF中PCT含量激增的机制尚不明确,但可以认为加强CSF循环更新速率有助于缓解局部炎症反应程度,但这种缓解效果特定于颅内无感染患者[24-25]。由于未长期监测CSF中PCT含量是否有轻微反弹或显着改变尚不得知;SAH患者的神经细胞因修复或应激过程,处于高负荷状态,同时受免疫细胞吞噬作用影响会将LAC含量维持在较高水平[26]。因此,有研究建议将CSF中LAC(截止水平>4 mmol/L)作为颅内细菌感染的重要指标,其单一用于诊断颅内感染时有较高的阳性预测值和阴性预测值,但其基本不会引发其他副产物的积累,因而临床医师多采取药物治疗方式进行含量控制[27-28]。本研究结果显示,高引流量组SAH患者CSF中CPI-C、FIB及CRP表达含量相对更低。CPI-C可直接表征动脉粥样斑块稳定性,其含量变化会影响细胞生长、浸润及转移等过程;肝脏生成的FIB主要生理功能是促进血液凝固,增加促凝物质的同时减少抗凝物质,除此之外FIB还可生成不可溶性的纤维蛋白多聚体,继而调节患者体内免疫和炎症;CRP则是反映机体即时状态的功能性蛋白,可综合反馈患者感染或炎症情况[29-30]。上述3项指标的改变综合说明,高引流量组患者干预后获取了相对更为稳定的应激状态,其体内炎症反应亦有所缓解。此外,组间比较结果还表明,高引流量组SAH患者ACTH含量低于低引流量组,但AT、CS含量差别不明显,可能与腰大池外引流后,2组SAH患者颅内压依然存在细微差别,持续存在将引发级联反应,促使体内ACTH不断递增,维持患者机体处于应激状态有关,其具体原因仍需后续探究。
综上所述,本研究结果提示SAH患者腰大池外引流时,通过精准调控引流量对患者CSF和血清中特征指标表达的影响,可为临床其他侵入性操作的临床实施提供一定指导策略;同时考虑到腰大池外引流与CSF和血清多项特征指标的密切关联,可尝试通过多指标联合检测预估患者临床临床状态,调整治疗方案。受限于研究指标,尚无法判定腰大池外引流与各指标的深层次关联性,可考虑结合基础实验展开后续研究加以验证。



