陶钰婷 吴敏佳
摘要 目的:探究盐酸多奈哌齐(DPH)对血管性痴呆(VD)小鼠认知功能障碍的影响及其作用机制。方法:75只雄性 C57BL/6小鼠按照随机数字表法分为5组:假手术组(Sham组)、VD模型组、DPH组(VD+DPH组)、DPH+长链非编码RNA-生长抑制特异性转录本5(lncRNA GAS5)无关片段组(VD+DPH+lncRNA GAS5 NC组)以及DPH+lncRNA GAS5过表达组(VD+DPH+lncRNA GAS5 OVE组),每组15只。采用小鼠双侧颈总动脉缩窄法构建VD模型。造模成功后2 d,DPH组小鼠给予DPH 1 mg/(kg·d)灌胃8周。Sham组和VD模型组小鼠给予等量的生理盐水灌胃处理。VD+DPH+lncRNA GAS5 OVE组小鼠脑室注射lncRNA GAS5 (每只1 010 pfu)后构建VD模型,2 d后给予DPH 1 mg/(kg·d)灌胃8周。VD+DPH+lncRNA GAS5 NC组小鼠脑室注射lncRNA GAS5 NC后构建VD模型,2 d后给予DPH 1 mg/(kg·d)灌胃8周。 实时荧光定量PCR(qRT-PCR)检测脑组织中lncRNA GAS5表达水平;Morris水迷宫实验检测各组小鼠学习记忆能力;分光光度法测定脑组织丙二醛(MDA)、超氧化物歧化酶(SOD)以及谷光甘肽过氧化物酶(GSH-Px);酶联免疫吸附实验(ELISA)检测血清白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)和肿瘤坏死因子α(TNF-α)含量;苏木素-伊红(HE)染色观察各组小鼠脑组织海马区域病理学改变。结果:与Sham组相比,VD模型组小鼠脑组织lncRNA GAS5水平和MDA含量,血清IL-6、IL-1β和TNF-α含量均明显升高(P<0.01),学习记忆能力、SOD、GSH-Px含量明显降低(P<0.01),且海马区域病理损伤明显。与VD模型组相比,VD+DPH组小鼠上述指标均被明显逆转,海马区域损伤减轻。与VD+DPH组相比,VD+DPH+lncRNA GAS5 OVE组小鼠lncRNA GAS5水平和MDA含量,血清IL-6、IL-1β和TNF-α含量均升高(P<0.01),学习记忆能力、SOD、GSH-Px含量明显降低(P<0.01),且海马区域病理损伤加重。结论:DPH能够改善VD小鼠认知功能障碍和炎症反应,其机制与抑制lncRNA GAS5表达相关。
关键词 血管性痴呆;认知功能障碍;盐酸多奈哌齐;炎症反应;长链非编码RNA-生长抑制特异性转录本5
doi:10.12102/j.issn.1672-1349.2024.07.014
血管性痴呆(vascular dementia,VD)是指由多种脑血管疾病引起的脑部功能障碍进而产生获得性神经功能损伤的综合征[1]。研究证实VD作为老年痴呆的第二大形式,大约占痴呆性疾病的20%~30%[2-3]。伴随人口老龄化的加剧,VD已经逐渐成为我国老年性痴呆的最主要类型[4]。研究表明导致VD的主要因素为脑血管病变,如小血管病变、大动脉病变等。脑血管病变会进一步引起控制学习、记忆功能的海马神经元缺血,进而导致神经元损伤和细胞凋亡,并最终引起痴呆[5-6]。盐酸多奈哌齐(donepezil hydrochloride,DPH)是治疗痴呆的一线药物,可以通过增强胆碱能神经功能发挥治疗作用[7]。既往研究显示,DPH能够改善VD小鼠学习和记忆能力障碍,其机制与抑制海马神经细胞凋亡和炎症反应相关[8]。但目前有关DPH对VD后认知功能障碍以及炎症反应的影响尚不
完全清楚。长链非编码RNA(lncRNA)是一类长度大于200 nt的非编码RNA,可以通过多种方式参与细胞的生长和发育。长链非编码RNA-生长抑制特异性转录本5(lncRNA GAS5)是由小鼠胚胎成纤维细胞中分离鉴定出来的[9]。研究表明,lncRNA GAS5是与神经功能损伤密切相关的一类lncRNA。在缺血性脑卒中病人和PC12细胞缺氧复氧后lncRNA GAS5表达显着升高[10]。另外,研究还发现,降低脑部lncRNA GAS5表达可以降低脑梗死体积,改善神经功能[11]。以上研究提示lncRNA GAS5的高表达可能是促进神经功能损伤的重要调控因子。但是有关lncRNA GAS5对VD小鼠神经功能障碍和炎症反应的影响尚不完全清楚。因此,本实验拟通过构建VD小鼠模型,观察DPH能否通过调控lncRNA GAS5改善VD小鼠神经功能障碍和炎症反应。
1 材料与方法
1.1 实验动物
雄性C57BL/6小鼠75只,体质量20~22 g,6~8周龄,实验动物由南京医科大学实验动物学部提供[合格证号:SCXK(苏)2018-0001],该实验通过了我院动物实验医学伦理委员会批准,动物实验遵循3R原则。
1.2 药品与试剂
DPH粉末(SELLECK公司,纯度≥99,批号:120011-70-3);苏木素-伊红(HE)染色液(碧云天生物技术公司生产,批号:C0105S);丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)以及谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒(南京建成生物工程有限公司生产);白细胞介素-6(interleukin-6,IL-6)酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)检测试剂盒(批号:RAB0311)、白细胞介素-1β(interleukin-1β,IL-1β)ELISA检测试剂盒(批号:RAB0277)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA检测试剂盒(批号:RAB0479)购自美国Sigma公司;聚合酶链式反应(PCR)检测试剂盒(江苏Solarbio公司,批号:SR1110);引物设计[生工生物工程(上海)股份有限公司]。
1.3 仪器
高速冷冻离心机(湖南湘仪实验室仪器有限公司生产,型号:G22-W型);多功能酶标仪(Thermo赛默飞世尔科技公司生产,型号:SuPerMax 3000FA型);细胞组织涡旋仪(武汉维塞尔生物科技有限公司生产,型号:M371450型);TC-XDS-500C型荧光倒置显微镜(日本/奥林巴斯Olympus);免疫印迹(Western Blotting)检测装置(美国Bio-Rad伯乐公司生产);GoodLook-1000型成像系统(美国Bio-Rad伯乐公司生产)。
1.4 方法
1.4.1 动物造模与分组
将75只雄性C57BL/6小鼠随机分为假手术组(Sham组)、VD模型组、DPH组(VD+DPH组)、DPH+lncRNA GAS5无关片段组(VD+DPH+lncRNA GAS5 NC组)及DPH+lncRNA GAS5过表达组(VD+DPH+lncRNA GAS5 OVE组),每组15只。采用小鼠双侧颈总动脉缩窄法构建VD模型[12]。造模成功后2 d,DPH组小鼠给予DPH 1 mg/(kg·d)灌胃8周。Sham组和VD模型组小鼠给予等量的生理盐水灌胃处理。VD+DPH+lncRNA GAS5 OVE组小鼠给予病毒液脑室注射lncRNA GAS5(每只1 010 pfu)构建VD模型,2 d后给予DPH 1 mg/(kg·d)灌胃8周。VD+DPH+lncRNA GAS5 NC组小鼠脑室注射lncRNA GAS5 NC后构建VD模型,2d后给予DPH1 mg/(kg·d)灌胃8周。
1.4.2 实时荧光定量PCR(qRT-PCR)检测脑组织lncRNA GAS5表达水平
按照RNA快速提取试剂盒说明书收集各组小鼠脑组织样本并提取总RNA,紫外分光光度仪测定RNA溶液OD260 nm/OD280 nm的吸光度值,计算RNA的纯度和浓度,按照逆转录试剂盒说明书的步骤将定量的总RNA逆转录合成cDNA,采用10 μL逆转录反应体系:RNA sample 5.0 μL,Prime Script RT Enzyme Mix I 0.5 μL,RT Primer 0.5 μL,5×Prime Script Buffer2 2.0 μL,RNase Free dH2O 2.0 μL,37 ℃条件下反应15 min,85 ℃条件下反应5s,反应产物4 ℃条件下保存,接着使用RT-PCR试剂盒进行RT-PCR反应,所有反应均设立3个复孔,每孔采用10 μL反应体系:2×SYBR Green 5.0 μL,Primer Mix 0.8 μL,DNase-free water 3.7 μL,RT product 0.5 μL。相对表达量采用2-△△Ct法计算。lncRNAGAS5正向引物:5′-TCTCACAGGCAGTTCTGTGG-3′,反向引物:5′-ATCCATCCAGTCACCTCTGG-3′;U6正向引物:5′-TGCGGGTGCTCGCTTCGGCAGC-3′,反向引物:5′-CCAGTGCAGGGTCCGAGGT-3′。上述引物设计与合成均由生工生物工程(上海)股份有限公司完成。
1.4.3 Morris水迷宫行为学实验
取6只小鼠进行定位航行实验:将5组小鼠连续训练3 d,每天4次。训练时,将小鼠从面向池壁的4个入水点放入水中,记录小鼠从水中到明确找到并站立于水下隐蔽平台的时间,所需时间为小鼠的逃避潜伏期,每组小鼠从池壁的4个入水点分别训练1次,每次间隔时长30 s。空间探索行为实验:在定位航行实验结束后,撤去平台,小鼠从池壁的同一入水点放入水中,记录小鼠在60 s内穿越原平台的次数。
1.4.4 MDA、SOD、GSH-Px含量测定
将各组小鼠断头处理后快速去除全脑组织,在冰上分离大脑海马组织,组织碾磨,二喹啉甲酸(BCA)法测定蛋白浓度并定量,按照试剂盒说明书操作步骤检测MDA、SOD、GSH-Px。
1.4.5 HE染色观察海马组织病理学形态
乙醚麻醉各组小鼠后,迅速断头取脑,摘取视交叉至漏斗柄的脑片,采用4%的多聚甲醛固定各组小鼠海马组织,脱水、透明、包埋、石蜡切片,并按照HE染色试剂盒进行海马组织染色,显微镜下观察各组小鼠海马组织形态学变化。
1.4.6 血清炎性因子检测
各组小鼠麻醉后,取6只小鼠,心脏取血,4 ℃,3 000 r/min,离心10 min,取其上清,按照ELISA检测试剂盒说明书测定IL-6、IL-1β、TNF-α含量。
1.5 统计学处理
采用SPSS 20.0统计软件进行统计分析。符合正态分布的定量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析(one-way analysis of variance,ANOVA),两组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
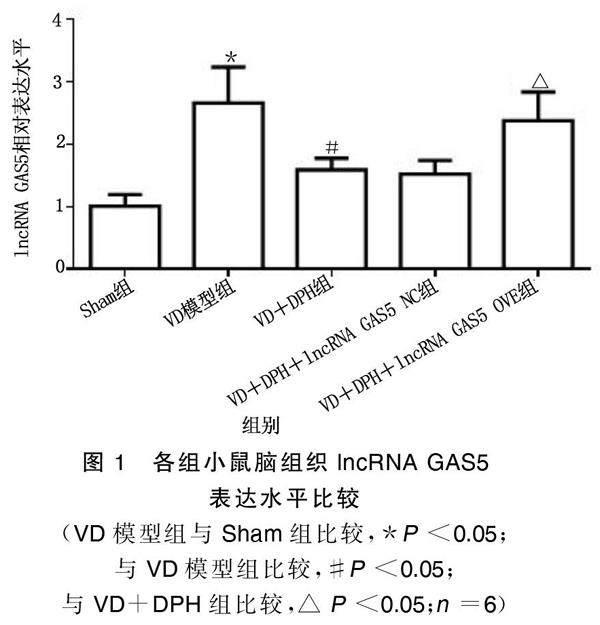
2.1 各组小鼠脑组织lncRNA GAS5表达水平比较
与Sham组相比,VD模型组小鼠脑组织lncRNA GAS5表达明显升高(P<0.05)。与VD模型组相比,VD+DPH组小鼠脑组织lncRNA GAS5表达明显降低(P<0.05)。与VD+DPH组相比,VD+DPH+lncRNA GAS5 OVE组小鼠脑组织lncRNA GAS5表达明显升高(P<0.05),VD+DPH+lncRNA GAS5 NC组小鼠脑组织lncRNA GAS5表达无明显差异。详见图1。
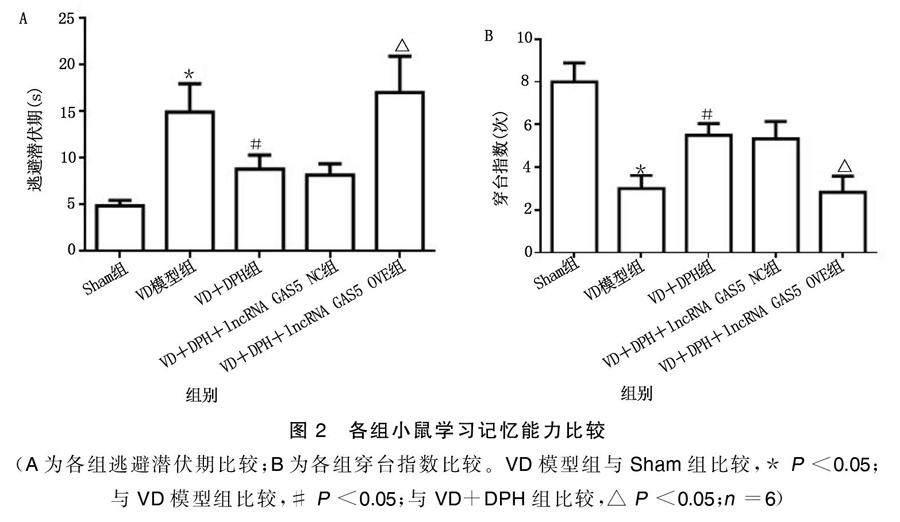
2.2 各组小鼠学习记忆能力比较
与Sham组相比,VD模型组小鼠逃避潜伏期明显延长(P<0.05),穿台指数明显降低(P<0.05)。与VD模型组相比,VD+DPH组小鼠逃避潜伏期明显缩短(P<0.05),穿台指数明显增加(P<0.05)。与VD+DPH组相比,VD+DPH+lncRNA GAS5 OVE组小鼠逃避潜伏期明显延长(P<0.05),穿台指数明显降低(P<0.05),VD+DPH+lncRNA GAS5 NC组小鼠逃避潜伏期和穿台指数无明显差异。详见图2。2.3 各组小鼠MDA、SOD、GSH-Px含量比较
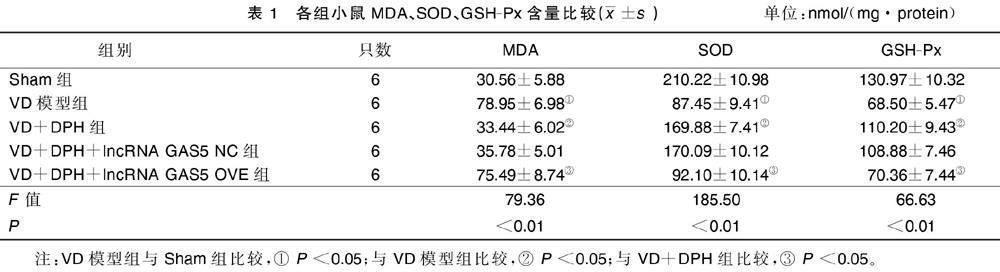
与Sham组相比,VD模型组小鼠海马组织MDA含量明显增加(P<0.05),GSH-Px和SOD活性均明显降低(P<0.05)。与VD模型组相比,VD+DPH组小鼠海马组织MDA含量明显降低(P<0.05),GSH-Px和SOD活性均明显升高(P<0.05)。与VD+DPH组相比,VD+DPH+lncRNA GAS5 OVE组小鼠大脑海马组织MDA含量明显增加(P<0.05),GSH-Px和SOD活性均明显降低(P<0.05),VD+DPH+lncRNA GAS5 NC组小鼠海马组织MDA、SOD、GSH-Px含量无明显差异。详见表1。
2.4 各组小鼠血清IL-6、IL-1β、TNF-α含量比较
与Sham组相比,VD模型组小鼠血清IL-6、IL-1β、TNF-α含量明显增加(P<0.05)。与VD模型组小鼠相比,VD+DPH组小鼠血清IL-6、IL-1β、TNF-α含量明显降低(P<0.05)。与VD+DPH组相比,VD+DPH+lncRNA GAS5 OVE组小鼠血清IL-6、IL-1β、TNF-α含量明显增加(P<0.05),VD+DPH+lncRNA GAS5 NC组小鼠血清IL-6、IL-1β、TNF-α含量无明显差异。详见表2。
2.5 各组小鼠海马组织形态学变化
Sham组小鼠海马CA1区神经元结构完整、清晰,细胞呈极性排列。VD模型组小鼠CA1区海马神经元数量明显减少,细胞排列紊乱,细胞大部分皱缩,部分神经元细胞核固缩,染色质出现明显聚集等。VD+DPH组小鼠CA1区病理性损伤明显减轻,神经元结构较为完整,细胞排列相对规则。与VD+DPH组相比,VD+DPH+lncRNA GAS5 OVE组小鼠CA1区病理损伤加重,神经元细胞数量降低,结构紊乱。VD+DPH+lncRNA GAS5 NC组小鼠神经元结构与VD+DPH组小鼠相比无明显改变。详见图3。
3 讨 论
VD是一种血管性认知功能障碍和神经退行性疾病,主要表现为神经活动、语言、学习以及记忆能力的障碍。脑部血流长期灌流不足会导致中枢胆碱功能障碍、神经元氧化应激损伤,是学习和记忆能力下降的重要原因[3]。因此,本研究通过双侧颈总动脉缩窄法构建VD小鼠模型。Morris水迷宫实验结果显示,与Sham组相比,VD模型组小鼠逃避潜伏期明显延长,穿台指数明显降低,且海马CA1区出现明显的病理损伤,表明VD小鼠模型构建成功。VD的危险因素主要包括脑卒中、动脉粥样硬化、糖尿病以及短暂性脑缺血发作等。既往研究显示,VD会诱发神经元死亡、炎症反应过度激活以及认知功能障碍等[13-14]。因此,积极探寻药物干预治疗VD尤为重要。目前临床上有关VD的治疗主要有药物治疗和特殊方式治疗等。其中药物包括神经保护剂、脑组织代谢改善剂等,神经递质的替代治疗是特殊方式治疗的关键[15]。DPH是治疗VD的一线临床药品,能够有效改善病人认知功能障碍、炎症反应以及神经元凋亡等。但是目前有关DPH对VD的具体作用机制尚不完全清楚。
多项研究发现,lncRNAs与缺血性脑卒中的发生关系密切。在缺血性脑卒中病人脑组织和血液中均发现lncRNAs表达发生显着改变,提示lncRNAs可能是缺血性脑卒中的潜在标志物[16]。研究显示,lncRNA GAS5在缺血性脑卒中病人中高表达[17]。另外,体外细胞实验证实在缺氧复氧处理的原代神经元中lncRNA GAS5表达明显升高,神经元的存活率降低,抑制lncRNA GAS5表达能够降低神经元凋亡率[18]。在体动物实验也证实抑制脑缺血再灌注损伤大鼠lncRNA GAS5表达,能够降低脑梗死体积,并最终改善神经功能[19]。以上研究表明,lncRNA GAS5在神经功能损伤中发挥重要作用,但是有关lncRNA GAS5对VD神经损伤的影响尚不清楚。本实验通过qRT-PCR检测显示,与Sham组相比,VD模型组小鼠脑组织lncRNA GAS5表达明显升高。基于DPH对VD的治疗作用以及lncRNA GAS5高表达与神经损伤相关,本研究推测DPH能否通过抑制lncRNA GAS5表达,改善VD神经损伤。为此,本研究通过给予VD小鼠病毒液脑室注射lncRNA GAS5过表达质粒观察DPH对VD小鼠神经功能障碍的影响,结果显示,与VD模型组相比,VD+DPH组小鼠脑组织lncRNA GAS5表达明显降低,且小鼠学习记忆能力提高,海马CA1区病理损伤减轻;与VD+DPH组相比,VD+DPH+lncRNA GAS5 OVE组小鼠,上述指标和现象均被明显逆转,表明DPH能够通过抑制lncRNA GAS5表达,从而改善VD诱导的海马神经损伤。氧化应激性损伤在神经退行性病变中发挥重要作用。脑部血流长期灌流不足会导致MDA含量升高、SOD以及GSH-Px活性降低[20]。另外,血清炎性因子如IL-6、IL-1β、TNF-α等亦是VD损伤的重要检测指标,在VD小鼠模型中血清炎性因子IL-6、IL-1β、TNF-α表达均明显升高,通过抑制脑部过度氧化应激以及炎症风暴能够改善VD神经损伤[21]。本研究结果显示,与VD模型组相比,VD+DPH组小鼠氧化应激水平以及炎性因子释放均明显降低;与VD+DPH组相比,VD+DPH+lncRNA GAS5 OVE组小鼠氧化应激水平以及炎性因子释放均明显升高,表明lncRNA GAS5能够通过调节氧化应激和炎症反应,从而影响VD小鼠神经功能障碍。
综上所述,本研究结果显示,DPH能够通过抑制lncRNA GAS5表达,降低氧化应激和炎症反应,改善VD小鼠认知功能障碍。
参考文献:
[1] 孙微,王一帆,张佳月.金纳多对血管性痴呆大鼠认知功能、海马区细胞凋亡及炎性因子的影响[J].中国老年学杂志,2021,41(16):3532-3535.
[2] KUA E H,HO E,TAN H H,et al.The natural history of dementia[J].Psychogeriatrics,2014,14(3):196-201.
[3] O′BRIEN J T,THOMAS A.Vascular dementia[J].Lancet,2015,386(10004):1698-1706.
[4] 田金洲,解恒革,秦斌,等.适用于中国人群的血管性痴呆筛查和诊断框架[J].中华内科杂志,2019,58(1):10-16.
[5] 王韵桥,夏猛,曹传东,等.五脏温阳化瘀汤对血管性痴呆模型大鼠Bcl-2及Caspase相关蛋白表达的影响[J].中华中医药杂志,2020,35(2):625-628.
[6] IADECOLA C.The pathobiology of vascular dementia[J].Neuron,2013,80(4):844-866.
[7] 梁杨,孙文,闫兴利.多奈哌齐联合丁苯酞对血管性痴呆患者认知功能及自理能力的影响[J].武警后勤学院学报(医学版),2021,30(5):66-68.
[8] 孙原,高敬华,李冬梅,等.盐酸多奈哌齐对VD大鼠海马CA1区神经细胞的保护作用及作用机制研究[J].中国煤炭工业医学杂志,2018,21(3):315-320.
[9] TAN X W,JIANG H F,FANG Y L,et al.The essential role of long non-coding RNA GAS5 in glioma:interaction with microRNAs,chemosensitivity and potential as a biomarker[J].Journal of Cancer,2021,12(1):224-231.
[10] WU R L,YUN Q,ZHANG J P,et al.RETRACTED:long non-coding RNA GAS5 retards neural functional recovery in cerebral ischemic stroke through modulation of the microRNA-455-5p/PTEN axis[J].Brain Research Bulletin,2021,167:80-88.
[11] CHEN F H,ZHANG L X,WANG E W,et al.LncRNA GAS5 regulates ischemic stroke as a competing endogenous RNA for miR-137 to regulate the Notch1 signaling pathway[J].Biochemical and Biophysical Research Communications,2018,496(1):184-190.
[12] 何治,潘志红,鲁文红.丹参酮ⅡA对血管性痴呆小鼠的神经保护作用机制初探[J].时珍国医国药,2009,20(12):3022-3024.
[13] GORELICK P B,COUNTS S E,NYENHUIS D.Vascular cognitive impairment and dementia[J].Biochimica et Biophysica Acta,2016,1862(5):860-868.
[14] WANG X X,ZHANG B,XIA R,et al.Inflammation,apoptosis and autophagy as critical players in vascular dementia[J].European Review for Medical and Pharmacological Sciences,2020,24(18):9601-9614.
[15] LIAO Z Y,BU Y L,LI M J,et al.Remote ischemic conditioning improves cognition in patients with subcortical ischemic vascular dementia[J].BMC Neurology,2019,19(1):206.
[16] BAO M H,SZETO V,YANG B B,et al.Long non-coding RNAs in ischemic stroke[J].Cell Death & Disease,2018,9:281.
[17] DENG Y M,CHEN D D,GAO F,et al.Silencing of long non-coding RNA GAS5 suppresses neuron cell apoptosis and nerve injury in ischemic stroke through inhibiting DNMT3B-dependent MAP4K4 methylation[J].Translational Stroke Research,2020,11(5):950-966.
[18] ZHAO J H,WANG B,WANG X H,et al.Effect of lncRNA GAS5 on the apoptosis of neurons via the Notch1 signaling pathway in rats with cerebral infarction[J].European Review for Medical and Pharmacological Sciences,2019,23(22):10083-10091.
[19] SHEN B,WANG L,XU Y J,et al.LncRNA GAS5 silencing attenuates oxygen-glucose deprivation/reperfusion-induced injury in brain microvascular endothelial cells via miR-34b-3p-dependent regulation of EPHA4[J].Neuropsychiatric Disease and Treatment,2021,17:1667-1678.
[20] ZENG J,ZHU L,LIU J,et al.Metformin protects against oxidative stress injury induced by ischemia/reperfusion via regulation of the lncRNA-H19/miR-148a-3p/Rock2 axis[J].Oxidative Medicine and Cellular Longevity,2019,2019:8768327.
[21] KALARIA R N,AKINYEMI R,IHARA M.Stroke injury,cognitive impairment and vascular dementia[J].Biochimica et Biophysica Acta,2016,1862(5):915-925.
(收稿日期:2022-07-24)
(本文编辑王丽)



