陈聪慧,段春辉,杨欣雨,夏 翠,郭云霞,纪守坤,严 慧,刘月琴,张英杰
(河北农业大学动物科技学院, 保定 071000)
动物在流动、转群、屠宰过程中不可避免要经历运输应激[1],运输应激是多种应激原共同作用的结果,包括运输前抓捕、装车,运输过程中温湿度和环境变化等。研究表明,运输应激会导致动物呼吸急促、心跳加速、惊惧不安,随着机体水分及营养物质的大量流失,内分泌系统紊乱、免疫功能下降,易引起各种呼吸性及消化性疾病,不同程度地影响畜禽的生产性能和经济效益[2-3]。因此,探索运输应激影响动物健康及代谢的机制,对运输应激的缓解及防治具有重要的生产意义。动物在运输过程中为了适应应激带来的不利影响,机体能量代谢加强,无氧糖酵解及脂质过氧化等反应加剧[4]。机体维持能量动态平衡的同时积累了大量代谢产物,肌肉中乳酸的累积使肉品质劣化[5]。研究表明,腺苷酸活化蛋白激酶(adenosine 5-monophosphate (AMP)-activated protein kinase, AMPK)在畜禽宰后肌肉糖酵解过程中起重要调节作用[6]。AMPK是生物能量代谢调节的关键分子,也是影响肌肉纤维类型转化的主要信号转导途径,可调节细胞能量水平[7]。AMPK可通过调节肌肉中的乙酰辅酶A羧化酶(acetyl-CoA carboxylase, ACC)/丙二酰辅酶A肉碱棕榈酰转移酶(carnitine palmitoyl transferase 1, CPT)途径,影响脂肪酸代谢[8]。因运输而引发的应激性疾病严重损害了羊肉品质及养殖场经济效益,运输应激已变成养羊业迅速发展过程中迫切需要解决的生产问题。揭示运输应激影响糖酵解的机制是减缓应激、改善肉质、提高动物福利和经济效益的关键,目前关于羊的运输应激机制研究较少。本试验拟研究运输后羔羊肌肉糖酵解及能量代谢水平的变化规律及不同干预方式对能量代谢的影响,为缓解羔羊运输应激、改善羊肉品质、提高动物福利提供参考。
1 材料与方法
1.1 试验动物及管理
本试验于2021年6月1日—2021年6月30日在张家口兰海畜牧养殖有限公司进行。试验前对圈舍、饲养工具等进行彻底消毒。选用体况良好、健康无病、4月龄、平均体重为(19.06±0.76) kg的湖羊公羔60只,所有试验羊均在同一栋舍内。由羊场提供基础饲粮,每日7:00和17:00饲喂2次,保证每日所有羔羊的料槽中均有剩料,饲粮组成及营养水平见表1。
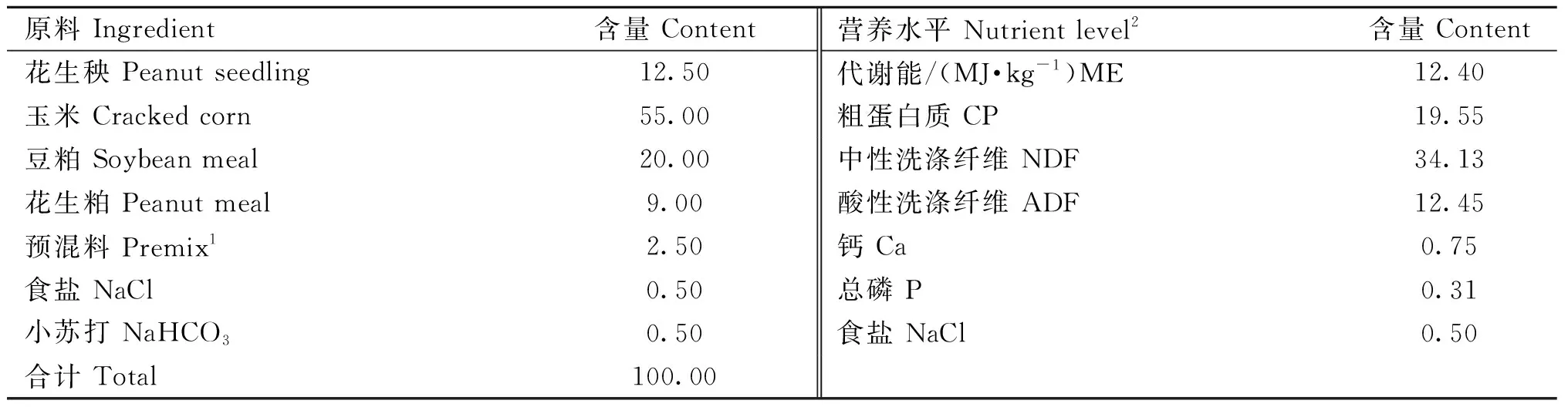
表1 全混合日粮(Total Mixed Rations; TMR)饲粮组成及营养水平(干物质基础)Table 1 TMR diet composition and nutrient levels(DM basis) %
1.2 试验设计
60只羔羊随机分为3组,每组20只,每组5个重复,运输当天记为试验第0天,在第0、7、14天每组每个重复中任选1只羔羊,每组共5只进行屠宰。对照组饲喂基础饲粮,电解多维组于运输前2 d至运输后7 d在饲粮中给每只羔羊添加电解多维375 mg·d-1,新霉素组于第0~7天在饲粮中给每只羔羊添加200 mg·d-1新霉素进行治疗。饲喂前先将电解多维粉和新霉素粉充分混合少量饲粮后,确保添加物被每只羔羊完全摄入,再自由采食基础饲粮。各组羔羊分群饲养。电解多维主要成分及含量见表2。
试验羔羊于2021年6月8日09:00—17:00经历8 h运输:采用三层半挂车装载,车厢长13 m,宽2.55 m,高4 m,车厢内无间隔,没有进行栓系等任何措施。运输距离约为350 km,运输途中禁食禁水,运输结束回圈舍12 h内仅提供饮水。
运输后第0、7、14天每重复分别随机挑选1只羔羊(每处理组5只)屠宰,宰前24 h禁食,2 h禁水。取右胴体背最长肌置于冻存管并标注,置于-80 ℃贮存。
1.3 检测指标
1.3.1 糖酵解潜力(glycolysis potential; GP) 准确称取肌肉组织并按重量(g)∶体积(mL)=1∶10比例加入预冷的生理盐水,高速研磨后置于离心管中,2500 r·min-1,离心10 min,取上清液并用生理盐水5倍稀释。
采用酶联免疫分析法(enzyme-linked immunosorbent assay, ELISA)检测肌肉中AMPK活性。根据Monin和Sellier[9]的方法,测定肉中糖原、游离葡萄糖、葡萄糖-6-磷酸(glucose 6-phosphate, G-6-P)及乳酸(lactic acid, LA)的含量,按如下公式计算肌肉GP:
糖酵解潜力(μmol·g-1)=2×[糖原含量(μmol·g-1)+游离葡萄糖含量(μmol·g-1)+G-6-P含量(μmol·g-1)]+LA含量(μmol·g-1)。
1.3.2 糖酵解酶活测定 肌酸激酶(creatine kinase, CK)、己糖激酶(hexokinase, HK)、丙酮酸激酶(pyruvate kinase, PK)、乳酸脱氢酶(lactate dehydrogenase, LDH)采用生化方法检测,试剂盒均购自南京建成生物工程研究所。
1.3.3 基因及蛋白表达
1.3.3.1 引物设计:以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参基因,参照GenBank中肝激酶B1(liver kinase B1,LKB1)、AMPKα1、AMPKα2、脂肪酸合酶(fatty acid synthase,FAS)、CPT-1、ACC、GAPDH基因的mRNA序列,运用Primer 6.0软件设计特异性引物送至北京六合华大基因科技有限公司合成,见表3。

表3 用于实时荧光定量PCR的引物序列Table 3 Nucleotide sequences of specific primers for real-time quantitative PCR analysis
1.3.3.2 RNA提取及反转录:TRIzol法提取肌肉中总RNA。超微量紫外可见分光光度计测定总RNA的浓度和纯度,并用1%琼脂糖凝胶电泳检测RNA的完整性。依据TaKaRa反转录试剂盒进行反转录,程序设置:25 ℃ 5 min;42 ℃ 30 min;85 ℃ 5 s。
1.3.3.3 反转录·聚合酶链反应(reverse transcription-polymerase chain reaction, RT q-PCR):用荧光定量PCR仪(ABIStep One PlusTM),GAPDH基因为内参,每个样本分别用待检测基因和内参基因引物扩增,3个复孔。采用2-ΔΔCt计算法对实时定量PCR数据进行处理和分析,计算方法如公式所示:
ΔΔCt=ΔCt(试验样品)-ΔCt(基准样品);
ΔCt(试验样品)=Ct(试验样品,目的基因)-Ct(试验样品,内参基因);
ΔCt(基准样品)=Ct(基准样品,目的基因)-Ct(基准样品,内参基因)。
1.3.3.4 Western blot:提取肌肉组织总蛋白,BCA法测定蛋白浓度。制备SDS-PAGE凝胶进行电泳,凝胶电泳结束后,从凝胶分离的蛋白质带分别用非标记一抗及辣根过氧化物酶标记的二抗对其进行孵育和检测。利用化学发光成像系统曝光拍照,AlphaEaseFC软件对Western blot条带进行灰度分析,结果以目的蛋白与GAPDH灰度值比值显示。Western blot所用抗体购自北京博奥森生物技术有限公司。
1.4 数据处理及分析
用SPSS 23.0统计软件中单因素ANOVA分析同时间不同处理、同处理不同时间各指标的变化差异,Duncan’s法进行多重比较。一般线性模型(GLM)分析处理及时间的影响。Western blot条带结果利用AlphaEaseFC软件对Western blot条带进行灰度分析,结果以目的蛋白与GAPDH灰度值比值显示,随后用SPSS 23.0进行双因素分析。数据用“平均数±标准误(Mean±SE)”表示,以P<0.05作为差异显着性判断标准,P<0.01表示差异极显着。
2 结 果
2.1 运输应激不同干预方式对羔羊背最长肌糖酵解潜力及AMPK活性的影响
由表4可知,处理极显着影响了羔羊肌肉糖原水平(P<0.01),第14天新霉素组糖原水平显着高于其他两组(P<0.05)。处理对LA、G-6-P、游离葡萄糖、GP、AMPK活性均无显着影响(P>0.05)。时间极显着影响了羔羊肌肉糖原和游离葡萄糖水平(P<0.01),肌肉糖原在运输后呈上升趋势,对照组和电解多维组在第7天最高,新霉素组第14天最高;游离葡萄糖在0~14 d先升高后降低,在第7天最高。时间对LA、G-6-P、GP、AMPK活性无显着影响(P>0.05)。处理×时间交互作用对羔羊肌肉糖酵解潜力及AMPK活性无显着影响(P>0.05)。
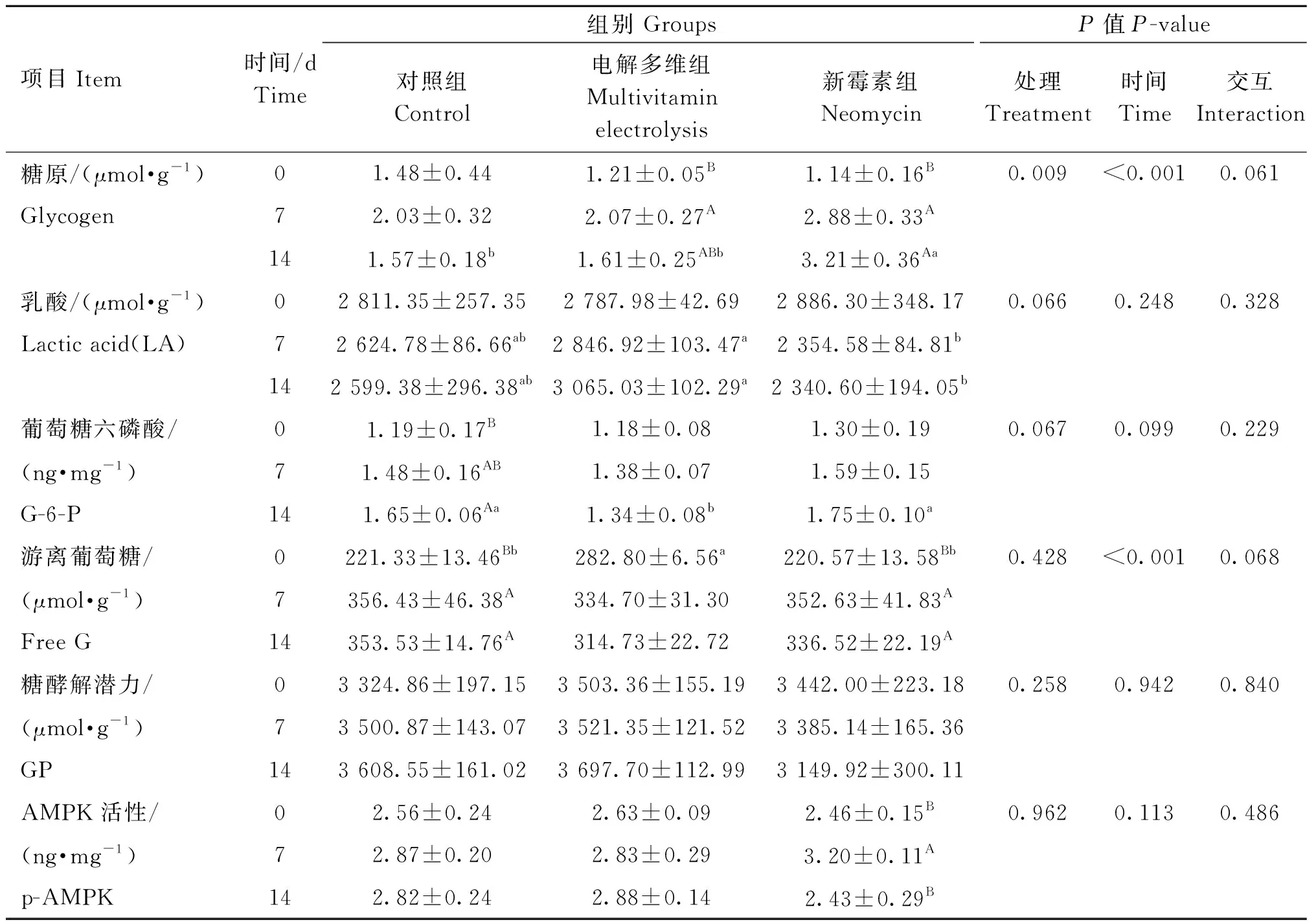
表4 运输应激不同干预方式对羔羊肌肉糖酵解潜力及AMPK活性的影响Table 4 Effects of different treatments of transportation stress on glycolysis potential and AMPK activity of lamb muscle
2.2 运输应激不同干预方式对羔羊背最长肌糖酵解相关酶活性的影响
由表5可知,处理及处理×时间对羔羊肌肉糖酵解相关酶活性无显着影响(P>0.05)。时间极显着地影响了羔羊肌肉HK及LDH活性(P<0.01),各组肌肉HK活性在运输后0~14天内先升高后降低,第7天最高;肌肉LDH活性在运输后呈上升趋势,对照组和新霉素组在第7天最高,电解多维组第14天最高。时间对CK、PK活性无显着影响(P>0.05)。
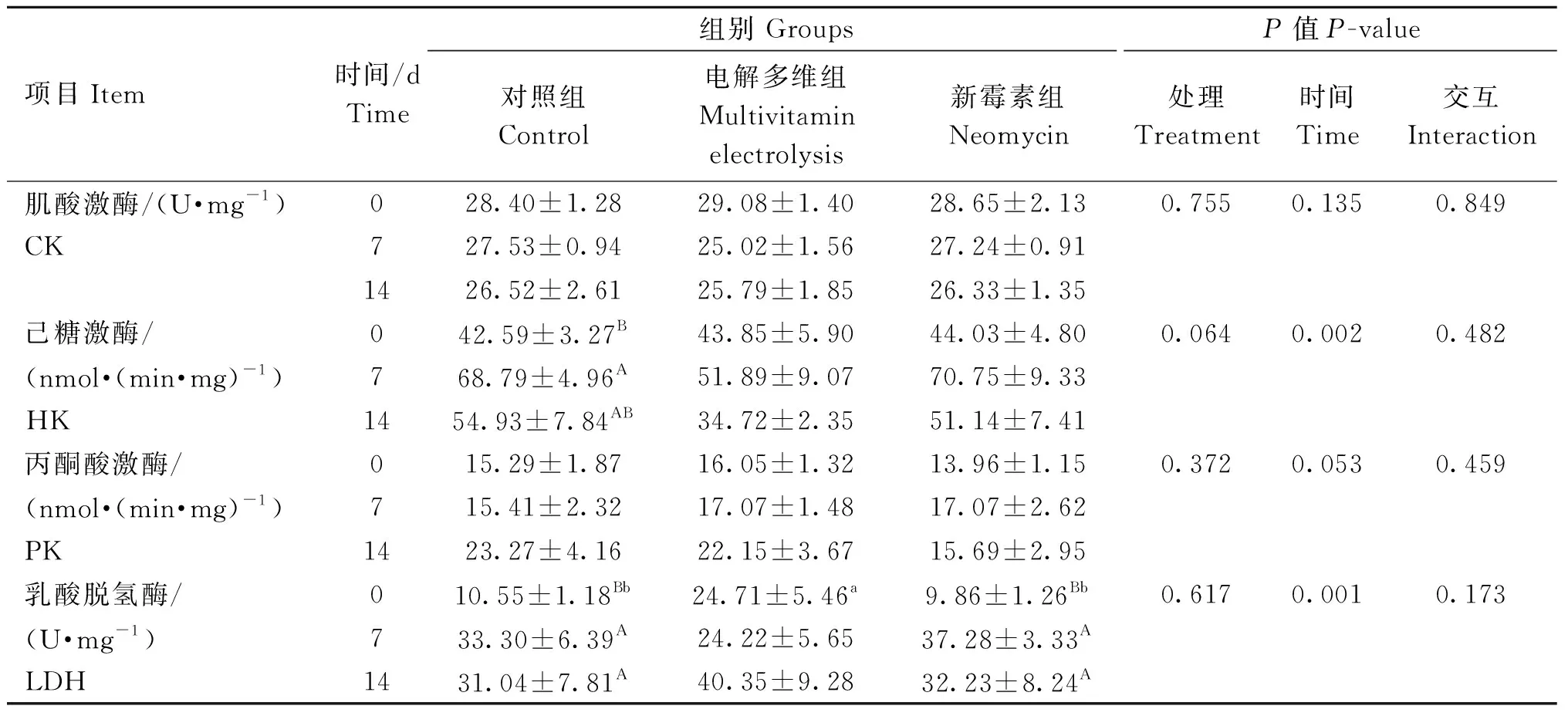
表5 运输应激不同干预方式对羔羊肌肉糖酵解相关酶活性的影响Table 5 Effects of different treatments of transportation stress on glycolysis-related enzyme activities in lamb muscle
2.3 运输应激不同干预方式对羔羊背最长肌LKB1、AMPKα1、AMPKα2基因表达量的影响
由表6可知,处理显着影响了LKB1的基因表达量(P<0.05),第7天新霉素组LKB1基因量显着高于电解多维组(P<0.05);处理对羔羊肌肉AMPKα1、AMPKα2基因表达无显着影响(P>0.05)。时间极显着地影响了AMPKα1、AMPKα2、LKB1表达量(P<0.01);各组AMPKα1、AMPKα2、LKB1基因表达量在0~14 天内均呈下降趋势。处理及时间交互对AMPKα1、AMPKα2、LKB1基因表达无显着影响(P>0.05)。
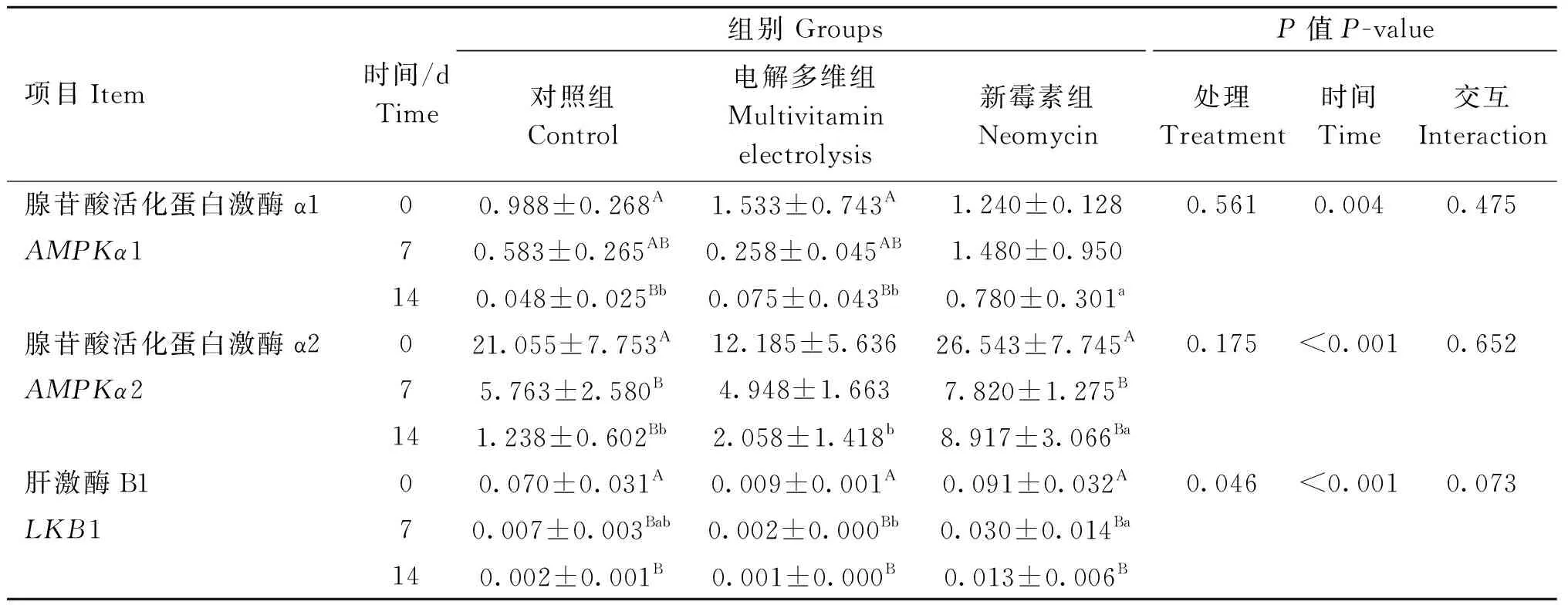
表6 运输应激不同干预方式对羔羊LKB1、AMPKα1、AMPKα2基因表达量的影响Table 6 Effects of different treatments oftransportation stress on gene expression of LKB1, AMPKα1 and AMPKα2 in lambs
2.4 运输应激不同干预方式对羔羊背最长肌FAS、CPT-1、ACC基因表达量的影响
由表7可知,处理及处理×时间对羔羊肌肉FAS、CPT-1、ACC基因表达均无显着影响(P>0.05)。时间极显着地影响了CPT-1基因表达量(P<0.01),显着影响了ACC基因表达量(P<0.05),各组CPT-1及ACC在运输后7、14 d基因表达量均高于第0天;时间对羔羊肌肉FAS基因表达无显着影响(P>0.05)。
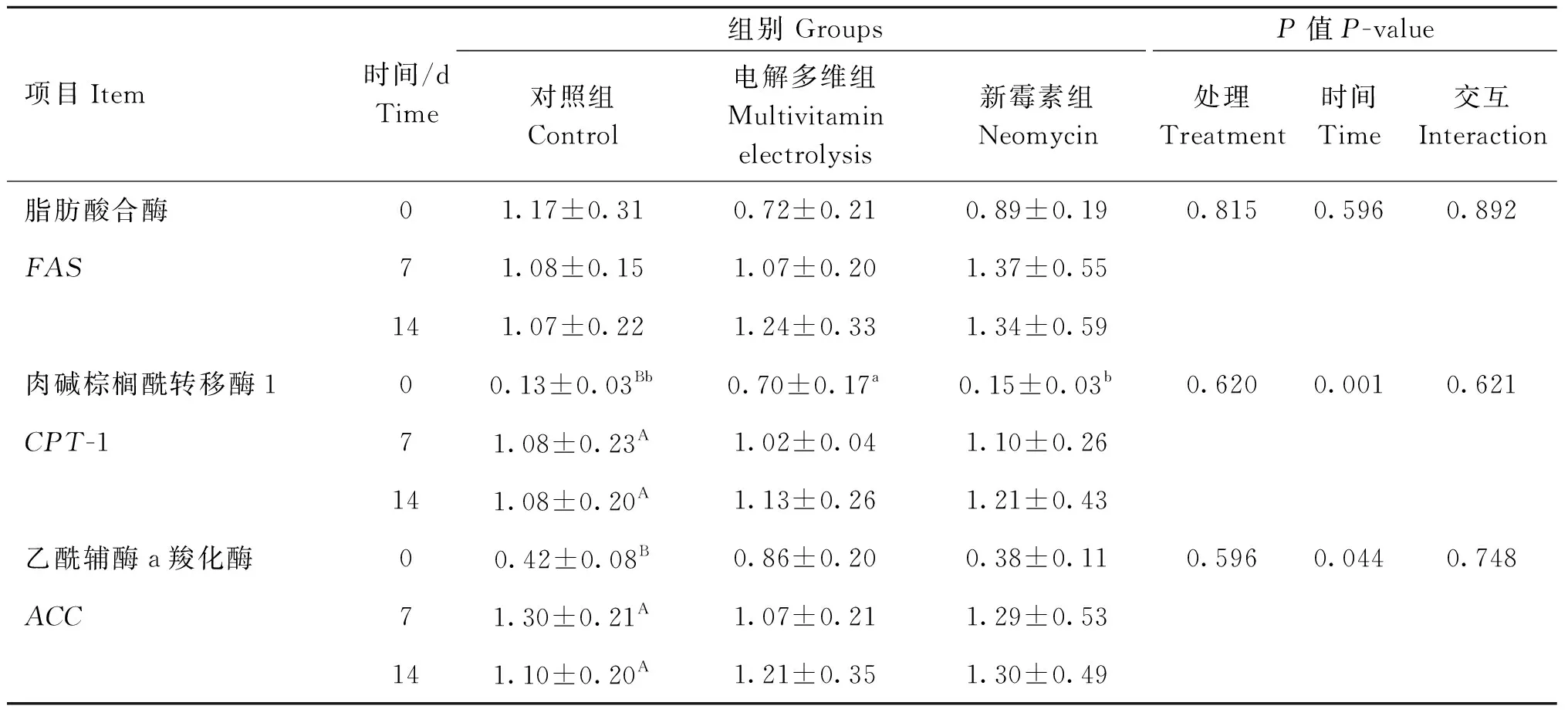
表7 运输应激不同干预方式对羔羊FAS、CPT-1、ACC基因表达量的影响Table 7 Effects of different treatments of transportation stress on gene expression of FAS, CPT-1 and ACC in lambs
2.5 运输应激不同干预方式对羔羊背最长肌LKB1、AMPKα1、AMPKα2蛋白表达量的影响
由表8可知,处理及处理×时间交互作用对羔羊肌肉AMPKα1、AMPKα2、LKB1蛋白表达均无显着影响(P>0.05)。时间显着地影响了LKB1蛋白表达量(P<0.05)。处理有影响AMPKα1的趋势(P<0.10)。各组AMPKα1、AMPKα2、LKB1蛋白表达量在0~14天内均呈下降趋势,与基因表达基本一致。Western blot检测结果如图1所示。
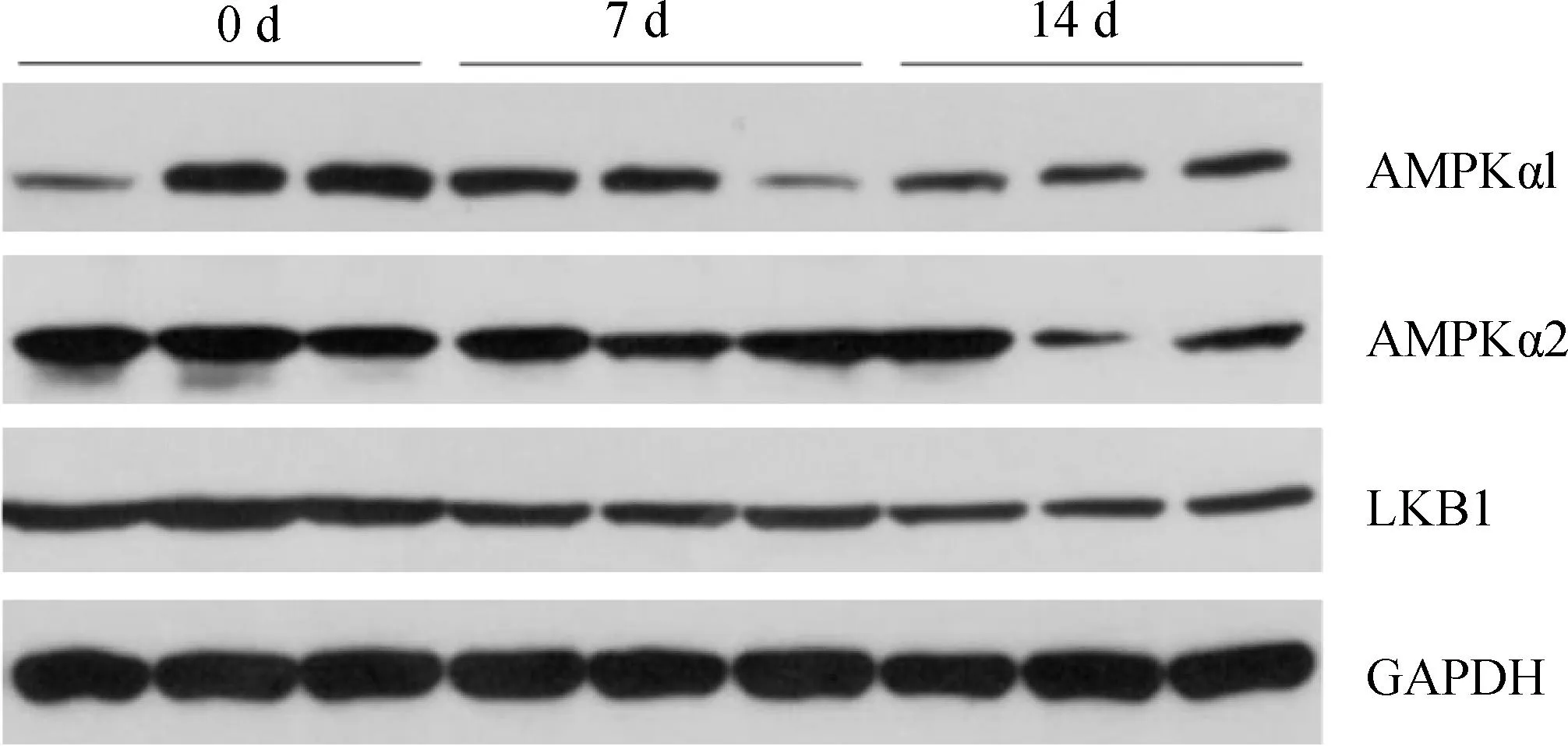
从左至右依次为第0天对照组、电解多维组、新霉素组;第7天对照组、电解多维组、新霉素组;第14天对照组、电解多维组、新霉素组From left to right in turn, there were 0 d control group, multivitamin electrolysis group and neomycin group; Control group, multivitamin electrolysis group and neomycin group on the 7th day; Control group, multivitamin electrolysis group and neomycin group on 14th day图1 Western blot检测LKB1、AMPKα1、AMPKα2蛋白表达Fig.1 Protein expression levels of LKB1, AMPKα1, and AMPKα2 analyzed by Western blot
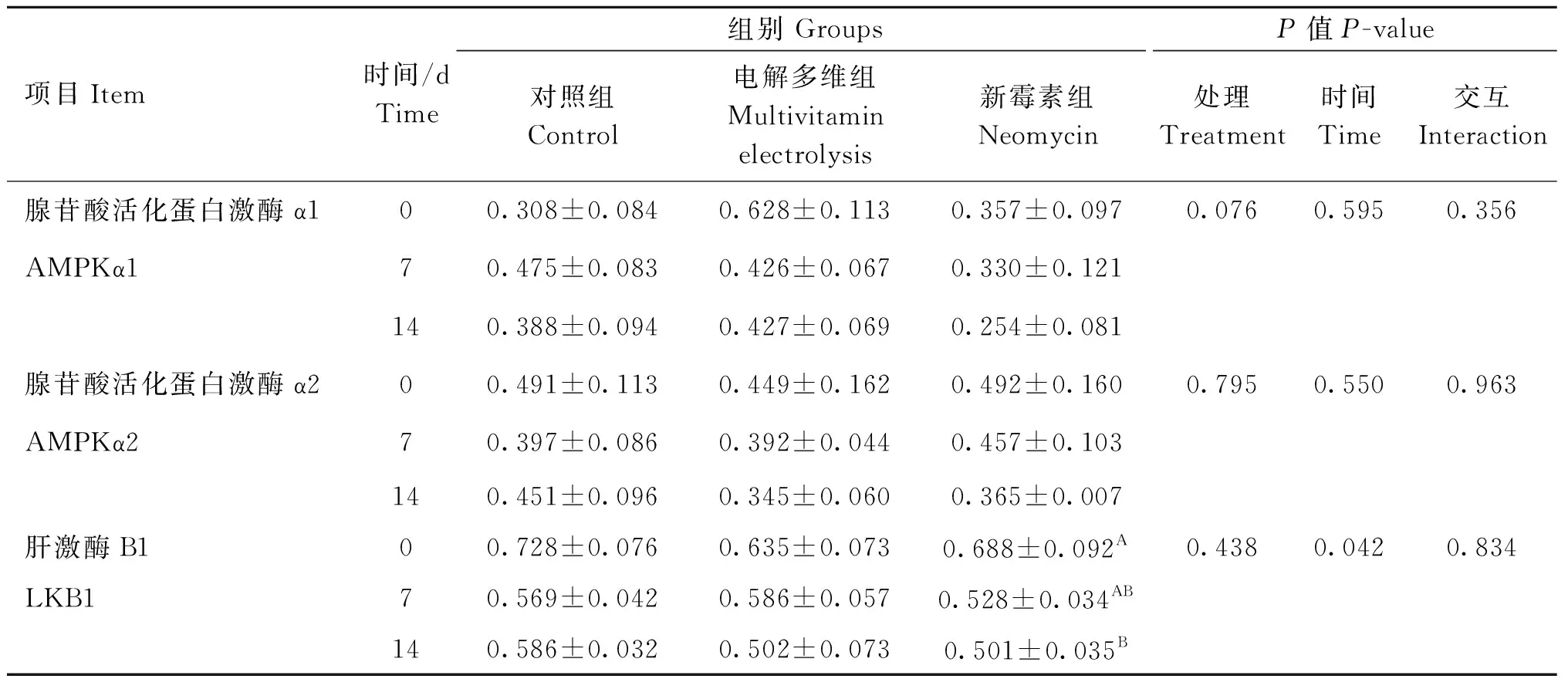
表8 运输应激不同干预方式对羔羊LKB1、AMPKα1、AMPKα2蛋白表达量的影响Table 8 Effects of different treatments of transportation on stress proteins expression of LKB1, AMPKα1 and AMPKα2 in lambs
3 讨 论
3.1 运输应激不同干预方式对羔羊背最长肌糖酵解潜力及AMPK活性的影响
屠宰后氧气供应中断,肌肉中葡萄糖与糖原代谢方式从有氧转变为无氧糖酵解[5]。运输应激会使肌糖原无氧糖酵解加剧,肌肉中LA持续积累,pH下降,导致肉品质劣化[10]。GP是动物肌肉中糖酵解产生乳酸的底物总量:GP=2×(糖原含量+游离葡萄糖含量+G-6-P含量)+LA含量[9]。畜禽宰后糖原耗尽时糖酵解停止,AMPK活性不再升高,糖原及LA决定了GP[9]。研究发现,肌糖原含量占pH24 h变化结果的40%~60%[11],GP显着影响了肌肉pH与肉色[12]。此外,低GP导致干硬DFD(dark,firm and dry,DFD)牛肉发生率显着提高,口感变差[13]。Cheng等[14]研究表明,维生素C对应激动物机体内细胞凋亡有一定的保护作用。电解多维能够改善因应激引起机体内环境变化,维持内环境稳态,增强机体抗病力,缓解应激。新霉素口服后可以透过受损的消化道黏膜,进入机体内循环输送到肝、肾、心、肺和腹腔等组织器官,有效减少疾病的发生并治疗[15]。张挺[16]研究发现,抗菌成分的添加使应激小鼠糖原显着提高,对其LA、GP水平无显着影响。本研究运输前后应用电解多维、运输后用新霉素使羔羊糖原水平提高,但对其GP没有显着影响,说明电解多维和新霉素可能对调节羔羊肌肉糖酵解速率有作用。电解多维组屠宰后LA含量高于对照组,而新霉素组低于对照组,说明电解多维及新霉素会影响机体糖酵解进程,第7、14天电解多维组羔羊使机体无氧糖酵解过程加快,而运输后新霉素治疗可能减缓了无氧糖酵解进程。AMPK活性变化既反映机体正常能量代谢情况,也反映细胞应激情况。AMPK可通过调节机体物质代谢以维持细胞能量、调节机体的产能和耗能[17],通常在营养缺乏、低氧、剧烈运动等状况下被激活。研究表明,AMPK激活降低了畜禽肉色稳定性、系水力、剪切力等品质[18]。本试验中,随着羔羊应激后饲养时间的延长,运输前后用电解多维及运输后用新霉素均未显着影响AMPK活性,AMPK处于活化状态。
3.2 运输应激不同干预方式对羔羊背最长肌糖酵解相关酶活性的影响
宰后糖酵解代谢速率直接影响pH的下降程度和速率,而糖酵解速率与控制其糖酵解的限速酶HK、PK和LDH等有关[19]。CK是机体应激状态下调节能量代谢的重要靶点[20],存在于动物肌肉、心与脑等组织的线粒体和细胞浆中。维生素A、C和E可清除自由基缓解机体氧化应激,保护机体细胞膜免受损害[21]。本试验中,电解多维及新霉素对肌肉CK活性无影响,运输后14 d内各组肌肉CK活性也无显着变化,而在之前的研究中,运输后14 d内各组羔羊血清CK活性均上升,且电解多维组及新霉素组血清CK含量均低于对照组,运输应激使血清CK持续性升高,说明血清CK更能反映机体应激情况[22-23]。HK是糖酵解途径中的第1个关键酶,可将葡萄糖转化为G-6-P,促进糖酵解的发生并有效补充细胞ATP能量[24]。PK和LDH作为糖酵解途径的关键末端酶,厌氧条件下分别将磷酸烯醇丙酮酸转化为丙酮酸、丙酮酸转化为乳酸[25]。LDH主要存在于心肌、肝、肾、骨骼肌或肺等动物组织中,其升高说明骨骼肌损伤或疲劳、存在肝炎等疾病[26]。肌肉LA的积累取决于细胞膜酶LDH和线粒体之间对来自糖酵解的丙酮酸的竞争[27]。Zhang等[28]研究表明,3 h的运输应激后肉鸡肌肉中HK、PK、LDH均显着上升,表明肌肉ATP的耗竭可能通过激活HK活性触发糖酵解机制,随后PK和LDH的活性增加,代谢物磷酸烯醇-丙酮酸和丙酮酸累积。本试验中处理有影响PK的趋势,电解多维组PK活性最低。本研究中,各组羔羊肌肉HK活性在运输后第0~14天先升高后降低,第7天最高;运输后第0、7、14天,三组间PK均无显着变化,电解多维及新霉素治疗对PK活性没有明显的调控作用,说明羔羊应激的糖酵解机制调节和肉鸡一样可能更依赖于HK,较高的HK活性可能代表着较高的糖酵解速率。运输后第0天,电解多维组肌肉LDH显着高于对照组和新霉素组,其可能的原因是电解多维的预防性添加有助于保护细胞膜完整性,防止肌细胞损伤。对照组及新霉素组第0天LDH显着低于第7、14天,说明运输应激使肌肉损伤或疲劳,LDH大量释放,随着运输后饲养时间的延长逐渐修复。
3.3 运输应激不同干预方式对羔羊背最长肌相关基因及蛋白表达的影响
AMPK是异源三聚体酶,在感应细胞内能量平衡和调控肌肉糖酵解方面发挥着重要作用[29]。AMPK可通过两种信号激活:肝激酶B1(LKB1)介导和钙调素依赖蛋白激酶介导[30]。在应激情况下,LKB1是引起AMPK活化的主要原因,尤其是在肌肉组织中。而钙调素依赖蛋白激酶激活AMPK主要与肝细胞中磷酸和钙、氢阳离子浓度增加密切相关,与肌细胞能量代谢相关性较小[31]。本试验中,处理显着影响了LKB1基因表达量,电解多维抑制了LKB1基因及蛋白表达,应激缓解效果最好。Hu等[32]研究表明,饥饿应激使鸡PM[33](快速糖酵解肌肉)的AMPKα2基因表达量显着降低。Zhang等[28]研究表明,宰前运输应激显着增加了鸡胸大肌LKB1和AMPKα2基因水平,对AMPKα1表达无显着影响,应激通过上调LKB1和AMPKα2表达激活AMPK。本研究中,随着运输后饲养时间的延长,各组羔羊肌肉AMPKα1、AMPKα2、LKB1基因及蛋白表达量均逐渐下降,机体应激逐渐缓解;运输后14 d内新霉素组AMPKα1、AMPKα2、LKB1基因及蛋白表达量持续高于电解多维组及对照组,在第7天停止用药后AMPK途径基因表达量仍处于较高水平,新霉素治疗可能并未有效抑制AMPK途径的激活。
低能量条件下AMPK可以磷酸化特异性的酶和位点,增加ATP生成,降低ATP消耗。研究表明,AMPK可通过促进大分子分解补充机体能量,并能保持脂肪代谢处于稳定状态[34]。AMPK途径的激活可通过磷酰化ACC调节脂肪酸代谢,减少机体丙二酰辅酶A含量,促进CPT-1蛋白活化,加速脂肪酸氧化。FAS是机体碳水化合物合成代谢转化为脂肪酸的关键酶,可催化乙酰辅酶A和丙二酰辅酶A形成长链脂肪酸[35]。本研究中,运输应激后随着饲养时间延长,羔羊肌肉FAS表达量无变化,运输后14 d脂肪合成情况未受影响。在脂肪酸的代谢途径中,ACC是丙二酰辅酶A合成的关键限速酶。丙二酰辅酶A又是脂肪酸关键合成前体物,也是CPT-1进入线粒体进行β氧化的高效抑制物质。ACC失活,CPT-1的抑制减少,糖原和脂肪酸合成减少,脂肪酸氧化增加,释放大量能量[36]。Désert等[37]研究表明,饥饿应激抑制了肉鸡肝组织中的脂肪酸合成并促进了脂肪酸β氧化。本研究中,运输后第0天电解多维组CPT-1表达量显着高于其余两组,电解多维的补充一定程度上可间接为机体供能。Hu等[32]研究表明,禁食24 h组ACC水平低于自由采食组,禁食24 h后补饲24 h组肉鸡ACC水平高于自由采食组及禁食24 h组,应激显着下调了ACC基因表达,诱导了骨骼肌中脂肪酸生物合成的抑制,再补饲ACC表达逐渐上升。与本研究结果一致,运输后ACC和CPT-1表达量上升,表明脂肪酸氧化仍在加剧进行,持续为机体补充能量。
4 结 论
综上所述,羔羊运输前、后添加电解多维可改善肌肉能量代谢状态,抑制运输诱导的AMPK途径激活。



