何尤夫 刘微△ 刘德斌 李玲 向仕菊 姚奇
(1.贵州省人民医院心血管内科,贵州 贵阳 550000;2.贵州省心血管疾病临床医学研究中心,贵州 贵阳 550000;3.广东省汕头市第二人民医院,广东 汕头 515000;4.遵义市正安县人民医院,贵州 遵义 563100)
急性心肌梗死(acute myocardial infarction,AMI)是由于各种原因导致冠脉急性缺血,进而引起的心肌细胞缺血坏死,具有很高的发病率和死亡率,并对健康构成严重威胁[1]。即使AMI患者及时接受介入治疗,心肌细胞的死亡仍不可避免,严重影响患者的预后[2]。替格瑞洛作为一种新型P2Y12-ADP受体拮抗剂,无须经肝脏代谢激活即可直接起效,可逆地与血小板P2Y12-ADP受体结合发挥抑制血小板的作用[3]。另有研究[4]显示替格瑞洛通过腺苷依赖的机制发挥增加冠脉血流量、减少心肌梗死面积等作用,但是替格瑞洛是否具有促进AMI后血管生成的作用尚不清楚。腺苷是一种重要的生物活性物质,具有介导血管生成的作用。已有试验证实替格瑞洛能过腺苷依赖的机制促进蛋白激酶B(akt)、AMP依赖的蛋白激酶(adenosine 5‘-monophosphate (AMP)-activated protein kinase,AMPK)及内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)磷酸化。但是,替格瑞洛是否通过腺苷依赖的akt/AMPK/eNOS信号通路发挥促进心肌梗死后血管生成的作用尚无研究报道。本研究就替格瑞洛通过腺苷依赖的 akt/AMPK/eNOS信号通路调节AMI后血管新生这一问题展开深入的探讨,旨在为替格瑞洛促进AMI后血管新生寻找新的理论依据。
1 材料与方法
1.1 实验动物c57BL/6纯系清洁级小鼠全部购自辽宁省长生生物技术有限公司。实验动物使用许可证号:SYXK(黔)2021-0005。实验动物的处理符合相关动物实验要求。
1.2 药品试剂及仪器血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体(武汉三鹰,19003-1-AP)、β-actin抗体(武汉三鹰,81115-1-RR)、akt抗体(武汉三鹰,10176-2-AP)、P-akt抗体(武汉三鹰,28731-1-AP)、MAPK抗体(武汉三鹰,10176-2-AP),p-MAPK抗体(武汉三鹰,28796-1-AP)、eNOS抗体(武汉三鹰,27120-1-AP)、p-ENOS抗体(武汉三鹰,28939-1-AP)、CD31抗体(武汉三鹰,28083-1-AP),逆转录试剂盒(日本takara),SYBR 绿色荧光 PCR 预混液(日本takara),Perifosine(美国MCE,157716-52-4),Dorsomorphin(美国MCE,866405-64-3),MRS1523(美国MCE,HY-121119),腺苷检测试剂盒(上海初态生物,CT68427),免疫组化试剂盒(中杉金桥,PV-9000),血栓弹力图分析仪(上海继圣,CFMS LEPU-8880),血小板功能分析仪(上海索虑,Sonoclot SCP2),小动物呼吸机(中国玉研仪器,V-1000),小动物心电图仪(中国玉研仪器,3306B)。
1.3 实验方法
1.3.1 建立急性心肌梗死小鼠模型将小鼠使用1%戊巴比妥钠50 mg/kg麻醉后固定于手术台,同时连接小动物心电图仪,在小动物呼吸机辅助通气下开胸,并结扎左前降支冠脉,结扎后可见心脏由暗紫色变为苍白色,在确认心电图出现明确心肌缺血改变后即为模型建立成功。
1.3.2 实验分组及小鼠饲养实验分为五组,假手术组(Sham组)、心肌梗死即刻组(AMI 0 h组)、心肌梗死48 h组(AMI 48 h组)、心肌梗死1周组(AMI 1 W组)、心肌梗死4周组(AMI 4 W组)、心肌梗死并服用氯吡格雷组(CLOP组)、心肌梗死并服用替格瑞洛组(TIC组)、心肌梗死并服用替格瑞洛且使用Dorsomorphin组(Dorsomorphin组)、心肌梗死并服用替格瑞洛且使用Perifosine组(Perifosine组)、心肌梗死并服用替格瑞洛且使用MRS1523组(MRS1523组)。随后根据不同分组,分别使用替格瑞洛(灌胃,300 mg/d,剂量根据氯吡格雷说明书及专家共识[5])、氯吡格雷(灌胃,90 mg/d,剂量根据氯吡格雷说明书及专家共识[5])Dorsomorphin(腹腔注射,1 mg/kg·d[6])、Perifosine (腹腔注射,20 mg/kg·d[7])、MRS1523(腹腔注射,0.1 μM/d[8])。所有小鼠在特定时间点取眼球血,并开胸取心脏备用。
1.3.3 酶标法测定小鼠血清腺苷含量取小鼠眼球血,离心后得血清,并根据试剂盒说明书,使用酶标法检测腺苷含量。
1.3.4 免疫组织化学取小鼠心脏,4%多聚甲醛固定72 h,梯度乙醇脱水,二甲苯透明,石蜡包埋、切片,随后操作步骤按中杉金桥( PV-9000) 试剂盒说明进行。
1.3.5 HE染色小鼠心脏标本石蜡包埋后切片,常规脱蜡至水。石蜡切片常规二甲苯、乙醇脱蜡至水,苏木素染色 10 min,0.7%盐酸乙醇分化3~5 s,流水洗涤后,伊红液浸染 3 min。梯度乙醇脱水,二甲苯透明,中性树胶封片,光学显微镜下观察分析。
1.3.6 Masson染色小鼠心脏标本石蜡包埋后切片,常规脱蜡至水,重铬酸钾染色,铁苏木素染色,丽春红酸性品红染色,磷钼酸染色,苯胺蓝染色,1%冰醋酸分化,常规脱水、透明、封片,光学显微镜下观察分析。
1.3.7 Western blot检测组织细胞中相关蛋白表达通过使用混合有1%蛋白酶抑制剂和磷酸化酶抑制剂的RIPA(碧云天,中国)从心脏组织细胞中分离蛋白质,并通过BCA蛋白质测定试剂盒(碧云天,中国)检测蛋白质浓度。将裂解液与5份SDS样品缓冲液混合并煮沸10 min。将裂解液样品在6%和12%SDS-PAGE上分离,并转移到PVDF膜上。在室温下用5%牛奶封闭溶液封闭印迹1 h,然后用合适的一抗孵育过夜。用TBST多次洗涤后,将膜与HRP标记的二抗进一步孵育1 h。用ECL Western blot检测试剂(碧云天,中国)对印迹进行可视化显影,并用GEL成像系统(Bio-Rad,美国)进行成像。通过软件Image J分析蛋白质的定量。
1.3.8 RT-PCR检测组织/细胞中相关基因表达各组心肌组织或细胞均使用Trizol法提取总RNA,根据说明书,使用逆转录试剂盒将对应RNA进行逆转录;用不同基因的特异性引物对cDNA进行qRT-PCR,使用SYBR试剂盒在Eppendorf MasterCycler RealPlex4(Eppendor,Wesseling Berzdorf,德国)上进行PCR反应,ΔΔCt法计算相对表达水平;使用β-actin对靶基因的表达进行标准化。VEGF:正义链为5’-GCA GAC TAT TCA GCG GAC TCA-3’,反义链为5’-CCG TTG GCA CGA TTT AAG AGG-3’;β-actin引物序列见生工试剂盒说明书。
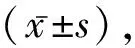
2 结 果
2.1 AMI模型中VEGF存在差异性表达图1A所示为各组心电图情况,心肌梗死后各组的ST段明显上抬,提示造模成功;图1B所示,AMI 1 W和AMI 4 W组可见明显的局部心肌损害、肌纤维碎裂;而在Masson染色的检测中,图1C~D所示,AMI 4 W组可见明显的胶原沉积,提示纤维化形成;与之对应的,在AMI 4 W组中,VEGF的蛋白水平(图1E~F)和mRNA水平(图1G)表达也明显下降。故而我们选择4周作为评估时间点进行后续研究。
注:A.各组AMI模型心电图;B.各组AMI大鼠心脏HE染色;C.各组AMI大鼠心脏Masson染色;D.通过Masson染色评估胶原沉积的统计图;E.Western bolt评估各组大鼠心肌内VEGF的蛋白表达水平;F.图E中VEGF蛋白水平相对值统计图;G.RT-PCR评估各组大鼠心肌内VEGF的mRNA表达水平。与Sham组相比,aP<0.05;AMI 0 h组相比,bP<0.05;与AMI 48 h组相比,cP<0.05;与AMI 1 W组相比,dP<0.05。
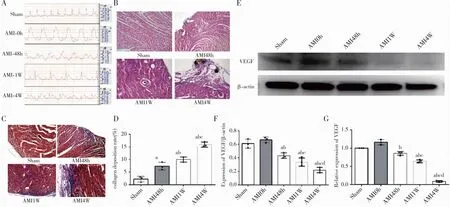
2.2 替格瑞洛对AMI模型小鼠的心肌保护作用为了解替格瑞洛在AMI后对梗死心肌内对血管生成的影响,我们选取了目前国内外较为公认的氯吡格雷作为阳性对照组。如图2A所示,在HE染色中,与AMI组相比,氯吡格雷组(CLOP组)和替格瑞洛组(TIC组)的局部心肌损害、肌纤维碎裂有所减轻。如图2B~C所示,在Masson染色中,与AMI组相比,CLOP组和TIC组的胶原蛋白沉积率明显下降(P<0.05)。在更进一步的腺苷表达检测(图2D)中,CLOP组和TIC组表达均相对比AMI组明显上升(P<0.05);而在血栓弹力图检测(图2E)和血小板聚集率检测(图2F)中,CLOP组和TIC组表达均相对比AMI组明显下降(P<0.05)。结果提示替格瑞洛和氯吡格雷均可改善AMI后的心肌纤维化,或与其可抑制腺苷表达有关,并同时还可调节血小板活性及血栓形成。
注:A.建立各组模型后取心肌组织行HE染色;B.各组Masson染色;C.Masson染色评估胶原沉积的统计图;D.各组中腺苷值统计图;E.各组中血栓弹力的统计图;F.各组中血小板活性率的统计图。Sham表示假手术组;AMI表示AMI后4周组;CLOP表示AMI并使用氯吡格雷灌胃治疗4周组;TIC表示AMI并使用替格瑞洛灌胃治疗4周组。与Sham组相比,aP<0.05;与AMI组相比,bP<0.05;与CLOP组相比,cP<0.05。
2.3 替格瑞洛可促进VEGF表达在进一步的研究中,我们还评估了替格瑞洛和氯吡格雷对于AMI后局部心肌细胞中VEGF表达的影响。如图3A-B所示,在免疫组化检测局部心肌细胞中VEGF表达里,与AMI组相比,CLOP组和TIC组中的VEGF表达均明显上调(P<0.05)。通过Western blot检测各组中VEGF蛋白水平表达情况(图3C~D),结果也与免疫组化结果基本一致。而在VEGF的mRNA水平表达检测中,RT-PCR结果也证实,与AMI组相比,CLOP组和TIC组中的VEGF的mRNA表达也明显上调(P<0.05)。我们的结果证实,在AMI中,替格瑞洛可明显促进VEGF的蛋白和mRNA水平表达。

注:A.免疫组化检测各组大鼠模型中心肌组织内VEGF表达;B.免疫组化中VEGF阳性值统计图;C.Western blot检测各组中VEGF蛋白水平表达情况;D.Western blot结果中VEGF相对表达量统计图;E.RT-PCR检测各组中VEGF mRNA表达情况统计图。Sham表示假手术组;AMI表示急性心肌梗死后4周组;CLOP表示急性心肌梗死并使用氯吡格雷90 mg/d灌胃治疗4周组;TIC表示急性心肌梗死并使用替格瑞洛300 mg/d灌胃治疗4周组。与Sham组相比,aP<0.05;与AMI组相比,bP<0.05;与CLOP组相比,cP<0.05。
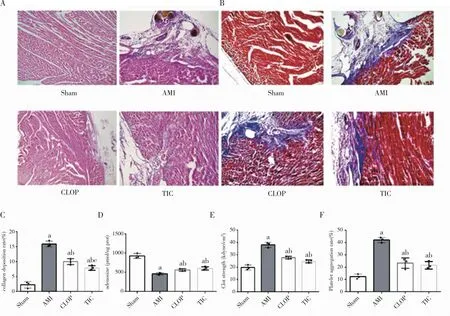
2.4 替格瑞洛通过调节VEGF表达保护心肌为了解替格瑞洛促进AMI后VEGF表达,进而调节局部心肌内血管新生的机制,我们初步评估了AMPK/AKT轴对心肌梗死后血栓弹力、血小板活性及腺苷浓度表达的调节作用。在HE染色结果中(图4A)我们发现无论抑制AMPK活性、AKT活性,还是抑制腺苷受体表达,均会减少替格瑞洛对于心肌损害的保护作用。在Masson染色中(图4B~C),与TIC组相比,Perifosine组(akt抑制剂)、Dorsomorphin组(AMPK抑制剂)和MRS1523组(腺苷受体抑制剂)的胶原沉积均明显上调(P<0.05),提示无论抑制akt、AMPK还是腺苷受体,均会减少替格瑞洛对于AMI后心肌纤维化的保护作用。在腺苷的检测中(图4D),与TIC组相比,Perifosine组、Dorsomorphin组和MRS1523组的腺苷浓度均明显上调(P<0.05)。在血栓弹力图检测(图4E)、血小板活性检测(图4F)中,与TIC组相比,Perifosine组、Dorsomorphin组和MRS1523组的血栓弹力图数值、血小板活性均明显下降(P<0.05)。
注:A.各组大鼠模型中心肌组织的HE染色;B.各组大鼠模型中心肌组织的Masson染色;C.Masson染色评估胶原沉积的统计图;D.各组中腺苷值统计图;E.各组中血栓弹力的统计图;F.各组中血小板活性率的统计图。Sham表示假手术组;AMI表示急性心肌梗死后4周组;TIC表示急性心肌梗死并使用替格瑞洛300 mg/d灌胃治疗4周组;Perifosine表示急性心肌梗死后同时使用300 mg/d替格瑞洛及akt抑制剂Perifosine20 mg/kg·d灌胃治疗4周组;Dorsomorphin表示急性心肌梗死后同时使用300 mg/d替格瑞洛及AMPK抑制剂Dorsomorphin 1 mg/kd·d灌胃治疗4周组;MRS1523表示急性心肌梗死后同时使用300 mg/d替格瑞洛及腺苷受体抑制剂MRS1523 0.1μM /kg·d灌胃治疗4周组。与Sham组相比,aP<0.05;与AMI组相比,bP<0.05;与TIC组相比,cP<0.05;与Perifosine组相比,cP<0.05;与Dorsomorphine组相比,dP<0.05。
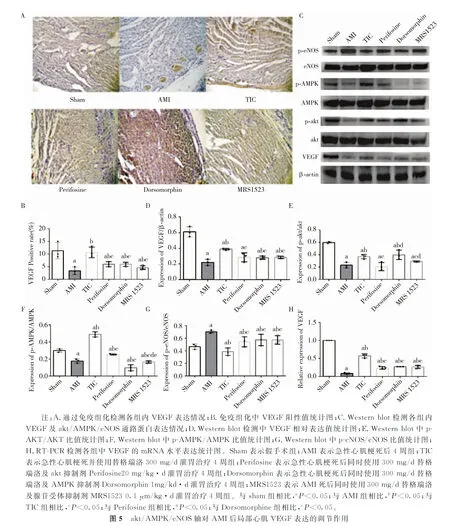
2.5 替格瑞洛可通过akt/AMPK/eNOS信号通路调节VEGF表达我们检测了akt/AMPK /eNOS轴对心肌梗死后局部心肌VEGF表达的调节作用。通过免疫组化(图5A~B)和Western blot(图5C~D)检测了各组中VEGF蛋白水平表达情况。与TIC组相比,Perifosine组、Dorsomorphin组和MRS1523组的VEGF蛋白水平表达均明显上调(P<0.05)。与AMI组相比,替格瑞洛可明显上调p-AKT/AKT(图5E)和p-eNOS/eNOS(图5G)比值(P<0.05),下降p-AMPK/AMPK(图5F)比值(P<0.05),提示替格瑞洛可明显改善由AMI导致的局部心肌细胞内AMPK/AKT/eNOS轴的活化。另外在VEGF的mRNA水平表达中,我们也得出了和蛋白水平一致的结果。结果表明,替格瑞洛可通过调节AMPK/AKT/eNOS轴,进而调节心肌梗死后局部心肌细胞内VEGF的表达。
3 讨 论
既往的研究[1]显示,AMI患者良好的侧支循环提供的残余血流能够有效减少梗死面积、改善左心收缩功能,侧支循环的缺失与心肌梗死后早期心源性休克密切相关。而AMI早期侧支循环的建立,能够进一步降低心肌梗死面积和心肌缺血面积,从而改善心肌梗死患者的预后[2]。PLATO试验[3]证实,与氯吡格雷(另一种P2Y12-ADP受体拮抗剂)相比,替格瑞洛在不增加主要出血的情况下,进一步降低急性冠脉综合征患者的心血管死亡/心肌梗死/卒中复合终点事件风险达16%,同时显着降低心血管死亡达21%。而另一项体外试验[4]进一步显示替格瑞洛能够抑制人红细胞对腺苷的吸收,其可能的机制是抑制了平衡型核苷转运蛋白1的活性。腺苷是人体内的一种重要生物活性物质,发挥着重要的病理生理调节功能,具有扩张冠状动脉[9]、抑制血小板聚集[10]、抑制炎症反应[11]、改善冠状动脉缺血再灌注损伤[12]等作用。在血管损伤后血管修复过程中腺苷引起内皮祖细胞的迁移与数量增加,而且这种效应呈浓度依懒性(腺苷浓度在1 nM/L至10 μM/L)[13]。内皮细胞的增殖和迁移是血管生成过程中的关键步骤。腺苷能够诱导心肌血管平滑肌细胞和心肌成肌细胞的VEGF mRNA的表达,增加VEGF蛋白浓度,从而介导了血管生成[13]。此外,有研究[14]发现细胞内腺苷可以通过调节表观遗传编程来促进血管生成。因此,替格瑞洛具有潜在的通过增加腺苷浓度促进血管生成的能力。但目前尚无研究证实替格瑞洛能否促进心肌梗死后血管生成,其作用机制也有待进一步研究。2013年一项基于健康成人的研究[15]显示,与氯吡格雷相比,替格瑞洛显着增加腺苷诱导的冠脉血流速度。此外,有研究[16]显示冠心病患者服用替格瑞洛21 d后血管功能和内皮功能得到改善。近期,研究者在猪动物模型上的研究[17]结果发现,替格瑞洛通过腺苷依赖的机制降低心肌梗死后的心肌损伤及水肿形成。以上这些研究表明,替格瑞洛可能通过腺苷依赖的机制发挥了更大的心脏保护作用。本研究在基于前述研究理论的基础上证实,替格瑞洛可促进AMI后小鼠心肌组织细胞内的VEGF蛋白水平和mRNA水平表达,而在使用腺苷受体抑制剂MRS1523后可明显抑制替格瑞洛对于VEGF的上调作用。本研究同时还初步探讨了替格瑞洛可通过促进AMI后小鼠体内腺苷浓度,进而促进心肌组织内VEGF的表达,这或许与其促进血管新生,并进一步调节AMI后的心肌组织修复有关。
血管新生是一个多信号介导、多细胞参与调控的过程。akt/AMPK/eNOS信号通路在细胞的增殖、迁移、蛋白合成及血管生成等过程中起着十分重要的作用[18]。在心肌梗死再灌注损伤小鼠动物模型实验中,研究者发现腺苷及其受体通过akt信号通路发挥减少心肌再灌注损伤[19]。而替格瑞洛则可通过腺苷依赖的机制促进akt、AMPK及eNOS磷酸化[20]。但是替格瑞洛是否通过akt/AMPK/eNOS信号通路促进心肌梗死后血管生成从而发挥更大的心脏保护作用尚不清楚。本研究通过akt抑制剂Perifosine和AMPK抑制剂Dorsomorphin,初步探讨了akt/AMPK在AMI后小鼠心肌组织细胞中对于VEGF表达的影响。本研究证实akt/AMPK/eNOS轴的磷酸化水平与AMI后小鼠体内腺苷水平密切相关,并进一步影响后AMI后小鼠心肌组织中VEGF蛋白水平和mRNA水平表达。
综上所述,本研究证实替格瑞洛可通过调节AMI后小鼠体内腺苷表达,进而调节心肌组织细胞内VEGF的表达,与受损心肌的恢复与血管状态密切相关,对于促进血管新生、恢复AMI梗死区域的血供和挽救病理性损害的心肌细胞具有极其重要的意义。
利益冲突说明/Conflict of Intetests
所有作者声明不存在利益冲突。
伦理批准及知情同意/Ethics Approval and Patient Consent
本研究通过贵州省人民医院伦理委员会审批[伦理号:伦审(动物)2022-018],动物实验不涉及知情同意。
作者贡献/Author Contributions
何尤夫、刘微提出主要研究目标,负责研究的构思与设计,研究的实施,撰写论文,并对文章整体负责,监督管理;刘德斌、向世菊进行数据的收集与整理;李玲、姚琦进行统计学处理,图、表的绘制与展示;刘微进行论文的修订、文章的质量控制与审查。



