孙 祯,黄赤兵,宋亚军,陈益荣,李传贵
(第三军医大学新桥医院泌尿外科,重庆 400037)
Exosome是一种起源于内吞体系统并被排出胞外的膜性囊泡,直径在30~100nm[1],含有大量与其来源相关的特异性蛋白,并由此发挥不同的功能[2]。T淋巴细胞是免疫系统的重要组成部分,并且不同的亚群具有各异的免疫学功能。例如CD4+CD25+Terg细胞具有诱导免疫耐受的作用[3];而接触抗原活化后的效应T细胞则是介导细胞毒作用的参与者。因此,作为细胞信号转导与功能信使的exosome将有可能是Treg细胞进行远端免疫耐受调控及效应T细胞上调免疫应答的未知机制[4]。故获得高纯度和无蛋白丢失的exosome样本是进一步探寻其功能和组成的基础。为此,本研究通过3种方法提取T细胞分泌的exosome,并比较不同方法所得样本的差异,以找出最适提取exosome的方法,为后续的免疫学功能和蛋白质组成的研究奠定基础。
1 材料与方法
1.1 实验动物 雄性清洁级6~8周龄SD大鼠,购买于第三军医大学实验动物中心。
1.2 方法
1.2.1 主要试剂与仪器 ExoQuick Precipitation(美国SBI公司);重水、分析纯蔗糖(美国Sigma公司);BCA试剂盒(碧云天生物技术有限公司);载破片(海门市神鹰实验器材厂);超滤离心管100×103(美国 Millipore公司,Amicon Ultra);高速冷冻离心机(美国 BECKMAN COULTER,Avanti J-30I,转子JA-30.50T1);超高速冷冻离心机(日本 Hitachi,转子 S55A);透射电镜(日本 Hitachi,H-7500-TEM);垂直电泳仪(美国Biorad公司);影像分析扫描仪(美国Biorad公司,GS-800)。
1.2.2 细胞提取及培养 无菌取出大鼠的肠系膜淋巴结(Mln)于装有10mL RPM1640培养基(含10%胎牛血清)的玻璃培养皿中,用载破片毛玻面研磨组织得到细胞悬液,用100目筛网过滤后转至15mL离心管中。1800r/min离心5min,弃上清液,用10mL磷酸盐缓冲液(PBS)重悬后小心加入预先装有15mL淋巴细胞分离液的50mL离心管中,保持分界清楚,2500r/min离心20min,吸出云雾状细胞,即为淋巴细胞。将培养用胎牛血清在4℃条件下42000r/min离心70min出去内源性exosome,接种分离得到的T细胞于培养瓶中,覆盖以RPM1640培养基(内含10%胎牛血清,0.1%青霉素、链霉素),至于37℃、5%CO2孵箱内培养3d,收集上清液,-20℃保存备用。
1.2.3 exosome制备
1.2.3.1 ExoQuick Precipitation提取法(A法) 将收集的上清利用ExoQuick Precipitation进行提取[5]。收集细胞培上清10mL,4℃条件下,5500r/min离心15min取上清液,加入ExoQuick Precipitation 2mL,混匀后4℃过夜,3000r/min离心30min弃上清液,3000r/min离心5min弃残存液体,100μL PBS重悬,所得悬液包含exosome。以此法收集的标本代号为“A”。
1.2.3.2 超滤及密度梯度离心法(B法) 将收集的上清液进行超滤及密度梯度离心法收集exosome[6]。收集细胞培养上清液50mL,4℃条件下,800r/min离心30min取上清液,10000r/min离心30min取上清液,上清液加入100×103超滤管中3000r/min离心30min进行浓缩,将浓缩液转移至30 g/L的蔗糖重水垫上42000r/min离心70min,取出蔗糖重水用50mL PBS稀释后置于Amicon超滤管中3000r/min离心30min进行浓缩,所得滤液即包含exosome。以此法收集的标本代号为“B”。
1.2.3.3 差速离心法(C法) 将收集的上清进行差速离心法收集exosome[7]。收集细胞培养上清50mL,4℃条件下,800 r/min离心10min取上清液,4500r/min离心10min取上清液,10000r/min离心30min取上清液,42000r/min离心70 min取沉淀,PBS重悬后42000r/min离心70min取沉淀,100μL PBS重悬,所得悬液即包含exosome。以此法收集的标本代号为“C”。
1.2.4 exosome的鉴定分析
1.2.4.1 形态观察 取不同方法提取的exosome悬液30μL于载样铜网上,室温静置1min,用滤纸从侧面小心吸干液体,滴加20g/L的磷钨酸,室温复染1min,用滤纸从侧面小心吸干液体,白炽灯下烘烤5min,透射电镜观察、照相。
1.2.4.2 蛋白定量 将溶解稀释至0.5mg/mL的蛋白标准品按0、1、2、4、8、12、16、20μL加到96孔板中,将每孔体积用PBS补充到20μL;取3种样本溶液各8μL加入到上述96孔板中,分别设3个复孔,加入PBS补充到20μL;各孔加入工作液200μL,37℃放置30min后测定蛋白浓度。
1.2.4.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)检测 按照蛋白定量结果调整至上样终浓度相同,上样终体积为25μL,100℃煮沸5min,加样于上样孔内,浓缩胶80V,35min;分离胶100V,100min。结束后,使用0.25%考马斯亮蓝染液进行烤染1min,立即用摇床缓慢摇晃10min,脱色液脱色至条带明显,使用Biorad(GS-800)图像分析仪进行观察拍照。
1.2.4.4 Western blotting检测 将进过SDS-PAGE分离后的蛋白转至PVDF膜上,封闭后,一抗为兔抗鼠IL-2,4℃过夜孵育。二抗为辣根过氧化物酶标记的山羊抗兔抗体,室温孵育3h候进行显色并观察。
1.3 统计学处理 采用SPSS20.0软件进行统计学分析,计量资料以表示,对蛋白质浓度和操作时间进行单因素方差分析并进行Tukey显着性检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 细胞培养 取培养第3天的淋巴细胞照片,显微镜下可见细胞分布均匀,已铺满瓶底,细胞呈球形,核圆,胞质少。见图1。
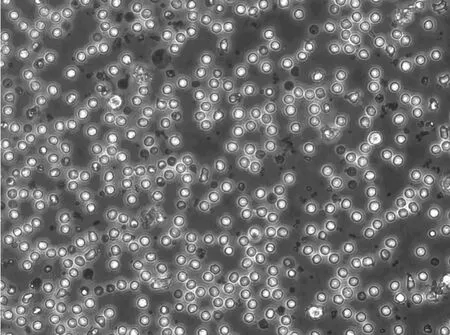
图1 淋巴细胞培养图(×200)
2.2 透射电镜 经透射电镜观察发现经3种方法提取T细胞培养上清中的exosome均具有以下形态特征:呈类圆形囊泡,囊泡外周可见其膜性结构,直径分布于30~100nm,可以单个分布,也可聚集成群,即为exosome。图2可见A、B法分离出的exosome背景清晰,exosome囊泡形态显着,分布均匀;C方法分离得出的exosome背景污染较为严重,单个囊泡形态显着者较少,多为成团出现,分布不均匀。

图2 3种方法所得exosome超微结构图(×93000)
2.3 操作时间比较 A方法平均耗时(14.8±1.42)h;B方法平均耗时(4.58±0.43)h;C方法平均耗时(6.75±0.53)h,A、B、C法的操作时间呈递减趋势,A法用时显着多余B、C法(P<0.05)。
2.4 蛋白定量 以BSA各级蛋白浓度对OD562处的吸光度值作图,得到标准曲线方程,以此得到A、B、C法提取exosome的蛋白浓度分别为:(2.18±0.09)μg/μL、(2.16±0.15)μg/μL、(1.67±0.17)μg/μL。其中 A、B法所得样本蛋白浓度均显着高于C法(P<0.05);A、B法所得样本蛋白浓度差异无统计学意义(P>0.05)。
2.5 SDS-PAGE电泳 蛋白质电泳图谱见图3:3种方法提取的同源exosome所含蛋白质种类丰富,且在蛋白表达强度上具有明显差异。
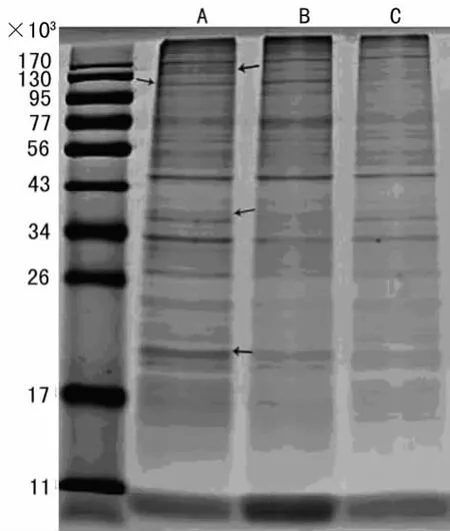
图3 3种方法所得样本SDS-PAGE电泳图
2.6 Western blotting结果 以β-actin为内参,检测白细胞介素2(IL-2)在3种方法提取出的exosome中的表达情况,见图4。ExoQuick Precipitation提取法(A)、超滤密度梯度离心法(B)、差速离心法(C)3种方法所得样本中均表达IL-2。
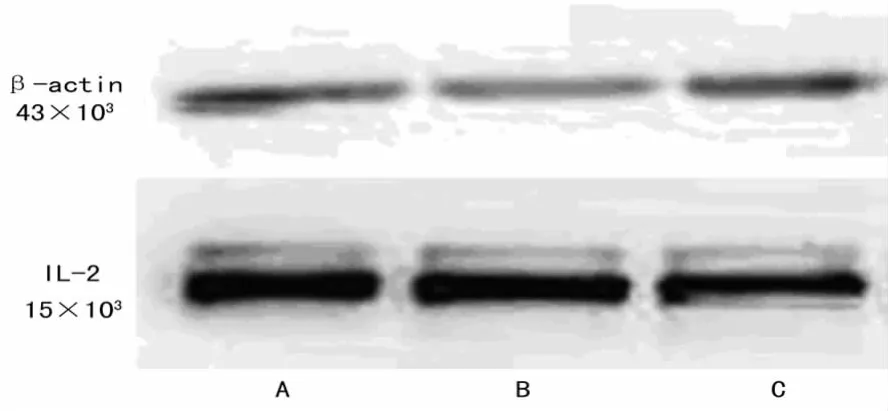
图4 Western blotting检测3种方法所得样本中IL-2的表达
3 讨 论
Exosome是一种可由多种细胞分泌的纳米级膜性囊泡,最早是在研究红细胞成熟时被发现[8]。随着研究的进展,还发现除红细胞之外的其他多种细胞均可分泌exosome,如B细胞、T细胞、树突状细胞、肥大细胞、肿瘤细胞等[9-11]。各种细胞来源的exosome小体均具有类似的结构:直径30~100nm,含有与其来源密切相关的蛋白质和功能性核酸分子[12-14]。
C法是传统的exosome提取方法,采用多步离心,分层去除污染物:800r/min与4500r/min分别离心10min以去除液体中残留细胞,10000r/min离心30min去除细胞碎片,第1次42000r/min离心70min沉淀下exosome和蛋白质聚合物,经过PBS重悬后进行第2次42000r/min,70min离心,得到沉淀为exosome[7]。此方法操作步骤繁琐,耗时长,易污染,不适合进行大量生产。超滤密度梯度离心(B法)最初由Henry等[16]建立,经过不断演变和改进发展至今,是由差速离心法演变而来,耗时段、成本低,并且能够有效的去除蛋白聚合物以及细胞凋亡时产生的核小体碎片而获得较高纯度的exosome样本[9]。ExoQuick Precipitation提取法(C法)是利用exosome的特异性提取试剂,根据免疫共沉淀原理进行exosome的提取,操作简便,能够获得高纯度的exosome样本[5],是1种较为新兴的提取方法。本研究首次以T细胞培养上清作为共同样本来源比较现行主要的3种exosome提取方法的操作耗时、样本电镜照片、样本蛋白质浓度、蛋白质表达种类以及特定细胞因子的表达情况。能够从提取步骤及结果分析层面有效的说明3种方法的优劣,从而可为接下来的蛋白质组成及功能学研究打下坚实的基础。从操作耗时分析,A法耗时显着高于B、C法。由电镜观察可得,C法所得样本单个囊泡形态显着者较少,多为成团出现,分布不均匀,背景浑浊;A、B法所的样本则exosome形态显着,分布均匀,背景清晰,其中A法所得样本密度高,视野中exosome囊泡数量众多。蛋白质浓度检测可得,A、B法所得样本浓度显着高于C法所得样本。已有文献报道差速离心法会导致部分蛋白质的丢失[5],而本研究的结果与其一致。SDS-PAGE结果显示,3种方法所得样本含蛋白种类繁多。通过 Western blotting检测可知3种样本均有IL-2的表达。综上所述,传统的差速离心法会造成exosome蛋白丢失、囊泡破损以及相互融合等现象;而超滤密度梯度离心法和ExoQuick Precipitation提取法则能获得高纯度、无蛋白丢失、样本保持完好的exosome囊泡,考虑到提取成本,则B方法更适合进行批量提取。
[1]Pfeffer SR.Two rabs for exosome release[J].Nat Cell Biol,2010,12(1):3-4.
[2]Simpson RJ,Lim JW,Moritz RL,et al.Exosome:proteomic insights and diagnostic potential[J].Expert Rev Proteomics,2009,6(3):267-283.
[3]Wood KJ,Sakaguchi S.Regulatory T cells in transplantation tolerance [J].Nat Rev Immunol,2003,3(3):199-210.
[4]Camussi G,Deregibus MC,Bruno S,et al.Exosomes/microvesicles as a mechanism of cell-to-cell communication[J].Kidney Int,2010,78(9):838-848.
[5]Douglas DT,Wolfgang Z,Cicek GT.Serum/Plasma Proteomics[M].Australia:Ludwig Institute for Cancer Research Ltd,2011:235-246.
[6]Lamparski HG,Met ha-Damani A,Yao JY,et al.Production and characterization of clinical grade exosomes derived from dendritic cells[J].Immunol Meth,2002,270(2):211-226.
[7]Clotilde T,Aled C,Sebastian A,et al.Isolation and characterization of exosomes from cell culture supernatants and biological fluids[J].Cell Biology,2006,3(22):1-29.
[8]Johnstone RM,Adam M,Hammond JR,et al.Vesicle from action during reticulocye maturation.Association of plasma membrane activities with released vesicles(exosomes)[J].J Biol Chem,1987,262(19):9412-9420.
[9]Thery C,Zitvogel L,Amigorena S.Exosomes:composition,biogenesis and function[J].Nat Rev Immunol,2002,2(8):569-579.
[10]Pant S,Hilton H,Burczynski ME.The multifaceted exosome:Biogenesis,role in normal and aberrant cellular function,and frontiers for pharmacological and biomarker opportunities[J].Biochem Phar,2012,83(11):1484-1494.
[11]Zakharova L,Svetlova M,Fomina AF.T cell exosomes induce cholesterol accumulation in human monocytes via phosphatidylserine receptor[J].J Cell Physiol,2007,212(1):174-181.
[12]Nazarenko I,Rana S,Baumann A,et al.Cell surface tetraspanin Tspan8contributes to molecular pathways of exosome-induced endothelial cell activation[J].Cancer Res,2010,70(4):1668-1678.
[13]Ashiru O,Boutet P,Fernández-Messina L,et al.Natural killer cell cytotoxicity is suppressed by exposure to the human NKG2Dligand MICA*008that is shed by tumor cells in exosomes[J].Cancer Res,2010,70(2):481-489.
[14]Pegtel DM,Cosmopoulos K,Thorley-Lawson DA,et al.Functional delivery of viral miRNAs via exosomes[J].Proc Natl Acad Sci USA,2010,107(14):6328-6333.
[15]Henry GL,Anita MD,Sanjay P,et al.Production and characterization of clinical grade exosomes derived from dendritic cells[J].J Immunol Methods,2002,270(2):211-226.



