陈国柱,覃 军,余 洁,郭文昀,董俊清,卢 巍,曾 颖,黄 岚
(第三军医大学新桥医院心血管内科/全军心血管病研究所,重庆 400037)
快速上升到2500米以上海拔可能会导致急性高原病(acute mountain sickness,AMS)、高原性脑水肿(high altitude cerebral edema,HACE)或高原性肺水肿(high altitude pulmonary edema,HAPE)[1]。AMS是一系列非特异性和主观的症状。其定义为近期进入到2500m以上海拔的个体,不能适应环境的变化,发生头痛及以下症状:胃肠道症状(食欲不振、恶心、呕吐);失眠、头晕、疲劳等[2]。目前根据不同的海拔高度,分为一般高海拔(1500~3500m),非常高海拔(3500~5500 m)和极端海拔(>5500m)[3]。在海拔3000~3950m高原,AMS的发病率在10%~36%[4-6]。中国是世界上高原面积最大的国家之一,AMS不仅损害人体的健康,也影响高原的旅游经济、军事及灾难救援等工作[7-8]。
低氧模拟舱研究发现,50%的最大极量运动负荷可能会加重机体缺氧,使头痛症状加剧和增加AMS发病率[9]。但在常压缺氧环境下(模拟4800m海拔),50%最大极量运动负荷没有明显增加缺氧暴露5、8、18h后AMS发病率[10]。上述两项研究的时间段皆小于缺氧暴露后18h。因此,更长时间的高原暴露及习服后,运动对AMS发生的影响尚不清楚。极端高原环境下的极量运动能够降低血氧饱和度(SpO2)[11]。现场研究也发现成年人及青少年在高原极量、亚极量运动后,其SpO2降低[12],AMS患者中这种降低更加明显[13]。但是,以较缓和的方式进入较低的一般高海拔(<3500m),低于亚极量运动负荷的适度运动对AMS的发病率及头痛症状的影响尚无报道。本课题组设计了以下的试验,以调查经火车进入3200m高原并停留2晚后,适度运动对年轻成人AMS发病率的影响。
1 资料与方法
1.1 一般资料 本研究共招募91名、久居平原的年轻成年男性,年龄(24.27±3.67)岁,身高 (173.79±5.55)cm,体质量(68.51±7.83)kg,体质量指数(22.62±1.92)kg/m2。
1.2 方法 受试者于2011年6月10日凌晨1:00从西安市出发(345m)乘火车经西宁市(2295m,停留8h)到青海省格尔木市。然后换乘汽车,于6月12日凌晨1:00到达格尔木市西北40km处驻地(3200m)。高原暴露2晚后,受试者进行步行5km运动。在运动前、后分别进行问卷调查。
7名内科医生进行1对1问卷量表填写及体检,检测血压、心率和外周SpO2(便携式血氧饱和度仪,Nonin Medical,Inc.美国)。步行速度为2~2.5km/h。途中随机抽取7名受试者进行心率和SpO2监测。根据平板运动试验指南,运动分为极量、亚极量运动等。受试者在运动中达到最大心率(maximum heart rate,MHR)时的运动为极量运动,而运动量等于85%、50%最大心率均为亚极量运动。根据平均年龄,受试者在高原适度运动,步行中平均心率控制在MHR的50%以下,低于96次/分。最大心率的计算公式:MHR=208-(0.7×年龄)[14]。
所有受试者在测量前都坐位休息30min。测试当日的气温为11~24℃,晴天。本试验获得第三军医大学新桥医院伦理委员会审批,每名受试者被充分告知,并签订了知情同意书。
1.3 问卷和评分系统 本课题组采用路易斯湖评分(Lake Louise Score,LLS)量表,含5项主要症状,症状按无、轻、中、重对应评分0~3分。头痛伴其他症状,LLS评分≥3分者诊断AMS,≥5分者诊断重度AMS(表1)。受试者在测试前完成人口学数据调查(年龄、性别、职业、身高、体质量、吸烟、饮酒史)。吸烟分为从不、曾经、目前吸烟,各自对应评分1~3分。
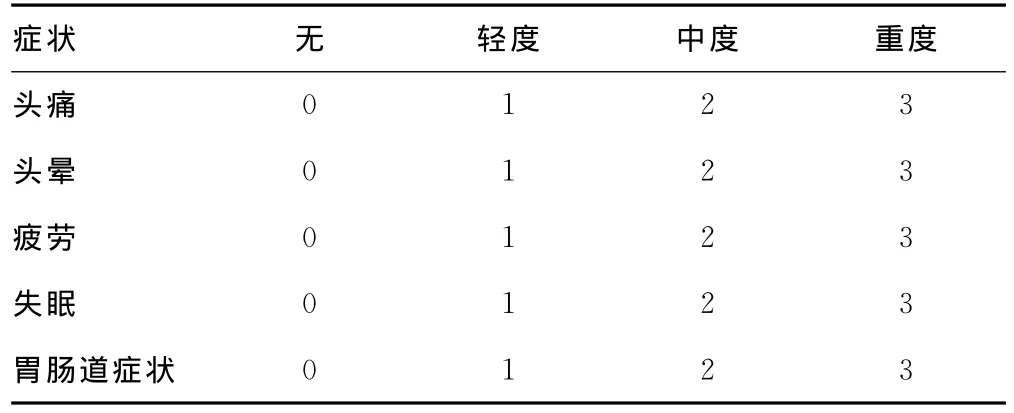
表1 LLS评分系统的症状及分级(n)
1.4 统计学处理 数据分析采用SPSS19.0统计软件。计量资料采用表示。两组间的计量资料比较应用t检验。计数资料采用率表示。症状分析应用非参数分析和Kruskal-Wallis test检验。等级资料应用交叉表和χ2检验。相关性分析采用Pearson和Spearman方法。以P<0.05为差异有统计学意义。
2 结 果
2.1 运动前后的AMS发病率比较 7名受试者因数据不全被排除最终分析。运动前后的AMS发病率分别为20.24%和11.90%(P=0.141)。头痛症状的发生率从运动前35.70%降至22.60%(P=0.045)。头晕、胃肠道及疲劳症状在运动前后差异无统计学意义(P>0.05),见表2。
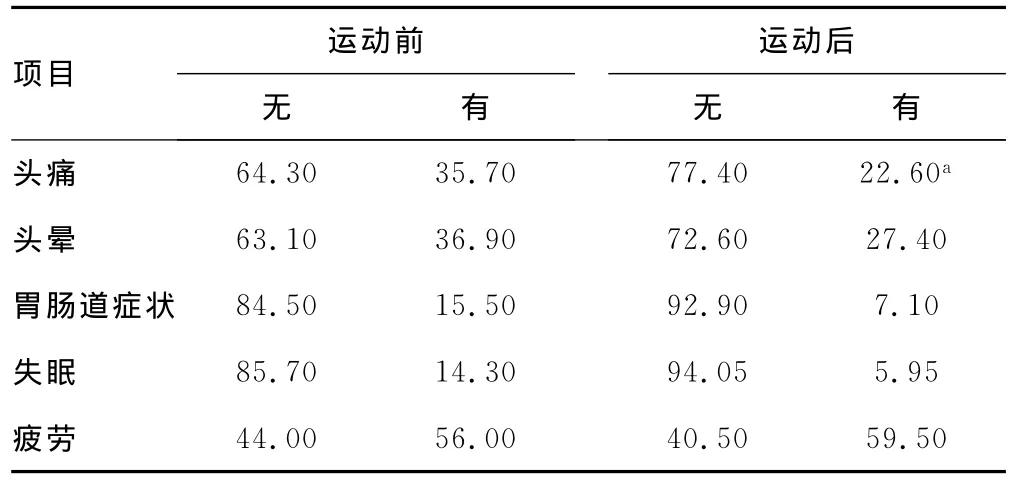
表2 运动前后症状比较(%)
2.2 运动前后生命体征与LLS评分比较 步行5km后心率从(73.83±9.96)次/分增至(84.31±12.55)次/分(P<0.05),收缩压从(128.86±13.93)mm Hg降至(124.48±13.13)mm Hg(P<0.05),SpO2水平从(92.80±2.25)% 降 至(89.94±2.45)%(P<0.05)。舒张压无明显变化(P>0.05)。LLS评分从(1.75±1.50)分降低至(1.40±1.33)分(P<0.05),见表3。不管是运动前或运动后,AMS与非AMS受试者之间的心率、SpO2和血压比较无统计学意义(P>0.05)。
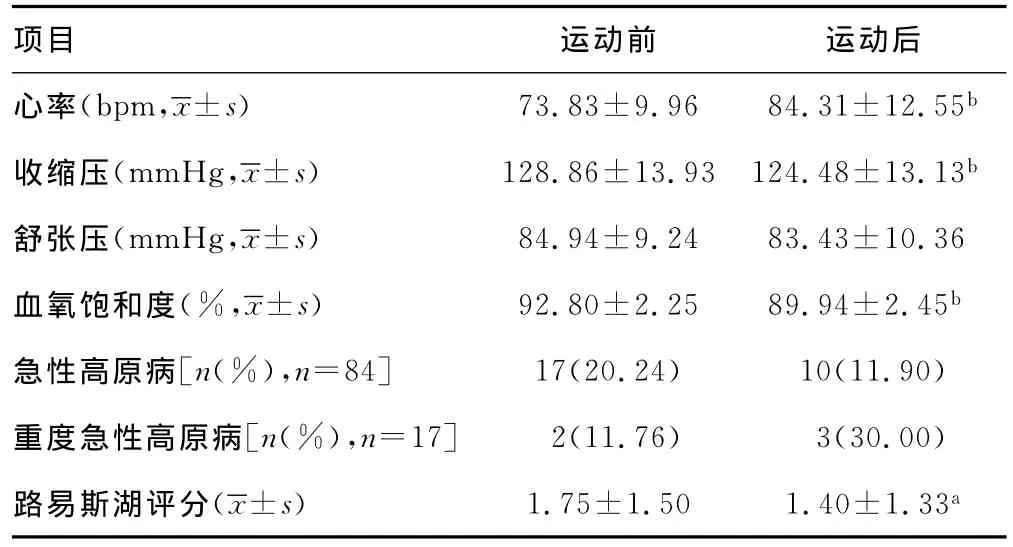
表3 运动前后生命体征、急性高原病发病率和路易斯湖评分比较
2.3 吸烟与AMS评分、头痛的相关性研究 受试者中从不、曾经、目前吸烟的比率分别为61.9%、11.9%和26.2%。运动前后,吸烟史与LLS成绩呈负相关(r=-0.218,P=0.046;r=-0.240,P=0.028)。吸烟史与运动前后的头痛及SpO2均无相关性(P>0.05)。
2.4 SpO2与AMS评分的相关性研究 不管是运动前还是运动后,AMS评分与SpO2无相关性(P=0.132、0.086)。
3 讨 论
本研究显示,通过火车及汽车较缓慢进入3200m高原,步行5km后,头痛症状,收缩压和SpO2降低,心率增加,其他症状以及舒张压无明显变化。运动后AMS的发病率降低但无统计学意义。吸烟史与AMS成绩呈负相关,但SpO2与AMS成绩无明显相关性。
通过火车进入海拔3200m,AMS的发病率为20.24%,与以前的研究类似[3-5,15]。但步行5km后AMS发病率有降低的趋势,这结果与Roach等[9]的研究并不一致,以下是导致与本课题研究结果不一致的可能原因:(1)Roach的研究与本研究海拔高度不同(4800mvs.3200m)以及不同的运动负荷,可能导致试验结果不一致;(2)此外,模拟舱与现场研究并不完全相同,以及他们在缺氧暴露10h内即进行了AMS评分,明显早于本研究;(3)本研究受试者采用的方式是较为缓慢的火车,并在3200m停留2夜,因此受试者习服时间明显超过模拟舱研究;(4)本研究受试者长期居住在平原地区,与之相反,Roach等[9]的受试者居住在1600~1800m海拔,而不同海拔的居民对模拟舱的低氧反应完全不同。最近在常压低氧的模拟舱试验中,适度的运动并不增加AMS的发病率[10],本现场研究结果发现,步行5km能够改善头痛症状,降低LLS评分,这说明在3200m海拔,适度运动可能对高原习服有一定有益的作用。但必须指出,运动前的评分测试是在早上8点,当时气温为11℃,而运动后的测试为下午,气温为24℃,因此早晨较高的AMS发病率可能有部分寒冷的因素[16-17]。
既往研究发现,在极端海拔运动是高原性头痛和发生AMS的一个危险因素[18]。运动后SpO2降低的水平为AMS发生的一个预测因素[19]。尽管本研究结果提示运动后SpO2降低,与以前的研究类似[19-20],但头痛症状较运动前降低。高原性头痛的具体机制目前尚未完全阐述清楚,可能与三叉血管系统(trigeminovascular system)及中枢神经系统对低氧的反应有关。根据“tight fit hypothesis”,缺氧导致脑水肿是导致头痛、AMS、HACE的可能机制之一[1-2,21]。对高原低氧的过度通气反应以及吸入高原干燥空气可通过通气导致大量不显性失水。运动更增加呼吸的频率,加上运动后出汗,明显增加脱水[22-25]。因此猜测在高原步行出汗可能导致机体更加脱水,降低血容量,从而降低低氧导致的脑水肿,缓解头痛症状。
本研究结果显示吸烟的状况与AMS评分呈负相关,与Wu等[26]的研究一致,这结果提示吸烟者在缓慢进入3200m后发生AMS的可能性较不吸烟者小。而SpO2在吸烟与不吸烟的个体中差异无统计学意义,提示在3200m海拔,吸烟可能并未影响全身的缺氧情况。
与 O'Connor等[27]及 Karinen等[5]的研究一致,本研究发现不管是运动前或运动后,AMS与SpO2水平差异并无统计学意义。并且,在AMS与非AMS个体中,SpO2水平差异亦无统计学意义,说明至少在3200m海拔,SpO2水平并不是AMS的一个预测因素。
综上所述,在3200m海拔步行5公里能够降低SpO2及收缩压,升高HR。但是,适度运动能够改善头痛,并且有降低AMS发生的趋势。
志谢:本课题组衷心感谢高旭滨教授对课题设计、讨论部分的指导,李明、卞世柱博士、刘曦、丁晓涵、刘阳、李双菲医生等收集、整理数据;衷心感谢本次试验受试者的参与及解放军第二十二医院的大力帮助。
[1]Hackett PH,Roach RC.High-altitude illness[J].N Engl J Med,2001,345(2):107-114.
[2]Roach RC,Bärtsch P,Hackett PH,et al.The Lake Louise acute mountain sickness scoring system.Hypoxia and Molecular Medicine[C].In Proceedings of the 8th International Hypoxia Symposium,Burlington,Canada,1993:272-274.
[3]Imray C,Wright A,Subudhi A,et al.Acute mountain sickness:pathophysiology,prevention,and treatment[J].Prog Cardiovasc Dis,2010,52(6):467-484.
[4]Vardy J,Vardy J,Judge K.Acute mountain sickness and ascent rates in trekkers above 2500min the Nepali Himalaya[J].Aviat Space Environ Med,2006,77(7):742-744.
[5]Karinen HM,Peltonen JE,Kähänen M,et al.Prediction of acute mountain sickness by monitoring arterial Oxygen saturation during ascent[J].High Alt Med Biol,2010,11(4):325-332.
[6]Wang SH,Yc C,Kao WF,et al.Epidemiology of acute mountain sickness on Jade Mountain,Taiwan:an annual prospective observational study[J].High Alt Med Biol,2010,11(1):43-49.
[7]Norris JN,Viirre E,Aralis H,et al.High altitude headache and acute mountain sickness at moderate elevations in a military population during battalion-level training exercises[J].Mil Med,2012,177(8):917-923.
[8]Wu T.Mountain rescue:the highest earthquake in Yushu[J].High Alt Med Biol,2011,12(1):93-95.
[9]Roach RC,Maes D,Sandoval D,et al.Exercise exacerbates acute mountain sickness at simulated high altitude[J].J Appl Physiol,2000,88(2):581-585.
[10]Schommer K,Hammer M,Hotz L,et al.Exercise intensity typical of mountain climbing does not exacerbate acute mountain sickness in normobaric hypoxia[J].J Appl Physiol,2012,113(7):1068-1074.
[11]West JB,Boyer SJ,Graber DJ,et al.Maximal exercise at extreme altitudes on Mount Everest[J].J Appl Physiol,1983,55(3):688-698.
[12]Imray CH,Myers SD,Pattinson KT,et al.Effect of exercise on cerebral perfusion in humans at high altitude[J].J Appl Physiol,2005,99(2):699-706.
[13]Major SA,Hogan RJ,Yeates E,et al.Peripheral arterial desaturation is further exacerbated by exercise in adolescents with acute mountain sickness[J].Wilderness Environ Med,2012,23(1):15-23.
[14]Tanaka H,Monahan KD,Seals DR.Age-predicted maximal heart rate revisited[J].J Am Coll Cardiol,2001,37(1):153-156.
[15]Honigman B,Theis MK,Koziol-McLain J,et al.Acute mountain sickness in a general tourist population at moderate altitudes[J].Ann Intern Med,1993,118(8):587-592.
[16]Maresh CM,Noble BJ,Robertson KL,et al.Maximal exercise during hypobaric hypoxia(447Torr)in moderatealtitude natives[J].Med Sci Sports Exerc,1983,15(5):360-365.
[17]Milledge JS.Altitude medicine and physiology including heat and cold:a review[J].Travel Med Infect Dis,2006,4(3/4):223-237.
[18]Burtscher M,Mairer K,Wille M,et al.Risk factors for high-altitude headache in mountaineers[J].Cephalalgia,2011,31(6):706-711.
[19]Richalet JP,Larmignat P,Poitrine E,et al.Physiological risk factors for severe high-altitude illness:aprospective cohort study[J].Am J Respir Crit Care Med,2012,185(2):192-198.
[20]Lazio MP,Van Roo JD,Pesce C,et al.Postexercise peripheral Oxygen saturation after completion of the 6-minute walk test predicts successfully reaching the summit of Aconcagua[J].Wilderness Environ Med,2010,21(4):309-317.
[21]Ross RT.The random Nature of cerebral mountain sickness[J].Lancet,1985,1(8435):990-991.
[22]Singh MV,Rawal SB,Tyagi AK.Body fluid status on induction,reinduction and prolonged stay at high altitude of human volunteers[J].Int J Biometeorol,1990,34(2):93-97.
[23]Robach P,Lafforgue E,Olsen NV,et al.Recovery of plasma volume after 1week of exposure at 4350m[J].Pflugers Arch,2002,444(6):821-828.
[24]Robach P,Déchaux M,Jarrot S,et al.Operation EverestⅢ:role of plasma volume expansion on VO(2)(max)during prolonged high-altitude exposure[J].J Appl Physiol,2000,89(1):29-37.
[25]Palmer BF.Physiology and pathophysiology with ascent to altitude[J].Am J Med Sci,2010,340(1):69-77.
[26]Wu TY,Ding SQ,Liu JL,et al.Smoking,acute mountain sickness and altitude acclimatisation:a cohort study[J].Thorax,2012,67(10):914-919.
[27]O'connor T,Dubowitz G,Bickler PE.Pulse oximetry in the diagnosis of acute mountain sickness[J].High Alt Med Biol,2004,5(3):341-348.



