王卒平,刘启蒙,张冬青,况 勇
(重庆医药高等专科学校 404100)
骨关节炎(osteoart hritis,OA)是一种常见的老年外科疾病,其主要临床表现为关节软组织的变性、破坏以及骨质增生,常引起老年患者关节疼痛,严重时影响其日常行动,使老年患者的生命质量严重下降。OA在临床上的治疗目前仍是一个难题,一般患者病情发展到终末期需行关节置换术,手术的创伤和经济负担常给患者及其家庭带来巨大压力[1]。而除了手术之外更加行之有效的药物治疗尚不明确,本文通过探讨人乳铁蛋白(h LF)在OA软骨细胞外蛋白激酶(ERK)表达与促进细胞增殖和活力中的作用,旨在为临床治疗OA,尤其是早期药物治疗提供新的治疗方向,现报道如下。
1 资料与方法
1.1 一般资料 8例OA患者,其中男6例,女2例,年龄55~65岁,平均(59.79±7.91)岁。所有患者均经过重庆医药高等专科学校相关实习医院骨外科的相关检查和诊断,根据中华医学会骨科分会《骨关节炎诊治指南(2007年版)》明确诊断为OA[2]。所有患者均在本院行关节置换术,将软骨组织取下,置入脱酶处理的EP管,液氮转移至-80℃冰箱保存备用。选取患者的软骨组织进行人关节软骨细胞分离和体外培养。上述试验经过医学伦理委员会的批准,所有患者均签署知情同意书。试验所用材料如下:h LF(英国Sig ma公司生产),Ⅱ型胶原酶(英国Paisley公司生产),胎牛血清(FBS)(英国Biowest公司生产),LIVE/DEAD试剂盒(荷兰Molecular Probes公司生产),All Prep DNA/RNA/Protein试剂盒(英国Qiagen Lld公司生产),DNA转录试剂盒(美国Applied Biosystems公司生产),i Cycler(英国Bio-Rad Labora-tories Ltd公司生产),噻唑蓝(MTT)、磷酸盐缓冲液(PBS)、胰蛋白酶、乙二胺四乙酸(EDTA)均由美国Cambrex Bioseience公司生产,ERK、磷酸化ERK抗体和荧光标记二抗均由英国R&D公司生产。
1.2 方法 取直径为1 mm,厚度为1 mm的人关节软骨组织,用Ⅱ型胶原酶进行消化,浓度为300 U/mL,于37℃水浴中震荡(75 r/min),消化时间为16 h。取胰蛋白酶与EDTA液配制而成的消化液加入FBS培养液进行培养,至原代细胞生长超过瓶底80%时,加入胰蛋白酶消化液,传代培养,取第2代体外培养细胞进行试验。将体外培养关节软骨细胞培养液接种于96孔培养板上,培养24 h后分别加入12.5、25.0、50.0、100.0、200.0 mg/L的h LF。并设置空白对照组,即h LF浓度为0。每组设6个复孔,培养后离心取细胞液用MTT法检测关节软骨细胞的增殖力,用LIVE/DEAD染色检测h LF对关节软骨细胞活力的影响,用实时定量PCR(RT-PCR)检测ERK mRNA的表达[3]。
1.3 统计学处理 采用SPSS15.0软件进行统计分析,计量数据以±s表示,组间比较采用t检验,多个样本之间的比较采用One-Way ANOVA方差分析,P<0.05为差异有统计学意义。
2 结 果
通过MTT法检测关节软骨细胞的增殖力,结果显示h LF对人关节软骨细胞的增殖力具有促进作用,且具有显着的浓度依赖性,差异有统计学意义(P<0.05),见表1。用LIVE/DEAD染色检测关节软骨细胞的活力,结果显示h LF对人关节软骨细胞的活力具有促进作用,差异有统计学意义(P<0.05),见表2、图1。通过RT-PCR检测ERK mRNA的表达,结果显示h LF能增加人关节软骨细胞的ERK mRNA的表达,差异有统计学意义(P<0.05),见表3。

表1 h LF对人关节软骨细胞增殖力的影响
表2 h LF对人关节软骨细胞活力的影响(±s,%)
组别 样本例数 关节软骨细胞存活细胞比率对照组16 83.71±5.73试验组16 99.52±3.85
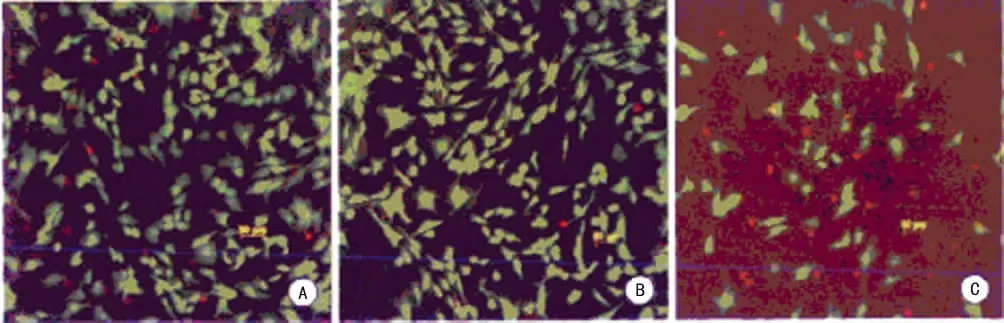
图1 h LF对关节软骨细胞活力的促进作用(LIVE/DEAD染色×20)
表3 h LF对人关节软骨细胞的ERK mRNA 表达影响(±s)

表3 h LF对人关节软骨细胞的ERK mRNA 表达影响(±s)
组别 样本例数 ERK mRNA 相对表达量对照组16 1.013±0.021试验组16 1.764±0.123
3 讨 论
OA是一种常见的老年慢性骨科疾病,其具体的发病机制尚未阐明清楚,主要表现为关节软组织的变性、破坏及骨质增生等病理性改变,是引发老年人关节疼痛的常见原因之一,严重时可影响其日常行动,降低老年患者的生存质量[4]。一般患者病情发展到终末期导致患者行动受限,则需行关节置换术,而早期积极的药物治疗研究仍未取得重大的进展和突破[5]。OA是一个复杂的发病过程,传统观点认为软骨基质的合成和降解失衡造成软骨细胞肥大变化、终末分化直至矿化等变化过程,软骨细胞合成分泌的蛋白多糖和胶原类型也随之发生改变,同时产生一定的增殖能力,进而导致OA发病[6]。但近年研究显示:丝分裂原激活蛋白激酶(MAPK)-ERK1/2信号通路在OA软骨细胞中的表达水平明显上调,且在软骨组织中也存在显着上调趋势,表明ERK1/2在调控OA软骨细胞病理改变中起到重要作用[7]。而MAPK在关节软骨的退变和OA的病程中发挥了重要作用,其磷酸化可能是软骨细胞受到刺激后的早期事件[8]。因此调节人类关节软骨退变中的MAPK信号转导通路,对OA的治疗具有重要意义。
软骨细胞是软骨组织中惟一的细胞,在合成和分解胶原、蛋白聚糖等细胞外基质中以及维持软骨组织相关功能方面具有重要的作用[9]。经过相关的病理检查可以发现,OA患者的软骨细胞发生了一系列的病理改变,包括肥大、增生、矿化等,使其正常的生理功能也发生了改变,导致软骨增生,引发病变[10]。而h LF是一种天然的具有免疫功能的多功能蛋白质,其主要生理功能包括抗氧化、抗感染、抗癌等调节免疫系统的功能[11]。近些年的研究显示h LF还表现出调控细胞增殖的功能,所以本文以此为线索,展开h LF对人关节软骨细胞增殖力及活力影响的探究[12]。
本试验表明,(1)h LF对人关节软骨细胞的增殖力具有促进作用,且具有显着的浓度依赖性,说明h LF通过显着促进关节软骨细胞的增殖力,可能在OA患者软骨的修复中起到重要作用。(2)h LF对关节软骨细胞的活力具有促进作用。(3)h LF能增加关节软骨细胞的ERK mRNA的表达,已知ERK属于MAPK家族中的一个亚族,由ERK1和ERK2两种异构体组成,在软骨细胞增殖、凋亡、转化、分化中有重要作用,可以促进软骨细胞中Ⅱ型胶原、整合素β1和软骨蛋白多糖的表达。本文研究提示h LF可能通过上调ERK基因表达而促进关节软骨细胞的增殖,进而在OA的治疗中起到重要作用。
综上所述,h LF能够上调ERK mRNA的表达,促进关节软骨细胞的增殖力与活力。临床上可以此为线索进一步研究OA的发病机制,寻找更有效的治疗方法。
[1]涂意辉,薛华明,夏志道,等.乳铁蛋白对骨关节炎软骨细胞增殖活力及细胞外调节蛋白激酶表达的影响[J].中华实验外科杂志,2012,29(7):1242-1244.
[2]郝锋,林剑浩.解读《骨关节炎诊治指南(2007年版)》[J].中国临床医生,2010,38(7):69-71.
[3]程亮,赵洪海,曾国庆,等.Akt与ERK1/2在人骨关节炎软骨细胞中的表达[J].中国病理生理杂志,2012,28(5):889-894.
[4]封丽,邓大平.乳铁蛋白的生理功能及研究进展[J].中国辐射卫生,2012,21(1):121-124.
[5]张文贤,王小燕,冯康虎,等.创伤性骨关节炎软骨细胞损坏与修复机制[J].中国组织工程研究,2012,16(46):8727-8732.
[6]马钢,任明姬.骨性关节炎软骨细胞凋亡的研究[J].中国组织化学与细胞化学杂志,2012,21(2):196-200.
[7]Pierce A,Legrand D,Mazurier J.Lactoferrin:a multifunctional protein[J].Med Sci(Paris),2009,25(3):361-369.
[8]Prasadam I,Friis T,Shi W,et al.Osteoarthritic cartilagechondrocytes alter subchondral bone osteoblast differentiation via MAPK signalling pathway involving ERK1/2[J].Bone,2010,46(1):226-235.
[9]马春辉,阎作勤,郭常安,等.Ⅱ型胶原与Bcl-2在骨关节炎软骨细胞中的表达[J].中国矫形外科杂志,2012,20(19):1786-1789.
[10]Wang X,Li F,Fan C,et al.Effects and relationship of ERK1and ERK2 in interleukin-1β-induced alterations in MMP3,MMP13,typeⅡcollagen and aggrecan expression in human chondrocytes[J].Int J Mol Med,2011,27(4):583-589.
[11]Zhang W,Nuki G,Moskowitz RW,et al.OARSI recommendations for the management of hip and knee osteoarthritis:partⅢ:Changes in evidence following systematiccumulative update of research published through January2009[J].Osteoarthritis Cartilage,2010,18(4):476-499.
[12]Hayashi S,Nishiyama T,Miura Y,et al.DcR3 inducescell proliferation through MAPK signaling in chondrocytes of osteoarthritis[J].Osteoarthritis Cartilage,2011,19(7):903-910.



