王静怡 江学良 欧阳建东※
(1.山东中医药大学中医学院,山东 济南 250014;2.山东中医药大学第二附属医院消化中心,山东 济南 250000)
胃溃疡(Gastric ulcer,GU)是指胃壁的黏膜防御功能破损,被幽门螺杆菌(Hp)感染就会出现溃疡。GU引发胃酸分泌过多,造成胃部血管和微血管损伤,进而导致胃黏膜缺血,严重时造成组织坏死[1]。GU 发病率逐年升高,Hp 感染是GU 发病的关键因素,因此有效抑制Hp 感染、修复胃黏膜为临床治疗本病的要点[2]。近年来,中医药治疗Hp感染性GU 的临床效果显着[3],本文采用乌贝止溃汤联合西药治疗Hp 感染性GU,现报道如下。
1 资料与方法
1.1 一般资料选取山东中医药大学第二附属医院就诊的Hp 感染性GU 患者102 例作为研究对象,按照随机数字表法分为治疗组与对照组,各51 例。治疗组男21例,女30 例;平均年龄(38.88±8.16)岁;平均病程(5.51±1.52)年。对照组男27 例,女24 例;平均年龄(37.76±9.02)岁;平均病程(6.02±1.87)年。2 组患者一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 诊断标准
1.2.1 西医诊断标准GU 诊断标准参照《消化性溃疡病诊断与治疗规范》[4]制定;Hp感染诊断标准参照《幽门螺杆菌感染基层诊疗指南(2019年)》[5]制定。
1.2.2 中医诊断标准中医诊断参照《消化性溃疡中医诊疗专家共识意见(2017)》[6]肝胃不和证型制定:主症为胃脘胀满或疼痛,两胁胀满。次症为情志不畅,心烦,嗳气频作,纳少。
1.3 入选标准纳入标准:患者签署知情同意书。排除标准:(1)合并多脏器功能衰竭及存在肝功能、肾功能异常;(2)对口服三联抗感染药物及乌贝止溃汤过敏;(3)合并肝癌、胃癌等恶性肿瘤;(4)治疗前1 个月服用其他相关药物;(5)孕妇及哺乳期女性。
1.4 治疗方法
1.4.1 对照组给予西医常规治疗,包括改善生活方式如戒烟酒,避免饮用咖啡、浓茶等。口服阿莫西林胶囊(珠海联邦制药股份有限公司中山分公司,国药准字H20003263,规格:每粒0.5 g),每次2 粒,每天3 次;口服克拉霉素片(上海雅培制药有限公司,国药准字H20033044,规格:每片0.25 g),每次1 片,每天2 次;口服泮托拉唑钠肠溶胶囊(杭州中美华东制药有限公司,国药准字H20010032,规格:每粒40 mg),每次1粒,每天2次。饭后服用,服用2周后停药。
1.4.2 治疗组在对照组基础上给予乌贝止溃汤加减治疗。组成:海螵蛸20 g,浙贝母10 g,延胡索20 g,木香10 g,砂仁10 g,三七粉(包煎)3 g,香附12 g,北柴胡12 g,川芎9 g,陈皮12 g,枳壳15 g,白芍9 g,炙甘草6 g。加减:见心烦较重者,加栀子12 g,蜜百合12 g;见口干较重者,加麦冬12 g,北沙参9 g,玉竹12 g;见反酸较重者,加龙骨20 g,瓦楞子12 g。日1剂,水煎400 mL,分早晚2 次饭后温服,每次200 mL。口服西药2周,同时口服乌贝止溃汤6周。
1.5 观察指标及疗效评价标准
1.5.1 临床疗效临床疗效评定标准参照《中药新药临床研究指导原则》[7]:显效:胃镜示胃部溃疡面消失且症状改善,中医证候积分减少≥70%;有效:胃镜示胃部溃疡面缩小50%以上,30%≤中医证候积分减少<70%;无效:胃镜示胃部溃疡面较前未变化甚至加重。总有效率=(显效+有效)例数/总例数×100%。
1.5.2 中医证候积分中医证候积分评定方法参照《胃肠疾病中医症状评分表(中国中西医结合学会消化系统疾病专业委员会,2010,苏州)》[8]有关标准制定:主症为胃脘胀满或疼痛、两胁胀满,依据无、轻、中、重计0、2、4、6 分。次症为情志不畅、心烦、嗳气频作、纳少,依据无、轻、中、重计0、1、2、3分。
1.5.3 实验室检查指标分别于治疗前后采集2 组患者清晨空腹静脉血10 mL,离心留取血清待测。使用酶联免疫吸附法对胃蛋白酶原Ⅰ(PGⅠ)、胃蛋白酶原Ⅱ(PGⅡ)、白细胞介素-6(IL-6)、C 反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)水平进行检测;使用放射免疫法对胃泌素(Gastrin,GAS)、胃动素(Motilin,MTL)水平进行检测。试剂盒由上海名劲生物科技有限公司提供。
1.6 统计学方法采用SPSS 24.0 统计软件进行统计分析,符合正态分布的计量资料以(±s)表示,组内比较采用t检验;计数资料以率(%)表示,比较采用x2检验。P<0.05为差异有统计学意义。
2 结果
2.1 2 组患者临床疗效比较治疗组临床总有效率为86.27%(44/51),高于对照组的68.63%(35/51),差异有统计学意义(P<0.05)。见表1。

表1 2组Hp感染性GU患者临床疗效比较
2.2 2 组患者中医证候积分比较治疗后,2 组患者的中医证候积分均较治疗前降低,且治疗组低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 2组Hp感染性GU患者中医证候积分比较(±s,分)
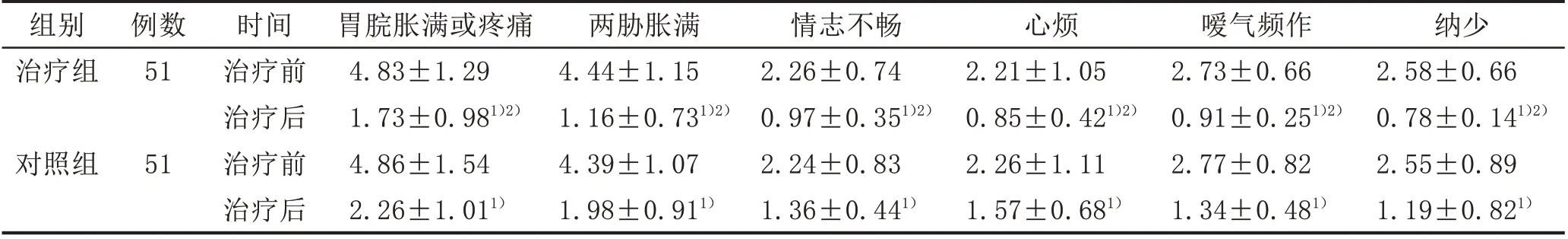
表2 2组Hp感染性GU患者中医证候积分比较(±s,分)
注:与本组治疗前比较,1)P<0.05;与对照组治疗后比较,2)P<0.05。
组别治疗组纳少2.58±0.66 0.78±0.141)2)2.55±0.89 1.19±0.821)例数51对照组51时间治疗前治疗后治疗前治疗后胃脘胀满或疼痛4.83±1.29 1.73±0.981)2)4.86±1.54 2.26±1.011)两胁胀满4.44±1.15 1.16±0.731)2)4.39±1.07 1.98±0.911)情志不畅2.26±0.74 0.97±0.351)2)2.24±0.83 1.36±0.441)心烦2.21±1.05 0.85±0.421)2)2.26±1.11 1.57±0.681)嗳气频作2.73±0.66 0.91±0.251)2)2.77±0.82 1.34±0.481)
2.3 2 组患者炎症因子水平比较治疗后,2 组患者的TNF-α、IL-6、CRP 水平均较治疗前下降,且治疗组下降水平较对照组更明显,差异有统计学意义(P<0.05)。见表3。
表3 2组Hp感染性GU患者炎症因子水平比较(±s)
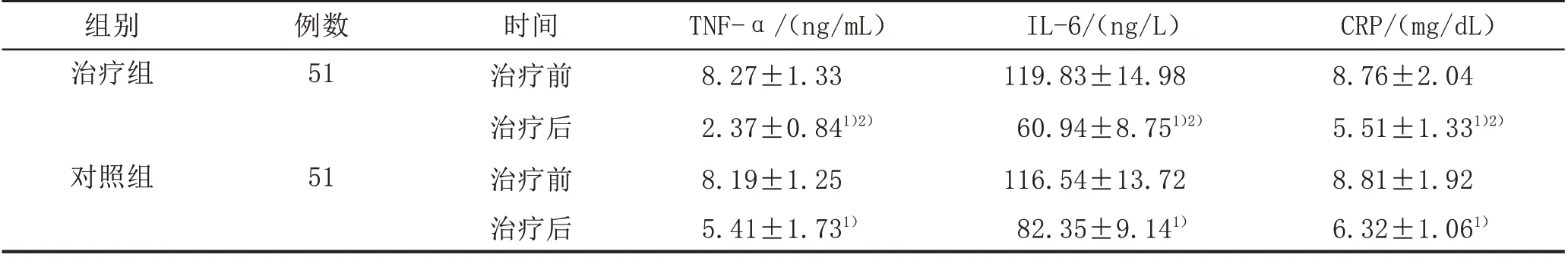
表3 2组Hp感染性GU患者炎症因子水平比较(±s)
注:与本组治疗前比较,1)P<0.05;与对照组治疗后比较,2)P<0.05。
CRP/(mg/dL)8.76±2.04 5.51±1.331)2)8.81±1.92 6.32±1.061)组别治疗组例数51对照组51时间治疗前治疗后治疗前治疗后TNF-α/(ng/mL)8.27±1.33 2.37±0.841)2)8.19±1.25 5.41±1.731)IL-6/(ng/L)119.83±14.98 60.94±8.751)2)116.54±13.72 82.35±9.141)
2.4 2 组患者胃肠激素水平比较治疗后,2 组患者的PGⅠ、PGⅡ、GAS、MTL水平均较治疗前下降,且治疗组低于对照组,差异有统计学意义(P<0.05)。见表4。
表4 2组Hp感染性GU患者胃肠激素水平比较(±s)

表4 2组Hp感染性GU患者胃肠激素水平比较(±s)
注:与本组治疗前比较,1)P<0.05;与对照组治疗后比较,2)P<0.05。
组别治疗组MTL/(pg/mL)253.91±30.22 103.52±17.131)2)256.52±33.88 154.49±19.011)例数51对照组51时间治疗前治疗后治疗前治疗后PGⅠ/(μg/L)306.77±43.56 179.38±29.871)2)303.65±45.29 251.36±30.181)PGⅡ/(μg/L)19.57±4.15 11.91±2.671)2)20.06±5.21 15.91±3.061)GAS/(pg/mL)105.87±23.44 81.35±12.511)2)107.28±29.15 93.06±14.331)
3 讨论
胃黏膜的内窥镜检查结果在Hp 血清流行人群中很重要。它不仅与GU 的风险密切相关,而且与胃黏膜细胞的排泄能力密切相关。在未感染的受试者中,常见的内镜检查结果是集合小静脉排列规则、慢性浅表性胃炎和糜烂性胃炎。在活动性Hp 感染的情况下,常见的内镜检查结果为胃窦结节、胃皱襞增厚。PGⅡ浓度升高与活动性Hp 感染密切相关,也表明胃溃疡的风险增加。胃内环境是低酸性的,在这种情况下胃溃疡的风险会增加。胃泌素是胃酸分泌的主要调节激素,Hp感染可能导致各种调节运动的胃激素如生长激素释放肽和MTL 发生变化。MTL 是一种内源性促动力激素,由胃肠内分泌细胞分泌。MTL 除了启动在胃肠道远端传播的胃收缩外,还会通过肠神经系统和直接作用于食管下括约肌(LES),增加LES 压力。大多数研究提出了Hp 是影响GU的主要因素,并取决于GAS和胃酸分泌的改变。GAS由胃窦G细胞释放,在Hp感染的成人中通常会增加。根据解剖区域和感染的后果,GAS 的血清水平及其作用可能会有所不同。根据目前提出的机制,保护作用是由Hp诱导的限制性胃炎介导的,这会导致壁细胞破坏,胃酸过少,使GAS 释放增加,最终导致胃溃疡的发展。相反,在胃窦受限的Hp 感染中,由于生长抑素分泌细胞的破坏,在感染过程中会发生无对抗的高胃泌素血症。因此,完整的体壁细胞的酸分泌增加,导致Hp 感染状态下GU 的发生率增加。GAS 水平降低是导致胃窦G 细胞萎缩的原因,由此产生的低酸度对GU 患者起到保护作用。
IL-6 是一种多功能细胞因子,被认为是急性和慢性炎症的主要调节因子,也是T 细胞和B 细胞的刺激物。它刺激炎症部位的中性粒细胞、巨噬细胞和淋巴细胞产生各种有害产物、活性氧自由基和溶酶体酶,酶负责胃溃疡中的组织损伤。GU 发炎组织中IL-6 的mRNA 水平显着升高,IL-6 的过度产生是各种炎症性疾病的发病机制。TNF-α 是另一种具有多效性的重要促炎细胞因子。它通过引发急性炎症反应,在GU 的发展中发挥核心作用,并伴有嗜中性粒细胞浸润到胃黏膜,通过激活胱天蛋白酶3(caspase-3)通路来调节胃黏膜的凋亡细胞死亡。它还可以抑制胃微循环、细胞增殖和溃疡边缘的血管生成,从而延迟溃疡愈合,因此可以认为降低TNF-α水平可能促进溃疡愈合。
本病归属于中医学“胃痛”“痞满”范畴,患者久病情志不畅,伤及肝脏,气机阻滞脾胃,脾胃升降失源、肝胃失和发为本病。本研究采用自拟乌贝止溃汤加减治疗,方中海螵蛸制酸止痛,浙贝母清热散结、开通中焦,共为君药。延胡索、木香行气止痛,香附、北柴胡疏肝解郁,肝气舒则脾胃和,四药共用直达肝脏,疏肝解郁,共为臣药。陈皮、枳壳理气健脾,砂仁化湿健脾,共促脾胃中焦气机通畅,补益脾胃,使气血生化有源,直达病灶。白芍柔肝养肝,川芎、三七粉活血化瘀,清除脾胃瘀滞,发挥调和肝脾之功。炙甘草调和诸药为使药。该研究结果发现,乌贝止溃汤可有效降低中医证候积分,改善患者症状,促进溃疡愈合。现代药理研究[9]发现,浙贝母的醇提物可促进体内一氧化氮释放,促进胃黏膜细胞增殖,有效减少溃疡;木香的有效成分醋酸乙酯提取物可以抑制溃疡指数,降低胃黏膜溃疡程度和减少胃液量,对胃总酸度及其蛋白酶活性有抑制作用,且能显着增加其胃组织中超氧化物歧化酶(SOD)活性,降低丙二醛(MDA)含量,进一步促进细胞增殖以提高机体抗氧化能力[10]。
PGⅠ及PGⅡ主要是由胃黏膜分泌的,PGⅠ水平随胃酸分泌量的增加而上升,PGⅡ可反映胃黏膜的分化与成熟程度。GU 患者由于胃黏膜防御屏障受损使得大量PGⅠ、PGⅡ进入血液,进而导致血液中PGⅠ、PGⅡ水平上升[11]。GAS 及MTL 可促进胃蛋白酶、胃酸的分泌,其水平过高是GU 的高危信号之一[12]。CRP 是一种转录因子,当炎症发生时,它会在GU 组织中受到刺激,并进一步刺激其他细胞因子、趋化因子和生长因子的产生。CRP 在机体受伤时会急剧升高,可直接参与炎症反应。IL-6和TNF-α 是参与各种免疫和炎症反应的炎性细胞因子。IL-6 可激活T 淋巴细胞分化,促进干细胞相关蛋白质的合成,加重炎症反应。TNF-α 由单核巨噬细胞分泌,作为炎症反应始动因子可对中性粒细胞、淋巴细胞进行活化,使得炎症细胞被胃黏膜黏附,引发胃黏膜屏障损伤[13]。本研究显示,乌贝止溃汤联合西药治疗后Hp 感染性GU 患者PGⅠ、PGⅡ、GAS、MTL、IL-6、CRP、TNF-α水平下降,表明二者联合可减轻炎症反应,修复胃黏膜防御屏障。
综上,乌贝止溃汤联合西药治疗Hp 感染性GU 临床效果显着,可降低中医证候积分,提高Hp 清除率,降低血清炎症因子水平、胃肠激素水平,促进溃疡面愈合。



